3.2.2 酚课件(共31张ppt)2023-2024学年高二化学人教版(2019)选择性必修3
文档属性
| 名称 | 3.2.2 酚课件(共31张ppt)2023-2024学年高二化学人教版(2019)选择性必修3 |

|
|
| 格式 | pptx | ||
| 文件大小 | 6.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-05 00:00:00 | ||
图片预览






文档简介
第三章 烃的衍生物 第二节 醇 酚
第2课时 酚
1. 能够有序说出苯酚的主要物理性质。
2.通过分析苯酚的结构特点,并与醇、苯进行比较,预测苯酚断键情况,再通过实验事实验证预测,书写相应的化学方程式,判断反应类型。
3.进一步认识基团之间的相互影响,再次丰富“结构决定性质、性质反映结构”的学科思想。
学习目标
外科消毒之父
———利斯特
【科学史话】
【药品名称】苯酚软膏
【性?? 状】黄色软膏,有苯酚臭味
【药理作用】?消毒防腐剂,
使细菌的蛋白质变性。
丁香酚
芝麻酚
漆酚
茶叶能够提供保护生命体的抗氧化剂——茶多酚
酚是羟基与苯环上的碳原子直接相连的化合物。
苯酚是一元酚,是酚类化合物中最简单的。
【学习任务一】苯酚的物理性质
{5940675A-B579-460E-94D1-54222C63F5DA}颜色
状态
气味
溶解性
无色
晶体
特殊气味
室温下溶解度较小,高于65℃与水互溶;
放置时间较长呈粉红色
易溶于乙醇等有机溶剂。
【活动1】阅读教材,有序说出苯酚的主要物理性质。
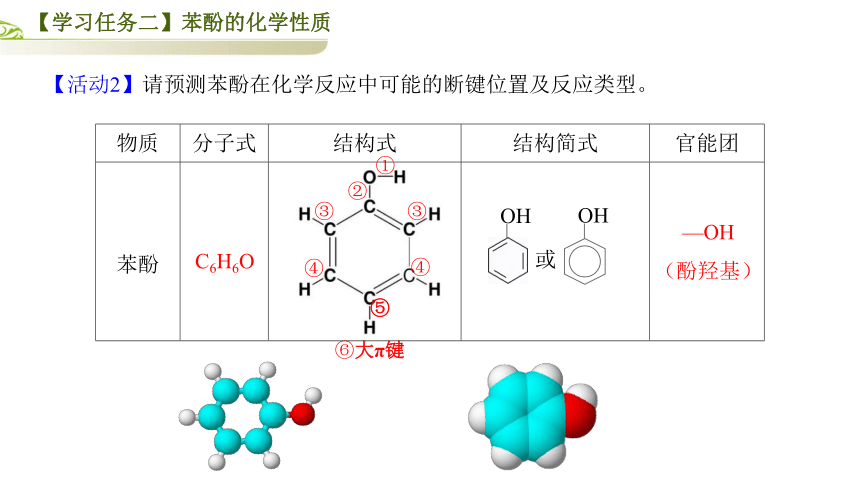
【活动2】请预测苯酚在化学反应中可能的断键位置及反应类型。
{5940675A-B579-460E-94D1-54222C63F5DA}物质
分子式
结构式
结构简式
官能团
苯酚
C6H6O
—OH
(酚羟基)
④
①
②
③
⑤
③
④
⑥大π键
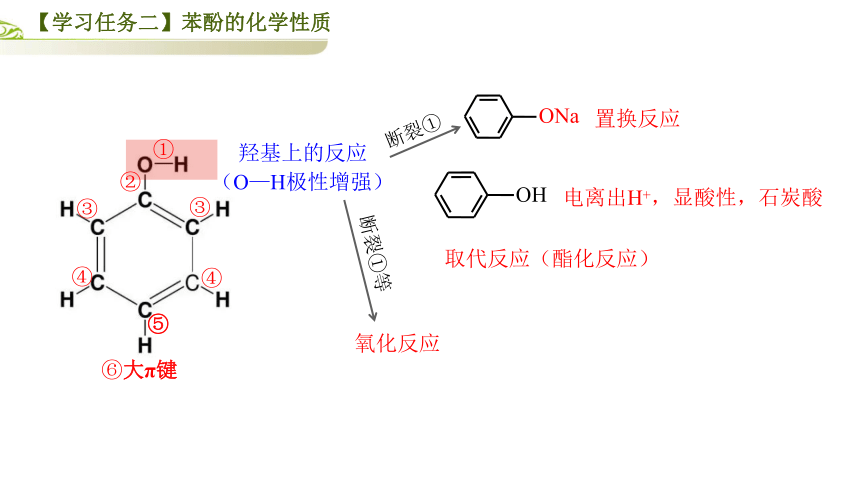
【学习任务二】苯酚的化学性质
OH
OH
或
{5940675A-B579-460E-94D1-54222C63F5DA}
甲烷
甲苯
苯
结构简式
CH4
与酸性高锰酸钾溶液
与液溴
CH3
不反应
不反应
被氧化成
COOH
苯环上三取代
苯环上一取代
不反应
CH3
活化
【学习任务二】苯酚的化学性质
羟基上的反应
苯环上的反应
①
④
②
③
⑤
③
④
⑥大π键
OH
基团相互活化
(O—H极性>醇中O—H极性)
【学习任务二】苯酚的化学性质
断裂①
取代反应(酯化反应)
置换反应
ONa
断裂①等
氧化反应
OH
电离出H+,显酸性,石炭酸
羟基上的反应
①
④
②
③
⑤
③
④
⑥大π键
(O—H极性增强)
【学习任务二】苯酚的化学性质
【预测】乙醇、水、苯酚均有羟基,水、苯酚分子中羟基的氢原子比乙醇分子中的活泼。水微弱电离,那么苯酚也能电离出H+,显酸性。
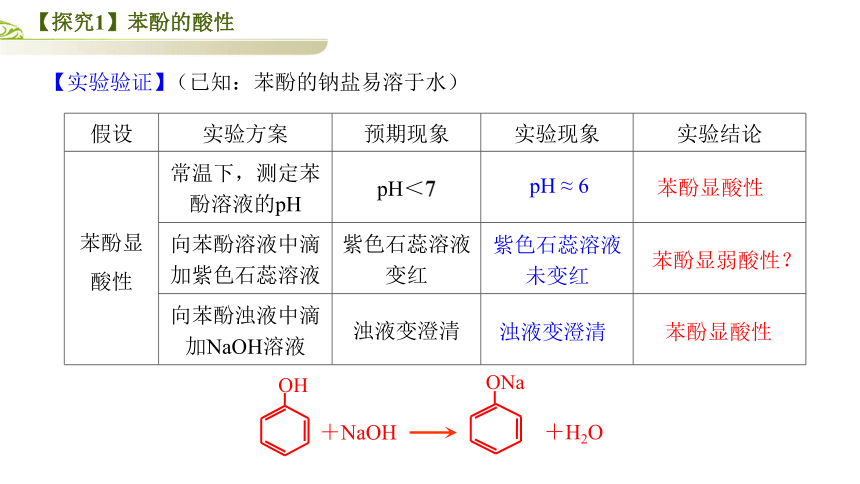
【实验验证】
{2D5ABB26-0587-4C30-8999-92F81FD0307C}假设
实验方案
预期实验现象
苯酚显
酸性
常温下,测定苯酚溶液的pH
向苯酚溶液中滴加紫色石蕊溶液
向苯酚浊液中滴加NaOH溶液
pH<7
紫色石蕊溶液变红
浊液变澄清
(已知:苯酚的钠盐易溶于水)
【探究1】苯酚的酸性
{2D5ABB26-0587-4C30-8999-92F81FD0307C}假设
实验方案
预期现象
实验现象
实验结论
苯酚显
酸性
常温下,测定苯酚溶液的pH
pH<7
向苯酚溶液中滴加紫色石蕊溶液
紫色石蕊溶液变红
向苯酚浊液中滴加NaOH溶液
浊液变澄清
pH ≈ 6
紫色石蕊溶液
未变红
浊液变澄清
苯酚显酸性
苯酚显弱酸性?
苯酚显酸性
+H2O
OH
ONa
+NaOH
【探究1】苯酚的酸性
【实验验证】
(已知:苯酚的钠盐易溶于水)
{2D5ABB26-0587-4C30-8999-92F81FD0307C}假设
实验方案
预期实验现象
苯酚为弱酸
苯酚钠溶液显碱性
苯酚酸性弱于碳酸
向苯酚钠溶液中通入CO2
向苯酚钠溶液中滴加盐酸
溶液出现白色浑浊
溶液出现白色浑浊
常温下,测苯酚钠溶液的pH
溶液pH>7
【探究2】苯酚的弱酸性
【实验验证】
{2D5ABB26-0587-4C30-8999-92F81FD0307C}假设
实验方案
预期实验现象
实验现象
实验结论
苯酚为弱酸
向苯酚钠溶液中滴加盐酸
溶液出现白色浑浊
苯酚酸性弱于碳酸
向苯酚钠溶液中通入CO2
溶液出现白色浑浊
苯酚钠溶液显碱性
常温下,测苯酚钠溶液的pH
溶液pH>7
溶液出现白色浑浊
溶液出现白色浑浊
酸性:
苯酚<碳酸
溶液pH>7
【探究2】苯酚的弱酸性
【实验验证】
+NaCl
ONa
OH
+HCl
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}电离平衡常数( 25℃ )
Ka1
Ka2
苯酚(C6H5OH)
1.2×10?10
——
碳酸(H2CO3)
4.4×10?7
4.7×10?11
【资料1】
+
H2O
ONa
+
OH
Na2CO3
CO2
+
?
【探究2】苯酚的弱酸性
+NaHCO3
OH
ONa
+Na2CO3
×
酸性:H2CO3 > 苯酚 >HCO3?
?
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}电离平衡常数( 25℃ )
Ka1
Ka2
苯酚(C6H5OH)
1.2×10?10
——
碳酸(H2CO3)
4.4×10?7
4.7×10?11
【资料1】
【探究2】苯酚的弱酸性
+NaHCO3
OH
ONa
+Na2CO3
+NaHCO3
ONa
OH
+CO2+H2O
二、苯酚的化学性质
1. 弱酸性(俗称石炭酸)——苯环使羟基活化
不能使酸碱指示剂变色。
—ONa
+ CO2 + H2O + NaHCO3
—OH
—ONa
+ HCl + NaCl
—OH
—OH
+ Na2CO3 + NaHCO3
—ONa
酸性:
H2CO3 > 苯酚 > HCO3?
?
—OH
+ NaOH + H2O
—ONa
知识梳理
【资料2】苯酚露置在空气中会因部分被O2氧化成苯醌类物质而呈粉红色。
粉红色
【学习任务二】苯酚的化学性质
—OH
O2
=O
O=
(1)在空气中被O2氧化呈粉红色
(2)能使酸性KMnO4溶液褪色
(3)可以燃烧
知识梳理
二、苯酚的化学性质
2. 氧化反应
【学习任务二】苯酚的化学性质
【活动2】请预测苯酚在化学反应中可能的断键位置及反应类型。
苯环上的反应
断裂③⑤
OH
Br
Br
Br
取代反应
断大π键
OH
加成反应
①
④
②
③
⑤
③
④
⑥大π键
白色沉淀
知识梳理
二、苯酚的化学性质
3. 取代反应(与饱和溴水)———羟基使苯环活化
2,4,6-三溴苯酚
苯酚与溴的反应很灵敏,可用于苯酚的定性检验与定量测定。
4. 加成反应
OH
+ 3H2
催化剂
△
OH
如何从分子内基团间相互作用的角度来解释下列事实:
(1)苯酚的酸性比乙醇的强。
(2)苯和苯酚发生溴代反应的条件和产物有很大的不同。
由于苯环对羟基的影响,O—H极性变强,氢原子易电离而使苯酚表现弱酸性。
由于羟基对苯环的影响,苯环上处于羟基邻位和对位的氢原子的活性增强,从而使苯酚比苯更易与溴发生取代反应。
【思考与讨论】
苯酚与FeCl3溶液作用显紫色,利用这一反应可以检验苯酚的存在。
酚类物质一般都可以与FeCl3溶液作用显色。
知识梳理
二、苯酚的化学性质
5. 显色反应(特征反应)
与 FeCl3溶液反应
苯酚的用途
酚醛树脂
合成纤维
合成香料
医药
消毒剂
染料
农药
防腐剂
含酚类物质的废水对生物具有毒害作用,会对水体造成严重污染。化工厂和炼焦厂的废水中常含有酚类物质,在排放前必须经过处理。
【调查作业】查阅有关资料,了解酚类废水的危害和工业上处理酚类废水的常用方法,并把你收集的资料设计成一份保护环境的宣传报道。
【化学与环境】
苯环的性质:
取代反应(三取代)
加成反应
OH
羟基的性质:
弱酸性
还原性
特征反应: 显色反应
羟基活化苯环
苯环活化羟基
官能团
基团之间相互影响改变键的极性
课堂小结
{5940675A-B579-460E-94D1-54222C63F5DA}
醇
酚
官能团
羟基
共性
①置换反应:与Na反应
②取代反应:酯化反应
③氧化反应:燃烧、被酸性KMnO4溶液氧化
特性
①某些醇消去反应
②某些醇催化氧化生成醛
(或酮)
①弱酸性,能与NaOH、Na2CO3反应
②与饱和溴水反应产生白色沉淀
③显色反应(遇FeCl3溶液显紫色)
课堂小结
1. 某有机化合物A含碳76.6%,氢6.4%,氧17.0%,相对分子质量为甲烷的5.88倍。在常温下,A可与溴水反应生成白色沉淀,1 mol A恰好与3 mol Br2作用。请据此确定A的结构简式。
M=16×5.88=94
含C个数:94×76.6%÷12=6
含H个数:94×6.4%÷1=6
含O个数:94×17.0%÷16=1
—OH
课堂检测
(1)与Na反应生成H2的有____________(填序号, 下同)
(2)与NaOH反应的有____________。
(3)与浓溴水反应的有____________。
(4)与FeCl3溶液显色的有____________。
(5)能与酸性KMnO4溶液反应的有_______________。
(6)能发生消去反应的有____________。
2. 下列物质中:
酚
醇
课堂检测
①②③④
②③
②③
②③
①②③④
④
酚
醇
酚
酚
酚
酚
醇
醇
与NaOH反应:
与浓溴水的反应:
(7)请写出② 发生以下反应的化学方程式。
OH
H3C
OH
H3C
+NaOH
ONa + H2O
H3C
OH
OH
—Br
CH3
Br—
+ 2Br2
+ 2HBr
CH3
课堂检测
本节内容结束
第2课时 酚
1. 能够有序说出苯酚的主要物理性质。
2.通过分析苯酚的结构特点,并与醇、苯进行比较,预测苯酚断键情况,再通过实验事实验证预测,书写相应的化学方程式,判断反应类型。
3.进一步认识基团之间的相互影响,再次丰富“结构决定性质、性质反映结构”的学科思想。
学习目标
外科消毒之父
———利斯特
【科学史话】
【药品名称】苯酚软膏
【性?? 状】黄色软膏,有苯酚臭味
【药理作用】?消毒防腐剂,
使细菌的蛋白质变性。
丁香酚
芝麻酚
漆酚
茶叶能够提供保护生命体的抗氧化剂——茶多酚
酚是羟基与苯环上的碳原子直接相连的化合物。
苯酚是一元酚,是酚类化合物中最简单的。
【学习任务一】苯酚的物理性质
{5940675A-B579-460E-94D1-54222C63F5DA}颜色
状态
气味
溶解性
无色
晶体
特殊气味
室温下溶解度较小,高于65℃与水互溶;
放置时间较长呈粉红色
易溶于乙醇等有机溶剂。
【活动1】阅读教材,有序说出苯酚的主要物理性质。
【活动2】请预测苯酚在化学反应中可能的断键位置及反应类型。
{5940675A-B579-460E-94D1-54222C63F5DA}物质
分子式
结构式
结构简式
官能团
苯酚
C6H6O
—OH
(酚羟基)
④
①
②
③
⑤
③
④
⑥大π键
【学习任务二】苯酚的化学性质
OH
OH
或
{5940675A-B579-460E-94D1-54222C63F5DA}
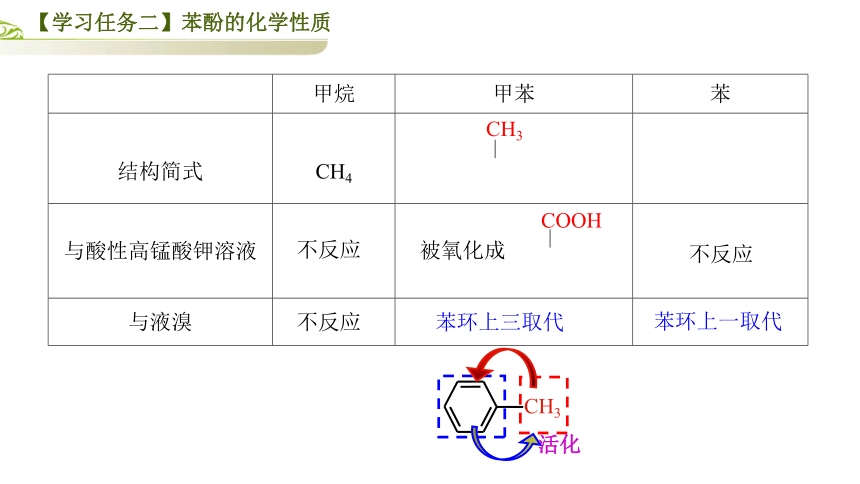
甲烷
甲苯
苯
结构简式
CH4
与酸性高锰酸钾溶液
与液溴
CH3
不反应
不反应
被氧化成
COOH
苯环上三取代
苯环上一取代
不反应
CH3
活化
【学习任务二】苯酚的化学性质
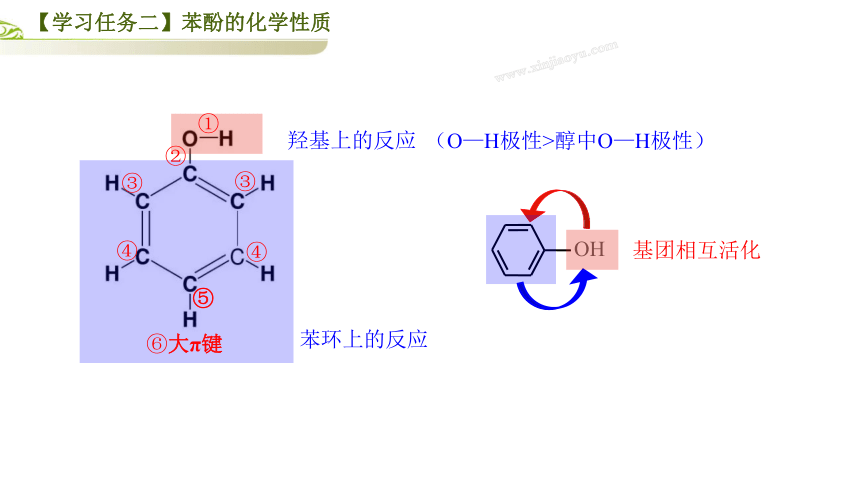
羟基上的反应
苯环上的反应
①
④
②
③
⑤
③
④
⑥大π键
OH
基团相互活化
(O—H极性>醇中O—H极性)
【学习任务二】苯酚的化学性质
断裂①
取代反应(酯化反应)
置换反应
ONa
断裂①等
氧化反应
OH
电离出H+,显酸性,石炭酸
羟基上的反应
①
④
②
③
⑤
③
④
⑥大π键
(O—H极性增强)
【学习任务二】苯酚的化学性质
【预测】乙醇、水、苯酚均有羟基,水、苯酚分子中羟基的氢原子比乙醇分子中的活泼。水微弱电离,那么苯酚也能电离出H+,显酸性。
【实验验证】
{2D5ABB26-0587-4C30-8999-92F81FD0307C}假设
实验方案
预期实验现象
苯酚显
酸性
常温下,测定苯酚溶液的pH
向苯酚溶液中滴加紫色石蕊溶液
向苯酚浊液中滴加NaOH溶液
pH<7
紫色石蕊溶液变红
浊液变澄清
(已知:苯酚的钠盐易溶于水)
【探究1】苯酚的酸性
{2D5ABB26-0587-4C30-8999-92F81FD0307C}假设
实验方案
预期现象
实验现象
实验结论
苯酚显
酸性
常温下,测定苯酚溶液的pH
pH<7
向苯酚溶液中滴加紫色石蕊溶液
紫色石蕊溶液变红
向苯酚浊液中滴加NaOH溶液
浊液变澄清
pH ≈ 6
紫色石蕊溶液
未变红
浊液变澄清
苯酚显酸性
苯酚显弱酸性?
苯酚显酸性
+H2O
OH
ONa
+NaOH
【探究1】苯酚的酸性
【实验验证】
(已知:苯酚的钠盐易溶于水)
{2D5ABB26-0587-4C30-8999-92F81FD0307C}假设
实验方案
预期实验现象
苯酚为弱酸
苯酚钠溶液显碱性
苯酚酸性弱于碳酸
向苯酚钠溶液中通入CO2
向苯酚钠溶液中滴加盐酸
溶液出现白色浑浊
溶液出现白色浑浊
常温下,测苯酚钠溶液的pH
溶液pH>7
【探究2】苯酚的弱酸性
【实验验证】
{2D5ABB26-0587-4C30-8999-92F81FD0307C}假设
实验方案
预期实验现象
实验现象
实验结论
苯酚为弱酸
向苯酚钠溶液中滴加盐酸
溶液出现白色浑浊
苯酚酸性弱于碳酸
向苯酚钠溶液中通入CO2
溶液出现白色浑浊
苯酚钠溶液显碱性
常温下,测苯酚钠溶液的pH
溶液pH>7
溶液出现白色浑浊
溶液出现白色浑浊
酸性:
苯酚<碳酸
溶液pH>7
【探究2】苯酚的弱酸性
【实验验证】
+NaCl
ONa
OH
+HCl
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}电离平衡常数( 25℃ )
Ka1
Ka2
苯酚(C6H5OH)
1.2×10?10
——
碳酸(H2CO3)
4.4×10?7
4.7×10?11
【资料1】
+
H2O
ONa
+
OH
Na2CO3
CO2
+
?
【探究2】苯酚的弱酸性
+NaHCO3
OH
ONa
+Na2CO3
×
酸性:H2CO3 > 苯酚 >HCO3?
?
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}电离平衡常数( 25℃ )
Ka1
Ka2
苯酚(C6H5OH)
1.2×10?10
——
碳酸(H2CO3)
4.4×10?7
4.7×10?11
【资料1】
【探究2】苯酚的弱酸性
+NaHCO3
OH
ONa
+Na2CO3
+NaHCO3
ONa
OH
+CO2+H2O
二、苯酚的化学性质
1. 弱酸性(俗称石炭酸)——苯环使羟基活化
不能使酸碱指示剂变色。
—ONa
+ CO2 + H2O + NaHCO3
—OH
—ONa
+ HCl + NaCl
—OH
—OH
+ Na2CO3 + NaHCO3
—ONa
酸性:
H2CO3 > 苯酚 > HCO3?
?
—OH
+ NaOH + H2O
—ONa
知识梳理
【资料2】苯酚露置在空气中会因部分被O2氧化成苯醌类物质而呈粉红色。
粉红色
【学习任务二】苯酚的化学性质
—OH
O2
=O
O=
(1)在空气中被O2氧化呈粉红色
(2)能使酸性KMnO4溶液褪色
(3)可以燃烧
知识梳理
二、苯酚的化学性质
2. 氧化反应
【学习任务二】苯酚的化学性质
【活动2】请预测苯酚在化学反应中可能的断键位置及反应类型。
苯环上的反应
断裂③⑤
OH
Br
Br
Br
取代反应
断大π键
OH
加成反应
①
④
②
③
⑤
③
④
⑥大π键
白色沉淀
知识梳理
二、苯酚的化学性质
3. 取代反应(与饱和溴水)———羟基使苯环活化
2,4,6-三溴苯酚
苯酚与溴的反应很灵敏,可用于苯酚的定性检验与定量测定。
4. 加成反应
OH
+ 3H2
催化剂
△
OH
如何从分子内基团间相互作用的角度来解释下列事实:
(1)苯酚的酸性比乙醇的强。
(2)苯和苯酚发生溴代反应的条件和产物有很大的不同。
由于苯环对羟基的影响,O—H极性变强,氢原子易电离而使苯酚表现弱酸性。
由于羟基对苯环的影响,苯环上处于羟基邻位和对位的氢原子的活性增强,从而使苯酚比苯更易与溴发生取代反应。
【思考与讨论】
苯酚与FeCl3溶液作用显紫色,利用这一反应可以检验苯酚的存在。
酚类物质一般都可以与FeCl3溶液作用显色。
知识梳理
二、苯酚的化学性质
5. 显色反应(特征反应)
与 FeCl3溶液反应
苯酚的用途
酚醛树脂
合成纤维
合成香料
医药
消毒剂
染料
农药
防腐剂
含酚类物质的废水对生物具有毒害作用,会对水体造成严重污染。化工厂和炼焦厂的废水中常含有酚类物质,在排放前必须经过处理。
【调查作业】查阅有关资料,了解酚类废水的危害和工业上处理酚类废水的常用方法,并把你收集的资料设计成一份保护环境的宣传报道。
【化学与环境】
苯环的性质:
取代反应(三取代)
加成反应
OH
羟基的性质:
弱酸性
还原性
特征反应: 显色反应
羟基活化苯环
苯环活化羟基
官能团
基团之间相互影响改变键的极性
课堂小结
{5940675A-B579-460E-94D1-54222C63F5DA}
醇
酚
官能团
羟基
共性
①置换反应:与Na反应
②取代反应:酯化反应
③氧化反应:燃烧、被酸性KMnO4溶液氧化
特性
①某些醇消去反应
②某些醇催化氧化生成醛
(或酮)
①弱酸性,能与NaOH、Na2CO3反应
②与饱和溴水反应产生白色沉淀
③显色反应(遇FeCl3溶液显紫色)
课堂小结
1. 某有机化合物A含碳76.6%,氢6.4%,氧17.0%,相对分子质量为甲烷的5.88倍。在常温下,A可与溴水反应生成白色沉淀,1 mol A恰好与3 mol Br2作用。请据此确定A的结构简式。
M=16×5.88=94
含C个数:94×76.6%÷12=6
含H个数:94×6.4%÷1=6
含O个数:94×17.0%÷16=1
—OH
课堂检测
(1)与Na反应生成H2的有____________(填序号, 下同)
(2)与NaOH反应的有____________。
(3)与浓溴水反应的有____________。
(4)与FeCl3溶液显色的有____________。
(5)能与酸性KMnO4溶液反应的有_______________。
(6)能发生消去反应的有____________。
2. 下列物质中:
酚
醇
课堂检测
①②③④
②③
②③
②③
①②③④
④
酚
醇
酚
酚
酚
酚
醇
醇
与NaOH反应:
与浓溴水的反应:
(7)请写出② 发生以下反应的化学方程式。
OH
H3C
OH
H3C
+NaOH
ONa + H2O
H3C
OH
OH
—Br
CH3
Br—
+ 2Br2
+ 2HBr
CH3
课堂检测
本节内容结束
