3.1 卤代烃课件(共42页)2023-2024学年高二化学人教版(2019)选择性必修3
文档属性
| 名称 | 3.1 卤代烃课件(共42页)2023-2024学年高二化学人教版(2019)选择性必修3 |

|
|
| 格式 | pptx | ||
| 文件大小 | 21.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-05 00:00:00 | ||
图片预览






文档简介
(共42张PPT)
第三章 烃的衍生物
第一节 卤代烃
PART
01
PART
02
通过从卤代烃的官能团及其转化角度认识卤代烃取代反应、消去反应的特点和规律,了解有机反应类型与有机化合物分子结构特点之间的关系。
掌握卤代烃在有机合成中的桥梁作用,培养“科学探究与社会责任”的核心素养。
不粘锅涂层:聚四氟乙烯
聚氯乙烯
DDT农药
卤代烃
化学与生活
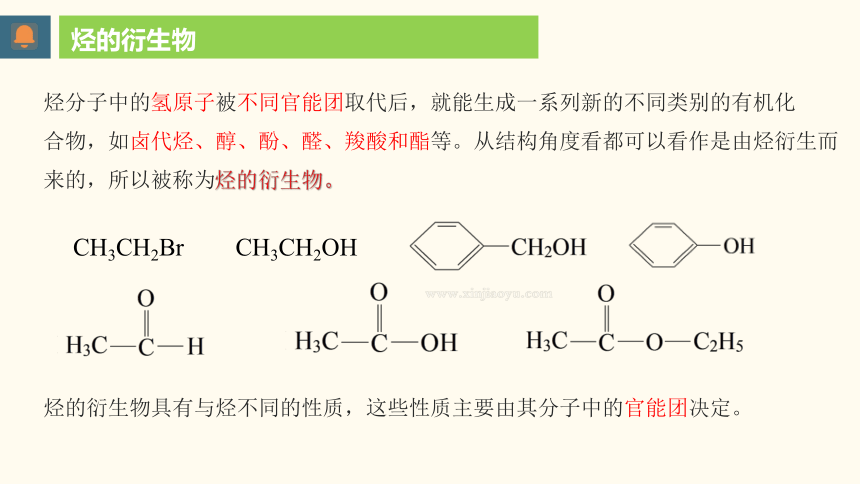
烃分子中的氢原子被不同官能团取代后,就能生成一系列新的不同类别的有机化
合物,如卤代烃、醇、酚、醛、羧酸和酯等。从结构角度看都可以看作是由烃衍生而
来的,所以被称为烃的衍生物。
烃的衍生物
CH3CH2Br
CH3CH2OH
烃的衍生物具有与烃不同的性质,这些性质主要由其分子中的官能团决定。
阅读教材52页,思考下列问题:
(1)什么是卤代烃?有哪些分类?
(2)第二章我们学习了烃,想想通过哪些反应可以将烃转化为卤代烃?
(3)卤代烃如何命名?根据资料卡片,结合烃类物质的命名,请你总结出卤代烃的命名原则。
认识卤代烃
烃分子中的氢原子被卤素原子取代后生成的化合物。
一元卤代烃可表示为:R—X
1.概念
—C—X 碳卤键
元素组成:一定含C、X(H不一定)
官能团:
如CCl4
认识卤代烃
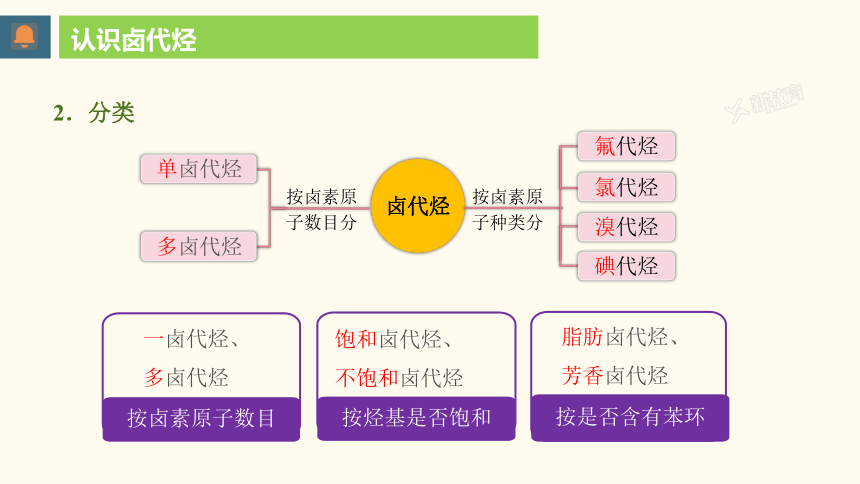
卤代烃
按卤素原
子数目分
单卤代烃
多卤代烃
按卤素原
子种类分
氟代烃
氯代烃
溴代烃
碘代烃
一卤代烃、多卤代烃
按卤素原子数目
饱和卤代烃、
不饱和卤代烃
按烃基是否饱和
脂肪卤代烃、芳香卤代烃
按是否含有苯环
认识卤代烃
2.分类
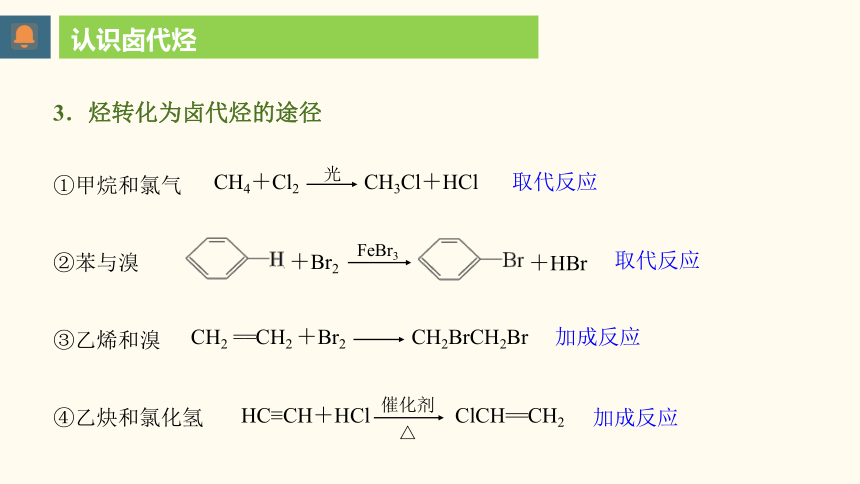
①甲烷和氯气
②苯与溴
③乙烯和溴
④乙炔和氯化氢
认识卤代烃
3.烃转化为卤代烃的途径
取代反应
CH4+Cl2
光
CH3Cl+HCl
取代反应
FeBr3
+Br2
+HBr
加成反应
CH2 ==CH2 +Br2
CH2BrCH2Br
加成反应
HC≡CH+HCl
催化剂
△
ClCH==CH2
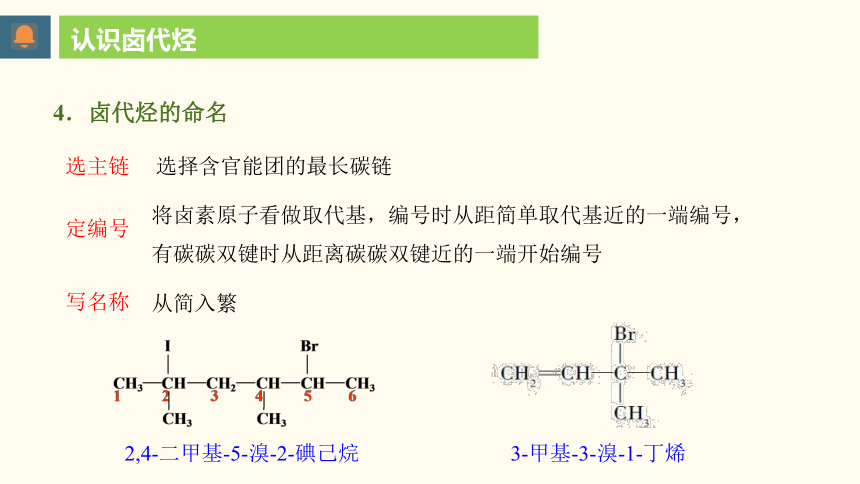
选主链
定编号
写名称
选择含官能团的最长碳链
将卤素原子看做取代基,编号时从距简单取代基近的一端编号,
有碳碳双键时从距离碳碳双键近的一端开始编号
从简入繁
3-甲基-3-溴-1-丁烯
认识卤代烃
4.卤代烃的命名
2,4-二甲基-5-溴-2-碘己烷
CH3CH2CH2CH2—Cl
CH3CH2CHCH3
Cl
—
CH3—C—CH3
Br
—
—
CH3
1-氯丁烷
2-氯丁烷
2-甲基-2-溴丙烷
3-甲基- 1,1-二溴戊烷
认识卤代烃
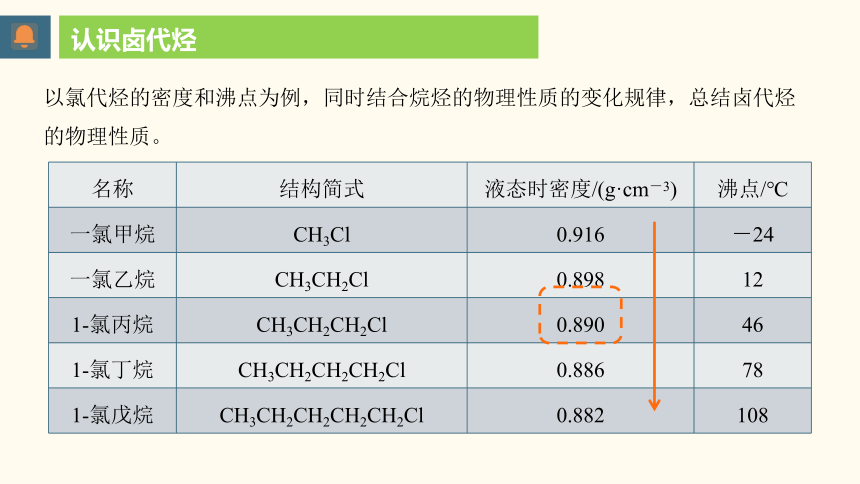
名称 结构简式 液态时密度/(g·cm-3) 沸点/℃
一氯甲烷 CH3Cl 0.916 -24
一氯乙烷 CH3CH2Cl 0.898 12
1-氯丙烷 CH3CH2CH2Cl 0.890 46
1-氯丁烷 CH3CH2CH2CH2Cl 0.886 78
1-氯戊烷 CH3CH2CH2CH2CH2Cl 0.882 108
以氯代烃的密度和沸点为例,同时结合烷烃的物理性质的变化规律,总结卤代烃的物理性质。
认识卤代烃
常温下除一氯甲烷、氯乙烷、氯乙烯等少数是气体外,
大多数为液体或固体。
除脂肪烃的一氟代物和一氯代物外,其余卤代烃密度都比水大。
一般随着烃基中碳原子数目的增加而减小。
卤代烃不溶于水,可溶于有机溶剂,某些卤代烃本身就是有机溶剂。
熔沸点大于同碳个数的烃,随碳原子数增多,沸点依次升高(碳原子数相同时,支链越多沸点越低)。
状态
沸点
密度
溶解性
认识卤代烃
5.卤代烃的物理性质
C2H5Br
CH3CH2Br 或 C2H5Br
核磁共振氢谱图
分子式:
结构式:
结构简式:
官能团:
电子式:
有2种化学环境的H原子,则核磁共振有2组峰,强度比为3∶2
以溴乙烷为例学习卤代烃的性质
1.溴乙烷的组成和结构
球棍模型
空间填充模型
—C—X(碳溴键)
颜 色:
状 态:
密 度:
溶解性:
沸 点:
无色透明
油状液体
比水大
不溶于水,
易溶于有机溶剂
沸点38.4℃
易挥发
对 比
无色
气体
-88.6 ℃
不溶于水
CH3CH3
比水小
>
卤代烃的熔沸点大于同C原子数的烃!
以溴乙烷为例学习卤代烃的性质
2.溴乙烷的物理性质
分析卤代烃的结构特点,推测卤代烃具有怎样的化学性质。
卤代烃中卤素原子吸引电子能力较强,共用电子对偏向卤素原子,使C—X具有较强的极性,所以卤代烃具有较强的反应活性,易发生取代反应和消去反应。
碳卤键
官能团:
X
C
δ—
δ+
例:溴乙烷和乙烷的结构相似,区别在于C—H与C—Br的不同。C—Br为极性键,由于溴原子吸引电子能力强,C—Br易断裂,使溴原子易被取代。
以溴乙烷为例学习卤代烃的性质
提出问题1:
溴乙烷(CH3CH2Br) 在水中能否电离出Br﹣?它是否为电解质?请设计实验证明。
实验:
无明显变化
溴乙烷不是电解质,不能电离出Br-。
提出问题2:CH3CH3+水→不反应,CH3CH2Br+H2O →
科学猜测:若反应,可能有 产生。
怎样证明有Br﹣产生?
资料卡片
C2H5Br与水的反应要在碱性环境下才容易进行
Br﹣
对溴乙烷化学性质的探索
实验装置
实验现象 ①中溶液_____ ;②中有机层厚度减小;④中有 生成
实验解释 溴乙烷与NaOH溶液共热产生了______
分层
淡黄色沉淀
Br-
【实验3-1】
(以溴乙烷为例)
卤代烃的化学性质
1.取代反应(水解反应)
CH3CH2—Br + Na—OH CH3CH2—OH + NaBr
H2O
△
从平衡移动的角度看,NaOH不断中和氢溴酸,促进溴乙烷的水解;加热的目的是提高反应速率,且水解是吸热反应,升高温度也有利于平衡右移。水相当于是催化剂
反应条件:
NaOH水溶液、加热
反应原理:
羟基取代溴原子
C2H5—Br +H—OH C2H5—OH + HBr
△
NaOH + HBr === NaBr + H2O
总反应:
所有卤代烃在碱性水溶液中都会发生水解反应
1.取代反应(水解反应)
(以溴乙烷为例)
卤代烃的化学性质
(1)在实验中加入过量稀硝酸的目的是什么?
①中和过量的NaOH溶液;②检验生成的沉淀是否溶于稀HNO3
(3)检验卤代烃中的卤原子一般流程:
AgNO3溶液
NaOH溶液
水解
HNO3溶液
酸化
R—X
AgCl 白色沉淀
AgBr 浅黄色沉淀
AgI 黄色沉淀
该步骤必不可少
思考:
(2)若不加稀硝酸,直接滴加AgNO3(aq),将会看到什么现象?
过量的NaOH与AgNO3反应,产生黑褐色的Ag2O↓
NaOH+AgNO3 === AgOH↓+NaNO3
2AgOH === Ag2O↓ +H2O
(以溴乙烷为例)
卤代烃的化学性质
在卤代烃分子中,由于卤素原子的吸电子作用,不仅使得α-C带部分正电荷,也使β-C带有更少量的正电荷,从而使β-H的活泼性增强,能在强碱的作用下,失去一分子卤化氢,生成烯烃,这就是卤代烃的消去反应。
C
C
Br
H
H
H
H
H
Br
δ+
δ-
δ+
(以溴乙烷为例)
卤代烃的化学性质
(以溴乙烷为例)
卤代烃的化学性质
现象:
高锰酸钾酸性溶液褪色
结论:
生成的气体分子中含有不饱和碳碳键
溴乙烷与NaOH的乙醇混合液
反应原理:
CH2—CH2 +NaOH CH2==CH2↑ + NaBr + H2O
Br
H
乙醇
△
有机化合物在一定条件下,从一个分子中脱去一个或几个小分子(如H2O、HX等),而生成不饱和键(双键或三键)的化合物的反应。。
消去反应:
2.消去反应(消除反应)
(以溴乙烷为例)
卤代烃的化学性质
思考:下列卤代烃能否发生消去反应?
①CH3I
CH2Br
③
Br
CH3CH CHCH3
Br
⑤
Br
⑥
CH3 C CH2Br
CH3
CH3
②
CH3CHBr2
④
由此你能得出什么结论?
(以溴乙烷为例)
卤代烃的化学性质
×
×
×
√
√
×
发生消去反应的条件:
①烃中碳原子数≥ 2
②连接卤素原子的相邻碳原子上有氢原子
反应条件:
+NaOH
— C— C—
H
X
醇
C==C
+ NaX + H2O
强碱的醇溶液、加热
物质结构条件:
(以溴乙烷为例)
卤代烃的化学性质
反应类型 消去反应 水解(取代)反应
反应条件
卤代烃的 断键规律
结构特点
产物特征
卤代烃的消去反应与取代(水解)反应的比较
NaOH醇溶液、加热
NaOH水溶液、加热
与X相连的C的邻位C上有H原子
含C—X键即可
消去HX,引入碳碳双键或碳碳三键
在碳上引入—OH,生成含—OH的有机物(醇)
(以溴乙烷为例)
卤代烃的化学性质
运用第一章所学的波谱方法检验取代产物1-丁醇
生成醇
生成烯烃
实验探究——1-溴丁烷的化学性质
CH3CH2CH2CH2Br
CH3CH2CH2CH2Br
CH3CH2CH2CH2OH、NaBr
CH3CH2CH=CH2、NaBr、H2O
+水
NaOH水溶液,加热
NaOH醇溶液,加热
1-溴丁烷和NaOH在不同条件下发生不同类型的反应
实验探究——1-溴丁烷的化学性质
还可以利用溴水、溴的CCl4溶液检验丁烯。
此时不需要先通入水中。
因受热而挥发的乙醇也能使高锰酸钾褪色,所以要先通过水除去乙醇,防止干扰实验。
乙醇与溴不反应,不会干扰乙烯的检验。
实验探究——1-溴丁烷的化学性质
2-丁烯
CH3-CH-CH2-CH3
Br
CH3-CH==CH-CH3
CH3-CH2-CH==CH2
(主产物)
1-丁烯
消去反应规则:当有多个产物时,以消H少的C原子上的H为主
“雪上加霜”
实验探究——1-溴丁烷的化学性质
卤代烯烃的某些化学性质与烯烃的相似,能发生加成反应和加聚反应。
聚氯乙烯和聚四氟乙烯都是用途广泛的高分子材料。
3.加成和加聚反应
卤代烃的化学性质
特富龙(Teflon)是美国杜邦公司对其研发的所有碳氢树脂的总称,包括聚四氟乙烯、聚全氟乙丙烯及各种共聚物。由于其独特优异的耐热(180℃-260℃)、耐低温(-200℃)、自润滑性及化学稳定性能等,而被称为“拒腐蚀、永不粘的特富龙”。
聚四氟乙烯不粘锅
聚四氟乙烯,俗称塑料王,具有最佳的耐热性和耐化学性,显示了独特的不粘性和润滑性。
?CF2—CF2?
生活中的卤代烃
运动场上的“化学大夫”
氯乙烷
液态的氯乙烷汽化时大量吸热,具有冷冻麻醉作用,可在身体局部产生快速镇痛效果。因此,常用氯乙烷与其他药物制成“复方氯乙烷气雾剂”,用于运动中的急性损伤,如肌肉拉伤、关节扭伤等的镇痛。
资料卡片
生活中的卤代烃
既可用于冰箱保鲜(-60℃),也可用于微波炉(+140℃)。
PVDC保鲜膜
聚偏二氯乙烯
PE保鲜膜
聚乙烯
PVC保鲜膜
聚氯乙烯
虽可用于食品包装,但在生产过程中需添加塑化剂。如在生产过程中添加了有毒塑化剂DEHA,则危害很大。
生活中的卤代烃
作业多多
老是写错
找到帮手
身体不适
医院就医
明白事因
涂改液中含有二氯乙烷、三氯乙烷、四氯乙烷等有机氯化合物对眼睛有明显的刺激作用,严重时会导恶心、呕吐、浑身不舒服等。
原来如此
生活中的卤代烃
卤代烃的“功”:
1)作溶剂:CHCl3(氯仿);CCl4;CH2Cl2
2)农药: “六六六”,DDT
3)制冷剂:氟氯代烷(商品名氟利昂) CHClF2、CCl2F2(冰箱用)
4)灭火剂: CCl4灭火剂 (电器类起火)
5)麻醉剂: CHCl3、氯乙烷
6)塑料: 聚四氟乙烯 (塑料王)、聚氯乙烯(PVC)
科学·技术·社会
→危害:氟氯烃——造成臭氧空洞的“罪魁祸首”
→卤代烃破坏臭氧层原理(了解):氟利昂可在强烈的紫外线作用下分解,产生的氯原子自由基会对臭氧层产生长久的破坏作用。以CCl3F为例,它破坏臭氧层的反应过程可表示为
实际上氯原子起了催化作用
卤代烃的“过”:
科学·技术·社会
课堂小结
1.下列卤代烃在NaOH醇溶液中不反应的是
2.下列卤代烃,在一定条件下能发生消去反应且产物只有一种的是
A B C D
巩固练习
3.某有机物的结构简式为 ,下列关于该物质的说法中正确的是
A.该物质在NaOH的醇溶液中加热可转化为醇类
B.该物质能和AgNO3溶液反应产生AgBr沉淀
C.该物质可以发生消去反应
D.该物质可与溴的四氯化碳溶液发生加成反应
巩固练习
4.化合物X的分子式为C5H11Cl,用NaOH的醇溶液处理X,可得分子式为C5H10的两种产物Y、Z,Y、Z经催化加氢后都可得到2-甲基丁烷。若将化合物X用NaOH的水溶液处理,则所得有机产物的结构简式可能是( )
A. CH3CH2CH2CH2CH2OH B.
C. D.
巩固练习
5.欲证明溴乙烷中溴元素的存在,下列操作步骤中正确的是
①加入硝酸银溶液 ②加入氢氧化钠溶液 ③加热 ④加入蒸馏水
⑤加入稀硝酸至溶液呈酸性 ⑥加入氢氧化钠醇溶液
A.④③①⑤ B.②③⑤①
C.④⑥③① D.⑥③④①
巩固练习
本节内容结束
第三章 烃的衍生物
第一节 卤代烃
PART
01
PART
02
通过从卤代烃的官能团及其转化角度认识卤代烃取代反应、消去反应的特点和规律,了解有机反应类型与有机化合物分子结构特点之间的关系。
掌握卤代烃在有机合成中的桥梁作用,培养“科学探究与社会责任”的核心素养。
不粘锅涂层:聚四氟乙烯
聚氯乙烯
DDT农药
卤代烃
化学与生活
烃分子中的氢原子被不同官能团取代后,就能生成一系列新的不同类别的有机化
合物,如卤代烃、醇、酚、醛、羧酸和酯等。从结构角度看都可以看作是由烃衍生而
来的,所以被称为烃的衍生物。
烃的衍生物
CH3CH2Br
CH3CH2OH
烃的衍生物具有与烃不同的性质,这些性质主要由其分子中的官能团决定。
阅读教材52页,思考下列问题:
(1)什么是卤代烃?有哪些分类?
(2)第二章我们学习了烃,想想通过哪些反应可以将烃转化为卤代烃?
(3)卤代烃如何命名?根据资料卡片,结合烃类物质的命名,请你总结出卤代烃的命名原则。
认识卤代烃
烃分子中的氢原子被卤素原子取代后生成的化合物。
一元卤代烃可表示为:R—X
1.概念
—C—X 碳卤键
元素组成:一定含C、X(H不一定)
官能团:
如CCl4
认识卤代烃
卤代烃
按卤素原
子数目分
单卤代烃
多卤代烃
按卤素原
子种类分
氟代烃
氯代烃
溴代烃
碘代烃
一卤代烃、多卤代烃
按卤素原子数目
饱和卤代烃、
不饱和卤代烃
按烃基是否饱和
脂肪卤代烃、芳香卤代烃
按是否含有苯环
认识卤代烃
2.分类
①甲烷和氯气
②苯与溴
③乙烯和溴
④乙炔和氯化氢
认识卤代烃
3.烃转化为卤代烃的途径
取代反应
CH4+Cl2
光
CH3Cl+HCl
取代反应
FeBr3
+Br2
+HBr
加成反应
CH2 ==CH2 +Br2
CH2BrCH2Br
加成反应
HC≡CH+HCl
催化剂
△
ClCH==CH2
选主链
定编号
写名称
选择含官能团的最长碳链
将卤素原子看做取代基,编号时从距简单取代基近的一端编号,
有碳碳双键时从距离碳碳双键近的一端开始编号
从简入繁
3-甲基-3-溴-1-丁烯
认识卤代烃
4.卤代烃的命名
2,4-二甲基-5-溴-2-碘己烷
CH3CH2CH2CH2—Cl
CH3CH2CHCH3
Cl
—
CH3—C—CH3
Br
—
—
CH3
1-氯丁烷
2-氯丁烷
2-甲基-2-溴丙烷
3-甲基- 1,1-二溴戊烷
认识卤代烃
名称 结构简式 液态时密度/(g·cm-3) 沸点/℃
一氯甲烷 CH3Cl 0.916 -24
一氯乙烷 CH3CH2Cl 0.898 12
1-氯丙烷 CH3CH2CH2Cl 0.890 46
1-氯丁烷 CH3CH2CH2CH2Cl 0.886 78
1-氯戊烷 CH3CH2CH2CH2CH2Cl 0.882 108
以氯代烃的密度和沸点为例,同时结合烷烃的物理性质的变化规律,总结卤代烃的物理性质。
认识卤代烃
常温下除一氯甲烷、氯乙烷、氯乙烯等少数是气体外,
大多数为液体或固体。
除脂肪烃的一氟代物和一氯代物外,其余卤代烃密度都比水大。
一般随着烃基中碳原子数目的增加而减小。
卤代烃不溶于水,可溶于有机溶剂,某些卤代烃本身就是有机溶剂。
熔沸点大于同碳个数的烃,随碳原子数增多,沸点依次升高(碳原子数相同时,支链越多沸点越低)。
状态
沸点
密度
溶解性
认识卤代烃
5.卤代烃的物理性质
C2H5Br
CH3CH2Br 或 C2H5Br
核磁共振氢谱图
分子式:
结构式:
结构简式:
官能团:
电子式:
有2种化学环境的H原子,则核磁共振有2组峰,强度比为3∶2
以溴乙烷为例学习卤代烃的性质
1.溴乙烷的组成和结构
球棍模型
空间填充模型
—C—X(碳溴键)
颜 色:
状 态:
密 度:
溶解性:
沸 点:
无色透明
油状液体
比水大
不溶于水,
易溶于有机溶剂
沸点38.4℃
易挥发
对 比
无色
气体
-88.6 ℃
不溶于水
CH3CH3
比水小
>
卤代烃的熔沸点大于同C原子数的烃!
以溴乙烷为例学习卤代烃的性质
2.溴乙烷的物理性质
分析卤代烃的结构特点,推测卤代烃具有怎样的化学性质。
卤代烃中卤素原子吸引电子能力较强,共用电子对偏向卤素原子,使C—X具有较强的极性,所以卤代烃具有较强的反应活性,易发生取代反应和消去反应。
碳卤键
官能团:
X
C
δ—
δ+
例:溴乙烷和乙烷的结构相似,区别在于C—H与C—Br的不同。C—Br为极性键,由于溴原子吸引电子能力强,C—Br易断裂,使溴原子易被取代。
以溴乙烷为例学习卤代烃的性质
提出问题1:
溴乙烷(CH3CH2Br) 在水中能否电离出Br﹣?它是否为电解质?请设计实验证明。
实验:
无明显变化
溴乙烷不是电解质,不能电离出Br-。
提出问题2:CH3CH3+水→不反应,CH3CH2Br+H2O →
科学猜测:若反应,可能有 产生。
怎样证明有Br﹣产生?
资料卡片
C2H5Br与水的反应要在碱性环境下才容易进行
Br﹣
对溴乙烷化学性质的探索
实验装置
实验现象 ①中溶液_____ ;②中有机层厚度减小;④中有 生成
实验解释 溴乙烷与NaOH溶液共热产生了______
分层
淡黄色沉淀
Br-
【实验3-1】
(以溴乙烷为例)
卤代烃的化学性质
1.取代反应(水解反应)
CH3CH2—Br + Na—OH CH3CH2—OH + NaBr
H2O
△
从平衡移动的角度看,NaOH不断中和氢溴酸,促进溴乙烷的水解;加热的目的是提高反应速率,且水解是吸热反应,升高温度也有利于平衡右移。水相当于是催化剂
反应条件:
NaOH水溶液、加热
反应原理:
羟基取代溴原子
C2H5—Br +H—OH C2H5—OH + HBr
△
NaOH + HBr === NaBr + H2O
总反应:
所有卤代烃在碱性水溶液中都会发生水解反应
1.取代反应(水解反应)
(以溴乙烷为例)
卤代烃的化学性质
(1)在实验中加入过量稀硝酸的目的是什么?
①中和过量的NaOH溶液;②检验生成的沉淀是否溶于稀HNO3
(3)检验卤代烃中的卤原子一般流程:
AgNO3溶液
NaOH溶液
水解
HNO3溶液
酸化
R—X
AgCl 白色沉淀
AgBr 浅黄色沉淀
AgI 黄色沉淀
该步骤必不可少
思考:
(2)若不加稀硝酸,直接滴加AgNO3(aq),将会看到什么现象?
过量的NaOH与AgNO3反应,产生黑褐色的Ag2O↓
NaOH+AgNO3 === AgOH↓+NaNO3
2AgOH === Ag2O↓ +H2O
(以溴乙烷为例)
卤代烃的化学性质
在卤代烃分子中,由于卤素原子的吸电子作用,不仅使得α-C带部分正电荷,也使β-C带有更少量的正电荷,从而使β-H的活泼性增强,能在强碱的作用下,失去一分子卤化氢,生成烯烃,这就是卤代烃的消去反应。
C
C
Br
H
H
H
H
H
Br
δ+
δ-
δ+
(以溴乙烷为例)
卤代烃的化学性质
(以溴乙烷为例)
卤代烃的化学性质
现象:
高锰酸钾酸性溶液褪色
结论:
生成的气体分子中含有不饱和碳碳键
溴乙烷与NaOH的乙醇混合液
反应原理:
CH2—CH2 +NaOH CH2==CH2↑ + NaBr + H2O
Br
H
乙醇
△
有机化合物在一定条件下,从一个分子中脱去一个或几个小分子(如H2O、HX等),而生成不饱和键(双键或三键)的化合物的反应。。
消去反应:
2.消去反应(消除反应)
(以溴乙烷为例)
卤代烃的化学性质
思考:下列卤代烃能否发生消去反应?
①CH3I
CH2Br
③
Br
CH3CH CHCH3
Br
⑤
Br
⑥
CH3 C CH2Br
CH3
CH3
②
CH3CHBr2
④
由此你能得出什么结论?
(以溴乙烷为例)
卤代烃的化学性质
×
×
×
√
√
×
发生消去反应的条件:
①烃中碳原子数≥ 2
②连接卤素原子的相邻碳原子上有氢原子
反应条件:
+NaOH
— C— C—
H
X
醇
C==C
+ NaX + H2O
强碱的醇溶液、加热
物质结构条件:
(以溴乙烷为例)
卤代烃的化学性质
反应类型 消去反应 水解(取代)反应
反应条件
卤代烃的 断键规律
结构特点
产物特征
卤代烃的消去反应与取代(水解)反应的比较
NaOH醇溶液、加热
NaOH水溶液、加热
与X相连的C的邻位C上有H原子
含C—X键即可
消去HX,引入碳碳双键或碳碳三键
在碳上引入—OH,生成含—OH的有机物(醇)
(以溴乙烷为例)
卤代烃的化学性质
运用第一章所学的波谱方法检验取代产物1-丁醇
生成醇
生成烯烃
实验探究——1-溴丁烷的化学性质
CH3CH2CH2CH2Br
CH3CH2CH2CH2Br
CH3CH2CH2CH2OH、NaBr
CH3CH2CH=CH2、NaBr、H2O
+水
NaOH水溶液,加热
NaOH醇溶液,加热
1-溴丁烷和NaOH在不同条件下发生不同类型的反应
实验探究——1-溴丁烷的化学性质
还可以利用溴水、溴的CCl4溶液检验丁烯。
此时不需要先通入水中。
因受热而挥发的乙醇也能使高锰酸钾褪色,所以要先通过水除去乙醇,防止干扰实验。
乙醇与溴不反应,不会干扰乙烯的检验。
实验探究——1-溴丁烷的化学性质
2-丁烯
CH3-CH-CH2-CH3
Br
CH3-CH==CH-CH3
CH3-CH2-CH==CH2
(主产物)
1-丁烯
消去反应规则:当有多个产物时,以消H少的C原子上的H为主
“雪上加霜”
实验探究——1-溴丁烷的化学性质
卤代烯烃的某些化学性质与烯烃的相似,能发生加成反应和加聚反应。
聚氯乙烯和聚四氟乙烯都是用途广泛的高分子材料。
3.加成和加聚反应
卤代烃的化学性质
特富龙(Teflon)是美国杜邦公司对其研发的所有碳氢树脂的总称,包括聚四氟乙烯、聚全氟乙丙烯及各种共聚物。由于其独特优异的耐热(180℃-260℃)、耐低温(-200℃)、自润滑性及化学稳定性能等,而被称为“拒腐蚀、永不粘的特富龙”。
聚四氟乙烯不粘锅
聚四氟乙烯,俗称塑料王,具有最佳的耐热性和耐化学性,显示了独特的不粘性和润滑性。
?CF2—CF2?
生活中的卤代烃
运动场上的“化学大夫”
氯乙烷
液态的氯乙烷汽化时大量吸热,具有冷冻麻醉作用,可在身体局部产生快速镇痛效果。因此,常用氯乙烷与其他药物制成“复方氯乙烷气雾剂”,用于运动中的急性损伤,如肌肉拉伤、关节扭伤等的镇痛。
资料卡片
生活中的卤代烃
既可用于冰箱保鲜(-60℃),也可用于微波炉(+140℃)。
PVDC保鲜膜
聚偏二氯乙烯
PE保鲜膜
聚乙烯
PVC保鲜膜
聚氯乙烯
虽可用于食品包装,但在生产过程中需添加塑化剂。如在生产过程中添加了有毒塑化剂DEHA,则危害很大。
生活中的卤代烃
作业多多
老是写错
找到帮手
身体不适
医院就医
明白事因
涂改液中含有二氯乙烷、三氯乙烷、四氯乙烷等有机氯化合物对眼睛有明显的刺激作用,严重时会导恶心、呕吐、浑身不舒服等。
原来如此
生活中的卤代烃
卤代烃的“功”:
1)作溶剂:CHCl3(氯仿);CCl4;CH2Cl2
2)农药: “六六六”,DDT
3)制冷剂:氟氯代烷(商品名氟利昂) CHClF2、CCl2F2(冰箱用)
4)灭火剂: CCl4灭火剂 (电器类起火)
5)麻醉剂: CHCl3、氯乙烷
6)塑料: 聚四氟乙烯 (塑料王)、聚氯乙烯(PVC)
科学·技术·社会
→危害:氟氯烃——造成臭氧空洞的“罪魁祸首”
→卤代烃破坏臭氧层原理(了解):氟利昂可在强烈的紫外线作用下分解,产生的氯原子自由基会对臭氧层产生长久的破坏作用。以CCl3F为例,它破坏臭氧层的反应过程可表示为
实际上氯原子起了催化作用
卤代烃的“过”:
科学·技术·社会
课堂小结
1.下列卤代烃在NaOH醇溶液中不反应的是
2.下列卤代烃,在一定条件下能发生消去反应且产物只有一种的是
A B C D
巩固练习
3.某有机物的结构简式为 ,下列关于该物质的说法中正确的是
A.该物质在NaOH的醇溶液中加热可转化为醇类
B.该物质能和AgNO3溶液反应产生AgBr沉淀
C.该物质可以发生消去反应
D.该物质可与溴的四氯化碳溶液发生加成反应
巩固练习
4.化合物X的分子式为C5H11Cl,用NaOH的醇溶液处理X,可得分子式为C5H10的两种产物Y、Z,Y、Z经催化加氢后都可得到2-甲基丁烷。若将化合物X用NaOH的水溶液处理,则所得有机产物的结构简式可能是( )
A. CH3CH2CH2CH2CH2OH B.
C. D.
巩固练习
5.欲证明溴乙烷中溴元素的存在,下列操作步骤中正确的是
①加入硝酸银溶液 ②加入氢氧化钠溶液 ③加热 ④加入蒸馏水
⑤加入稀硝酸至溶液呈酸性 ⑥加入氢氧化钠醇溶液
A.④③①⑤ B.②③⑤①
C.④⑥③① D.⑥③④①
巩固练习
本节内容结束
