专题4 分子空间结构与物质性质 检测题(含解析) 2023-2024学年高二下学期化学苏教版(2019)选择性必修2
文档属性
| 名称 | 专题4 分子空间结构与物质性质 检测题(含解析) 2023-2024学年高二下学期化学苏教版(2019)选择性必修2 |

|
|
| 格式 | docx | ||
| 文件大小 | 693.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-06 00:00:00 | ||
图片预览


文档简介
专题4《分子空间结构与物质性质》检测题
一、单选题
1.等电子体具有原子数相同,电子数相同的特征,下列属于等电子体的一组微粒是
A.NO和CO2 B.NO2和CO2 C.SO2和CO2 D.CO和N2
2.某有机物的结构简式为HC≡CCH2CH=CH2,则该有机物分子中含有的键和键的数目分别为
A.11、3 B.10、3 C.11、4 D.10、4
3.干冰汽化时,下列所述内容发生变化的是
A.分子内共价键 B.分子间的作用力增大
C.分子间的距离 D.分子内共价键的键长
4.核素C的质量数为
A.6 B.8 C.14 D.20
5.已知带静电的有机玻璃棒靠近纯水的细流,细流会发生偏转,则用带静电的有机玻璃棒靠近下列物质的细流时,细流也发生偏转的是( )
A.苯 B.二硫化碳 C.双氧水 D.四氯化碳
6.下列有关叙述及相关解释均正确的是
选项 叙述 解释
A 键的极性的强弱: N-H>O-H>F-H 电负性: NB 稳定性:H2O>H2S 两种元素同主族,且半径OC 熔点: I形成分子内氢键,II形成分子间氢键
D 酸性: HI>HBr>HCl HI、HBr、HCI中的范德华力逐渐减小
A.A B.B C.C D.D
7.关于键长、键能和键角,下列说法正确的是
A.C≡C 键的键能等于 C-C 键键能的三倍
B.N2 的 N ≡N 键非常牢固,不易断裂
C.CN)2分子(结构式为 N ≡C C ≡N )中 N C 键的键长大于 C C 键的键长
D.白磷( P4 )分子呈正四面体结构,其键角为 109°28′
8.下列说法正确的是
A.的电子式为: B.是手性分子
C.晶体中,的空间构型与水分子不同 D.中N的杂化轨道:
9.氨硼烷(NH3BH3) 是一种新型储氢材料,分子结构和乙烷相似。分子中与N原子相连的H呈正电性(δ+),与B原子相连的H呈负电性(δ-),它们之间存在静电作用,称双氢键,用“N H H B”表示。下列说法错误的是
A.N和B元素均位于元素周期表的P区
B.第一电离能: N> B
C.氨硼烷的沸点高于乙烷
D.电负性:N>B>H
10.关于CO2说法正确的是
A.碳原子采取sp3杂化 B.CO2是直线型结构
C.干冰是原子晶体 D.CO2为极性分子
11.下列物质互为同素异形体的是
A.H2O和H2O2 B.H2和Cl2 C.金刚石和石灰石 D.O2和O3
12.中国科学院近代物理研究所人员成功合成了新核素,主要用于宇航飞行器的热源。可由转化而成,下列有关、的说法中正确的是
A.核外电子数分别为116、118 B.、化学性质相同
C.、在周期表中的位置不同 D.物质的量相等的、质量相同
13.有下列说法,①分子间作用力越大,分子越稳定;②离子化合物中只含有离子键;共价化合物一定不含离子键;③熔融状态下能导电的化合物一定是离子化合物④键长越长,共价键越牢固;⑤冰融化时水分子中的共价键发生了断裂;⑥杂化轨道只能用来形成键或容纳孤对电子;⑦CF4中中心原子采取杂化。其中正确的是
A.①③⑦ B.①②④⑤⑥
C.②④⑤⑥③ D.③⑥⑦
14.下列说法正确的是
A.甲醛(HCHO)和光气()分子中键角:∠H—C—H<∠Cl—C—Cl
B.用原子轨道描述氢分子中化学键的形成:
C.C原子的杂化轨道中s成分占比:—C≡CH<—CH=CH2
D.异硫氰酸(H—N=C=S)比硫氰酸(H—S—C≡N)的沸点高
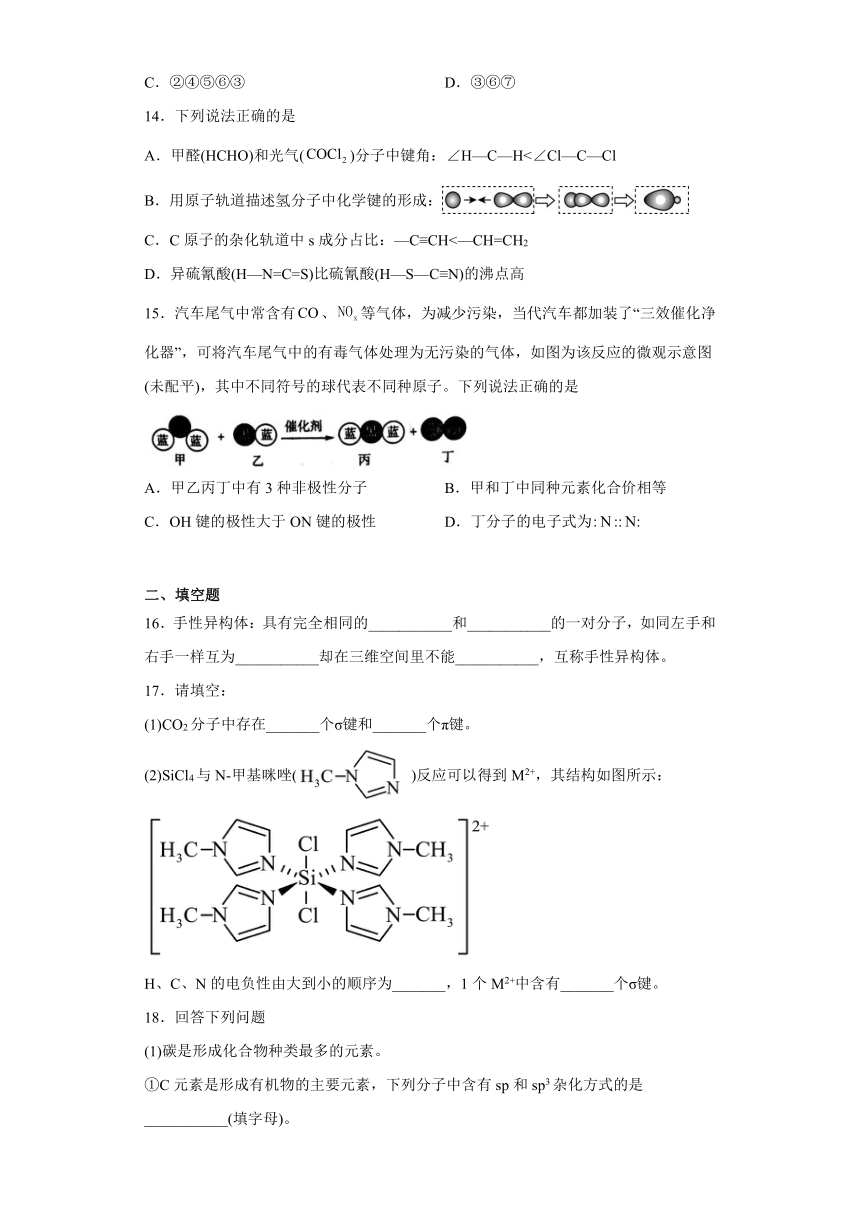
15.汽车尾气中常含有、等气体,为减少污染,当代汽车都加装了“三效催化净化器”,可将汽车尾气中的有毒气体处理为无污染的气体,如图为该反应的微观示意图(未配平),其中不同符号的球代表不同种原子。下列说法正确的是
A.甲乙丙丁中有3种非极性分子 B.甲和丁中同种元素化合价相等
C.OH键的极性大于ON键的极性 D.丁分子的电子式为
二、填空题
16.手性异构体:具有完全相同的___________和___________的一对分子,如同左手和右手一样互为___________却在三维空间里不能___________,互称手性异构体。
17.请填空:
(1)CO2分子中存在_______个σ键和_______个π键。
(2)SiCl4与N-甲基咪唑( )反应可以得到M2+,其结构如图所示:
H、C、N的电负性由大到小的顺序为_______,1个M2+中含有_______个σ键。
18.回答下列问题
(1)碳是形成化合物种类最多的元素。
①C元素是形成有机物的主要元素,下列分子中含有sp和sp3杂化方式的是___________(填字母)。
a. b. c. d.
②乙醇()与二甲醚()的分子式均为,但的沸点高于的沸点,其原因是___________。
(2)肼的性质与氨气相似,易溶于水,可发生两步电离过程,第一步电离过程,试写出第二步电离过程___________。常温下,某浓度溶液的pH为4,则该溶液中水电离出的___________。
(3)液氨中存在平衡:。如图1所示为电解池装置,以的液氨溶液为电解液,电解过程中a、b两个惰性电极上都有气泡产生。b电极连接的是电源的___________(填“正”或“负”)极;a电极的反应为___________。电解过程中,阴极附近浓度___________(填“增大”“减小”或“不变”);理论上阴、阳极产生的气体物质的量之比为___________。
(4)柠檬酸的结构简式如下图。1mol柠檬酸分子中碳原子与氧原子形成的键的数目为___________。
(5)基态Fe原子有___________个未成对电子,的价电子排布图(轨道表达式)为___________;Se基态核外电子排布式为___________。
三、实验题
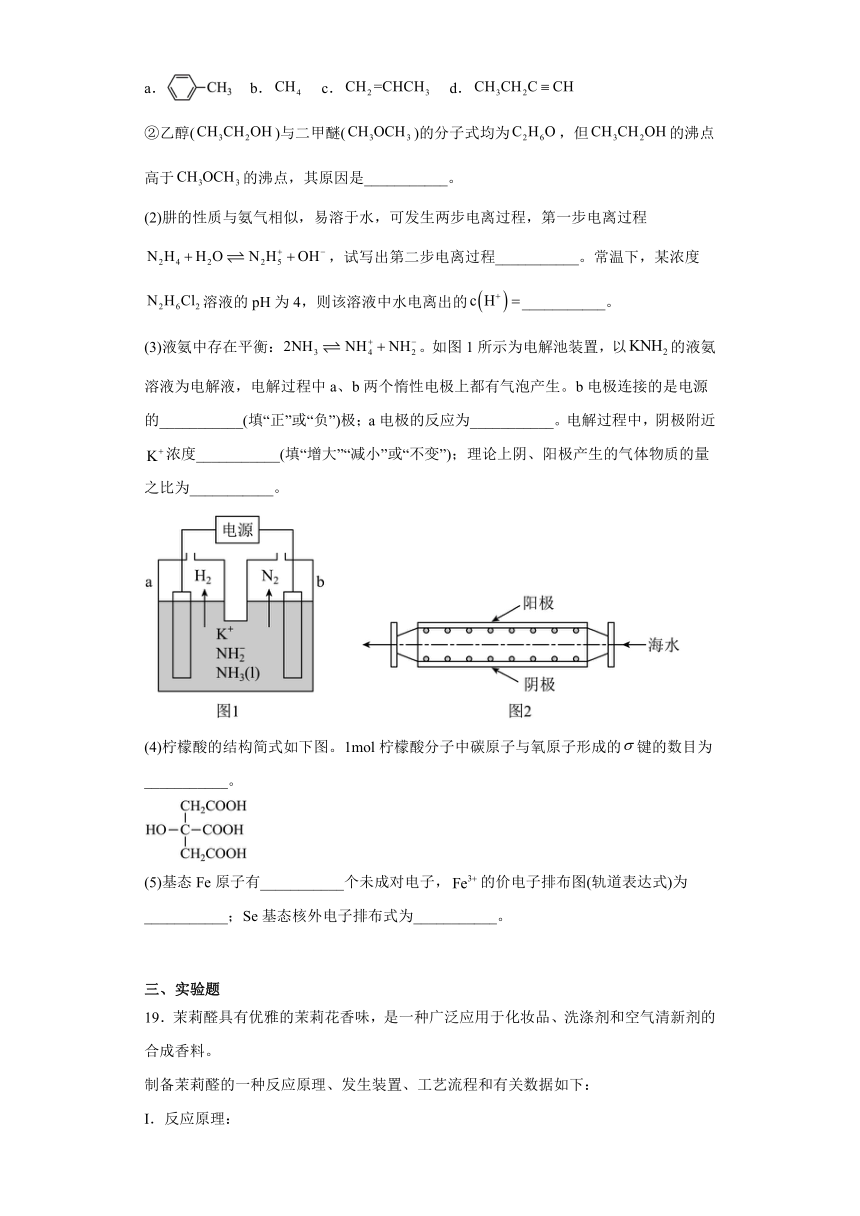
19.茉莉醛具有优雅的茉莉花香味,是一种广泛应用于化妆品、洗涤剂和空气清新剂的合成香料。
制备茉莉醛的一种反应原理、发生装置、工艺流程和有关数据如下:
I.反应原理:
II.发生装置:
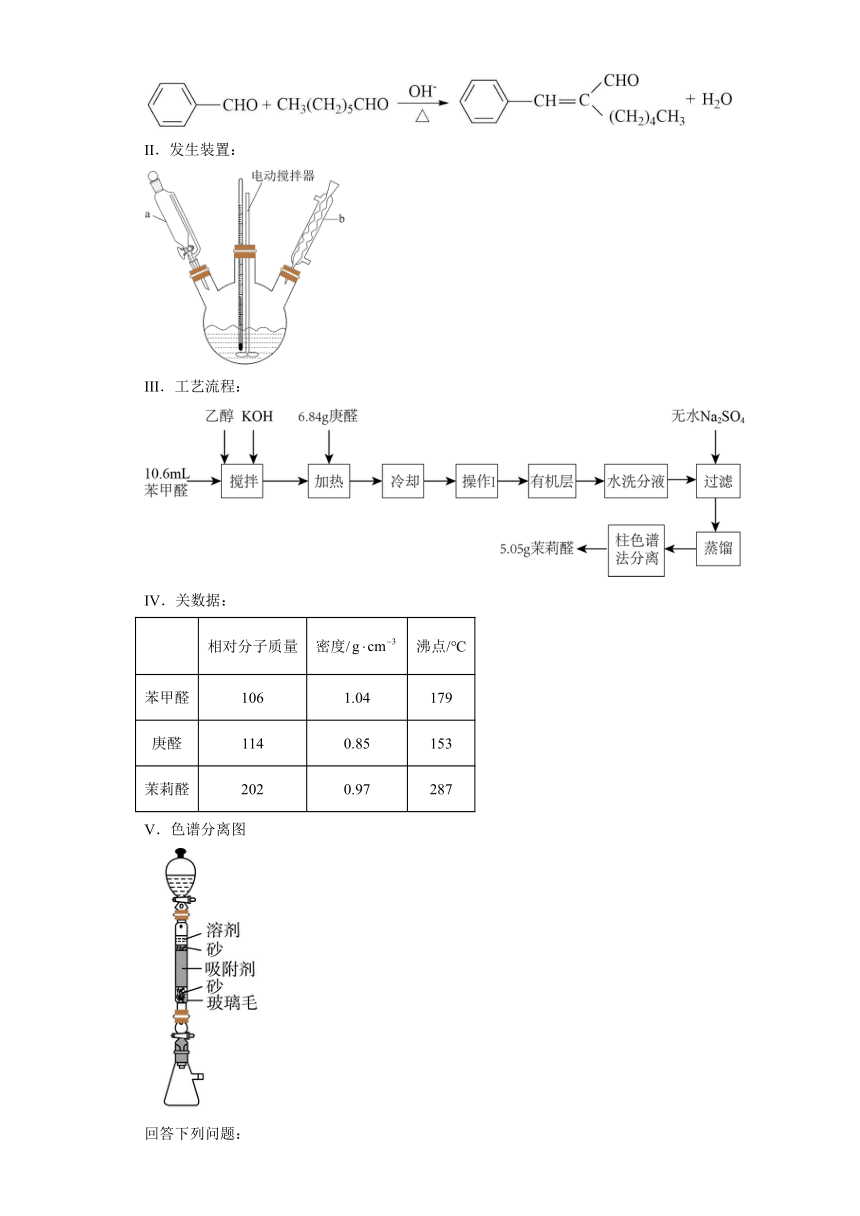
III.工艺流程:
IV.关数据:
相对分子质量 密度/ 沸点/℃
苯甲醛 106 1.04 179
庚醛 114 0.85 153
茉莉醛 202 0.97 287
V.色谱分离图
回答下列问题:
(1)仪器b的名称是______;a与普通分液漏斗相比,其优点是______。
(2)“搅拌”中加入乙醇的作用是______;“加热”中需保持温度为60~65℃,应采取的加热方法是______;“操作I”的名称是______。
(3)柱色谱分离法是利用吸附剂对物质吸附能力的不同,进行物质分离提纯的一种方法。吸附剂一般难溶于水、表面积比较大,可选用下列物质中______作吸附剂。(填正确选项)
a.氯化钠 B.活性炭
(4)茉莉醛分子中碳原子的杂化方式为______。
(5)根据题中所给数据,所得茉莉醛产率约为______%(保留三位有效数字)。
20.某小组同学探究FeCl3溶液显黄色的原因。
资料:FeCl3溶液中存在如下化学平衡:[Fe(H2O)6]3++ H2O[Fe(H2O)5(OH)]2++ H3O+
I.猜想与预测
小组同学认为可能是Fe3+与其他微粒配位形成的配离子导致溶液显黄色,进而提出以下猜想:
i.Fe3+与OH-配位
ii.Fe3+与H2O配位
iii.Fe3+与Cl-配位
(1)上述微粒能形成配离子的原因是___________。
II.实验与分析
为验证猜想i,小组同学设计并完成了以下实验。
实验 实验操作 实验现象
a 向2 mL FeCl3溶液中加0.5 mL稀硝酸 溶液由黄色变为浅黄色
b 向2 mL FeCl3溶液中加0.5 mL水 溶液黄色略变浅
(2)实验b的目的是___________。
(3)甲同学认为综合上述实验证明猜想i成立,乙同学认为不严谨,并进行了如下实验探究。
实验c:向2 mL黄色的Fe(NO3)3溶液中滴加2滴稀硝酸,观察到溶液由黄色变为无色。
①乙同学认为甲同学结论不严谨的理由是___________。
②乙同学认为实验c可以证明猜想i成立,猜想ii不成立,理由是___________。
③小组同学进一步设计实验证明了猜想iii成立。该实验为:向实验c所得无色溶液中加入少量___________,溶液由无色变为黄色。
III.结论与反思
(4)综合上述现象解释FeCl3溶液显黄色的原因是______。
(5)向2 mL FeCl3溶液中加0.5 mL稀盐酸,溶液黄色没有明显变化,用平衡移动原理解释:______。
四、计算题
21.倍半硅氧烷在液晶显示、塑料阻燃、生物医用等领域具有重要应用,氢基倍半硅氧烷的分子结构如图A所示,其加热分解产物中SiO2的晶胞结构如图B所示。回答下列问题:
(1)基态Si原子的核外电子排布式为_______,其中每对成对电子之间的区别是_______。
(2)图A分子结构中,一个硅原子被3个_______元环共用,该分子的分子式为_______。
(3)图A分子结构中H元素的化合价为_______,O原子采用_______杂化,形成的极性共价键类型为(电子云重叠方式)_______;键的极性:Si-O键_______Si-H键(填“>”“<”或“=”)。
(4)氢基倍半硅氧烷为_______晶体,SiO2为_______晶体。
(5)每个SiO2晶胞中含有O原子的个数为_______;已知SiO2晶体为面心立方结构,晶胞参数为anm,阿伏加德罗常数的值为NA,则SiO2晶体的密度为_______g cm-3。
试卷第4页,共7页
参考答案:
1.D
【分析】原子数和最外层电子数均相同的微粒为等电子体。
【详解】A.NO和CO2原子数不同,最外层电子数分别为11和16,即最外层电子数也不相同,A不符题意;
B.NO2和CO2的最外层电子数分别为17和16,最外层电子数不同,B不符题意;
C.SO2和CO2的最外层电子数分别为18和16,最外层电子数不同,C不符题意;
D.CO和N2的原子数均为2,最外层电子数均为10,二者为等电子体,D符合题意;
答案选D。
2.B
【详解】单键全部为σ键,双键中有1个σ键和1个π键,三键中有1个σ键和2个π键,故该有机物分子中的碳氢σ键6个,碳碳σ键4个,因此σ键总数为10个,π键总数为3个,故B正确。
综上所述,答案为B。
3.C
【详解】汽化是液态变气态的过程,是物理变化,二氧化碳分子没有改变,只是分子间的距离发生了变化,因此分子内的共价键没有任何变化、共价键的键长自然而然也不变,由于分子间距离增大,分子间的作用力被减弱,C符合题意。
故选:C。
4.C
【详解】根据核素符号中左上角为质量数,左下角为质子数,所以核素C的质量数为14。故选C。
5.C
【分析】带静电的有机玻璃棒靠近纯水的细流,细流会发生偏转说明水是极性分子。
【详解】A. 苯的结构对称,为非极性分子,电荷分布均匀,用带静电的有机玻璃棒靠近下列物质的细流时,细流不发生偏转,故A错误;
B.二硫化碳的结构对称,为非极性分子,电荷分布均匀,用带静电的有机玻璃棒靠近下列物质的细流时,细流不发生偏转,故B错误;
C. 双氧水的结构不对称,为极性分子,电荷分布不均匀,用带静电的有机玻璃棒靠近时,细流会发生偏转,故C正确;
D.四氯化碳的结构对称,为非极性分子,电荷分布均匀,用带静电的有机玻璃棒靠近下列物质的细流时,细流不发生偏转,故D错误;
答案选C。
6.B
【详解】A. 电负性:NB. 同主族从上到下半径增大,非金属减弱,则气态氢化物的稳定性H2O>H2S,与故项B正确;
C. I分子形成分子内氢键,分子间作用力小,II分子形成分子间氢键,分子间作用力大,熔点:ID. 酸性:HI>HBr>HCl,HI、HBr、HCI中共价键越来越强,在水中电离能力变弱,故D项错误;
综上所述,本题正确答案为B。
7.B
【详解】A.碳碳三键中两个是π键,一个是σ键,碳碳单键是σ键,C≡C的键能小于C-C的键能的三倍,故A错误;
B.氮分子中的N≡N键的键能较大,使得N≡N键非常牢固,不易断裂,故B正确;
C.同一周期元素中,原子半径随着原子序数的增大而减小,原子半径越大其形成的共价键的键长越长,碳原子半径大于氮原子,所以氰分子中C≡N键长小于C≡C键长,而C≡C键长又小于C C 键的键长,因此N≡C 键的键长小于 C C 键的键长,故C错误;
D.白磷的分子的结构为,白磷分子呈正四面体,键角60°,故D错误;
故选B。
8.B
【详解】A.为共价化合物,N和F之间共用1对电子,N和N之间共用1对电子,N和F最外层电子数均为8,电子式为,故A错误;
B.的中心碳原子连接的四个基团不相同,是手性分子;故B正确;
C.的孤电子对为,价层电子对数为4,有两对孤电子对,离子的几何构型为V型,与水分子相同,故C错误;
D.中每个N原子含有1对孤电子对,VSEPR模型为四面体,N原子的杂化形式为sp3,故D错误;
故答案选B。
9.D
【详解】A.N元素基态原子价层电子排布式为2s22p3,B元素基态原子价层电子排布式为2s22p1,两种元素均位于元素周期表的P区,故A正确;
B.根据同周期从左到右第一电离能呈增大趋势,因此第一电离能: N> B,故B正确;
C.它们之间存在静电作用,称双氢键,用“N H H B”表示,则氨硼烷的沸点高于乙烷,故C正确;
D.根据分子中与N原子相连的H呈正电性(δ+),与B原子相连的H呈负电性(δ-),因此电负性:N>H>B,故D错误。
综上所述,答案为D。
10.B
【详解】CO2分子中,中心原子的确是采取的sp杂化,干冰是分子晶体,CO2为含极性键的非极性分子。答案选B。
11.D
【解析】由同种元素形成的不同单质互为同素异形体,互为同素异形体的物质需要满足两个条件,即同种元素、不同单质,由此分析。
【详解】A.H2O和H2O2都是化合物,不是单质,不属于同素异形体,故A不符合题意;
B.H2和Cl2是单质,但不是同种元素组成的单质,故B不符合题意;
C.金刚石是碳的单质,石灰石的主要成分是碳酸钙,不是单质,金刚石和石灰石不属于同素异形体,故C不符合题意;
D.O2和O3都是氧元素形成的不同单质,互为同素异形体,故D符合题意;
答案选D。
12.B
【详解】A.、质子数相同,核外电子数相同均为89,中子数不同分别为116、118,A错误;
B.、的核外电子排布相同,故二者的化学性质几乎相同,B正确;
C.、互为同位素,质子数相同,在元素周期表中的位置相同,C错误;
D.、的质量数不同,故相同物质的量的和的质量不同,D错误;
故选B。
13.D
【详解】①分子间作用力影响分子的物理性质,不影响物质的化学性质,而分子的稳定性属于化学性质,故①错误;
②离子化合物一定含有离子键,可能含有共价键,例如NaOH既含有离子键,又含有共价键,故②错误;
③熔融状态下能导电的化合物说明由阴、阳离子组成的,故一定是离子化合物,故③正确;
④共价键的键长越长,键能越小,共价键越不牢固,故④错误;
⑤冰融化时,水由固态变为液态,破坏氢键和分子间作用力,水分子中共价键没有断裂,故⑤错误;
⑥杂化轨道形成的键都是键,而双键、三键中的π键都是未杂化的轨道形成的,故杂化轨道只用于形成键或用于容纳未参与成键的孤对电子,故⑥正确;
⑦CF4中中心原子形成了4个键,孤电子对数为0,C杂化方式为:杂化,故⑦正确;
正确的是③⑥⑦;
故选D。
14.D
【详解】A.甲醛(HCHO)和光气()分子中,碳原子都采取sp2杂化,但Cl的电负性大于H,H-C比Cl-C共用电子对靠近碳原子,H-C中C的两对成键电子对排斥力大,H-C键角大,故A错误;
B.氢气分子的形成是两个球形的s轨道形成H-H键,故B错误;
C.—C≡CH中C采取sp杂化,s轨道占,—CH=CH2中C采取sp2杂化,s轨道占,故C错误;
D.异硫氰酸(H—N=C=S)可以形成分子间氢键,硫氰酸(H—S—C≡N)不能,故异硫氰酸(H—N=C=S)比硫氰酸(H—S—C≡N)的沸点高,故D正确;
故答案为D。
15.C
【详解】A.、在催化剂作用下转化为无污染的气体,由该反应的微观示意图可知,其化学方程式为,甲、乙、丙、丁中、为非极性分子,、为极性分子,A项错误;
B.、中N元素的化合价分别为、0,B项错误;
C.电负性插值越大,共价键的极性越强。N的电负性大于H,键的极性大于键的极性,C项正确;
D.的电子式为,D项错误。
故选C。
16. 组成 原子 镜像 叠合
【解析】略
17.(1) 2 2
(2) N>C>H 54
【详解】(1)CO2分子的结构式为O=C=O,则1个CO2分子含2个σ键和2个π键。
(2)元素的非金属性越强,其电负性越大,元素的非极性强弱顺序为N>C>H,则元素电负性的大小顺序为N>C>H;M2+离子的结构中含有单键、双键和配位键,单键和配位键都是σ键,双键中含有1个σ键,则离子中含有54个σ键。
18.(1) d 乙醇中分子间能形成氢键,甲醚不能形成氢键,导致乙醇的沸点高于甲醚
(2) N2H+H2ON2H+OH- 1×10 4 mol L 1
(3) 正 增大 3:1
(4)7
(5) 4 [Ar]3d104s24p4
【详解】(1)①a.中苯环上的碳原子价层电子对数为3,是sp2杂化,甲基上的碳原子价层电子对数为4,是sp3杂化;
b.的碳原子价层电子对数为4,是sp3杂化;
c.中前两个的碳原子价层电子对数为3,是sp2杂化,后面的碳原子价层电子对数为4,是sp3杂化;
d.四个碳原子价层电子对数分别为4、3、2、2,杂化类型分别为sp3、sp2、sp、sp杂化;故答案为:d。
②的沸点高于的沸点,其原因是两者都是分子,乙醇存在分子间氢键,而甲醚不能形成分子间氢键,因此甲醚的沸点比乙醇沸点低;故答案为:乙醇中分子间能形成氢键,甲醚不能形成氢键,导致乙醇的沸点高于甲醚。
(2)肼的性质与氨气相似,易溶于水,可发生两步电离过程,第一步电离过程,根据第一步分析得到第二步电离生成二价阳离子和氢氧根,其电离过程。常温下,某浓度溶液的pH为4,则该溶液中水解显酸性,因此溶液中的氢离子就是水电离出的氢离子,则水电离出的1.0×10 4mol L 1;故答案为:;1.0×10 4mol L 1。
(3)根据题意得到b电极产生氮气,是氨气中氮化合价升高,失去电子,因此b为阳极,则b电极连接的是电源的正极;a电极为阴极,生成氢气,其电极反应式为。电解过程中,阳离子移向阴极,因此阴极附近浓度增大;根据得失电子守恒相等,生成1mol氮气转移6mol电子,生成1mol氢气转移2mol电子,则理论上阴、阳极产生的气体物质的量之比为3:1;故答案为:正;;增大;3:1。
(4)1个羧基中碳原子与氧形成2个σ键,1个羟基与碳形成1个σ键,因此1mol柠檬酸分子中碳原子与氧原子形成的σ键σ键的数目为7mol;故答案为:7。
(5)基态Fe原子价层电子排布式为3d64s2,有4个未成对电子,的价电子排布式为3d5,价电子排布图(轨道表达式)为;Se为34号元素,其基态核外电子排布式为[Ar]3d104s24p4;故答案为:4;;[Ar]3d104s24p4。
19.(1) 球形冷凝管 内外压强相通,便于液体顺利流下
(2) 做溶剂,增加苯甲醛的溶解度 水浴加热 分液
(3)B
(4)、
(5)41.7
【分析】茉莉醛是苯甲醛和庚醛在碱性条件下水浴加热反应得到,用乙醇溶解苯甲醛和KOH,再加入庚醛在水浴条件下反应,冷却后分液得到有机层,再水洗分液、过滤,再蒸馏,柱色谱分离,最终得到产品。
【详解】(1)根据图中信息得到仪器b的名称是球形冷凝管;仪器a是恒压分液漏斗,a与普通分液漏斗相比,其优点是内外压强相通,便于液体顺利流下;故答案为:球形冷凝管;内外压强相通,便于液体顺利流下。
(2)整个反应中乙醇没有作反应物,因此“搅拌”中加入乙醇的作用是做溶剂,增加苯甲醛的溶解度;“加热”中需保持温度为60~65℃,应采取的加热方法是水浴加热;根据“操作I”后得到有机层,说明“操作I”的名称是分液;故答案为:做溶剂,增加苯甲醛的溶解度;水浴加热;分液。
(3)吸附剂一般难溶于水、表面积比较大,活性炭具有表面积大,难溶于水,而氯化钠易溶于水,因此可选用活性炭作吸附剂;故答案为:B。
(4)茉莉醛分子中 (CH2)4CH3中碳原子都为sp3杂化,其他的碳原子都是sp2杂化,因此分子中碳原子的杂化方式为、;故答案为:、。
(5)10.6mL苯甲醛物质的量为,6.84g庚醛物质的量为,则按照庚醛进行计算得到茉莉醛物质的量为0.06mol,根据题中所给数据,所得茉莉醛产率约为;故答案为:41.7。
20.(1)Fe3+具有空轨道,OH-、H2O、Cl-可以提供孤对电子
(2)控制Fe3+离子浓度相同
(3) 实验b加0.5mL水,溶液黄色略变浅,不能排除Fe3+与H2O、Cl-是否配位 滴加2滴稀硝酸,观察到溶液由黄色变为无色,说明[Fe(H2O)6]3++H2O [Fe(H2O)5(OH)]2++H3O+逆向移动 固体氯化钠
(4)Fe3+与OH-配位和Fe3+与Cl-配位
(5)增大氢离子浓度,Fe3+与OH-配位被破坏颜色变浅,溶液黄色没有明显变化,增大氯离子浓度,Fe3+与Cl-配位增大颜色加深,二者相互抵消,向2mLFeCl3溶液中加0.5mL稀盐酸,溶液黄色没有明显变化
【详解】(1)上述微粒能形成配离子的原因是Fe3+具有空轨道,OH-、H2O、Cl-可以提供孤对电子,故答案为:Fe3+具有空轨道,OH-、H2O、Cl-可以提供孤对电子;
(2)实验b的目的是对照试验,控制Fe3+离子浓度相同,故答案为:控制Fe3+离子浓度相同;
(3)①乙同学认为甲同学结论不严谨的理由是:实验b加0.5mL水,溶液黄色略变浅,不能排除Fe3+与H2O、Cl-是否配位,故答案为:实验b加0.5mL水,溶液黄色略变浅,不能排除Fe3+与H2O、Cl-是否配位;
②实验c:向2mL黄色的Fe(NO3)3溶液中滴加2滴稀硝酸,观察到溶液由黄色变为无色,说明[Fe(H2O)6]3++H2O [Fe(H2O)5(OH)]2++H3O+逆向移动,证明猜想ⅰ成立,猜想ⅱ不成立,故答案为:滴加2滴稀硝酸,观察到溶液由黄色变为无色,说明[Fe(H2O)6]3++H2O [Fe(H2O)5(OH)]2++H3O+逆向移动;
③小组同学进一步设计实验证明了猜想ⅲ成立该实验为:向实验c所得无色溶液中加入少量氯化钠固体,溶液由无色变为黄色,证明实验ⅲ.Fe3+与Cl-配位,故答案为:固体氯化钠;
(4)综合上述现象解释FeCl3溶液显黄色的原因是ⅰ.Fe3+与OH-配位和ⅲ.Fe3+与Cl-配位;故答案为:Fe3+与OH-配位和Fe3+与Cl-配位;
(5)向2mLFeCl3溶液中加0.5mL稀盐酸,增大氢离子浓度,Fe3+与OH-配位被破坏颜色变浅,溶液黄色没有明显变化,增大氯离子浓度,Fe3+与Cl-配位增大颜色加深,二者相互抵消,向2mLFeCl3溶液中加0.5mL稀盐酸,溶液黄色没有明显变化,故答案为:增大氢离子浓度,Fe3+与OH-配位被破坏颜色变浅,溶液黄色没有明显变化,增大氯离子浓度,Fe3+与Cl-配位增大颜色加深,二者相互抵消,向2mLFeCl3溶液中加0.5mL稀盐酸,溶液黄色没有明显变化。
21.(1) 1s22s22p63s23p2/[Ne] 3s23p2 自旋方向相反
(2) 八 Si8H8O12
(3) 1 sp3 σ键 >
(4) 分子 共价/原子
(5) 8
【详解】(1)硅原子核外有14个电子,根据核外电子排布规律知,每个电子层上最多排2n2个电子,但最外层不大于8个电子,s能级上最多排2个电子,p能级上最多排6个电子,所以硅原子的核外电子排布式为1s22s22p63s23p2或者[Ne] 3s23p2;根据泡利原理成对电子自旋方向相反;
故答案为1s22s22p63s23p2或者[Ne] 3s23p2,自旋方向相反;
(2)A分子结构中Si原子位于顶点,被3个面所共有,每个面含有4个O原子和4个Si原子,共8个原子,硅的配位数为4;A为分子结构式,所有原子均为一个分子共有,分子中含有8个Si原子,8个H原子和12个O原子,故分子式为Si8H8O12;
故答案为八,Si8H8O12;
(3)A分子中O原子显 2价,则Si显+4价,H显 1价;O原子与Si原子形成2个σ共价键,且O原子还有2对孤对电子,即含有4个σ电子对,所以O原子采用的杂化类型为sp3杂化;两种元素非金属性差距越大极性越大,Si O之间的非金属性之差大于Si H之间的非金属性之差,所以Si O键的极性强于Si H键的极性;
故答案为 1,sp3,σ键,>;
(4)图A所示为氢基倍半硅氧烷的分子结构,所以则氢基倍半硅氧烷形成的晶体类型为分子晶体,而SiO2为原子晶体;
故答案为分子,原子;
(5)SiO2晶体为面心立方结构,每个SiO2晶胞含有Si原子的个数为,一个晶胞含有8个“SiO2”结构,所以一个晶胞的质量为,晶胞边长为anm,故SiO2晶体的密度=;
故答案为8,
一、单选题
1.等电子体具有原子数相同,电子数相同的特征,下列属于等电子体的一组微粒是
A.NO和CO2 B.NO2和CO2 C.SO2和CO2 D.CO和N2
2.某有机物的结构简式为HC≡CCH2CH=CH2,则该有机物分子中含有的键和键的数目分别为
A.11、3 B.10、3 C.11、4 D.10、4
3.干冰汽化时,下列所述内容发生变化的是
A.分子内共价键 B.分子间的作用力增大
C.分子间的距离 D.分子内共价键的键长
4.核素C的质量数为
A.6 B.8 C.14 D.20
5.已知带静电的有机玻璃棒靠近纯水的细流,细流会发生偏转,则用带静电的有机玻璃棒靠近下列物质的细流时,细流也发生偏转的是( )
A.苯 B.二硫化碳 C.双氧水 D.四氯化碳
6.下列有关叙述及相关解释均正确的是
选项 叙述 解释
A 键的极性的强弱: N-H>O-H>F-H 电负性: N
D 酸性: HI>HBr>HCl HI、HBr、HCI中的范德华力逐渐减小
A.A B.B C.C D.D
7.关于键长、键能和键角,下列说法正确的是
A.C≡C 键的键能等于 C-C 键键能的三倍
B.N2 的 N ≡N 键非常牢固,不易断裂
C.CN)2分子(结构式为 N ≡C C ≡N )中 N C 键的键长大于 C C 键的键长
D.白磷( P4 )分子呈正四面体结构,其键角为 109°28′
8.下列说法正确的是
A.的电子式为: B.是手性分子
C.晶体中,的空间构型与水分子不同 D.中N的杂化轨道:
9.氨硼烷(NH3BH3) 是一种新型储氢材料,分子结构和乙烷相似。分子中与N原子相连的H呈正电性(δ+),与B原子相连的H呈负电性(δ-),它们之间存在静电作用,称双氢键,用“N H H B”表示。下列说法错误的是
A.N和B元素均位于元素周期表的P区
B.第一电离能: N> B
C.氨硼烷的沸点高于乙烷
D.电负性:N>B>H
10.关于CO2说法正确的是
A.碳原子采取sp3杂化 B.CO2是直线型结构
C.干冰是原子晶体 D.CO2为极性分子
11.下列物质互为同素异形体的是
A.H2O和H2O2 B.H2和Cl2 C.金刚石和石灰石 D.O2和O3
12.中国科学院近代物理研究所人员成功合成了新核素,主要用于宇航飞行器的热源。可由转化而成,下列有关、的说法中正确的是
A.核外电子数分别为116、118 B.、化学性质相同
C.、在周期表中的位置不同 D.物质的量相等的、质量相同
13.有下列说法,①分子间作用力越大,分子越稳定;②离子化合物中只含有离子键;共价化合物一定不含离子键;③熔融状态下能导电的化合物一定是离子化合物④键长越长,共价键越牢固;⑤冰融化时水分子中的共价键发生了断裂;⑥杂化轨道只能用来形成键或容纳孤对电子;⑦CF4中中心原子采取杂化。其中正确的是
A.①③⑦ B.①②④⑤⑥
C.②④⑤⑥③ D.③⑥⑦
14.下列说法正确的是
A.甲醛(HCHO)和光气()分子中键角:∠H—C—H<∠Cl—C—Cl
B.用原子轨道描述氢分子中化学键的形成:
C.C原子的杂化轨道中s成分占比:—C≡CH<—CH=CH2
D.异硫氰酸(H—N=C=S)比硫氰酸(H—S—C≡N)的沸点高
15.汽车尾气中常含有、等气体,为减少污染,当代汽车都加装了“三效催化净化器”,可将汽车尾气中的有毒气体处理为无污染的气体,如图为该反应的微观示意图(未配平),其中不同符号的球代表不同种原子。下列说法正确的是
A.甲乙丙丁中有3种非极性分子 B.甲和丁中同种元素化合价相等
C.OH键的极性大于ON键的极性 D.丁分子的电子式为
二、填空题
16.手性异构体:具有完全相同的___________和___________的一对分子,如同左手和右手一样互为___________却在三维空间里不能___________,互称手性异构体。
17.请填空:
(1)CO2分子中存在_______个σ键和_______个π键。
(2)SiCl4与N-甲基咪唑( )反应可以得到M2+,其结构如图所示:
H、C、N的电负性由大到小的顺序为_______,1个M2+中含有_______个σ键。
18.回答下列问题
(1)碳是形成化合物种类最多的元素。
①C元素是形成有机物的主要元素,下列分子中含有sp和sp3杂化方式的是___________(填字母)。
a. b. c. d.
②乙醇()与二甲醚()的分子式均为,但的沸点高于的沸点,其原因是___________。
(2)肼的性质与氨气相似,易溶于水,可发生两步电离过程,第一步电离过程,试写出第二步电离过程___________。常温下,某浓度溶液的pH为4,则该溶液中水电离出的___________。
(3)液氨中存在平衡:。如图1所示为电解池装置,以的液氨溶液为电解液,电解过程中a、b两个惰性电极上都有气泡产生。b电极连接的是电源的___________(填“正”或“负”)极;a电极的反应为___________。电解过程中,阴极附近浓度___________(填“增大”“减小”或“不变”);理论上阴、阳极产生的气体物质的量之比为___________。
(4)柠檬酸的结构简式如下图。1mol柠檬酸分子中碳原子与氧原子形成的键的数目为___________。
(5)基态Fe原子有___________个未成对电子,的价电子排布图(轨道表达式)为___________;Se基态核外电子排布式为___________。
三、实验题
19.茉莉醛具有优雅的茉莉花香味,是一种广泛应用于化妆品、洗涤剂和空气清新剂的合成香料。
制备茉莉醛的一种反应原理、发生装置、工艺流程和有关数据如下:
I.反应原理:
II.发生装置:
III.工艺流程:
IV.关数据:
相对分子质量 密度/ 沸点/℃
苯甲醛 106 1.04 179
庚醛 114 0.85 153
茉莉醛 202 0.97 287
V.色谱分离图
回答下列问题:
(1)仪器b的名称是______;a与普通分液漏斗相比,其优点是______。
(2)“搅拌”中加入乙醇的作用是______;“加热”中需保持温度为60~65℃,应采取的加热方法是______;“操作I”的名称是______。
(3)柱色谱分离法是利用吸附剂对物质吸附能力的不同,进行物质分离提纯的一种方法。吸附剂一般难溶于水、表面积比较大,可选用下列物质中______作吸附剂。(填正确选项)
a.氯化钠 B.活性炭
(4)茉莉醛分子中碳原子的杂化方式为______。
(5)根据题中所给数据,所得茉莉醛产率约为______%(保留三位有效数字)。
20.某小组同学探究FeCl3溶液显黄色的原因。
资料:FeCl3溶液中存在如下化学平衡:[Fe(H2O)6]3++ H2O[Fe(H2O)5(OH)]2++ H3O+
I.猜想与预测
小组同学认为可能是Fe3+与其他微粒配位形成的配离子导致溶液显黄色,进而提出以下猜想:
i.Fe3+与OH-配位
ii.Fe3+与H2O配位
iii.Fe3+与Cl-配位
(1)上述微粒能形成配离子的原因是___________。
II.实验与分析
为验证猜想i,小组同学设计并完成了以下实验。
实验 实验操作 实验现象
a 向2 mL FeCl3溶液中加0.5 mL稀硝酸 溶液由黄色变为浅黄色
b 向2 mL FeCl3溶液中加0.5 mL水 溶液黄色略变浅
(2)实验b的目的是___________。
(3)甲同学认为综合上述实验证明猜想i成立,乙同学认为不严谨,并进行了如下实验探究。
实验c:向2 mL黄色的Fe(NO3)3溶液中滴加2滴稀硝酸,观察到溶液由黄色变为无色。
①乙同学认为甲同学结论不严谨的理由是___________。
②乙同学认为实验c可以证明猜想i成立,猜想ii不成立,理由是___________。
③小组同学进一步设计实验证明了猜想iii成立。该实验为:向实验c所得无色溶液中加入少量___________,溶液由无色变为黄色。
III.结论与反思
(4)综合上述现象解释FeCl3溶液显黄色的原因是______。
(5)向2 mL FeCl3溶液中加0.5 mL稀盐酸,溶液黄色没有明显变化,用平衡移动原理解释:______。
四、计算题
21.倍半硅氧烷在液晶显示、塑料阻燃、生物医用等领域具有重要应用,氢基倍半硅氧烷的分子结构如图A所示,其加热分解产物中SiO2的晶胞结构如图B所示。回答下列问题:
(1)基态Si原子的核外电子排布式为_______,其中每对成对电子之间的区别是_______。
(2)图A分子结构中,一个硅原子被3个_______元环共用,该分子的分子式为_______。
(3)图A分子结构中H元素的化合价为_______,O原子采用_______杂化,形成的极性共价键类型为(电子云重叠方式)_______;键的极性:Si-O键_______Si-H键(填“>”“<”或“=”)。
(4)氢基倍半硅氧烷为_______晶体,SiO2为_______晶体。
(5)每个SiO2晶胞中含有O原子的个数为_______;已知SiO2晶体为面心立方结构,晶胞参数为anm,阿伏加德罗常数的值为NA,则SiO2晶体的密度为_______g cm-3。
试卷第4页,共7页
参考答案:
1.D
【分析】原子数和最外层电子数均相同的微粒为等电子体。
【详解】A.NO和CO2原子数不同,最外层电子数分别为11和16,即最外层电子数也不相同,A不符题意;
B.NO2和CO2的最外层电子数分别为17和16,最外层电子数不同,B不符题意;
C.SO2和CO2的最外层电子数分别为18和16,最外层电子数不同,C不符题意;
D.CO和N2的原子数均为2,最外层电子数均为10,二者为等电子体,D符合题意;
答案选D。
2.B
【详解】单键全部为σ键,双键中有1个σ键和1个π键,三键中有1个σ键和2个π键,故该有机物分子中的碳氢σ键6个,碳碳σ键4个,因此σ键总数为10个,π键总数为3个,故B正确。
综上所述,答案为B。
3.C
【详解】汽化是液态变气态的过程,是物理变化,二氧化碳分子没有改变,只是分子间的距离发生了变化,因此分子内的共价键没有任何变化、共价键的键长自然而然也不变,由于分子间距离增大,分子间的作用力被减弱,C符合题意。
故选:C。
4.C
【详解】根据核素符号中左上角为质量数,左下角为质子数,所以核素C的质量数为14。故选C。
5.C
【分析】带静电的有机玻璃棒靠近纯水的细流,细流会发生偏转说明水是极性分子。
【详解】A. 苯的结构对称,为非极性分子,电荷分布均匀,用带静电的有机玻璃棒靠近下列物质的细流时,细流不发生偏转,故A错误;
B.二硫化碳的结构对称,为非极性分子,电荷分布均匀,用带静电的有机玻璃棒靠近下列物质的细流时,细流不发生偏转,故B错误;
C. 双氧水的结构不对称,为极性分子,电荷分布不均匀,用带静电的有机玻璃棒靠近时,细流会发生偏转,故C正确;
D.四氯化碳的结构对称,为非极性分子,电荷分布均匀,用带静电的有机玻璃棒靠近下列物质的细流时,细流不发生偏转,故D错误;
答案选C。
6.B
【详解】A. 电负性:N
C. I分子形成分子内氢键,分子间作用力小,II分子形成分子间氢键,分子间作用力大,熔点:I
综上所述,本题正确答案为B。
7.B
【详解】A.碳碳三键中两个是π键,一个是σ键,碳碳单键是σ键,C≡C的键能小于C-C的键能的三倍,故A错误;
B.氮分子中的N≡N键的键能较大,使得N≡N键非常牢固,不易断裂,故B正确;
C.同一周期元素中,原子半径随着原子序数的增大而减小,原子半径越大其形成的共价键的键长越长,碳原子半径大于氮原子,所以氰分子中C≡N键长小于C≡C键长,而C≡C键长又小于C C 键的键长,因此N≡C 键的键长小于 C C 键的键长,故C错误;
D.白磷的分子的结构为,白磷分子呈正四面体,键角60°,故D错误;
故选B。
8.B
【详解】A.为共价化合物,N和F之间共用1对电子,N和N之间共用1对电子,N和F最外层电子数均为8,电子式为,故A错误;
B.的中心碳原子连接的四个基团不相同,是手性分子;故B正确;
C.的孤电子对为,价层电子对数为4,有两对孤电子对,离子的几何构型为V型,与水分子相同,故C错误;
D.中每个N原子含有1对孤电子对,VSEPR模型为四面体,N原子的杂化形式为sp3,故D错误;
故答案选B。
9.D
【详解】A.N元素基态原子价层电子排布式为2s22p3,B元素基态原子价层电子排布式为2s22p1,两种元素均位于元素周期表的P区,故A正确;
B.根据同周期从左到右第一电离能呈增大趋势,因此第一电离能: N> B,故B正确;
C.它们之间存在静电作用,称双氢键,用“N H H B”表示,则氨硼烷的沸点高于乙烷,故C正确;
D.根据分子中与N原子相连的H呈正电性(δ+),与B原子相连的H呈负电性(δ-),因此电负性:N>H>B,故D错误。
综上所述,答案为D。
10.B
【详解】CO2分子中,中心原子的确是采取的sp杂化,干冰是分子晶体,CO2为含极性键的非极性分子。答案选B。
11.D
【解析】由同种元素形成的不同单质互为同素异形体,互为同素异形体的物质需要满足两个条件,即同种元素、不同单质,由此分析。
【详解】A.H2O和H2O2都是化合物,不是单质,不属于同素异形体,故A不符合题意;
B.H2和Cl2是单质,但不是同种元素组成的单质,故B不符合题意;
C.金刚石是碳的单质,石灰石的主要成分是碳酸钙,不是单质,金刚石和石灰石不属于同素异形体,故C不符合题意;
D.O2和O3都是氧元素形成的不同单质,互为同素异形体,故D符合题意;
答案选D。
12.B
【详解】A.、质子数相同,核外电子数相同均为89,中子数不同分别为116、118,A错误;
B.、的核外电子排布相同,故二者的化学性质几乎相同,B正确;
C.、互为同位素,质子数相同,在元素周期表中的位置相同,C错误;
D.、的质量数不同,故相同物质的量的和的质量不同,D错误;
故选B。
13.D
【详解】①分子间作用力影响分子的物理性质,不影响物质的化学性质,而分子的稳定性属于化学性质,故①错误;
②离子化合物一定含有离子键,可能含有共价键,例如NaOH既含有离子键,又含有共价键,故②错误;
③熔融状态下能导电的化合物说明由阴、阳离子组成的,故一定是离子化合物,故③正确;
④共价键的键长越长,键能越小,共价键越不牢固,故④错误;
⑤冰融化时,水由固态变为液态,破坏氢键和分子间作用力,水分子中共价键没有断裂,故⑤错误;
⑥杂化轨道形成的键都是键,而双键、三键中的π键都是未杂化的轨道形成的,故杂化轨道只用于形成键或用于容纳未参与成键的孤对电子,故⑥正确;
⑦CF4中中心原子形成了4个键,孤电子对数为0,C杂化方式为:杂化,故⑦正确;
正确的是③⑥⑦;
故选D。
14.D
【详解】A.甲醛(HCHO)和光气()分子中,碳原子都采取sp2杂化,但Cl的电负性大于H,H-C比Cl-C共用电子对靠近碳原子,H-C中C的两对成键电子对排斥力大,H-C键角大,故A错误;
B.氢气分子的形成是两个球形的s轨道形成H-H键,故B错误;
C.—C≡CH中C采取sp杂化,s轨道占,—CH=CH2中C采取sp2杂化,s轨道占,故C错误;
D.异硫氰酸(H—N=C=S)可以形成分子间氢键,硫氰酸(H—S—C≡N)不能,故异硫氰酸(H—N=C=S)比硫氰酸(H—S—C≡N)的沸点高,故D正确;
故答案为D。
15.C
【详解】A.、在催化剂作用下转化为无污染的气体,由该反应的微观示意图可知,其化学方程式为,甲、乙、丙、丁中、为非极性分子,、为极性分子,A项错误;
B.、中N元素的化合价分别为、0,B项错误;
C.电负性插值越大,共价键的极性越强。N的电负性大于H,键的极性大于键的极性,C项正确;
D.的电子式为,D项错误。
故选C。
16. 组成 原子 镜像 叠合
【解析】略
17.(1) 2 2
(2) N>C>H 54
【详解】(1)CO2分子的结构式为O=C=O,则1个CO2分子含2个σ键和2个π键。
(2)元素的非金属性越强,其电负性越大,元素的非极性强弱顺序为N>C>H,则元素电负性的大小顺序为N>C>H;M2+离子的结构中含有单键、双键和配位键,单键和配位键都是σ键,双键中含有1个σ键,则离子中含有54个σ键。
18.(1) d 乙醇中分子间能形成氢键,甲醚不能形成氢键,导致乙醇的沸点高于甲醚
(2) N2H+H2ON2H+OH- 1×10 4 mol L 1
(3) 正 增大 3:1
(4)7
(5) 4 [Ar]3d104s24p4
【详解】(1)①a.中苯环上的碳原子价层电子对数为3,是sp2杂化,甲基上的碳原子价层电子对数为4,是sp3杂化;
b.的碳原子价层电子对数为4,是sp3杂化;
c.中前两个的碳原子价层电子对数为3,是sp2杂化,后面的碳原子价层电子对数为4,是sp3杂化;
d.四个碳原子价层电子对数分别为4、3、2、2,杂化类型分别为sp3、sp2、sp、sp杂化;故答案为:d。
②的沸点高于的沸点,其原因是两者都是分子,乙醇存在分子间氢键,而甲醚不能形成分子间氢键,因此甲醚的沸点比乙醇沸点低;故答案为:乙醇中分子间能形成氢键,甲醚不能形成氢键,导致乙醇的沸点高于甲醚。
(2)肼的性质与氨气相似,易溶于水,可发生两步电离过程,第一步电离过程,根据第一步分析得到第二步电离生成二价阳离子和氢氧根,其电离过程。常温下,某浓度溶液的pH为4,则该溶液中水解显酸性,因此溶液中的氢离子就是水电离出的氢离子,则水电离出的1.0×10 4mol L 1;故答案为:;1.0×10 4mol L 1。
(3)根据题意得到b电极产生氮气,是氨气中氮化合价升高,失去电子,因此b为阳极,则b电极连接的是电源的正极;a电极为阴极,生成氢气,其电极反应式为。电解过程中,阳离子移向阴极,因此阴极附近浓度增大;根据得失电子守恒相等,生成1mol氮气转移6mol电子,生成1mol氢气转移2mol电子,则理论上阴、阳极产生的气体物质的量之比为3:1;故答案为:正;;增大;3:1。
(4)1个羧基中碳原子与氧形成2个σ键,1个羟基与碳形成1个σ键,因此1mol柠檬酸分子中碳原子与氧原子形成的σ键σ键的数目为7mol;故答案为:7。
(5)基态Fe原子价层电子排布式为3d64s2,有4个未成对电子,的价电子排布式为3d5,价电子排布图(轨道表达式)为;Se为34号元素,其基态核外电子排布式为[Ar]3d104s24p4;故答案为:4;;[Ar]3d104s24p4。
19.(1) 球形冷凝管 内外压强相通,便于液体顺利流下
(2) 做溶剂,增加苯甲醛的溶解度 水浴加热 分液
(3)B
(4)、
(5)41.7
【分析】茉莉醛是苯甲醛和庚醛在碱性条件下水浴加热反应得到,用乙醇溶解苯甲醛和KOH,再加入庚醛在水浴条件下反应,冷却后分液得到有机层,再水洗分液、过滤,再蒸馏,柱色谱分离,最终得到产品。
【详解】(1)根据图中信息得到仪器b的名称是球形冷凝管;仪器a是恒压分液漏斗,a与普通分液漏斗相比,其优点是内外压强相通,便于液体顺利流下;故答案为:球形冷凝管;内外压强相通,便于液体顺利流下。
(2)整个反应中乙醇没有作反应物,因此“搅拌”中加入乙醇的作用是做溶剂,增加苯甲醛的溶解度;“加热”中需保持温度为60~65℃,应采取的加热方法是水浴加热;根据“操作I”后得到有机层,说明“操作I”的名称是分液;故答案为:做溶剂,增加苯甲醛的溶解度;水浴加热;分液。
(3)吸附剂一般难溶于水、表面积比较大,活性炭具有表面积大,难溶于水,而氯化钠易溶于水,因此可选用活性炭作吸附剂;故答案为:B。
(4)茉莉醛分子中 (CH2)4CH3中碳原子都为sp3杂化,其他的碳原子都是sp2杂化,因此分子中碳原子的杂化方式为、;故答案为:、。
(5)10.6mL苯甲醛物质的量为,6.84g庚醛物质的量为,则按照庚醛进行计算得到茉莉醛物质的量为0.06mol,根据题中所给数据,所得茉莉醛产率约为;故答案为:41.7。
20.(1)Fe3+具有空轨道,OH-、H2O、Cl-可以提供孤对电子
(2)控制Fe3+离子浓度相同
(3) 实验b加0.5mL水,溶液黄色略变浅,不能排除Fe3+与H2O、Cl-是否配位 滴加2滴稀硝酸,观察到溶液由黄色变为无色,说明[Fe(H2O)6]3++H2O [Fe(H2O)5(OH)]2++H3O+逆向移动 固体氯化钠
(4)Fe3+与OH-配位和Fe3+与Cl-配位
(5)增大氢离子浓度,Fe3+与OH-配位被破坏颜色变浅,溶液黄色没有明显变化,增大氯离子浓度,Fe3+与Cl-配位增大颜色加深,二者相互抵消,向2mLFeCl3溶液中加0.5mL稀盐酸,溶液黄色没有明显变化
【详解】(1)上述微粒能形成配离子的原因是Fe3+具有空轨道,OH-、H2O、Cl-可以提供孤对电子,故答案为:Fe3+具有空轨道,OH-、H2O、Cl-可以提供孤对电子;
(2)实验b的目的是对照试验,控制Fe3+离子浓度相同,故答案为:控制Fe3+离子浓度相同;
(3)①乙同学认为甲同学结论不严谨的理由是:实验b加0.5mL水,溶液黄色略变浅,不能排除Fe3+与H2O、Cl-是否配位,故答案为:实验b加0.5mL水,溶液黄色略变浅,不能排除Fe3+与H2O、Cl-是否配位;
②实验c:向2mL黄色的Fe(NO3)3溶液中滴加2滴稀硝酸,观察到溶液由黄色变为无色,说明[Fe(H2O)6]3++H2O [Fe(H2O)5(OH)]2++H3O+逆向移动,证明猜想ⅰ成立,猜想ⅱ不成立,故答案为:滴加2滴稀硝酸,观察到溶液由黄色变为无色,说明[Fe(H2O)6]3++H2O [Fe(H2O)5(OH)]2++H3O+逆向移动;
③小组同学进一步设计实验证明了猜想ⅲ成立该实验为:向实验c所得无色溶液中加入少量氯化钠固体,溶液由无色变为黄色,证明实验ⅲ.Fe3+与Cl-配位,故答案为:固体氯化钠;
(4)综合上述现象解释FeCl3溶液显黄色的原因是ⅰ.Fe3+与OH-配位和ⅲ.Fe3+与Cl-配位;故答案为:Fe3+与OH-配位和Fe3+与Cl-配位;
(5)向2mLFeCl3溶液中加0.5mL稀盐酸,增大氢离子浓度,Fe3+与OH-配位被破坏颜色变浅,溶液黄色没有明显变化,增大氯离子浓度,Fe3+与Cl-配位增大颜色加深,二者相互抵消,向2mLFeCl3溶液中加0.5mL稀盐酸,溶液黄色没有明显变化,故答案为:增大氢离子浓度,Fe3+与OH-配位被破坏颜色变浅,溶液黄色没有明显变化,增大氯离子浓度,Fe3+与Cl-配位增大颜色加深,二者相互抵消,向2mLFeCl3溶液中加0.5mL稀盐酸,溶液黄色没有明显变化。
21.(1) 1s22s22p63s23p2/[Ne] 3s23p2 自旋方向相反
(2) 八 Si8H8O12
(3) 1 sp3 σ键 >
(4) 分子 共价/原子
(5) 8
【详解】(1)硅原子核外有14个电子,根据核外电子排布规律知,每个电子层上最多排2n2个电子,但最外层不大于8个电子,s能级上最多排2个电子,p能级上最多排6个电子,所以硅原子的核外电子排布式为1s22s22p63s23p2或者[Ne] 3s23p2;根据泡利原理成对电子自旋方向相反;
故答案为1s22s22p63s23p2或者[Ne] 3s23p2,自旋方向相反;
(2)A分子结构中Si原子位于顶点,被3个面所共有,每个面含有4个O原子和4个Si原子,共8个原子,硅的配位数为4;A为分子结构式,所有原子均为一个分子共有,分子中含有8个Si原子,8个H原子和12个O原子,故分子式为Si8H8O12;
故答案为八,Si8H8O12;
(3)A分子中O原子显 2价,则Si显+4价,H显 1价;O原子与Si原子形成2个σ共价键,且O原子还有2对孤对电子,即含有4个σ电子对,所以O原子采用的杂化类型为sp3杂化;两种元素非金属性差距越大极性越大,Si O之间的非金属性之差大于Si H之间的非金属性之差,所以Si O键的极性强于Si H键的极性;
故答案为 1,sp3,σ键,>;
(4)图A所示为氢基倍半硅氧烷的分子结构,所以则氢基倍半硅氧烷形成的晶体类型为分子晶体,而SiO2为原子晶体;
故答案为分子,原子;
(5)SiO2晶体为面心立方结构,每个SiO2晶胞含有Si原子的个数为,一个晶胞含有8个“SiO2”结构,所以一个晶胞的质量为,晶胞边长为anm,故SiO2晶体的密度=;
故答案为8,
