4.1 原子结构与元素周期表 同步练习题(含解析) 2023-2024学年高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 4.1 原子结构与元素周期表 同步练习题(含解析) 2023-2024学年高一上学期化学人教版(2019)必修第一册 |  | |
| 格式 | docx | ||
| 文件大小 | 137.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-06 14:49:25 | ||
图片预览


文档简介
4.1 原子结构与元素周期表 同步练习题
一、选择题
1.下列表格中各项分类都正确的一组是
类别 选项 同素异形体 混合物 强电解质 弱电解质 非电解质
A 和 氢氧化铁胶体 苛性钾 冰水混合物 乙醇
B 红磷和白磷 海水 浓硫酸 高氯酸 甲烷
C 金刚石和石墨 不锈钢 硫酸钡
D CaO和 空气 氯化钠 氨水 三氧化硫
A.A B.B C.C D.D
2.1811年提出分子学说,使人们对物质结构的认识发展到一个新的阶段,提出该学说的科学家是
A.波义耳 B.拉瓦锡 C.阿伏加德罗 D.道尔顿
3.下列说法中错误的是
①同位素的化学性质基本相同②质子数相同的微粒一定是同种元素③电子数相同的微粒不一定是同一种原子④某种元素的相对原子质量取整数,就是其质量数
A.①③ B.③④ C.①② D.②④
4.“科学技术是第一生产力”,高科技的发展与化学密切相关。下列说法错误的是
A.可人工合成葡萄糖和脂肪酸,葡萄糖属于单糖
B.氘氚核聚变可实现“人造太阳”,氘和氚互为同位素
C.利用全新原理可实现海水直接电解制氢,氢气是可再生能源
D.涤纶纤维可制作飞船着陆器的降落伞,涤纶是无机非金属材料
5.元素周期表中,第2、3、4周期元素的数目分别是
A.2、8、8 B.8、8、8 C.8、8、18 D.8、18、32
6.某粒子含有6个质子,7个中子,电荷为0,则它的化学符号是
A.13Al B.13Al C.13C D.13C
7.太空探索器常用制成的核电池提供动力,该钚原子的中子数与核外电子数之差为
A.238 B.144 C.94 D.50
8.磷存在于人体所有细胞中,是维持骨骼和牙齿的必要物质,几乎参与所有生理上的化学反应。下列关于白磷和红磷的说法中正确的是
A.化学性质和物理性质完全相同
B.都是由磷元素组成的,二者混合后仍属于纯净物
C.白磷转化为红磷属于物理变化
D.都是磷元素的同素异形体
二、非选择题
9.填空:
(1)微粒中的质子数是 ,中子数是 ,核外电子数是 。
(2)1.5mol CO2中含 mol碳原子, 个氧原子(以NA为阿伏加德罗常数的值),标准状况下的体积为 L。
(3)在一定温度和压强下,5体积气体A2跟15体积的气体B2完全化合生成10体积某气体C,则该气体C的化学式为(用A、B表示) 。
10.卢瑟福因其在科学上作出的巨大的贡献而获得诺贝尔奖。
(1)在研究原子结构时,对汤姆生的葡萄干面包模型,他进行了思索,如果这个模型的假设是正确的,那么用质量大而体积小且高速运动的微粒轰击金属薄膜,这一微粒应该是 (填“直线穿过”或“折线穿过”)金属薄膜。
(2)根据上述想法,卢瑟福用α粒子轰击金箔,α粒子的化学符号是 ,实验结果是绝大部分α粒子 ,说明原子是 (填“实心的”或“中空的”);极少数α粒子穿过金箔时发生了 ,有个别的α粒子竟然偏转了180°,被 ,说明原子中存在着体积很 (填“小”或“大”)的、质量很 (填“小”或“大”)的带正电的核。
11.下表显示了元素周期表中短周期的一部分,①~⑥代表6种短周期元素。
① ② ③
④ ⑤ ⑥
已知③与氢元素能组成生活中最常见的化合物X。请填写下列空白。
(1)①在周期表中的位置为 。
(2)②与氢元素可组成含10个电子的分子,其化学式为 。
(3)④的单质与X反应的离子方程式为 。
(4)与⑤同族的下一周期元素的原子结构示意图为 。
(5)⑥的单质与X反应的化学方程式为 。
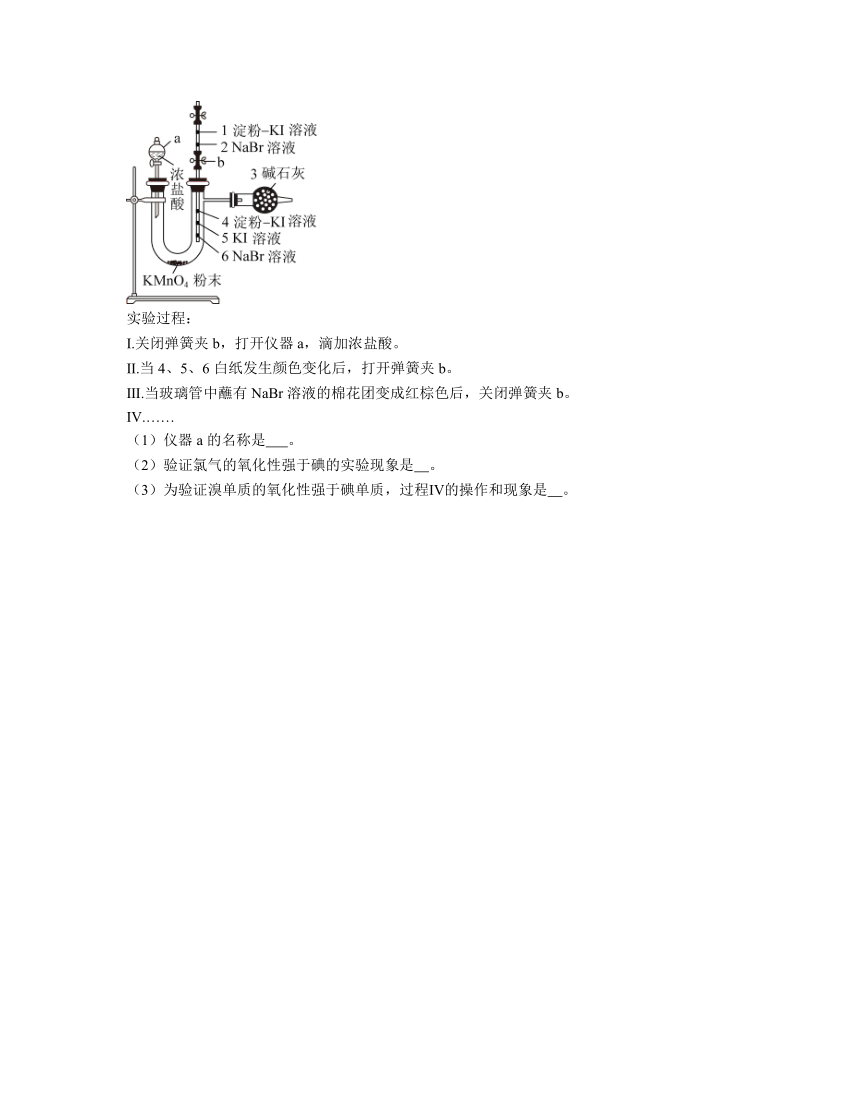
12.为验证卤素单质氧化性的相对强弱,某小组用如图所示装置进行实验(气密性已检验)。4、5、6是蘸有相应溶液的白纸,U形管上方插入填充有淀粉—KI溶液和NaBr溶液的两团棉花、两头带有弹簧夹的玻璃管。
实验过程:
Ⅰ.关闭弹簧夹b,打开仪器a,滴加浓盐酸。
Ⅱ.当4、5、6白纸发生颜色变化后,打开弹簧夹b。
Ⅲ.当玻璃管中蘸有NaBr溶液的棉花团变成红棕色后,关闭弹簧夹b。
Ⅳ.……
(1)仪器a的名称是 。
(2)验证氯气的氧化性强于碘的实验现象是 。
(3)为验证溴单质的氧化性强于碘单质,过程Ⅳ的操作和现象是 。
【参考答案】
一、选择题
1.A
解析:A.各物质分类正确,A正确;
B.浓硫酸为混合物,既不是电解质也不是非电解质;高氯酸为强酸,属于强电解质,B错误;
C.氢气是单质,既不是电解质也不是非电解质,C错误;
D.同素异形体为单质,CaO和CaO2为钙元素形成的不同化合物;氨水为混合物,既不是电解质也不是非电解质,D错误;
故答案为:A。
2.C
解析:A.英国化学家波义耳在1662年根据实验结果提出:“在密闭容器中的定量气体,在恒温下,气体的压强和体积成反比关系。”称之为波义耳定律,A不选;
B.法国著名化学家拉瓦锡提出了质量守恒定律,B不选;
C.1811年意大利的阿伏加德罗提出分子学说,C选;
D.1803年英国化学家道尔顿提出了原子学说,D不选;
答案选C。
3.D
解析:①同位素是指质子数相同中子数不同的原子互为同位素,其最外层电子数相同,化学性质基本相同,故①正确;
②元素是指具有相同质子数的一类原子的总称,所以质子数相同的微粒,可能是原子团或分子,不一定是同种元素,故②错误;
③微粒包含离子、原子、原子团、分子等,所以电子数相同的微粒不一定是同一种原子,故③正确;
④质量数是指中性原子中,将原子内所有质子和中子的相对质量取近似整数值相加而得到的数值。由于一个质子和一个中子相对质量取近似整数值时均为1,所以质量数(A)=质子数(Z)+中子数(N),故④错误;
综上所述,②④错误;
故选D。
4.D
解析:A.通过电催化将高效还原合成高浓度乙酸,并进一步利用微生物发酵生产葡萄糖和长链脂肪酸,葡萄糖属于单糖,故A正确;
B.氘氚核聚变可实现“人造太阳”,氘和氚互为同位素,故B正确;
C.利用全新原理可实现海水直接电解制氢,氢气燃烧后又生成水,氢气是可再生能源,故C正确;
D.涤纶是有机高分子材料,故D错误;
故选D。
5.C
解析:在元素周期表中,第1、2、3、4周期元素的数目分别是2、8、8、18,答案选C。
6.C
解析:某粒子含有6个质子,7个中子,可以确定是6号元素碳,电荷为0,所以是质量数为13的碳原子,质量数应该写在元素符号左上角, A B D错误,故选C。
7.D
解析:的中子数为238 94=144,钚原子的核外电子数为94,则中子数与核外电子数之差为144 94=50, D符合题意。
综上所述,答案为D。
8.D
解析:A.白磷和红磷是不同的单质,物理性质不同,A错误;
B.都是由磷元素组成的物质,二者混合后属于混合物,B错误;
C.白磷转化为红磷,生成了新物质,属于化学变化,C错误;
D.白磷和红磷是磷元素的不同的单质,是磷元素的同素异形体,D正确;
故选D。
二、非选择题
9.(1) 16 18 18
(2) 1.5 33.6
(3)
解析:(1)该离子的质子数为16,中子数=34-16=18,核外电子数=16+2=18;
(2)的分子式表明1个分子由1个C原子和2个O原子构成,所以1.5mol 含1.5mol C原子,个O原子,其标况下的体积为;
(3)根据阿伏加德多定律可知,5mol A2和15mol B2反应生成10mol C,根据元素守恒,则可以推出C的化学式为。
10.(1)直线穿过
(2) He2+ 直线穿过金箔 中空的 偏转 反弹回来 小 大
解析: (1)在研究原子结构时,对汤姆生的葡萄干面包模型,他进行了思索,如果这个模型的假设是正确的,那么用质量大而体积小且高速运动的微粒轰击金属薄膜,微粒不能碰撞到金箔的构成为,因此这一微粒应该是直线穿过。
(2)α粒子是He元素的原子核。He是2号元素,则He失去核外的2个电子就只剩余原子核,该微粒的化学符号是He2+。
实验结果是绝大部分α粒子直线穿过金箔,说明原子是中空的。极少数α粒子穿过金箔时发生了偏转,有个别的α粒子竟然偏转了180°,被反弹回来,说明原子中存在着体积很小,质量很大的核。
11.(1)第二周期IVA族
(2)NH3
(3)2H2O+2Na=2Na++2OH-+H2↑
(4)
(5)H2O+Cl2=HClO+HCl
解析:(1)为元素,位于周期表第二周期第Ⅳ族;
(2)元素,其质子数为,②与氢元素可组成含10个电子的分子为;
(3)为元素,其最简单氢化物为,与水反应生成和,对应离子方程式为:,故答案为:;;
(4)为其同族的下一周期元素为,原子结构示意图为:;
(5)⑥为元素,X为,与X反应的化学方程式为H2O+Cl2=。
12.分液漏斗 白纸5变成黄色(或白纸4变蓝) 取下玻璃管,加热2处,棉花团1变蓝(4)反应生成溴单质,并防止氯气干扰
解析:(1).根据装置图可知,仪器的名称是分液漏斗,故答案为:分液漏斗;
(2).氯气能置换出碘化钾中的碘,验证氯气的氧化性强于碘的实验现象是白纸4变蓝或白纸5变黄,故答案为:白纸5变成黄色(或白纸4变蓝);
(3).为验证溴单质的氧化性强于碘单质,应使棉花团2中生成的溴挥发到蘸有淀粉溶液的棉花团1上,实验同时应避免氯气的干扰,当棉花团2变为红棕色时,说明有大量的溴生成,此时应关闭弹簧夹,否则氯气过量,会干扰后续与氧化性的判断,故答案为:取下玻璃管,加热2处,棉花团1变蓝(4)反应生成溴单质,并防止氯气干扰
一、选择题
1.下列表格中各项分类都正确的一组是
类别 选项 同素异形体 混合物 强电解质 弱电解质 非电解质
A 和 氢氧化铁胶体 苛性钾 冰水混合物 乙醇
B 红磷和白磷 海水 浓硫酸 高氯酸 甲烷
C 金刚石和石墨 不锈钢 硫酸钡
D CaO和 空气 氯化钠 氨水 三氧化硫
A.A B.B C.C D.D
2.1811年提出分子学说,使人们对物质结构的认识发展到一个新的阶段,提出该学说的科学家是
A.波义耳 B.拉瓦锡 C.阿伏加德罗 D.道尔顿
3.下列说法中错误的是
①同位素的化学性质基本相同②质子数相同的微粒一定是同种元素③电子数相同的微粒不一定是同一种原子④某种元素的相对原子质量取整数,就是其质量数
A.①③ B.③④ C.①② D.②④
4.“科学技术是第一生产力”,高科技的发展与化学密切相关。下列说法错误的是
A.可人工合成葡萄糖和脂肪酸,葡萄糖属于单糖
B.氘氚核聚变可实现“人造太阳”,氘和氚互为同位素
C.利用全新原理可实现海水直接电解制氢,氢气是可再生能源
D.涤纶纤维可制作飞船着陆器的降落伞,涤纶是无机非金属材料
5.元素周期表中,第2、3、4周期元素的数目分别是
A.2、8、8 B.8、8、8 C.8、8、18 D.8、18、32
6.某粒子含有6个质子,7个中子,电荷为0,则它的化学符号是
A.13Al B.13Al C.13C D.13C
7.太空探索器常用制成的核电池提供动力,该钚原子的中子数与核外电子数之差为
A.238 B.144 C.94 D.50
8.磷存在于人体所有细胞中,是维持骨骼和牙齿的必要物质,几乎参与所有生理上的化学反应。下列关于白磷和红磷的说法中正确的是
A.化学性质和物理性质完全相同
B.都是由磷元素组成的,二者混合后仍属于纯净物
C.白磷转化为红磷属于物理变化
D.都是磷元素的同素异形体
二、非选择题
9.填空:
(1)微粒中的质子数是 ,中子数是 ,核外电子数是 。
(2)1.5mol CO2中含 mol碳原子, 个氧原子(以NA为阿伏加德罗常数的值),标准状况下的体积为 L。
(3)在一定温度和压强下,5体积气体A2跟15体积的气体B2完全化合生成10体积某气体C,则该气体C的化学式为(用A、B表示) 。
10.卢瑟福因其在科学上作出的巨大的贡献而获得诺贝尔奖。
(1)在研究原子结构时,对汤姆生的葡萄干面包模型,他进行了思索,如果这个模型的假设是正确的,那么用质量大而体积小且高速运动的微粒轰击金属薄膜,这一微粒应该是 (填“直线穿过”或“折线穿过”)金属薄膜。
(2)根据上述想法,卢瑟福用α粒子轰击金箔,α粒子的化学符号是 ,实验结果是绝大部分α粒子 ,说明原子是 (填“实心的”或“中空的”);极少数α粒子穿过金箔时发生了 ,有个别的α粒子竟然偏转了180°,被 ,说明原子中存在着体积很 (填“小”或“大”)的、质量很 (填“小”或“大”)的带正电的核。
11.下表显示了元素周期表中短周期的一部分,①~⑥代表6种短周期元素。
① ② ③
④ ⑤ ⑥
已知③与氢元素能组成生活中最常见的化合物X。请填写下列空白。
(1)①在周期表中的位置为 。
(2)②与氢元素可组成含10个电子的分子,其化学式为 。
(3)④的单质与X反应的离子方程式为 。
(4)与⑤同族的下一周期元素的原子结构示意图为 。
(5)⑥的单质与X反应的化学方程式为 。
12.为验证卤素单质氧化性的相对强弱,某小组用如图所示装置进行实验(气密性已检验)。4、5、6是蘸有相应溶液的白纸,U形管上方插入填充有淀粉—KI溶液和NaBr溶液的两团棉花、两头带有弹簧夹的玻璃管。
实验过程:
Ⅰ.关闭弹簧夹b,打开仪器a,滴加浓盐酸。
Ⅱ.当4、5、6白纸发生颜色变化后,打开弹簧夹b。
Ⅲ.当玻璃管中蘸有NaBr溶液的棉花团变成红棕色后,关闭弹簧夹b。
Ⅳ.……
(1)仪器a的名称是 。
(2)验证氯气的氧化性强于碘的实验现象是 。
(3)为验证溴单质的氧化性强于碘单质,过程Ⅳ的操作和现象是 。
【参考答案】
一、选择题
1.A
解析:A.各物质分类正确,A正确;
B.浓硫酸为混合物,既不是电解质也不是非电解质;高氯酸为强酸,属于强电解质,B错误;
C.氢气是单质,既不是电解质也不是非电解质,C错误;
D.同素异形体为单质,CaO和CaO2为钙元素形成的不同化合物;氨水为混合物,既不是电解质也不是非电解质,D错误;
故答案为:A。
2.C
解析:A.英国化学家波义耳在1662年根据实验结果提出:“在密闭容器中的定量气体,在恒温下,气体的压强和体积成反比关系。”称之为波义耳定律,A不选;
B.法国著名化学家拉瓦锡提出了质量守恒定律,B不选;
C.1811年意大利的阿伏加德罗提出分子学说,C选;
D.1803年英国化学家道尔顿提出了原子学说,D不选;
答案选C。
3.D
解析:①同位素是指质子数相同中子数不同的原子互为同位素,其最外层电子数相同,化学性质基本相同,故①正确;
②元素是指具有相同质子数的一类原子的总称,所以质子数相同的微粒,可能是原子团或分子,不一定是同种元素,故②错误;
③微粒包含离子、原子、原子团、分子等,所以电子数相同的微粒不一定是同一种原子,故③正确;
④质量数是指中性原子中,将原子内所有质子和中子的相对质量取近似整数值相加而得到的数值。由于一个质子和一个中子相对质量取近似整数值时均为1,所以质量数(A)=质子数(Z)+中子数(N),故④错误;
综上所述,②④错误;
故选D。
4.D
解析:A.通过电催化将高效还原合成高浓度乙酸,并进一步利用微生物发酵生产葡萄糖和长链脂肪酸,葡萄糖属于单糖,故A正确;
B.氘氚核聚变可实现“人造太阳”,氘和氚互为同位素,故B正确;
C.利用全新原理可实现海水直接电解制氢,氢气燃烧后又生成水,氢气是可再生能源,故C正确;
D.涤纶是有机高分子材料,故D错误;
故选D。
5.C
解析:在元素周期表中,第1、2、3、4周期元素的数目分别是2、8、8、18,答案选C。
6.C
解析:某粒子含有6个质子,7个中子,可以确定是6号元素碳,电荷为0,所以是质量数为13的碳原子,质量数应该写在元素符号左上角, A B D错误,故选C。
7.D
解析:的中子数为238 94=144,钚原子的核外电子数为94,则中子数与核外电子数之差为144 94=50, D符合题意。
综上所述,答案为D。
8.D
解析:A.白磷和红磷是不同的单质,物理性质不同,A错误;
B.都是由磷元素组成的物质,二者混合后属于混合物,B错误;
C.白磷转化为红磷,生成了新物质,属于化学变化,C错误;
D.白磷和红磷是磷元素的不同的单质,是磷元素的同素异形体,D正确;
故选D。
二、非选择题
9.(1) 16 18 18
(2) 1.5 33.6
(3)
解析:(1)该离子的质子数为16,中子数=34-16=18,核外电子数=16+2=18;
(2)的分子式表明1个分子由1个C原子和2个O原子构成,所以1.5mol 含1.5mol C原子,个O原子,其标况下的体积为;
(3)根据阿伏加德多定律可知,5mol A2和15mol B2反应生成10mol C,根据元素守恒,则可以推出C的化学式为。
10.(1)直线穿过
(2) He2+ 直线穿过金箔 中空的 偏转 反弹回来 小 大
解析: (1)在研究原子结构时,对汤姆生的葡萄干面包模型,他进行了思索,如果这个模型的假设是正确的,那么用质量大而体积小且高速运动的微粒轰击金属薄膜,微粒不能碰撞到金箔的构成为,因此这一微粒应该是直线穿过。
(2)α粒子是He元素的原子核。He是2号元素,则He失去核外的2个电子就只剩余原子核,该微粒的化学符号是He2+。
实验结果是绝大部分α粒子直线穿过金箔,说明原子是中空的。极少数α粒子穿过金箔时发生了偏转,有个别的α粒子竟然偏转了180°,被反弹回来,说明原子中存在着体积很小,质量很大的核。
11.(1)第二周期IVA族
(2)NH3
(3)2H2O+2Na=2Na++2OH-+H2↑
(4)
(5)H2O+Cl2=HClO+HCl
解析:(1)为元素,位于周期表第二周期第Ⅳ族;
(2)元素,其质子数为,②与氢元素可组成含10个电子的分子为;
(3)为元素,其最简单氢化物为,与水反应生成和,对应离子方程式为:,故答案为:;;
(4)为其同族的下一周期元素为,原子结构示意图为:;
(5)⑥为元素,X为,与X反应的化学方程式为H2O+Cl2=。
12.分液漏斗 白纸5变成黄色(或白纸4变蓝) 取下玻璃管,加热2处,棉花团1变蓝(4)反应生成溴单质,并防止氯气干扰
解析:(1).根据装置图可知,仪器的名称是分液漏斗,故答案为:分液漏斗;
(2).氯气能置换出碘化钾中的碘,验证氯气的氧化性强于碘的实验现象是白纸4变蓝或白纸5变黄,故答案为:白纸5变成黄色(或白纸4变蓝);
(3).为验证溴单质的氧化性强于碘单质,应使棉花团2中生成的溴挥发到蘸有淀粉溶液的棉花团1上,实验同时应避免氯气的干扰,当棉花团2变为红棕色时,说明有大量的溴生成,此时应关闭弹簧夹,否则氯气过量,会干扰后续与氧化性的判断,故答案为:取下玻璃管,加热2处,棉花团1变蓝(4)反应生成溴单质,并防止氯气干扰
