2.2 氯及其化合物 同步练习题 (含解析)2023-2024学年高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 2.2 氯及其化合物 同步练习题 (含解析)2023-2024学年高一上学期化学人教版(2019)必修第一册 |
|
|
| 格式 | docx | ||
| 文件大小 | 206.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-06 00:00:00 | ||
图片预览


文档简介
2.2 氯及其化合物 同步练习题
一、选择题
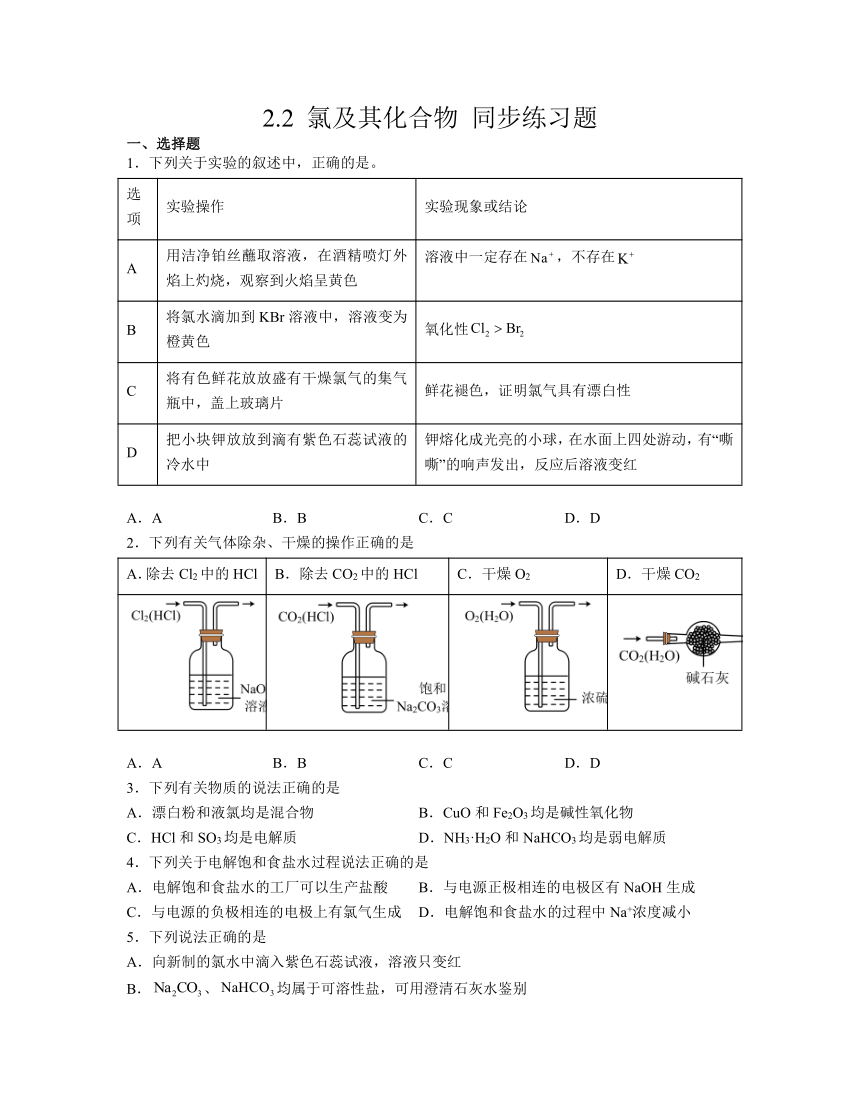
1.下列关于实验的叙述中,正确的是。
选项 实验操作 实验现象或结论
A 用洁净铂丝蘸取溶液,在酒精喷灯外焰上灼烧,观察到火焰呈黄色 溶液中一定存在,不存在
B 将氯水滴加到KBr溶液中,溶液变为橙黄色 氧化性
C 将有色鲜花放放盛有干燥氯气的集气瓶中,盖上玻璃片 鲜花褪色,证明氯气具有漂白性
D 把小块钾放放到滴有紫色石蕊试液的冷水中 钾熔化成光亮的小球,在水面上四处游动,有“嘶嘶”的响声发出,反应后溶液变红
A.A B.B C.C D.D
2.下列有关气体除杂、干燥的操作正确的是
A.除去Cl2中的HCl B.除去CO2中的HCl C.干燥O2 D.干燥CO2
A.A B.B C.C D.D
3.下列有关物质的说法正确的是
A.漂白粉和液氯均是混合物 B.CuO和Fe2O3均是碱性氧化物
C.HCl和SO3均是电解质 D.NH3·H2O和NaHCO3均是弱电解质
4.下列关于电解饱和食盐水过程说法正确的是
A.电解饱和食盐水的工厂可以生产盐酸 B.与电源正极相连的电极区有NaOH生成
C.与电源的负极相连的电极上有氯气生成 D.电解饱和食盐水的过程中Na+浓度减小
5.下列说法正确的是
A.向新制的氯水中滴入紫色石蕊试液,溶液只变红
B.、均属于可溶性盐,可用澄清石灰水鉴别
C.向新制氯水中加入粉末,有气泡产生,说明新制氯水中含有
D.一定量的粉末加入一定量的溶液后,溶液质量一定增加
6.下列物质转化不能通过一步反应直接实现的是
A. B.
C. D.
7.漂粉精是生活中常见的消毒剂,其有效成分属于
A.酸 B.碱 C.盐 D.氧化物
8.分类是认识和研究物质及其变化的一种常用的科学方法。下列物质中属于纯净物的是
A.碘酒 B.苏打 C.大理石 D.漂白粉
二、非选择题
9.在4种无机物①氯化钠、②碳酸钠、③次氯酸钙、④过氧化钠中,可用作食用碱的是_______(填序号,下同),可用作调味品的是_______,可用作呼吸面具供氧剂的是_______,可用作消毒剂的是_______(每种物质仅限填一次)。
10.反应MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O中,___是氧化剂;___是还原剂;___元素被氧化;___元素被还原;___是氧化产物;___是还原产物。
11.室温下,单质A、B、C分别为固体、黄绿色气体、无色气体,合适的反应条件下,它们可以按如图所示进行反应。又知E溶液是无色的,F溶液是浅绿色的。
请回答:
(1)试写出下列物质的化学式:
A___________、B___________、C___________
(2)反应①的化学方程式:___________
(3)反应③的化学方程式:___________
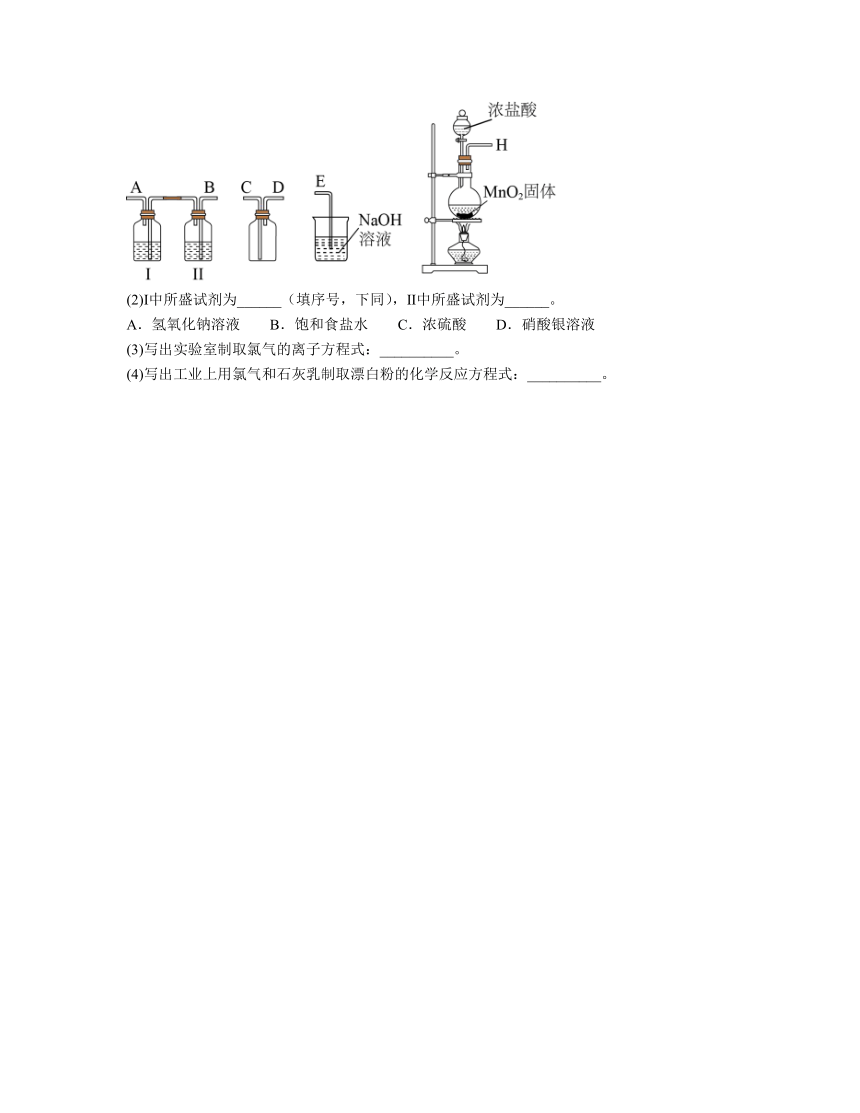
12.氯气和漂白粉是现代工业和生活中常用的杀菌消毒剂,实验室拟用如图所示装置制备干燥纯净的氯气,请回答下列问题。
(1)请按正确的顺序连接装置:H→______、______、→______、______→______;选择最后一个装置的目的是__________。
(2)Ⅰ中所盛试剂为______(填序号,下同),Ⅱ中所盛试剂为______。
A.氢氧化钠溶液 B.饱和食盐水 C.浓硫酸 D.硝酸银溶液
(3)写出实验室制取氯气的离子方程式:__________。
(4)写出工业上用氯气和石灰乳制取漂白粉的化学反应方程式:__________。
【参考答案】
一、选择题
1.B
解析:A.火焰呈黄色说明一定存在Na+,可能存在K+,需透过蓝色钴玻璃观察才能确定是否存在K+,A错误;
B.将氯水滴加到KBr溶液中,溶液变为橙黄色,说明生成了Br2,故可以说明氧化性,B正确;
C.干燥的氯气无漂白性,鲜花褪色是由于氯气和水反应生成HClO具有漂白性,C错误;
D.钾和水反应生成氢氧化钾而使溶液呈碱性,因此遇到紫色石蕊试液变蓝,D错误;
故选B。
2.C
解析:A.氯气和氯化氢都能被氢氧化钠溶液吸收,应用饱和食盐水,A错误;
B.二氧化碳会和碳酸钠生成碳酸氢钠溶液,应用饱和碳酸氢钠,B错误;
C.浓硫酸能吸收水且不和氧气反应,能干燥,C正确;
D.二氧化碳会被碱石灰吸收,不能用其干燥,D错误;
故选C。
3.B
解析:A.液氯是液态的氯气,为纯净物,故A错误;
B.碱性氧化物包括活泼金属氧化物和其他金属的低价氧化物,CuO和Fe2O3均是碱性氧化物,故B正确;
C.SO3遇到水就和水反应了,所以不存在它的溶液,而它是共价化合物,熔融状态又不电离,所以它是非电解质,故C错误;
D.NaHCO3是钠盐,属于强电解质,故D错误;
故答案选B。
4.A
解析:A.电解饱和食盐水制得的H2和Cl2可作为生产盐酸的原材料,A正确;
B.与电源正极相连的电极是阳极,电极反应式为,Cl2可与NaOH反应,因此该电极区不能生成NaOH,B错误;
C.与电源负极相连的电极是阴极,电极反应式为,没有Cl2生成,C错误;
D.电解的总反应方程式为:2NaCl+2H2O=2NaOH+Cl2↑+H2↑,反应过程水被消耗,Na+浓度增大,D错误;
故选A。
5.C
解析:A.向新制的氯水中含有氯气和水生成的盐酸、次氯酸,次氯酸具有漂白性,滴入紫色石蕊试液,溶液变红后又褪色,A错误;
B.、均和石灰水生成碳酸钙沉淀,不能用石灰水鉴别,B错误;
C.氢离子和碳酸氢根离子生成二氧化碳和水,向新制氯水中加入粉末,有气泡产生,说明新制氯水中含有,C正确;
D.一定量的粉末加入一定量的溶液后,过氧化钠和水生成氢氧化钠和氧气,氢氧化钠和硫酸铜生成氢氧化铜沉淀,若生成沉淀质量大于加入过氧化钠质量,则溶液质量会减小,D错误;
故选C。
6.C
解析:A.氯气和铁反应生成氯化铁,能一步实现,A不符合题意;
B.氯气和氢氧化钙反应生成次氯酸钙和氯化钙,能一步实现,B不符合题意;
C.次氯酸钙不能一步反应生成二氧化碳,C符合题意;
D.过氧化钠和水或二氧化碳都能反应生成氧气,能一步实现,D不符合题意;
故选C。
7.C
解析:漂粉精有效成分为Ca(ClO)2,该物质由金属阳离子和酸根组成为盐类。
故选C。
8.B
【分析】纯净物是由一种物质组成的;
解析:A.碘酒是碘的酒精溶液,为混合物,A错误;
B.苏打为碳酸钠,属于纯净物,B正确;
C.大理石主要成分为碳酸钙,属于混合物,C错误;
D.漂白粉含有氯化钙和次氯酸钙,D错误;
故选B。
二、非选择题
9. ② ① ④ ③
解析:①氯化钠、②碳酸钠、③次氯酸钙、④过氧化钠中,可用作食用碱的是②纯碱碳酸钠,可用作调味品的是①食盐氯化钠,可用作呼吸面具供氧剂的是④过氧化钠,过氧化钠能和二氧化碳或水反应生成氧气,可用作消毒剂的是③次氯酸钙。
10. MnO2 HCl Cl Mn Cl2 MnCl2
解析:由方程式可知,反应中锰元素化合价降低被还原,二氧化锰是反应的氧化剂,氯化锰是还原产物,氯元素化合价部分升高被氧化,氯化氢是反应的还原剂,氯气是氧化产物,故答案为:MnO2;HCl;Cl;Mn;Cl2;MnCl2。
11.(1) Fe Cl2 H2
(2)2Fe+3Cl22FeCl3
(3)Fe+2HCl=FeCl2+H2↑
解析:由B为黄绿色气体且为单质,可知B为Cl2;固体D为固体单质A与Cl2反应生成的一种氯化物; E为Cl2与气体单质C生成的一种可溶于水的氯化物,且E溶液和固体单质A又可以重新生成气体C和F,只有当C为H2,F为一种氯化物时才能满足这一过程;而A与Cl2反应已生成了一种氯化物D,F又是一种氯化物、F溶液是浅绿色的,所以A为变价金属,应为Fe,所以A为Fe,B为Cl2,C为H2,D为FeCl3,E为HCl,F为FeCl2,据此回答。
(1)据分析,A是Fe,B是Cl2,C是H2。
(2)由分析可知,反应①为Fe和Cl2反应,其化学方程式为:2Fe+3Cl22FeCl3。
(3)由分析可知,反应③为Fe和HCl反应,化学方程式为:Fe+2HCl=FeCl2+H2↑
12.(1) B A C D E 吸收尾气,防止污染空气
(2) C A
(3)MnO2+4H++2Cl-Mn2++Cl2↑+2H O
(4)2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
【分析】实验室用二氧化锰和浓盐酸在加热的条件下生成氯气,H导出的氯气中含有HCl、水蒸气,先用饱和食盐水除去HCl,再用浓硫酸干燥氯气,采取向上排空气法收集氯气,最后用氢氧化钠溶液吸收多余的氯气,防止污染空气,用氢氧化钠溶液吸收氯气防止倒吸,以此解答。
解析:(1)H导出的氯气中含有HCl、水蒸气,先用饱和食盐水除去HCl,再用浓硫酸干燥氯气,采取向上排空气法收集氯气,最后用氢氧化钠溶液吸收多余的氯气,防止污染空气,用氢氧化钠溶液吸收氯气防止倒吸,各装置中气体应为长进短出,正确的顺序连接装置:H→B→A→C→D→E,最后一个装置的目的是:吸收尾气,防止污染空气。
(2)H导出的氯气中含有HCl、水蒸气,先用饱和食盐水除去HCl,再用浓硫酸干燥氯气,采取向上排空气法收集氯气,最后用氢氧化钠溶液吸收多余的氯气,防止污染空气,故选C;A。
(3)实验室用二氧化锰和浓盐酸在加热的条件下生成氯气,离子方程式为:MnO2+4H++2Cl-Mn2++Cl ↑+2H O。
(4)用氯气和石灰乳制取漂白粉,反应生成氯化钙、次氯酸钙与水,化学方程式为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
一、选择题
1.下列关于实验的叙述中,正确的是。
选项 实验操作 实验现象或结论
A 用洁净铂丝蘸取溶液,在酒精喷灯外焰上灼烧,观察到火焰呈黄色 溶液中一定存在,不存在
B 将氯水滴加到KBr溶液中,溶液变为橙黄色 氧化性
C 将有色鲜花放放盛有干燥氯气的集气瓶中,盖上玻璃片 鲜花褪色,证明氯气具有漂白性
D 把小块钾放放到滴有紫色石蕊试液的冷水中 钾熔化成光亮的小球,在水面上四处游动,有“嘶嘶”的响声发出,反应后溶液变红
A.A B.B C.C D.D
2.下列有关气体除杂、干燥的操作正确的是
A.除去Cl2中的HCl B.除去CO2中的HCl C.干燥O2 D.干燥CO2
A.A B.B C.C D.D
3.下列有关物质的说法正确的是
A.漂白粉和液氯均是混合物 B.CuO和Fe2O3均是碱性氧化物
C.HCl和SO3均是电解质 D.NH3·H2O和NaHCO3均是弱电解质
4.下列关于电解饱和食盐水过程说法正确的是
A.电解饱和食盐水的工厂可以生产盐酸 B.与电源正极相连的电极区有NaOH生成
C.与电源的负极相连的电极上有氯气生成 D.电解饱和食盐水的过程中Na+浓度减小
5.下列说法正确的是
A.向新制的氯水中滴入紫色石蕊试液,溶液只变红
B.、均属于可溶性盐,可用澄清石灰水鉴别
C.向新制氯水中加入粉末,有气泡产生,说明新制氯水中含有
D.一定量的粉末加入一定量的溶液后,溶液质量一定增加
6.下列物质转化不能通过一步反应直接实现的是
A. B.
C. D.
7.漂粉精是生活中常见的消毒剂,其有效成分属于
A.酸 B.碱 C.盐 D.氧化物
8.分类是认识和研究物质及其变化的一种常用的科学方法。下列物质中属于纯净物的是
A.碘酒 B.苏打 C.大理石 D.漂白粉
二、非选择题
9.在4种无机物①氯化钠、②碳酸钠、③次氯酸钙、④过氧化钠中,可用作食用碱的是_______(填序号,下同),可用作调味品的是_______,可用作呼吸面具供氧剂的是_______,可用作消毒剂的是_______(每种物质仅限填一次)。
10.反应MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O中,___是氧化剂;___是还原剂;___元素被氧化;___元素被还原;___是氧化产物;___是还原产物。
11.室温下,单质A、B、C分别为固体、黄绿色气体、无色气体,合适的反应条件下,它们可以按如图所示进行反应。又知E溶液是无色的,F溶液是浅绿色的。
请回答:
(1)试写出下列物质的化学式:
A___________、B___________、C___________
(2)反应①的化学方程式:___________
(3)反应③的化学方程式:___________
12.氯气和漂白粉是现代工业和生活中常用的杀菌消毒剂,实验室拟用如图所示装置制备干燥纯净的氯气,请回答下列问题。
(1)请按正确的顺序连接装置:H→______、______、→______、______→______;选择最后一个装置的目的是__________。
(2)Ⅰ中所盛试剂为______(填序号,下同),Ⅱ中所盛试剂为______。
A.氢氧化钠溶液 B.饱和食盐水 C.浓硫酸 D.硝酸银溶液
(3)写出实验室制取氯气的离子方程式:__________。
(4)写出工业上用氯气和石灰乳制取漂白粉的化学反应方程式:__________。
【参考答案】
一、选择题
1.B
解析:A.火焰呈黄色说明一定存在Na+,可能存在K+,需透过蓝色钴玻璃观察才能确定是否存在K+,A错误;
B.将氯水滴加到KBr溶液中,溶液变为橙黄色,说明生成了Br2,故可以说明氧化性,B正确;
C.干燥的氯气无漂白性,鲜花褪色是由于氯气和水反应生成HClO具有漂白性,C错误;
D.钾和水反应生成氢氧化钾而使溶液呈碱性,因此遇到紫色石蕊试液变蓝,D错误;
故选B。
2.C
解析:A.氯气和氯化氢都能被氢氧化钠溶液吸收,应用饱和食盐水,A错误;
B.二氧化碳会和碳酸钠生成碳酸氢钠溶液,应用饱和碳酸氢钠,B错误;
C.浓硫酸能吸收水且不和氧气反应,能干燥,C正确;
D.二氧化碳会被碱石灰吸收,不能用其干燥,D错误;
故选C。
3.B
解析:A.液氯是液态的氯气,为纯净物,故A错误;
B.碱性氧化物包括活泼金属氧化物和其他金属的低价氧化物,CuO和Fe2O3均是碱性氧化物,故B正确;
C.SO3遇到水就和水反应了,所以不存在它的溶液,而它是共价化合物,熔融状态又不电离,所以它是非电解质,故C错误;
D.NaHCO3是钠盐,属于强电解质,故D错误;
故答案选B。
4.A
解析:A.电解饱和食盐水制得的H2和Cl2可作为生产盐酸的原材料,A正确;
B.与电源正极相连的电极是阳极,电极反应式为,Cl2可与NaOH反应,因此该电极区不能生成NaOH,B错误;
C.与电源负极相连的电极是阴极,电极反应式为,没有Cl2生成,C错误;
D.电解的总反应方程式为:2NaCl+2H2O=2NaOH+Cl2↑+H2↑,反应过程水被消耗,Na+浓度增大,D错误;
故选A。
5.C
解析:A.向新制的氯水中含有氯气和水生成的盐酸、次氯酸,次氯酸具有漂白性,滴入紫色石蕊试液,溶液变红后又褪色,A错误;
B.、均和石灰水生成碳酸钙沉淀,不能用石灰水鉴别,B错误;
C.氢离子和碳酸氢根离子生成二氧化碳和水,向新制氯水中加入粉末,有气泡产生,说明新制氯水中含有,C正确;
D.一定量的粉末加入一定量的溶液后,过氧化钠和水生成氢氧化钠和氧气,氢氧化钠和硫酸铜生成氢氧化铜沉淀,若生成沉淀质量大于加入过氧化钠质量,则溶液质量会减小,D错误;
故选C。
6.C
解析:A.氯气和铁反应生成氯化铁,能一步实现,A不符合题意;
B.氯气和氢氧化钙反应生成次氯酸钙和氯化钙,能一步实现,B不符合题意;
C.次氯酸钙不能一步反应生成二氧化碳,C符合题意;
D.过氧化钠和水或二氧化碳都能反应生成氧气,能一步实现,D不符合题意;
故选C。
7.C
解析:漂粉精有效成分为Ca(ClO)2,该物质由金属阳离子和酸根组成为盐类。
故选C。
8.B
【分析】纯净物是由一种物质组成的;
解析:A.碘酒是碘的酒精溶液,为混合物,A错误;
B.苏打为碳酸钠,属于纯净物,B正确;
C.大理石主要成分为碳酸钙,属于混合物,C错误;
D.漂白粉含有氯化钙和次氯酸钙,D错误;
故选B。
二、非选择题
9. ② ① ④ ③
解析:①氯化钠、②碳酸钠、③次氯酸钙、④过氧化钠中,可用作食用碱的是②纯碱碳酸钠,可用作调味品的是①食盐氯化钠,可用作呼吸面具供氧剂的是④过氧化钠,过氧化钠能和二氧化碳或水反应生成氧气,可用作消毒剂的是③次氯酸钙。
10. MnO2 HCl Cl Mn Cl2 MnCl2
解析:由方程式可知,反应中锰元素化合价降低被还原,二氧化锰是反应的氧化剂,氯化锰是还原产物,氯元素化合价部分升高被氧化,氯化氢是反应的还原剂,氯气是氧化产物,故答案为:MnO2;HCl;Cl;Mn;Cl2;MnCl2。
11.(1) Fe Cl2 H2
(2)2Fe+3Cl22FeCl3
(3)Fe+2HCl=FeCl2+H2↑
解析:由B为黄绿色气体且为单质,可知B为Cl2;固体D为固体单质A与Cl2反应生成的一种氯化物; E为Cl2与气体单质C生成的一种可溶于水的氯化物,且E溶液和固体单质A又可以重新生成气体C和F,只有当C为H2,F为一种氯化物时才能满足这一过程;而A与Cl2反应已生成了一种氯化物D,F又是一种氯化物、F溶液是浅绿色的,所以A为变价金属,应为Fe,所以A为Fe,B为Cl2,C为H2,D为FeCl3,E为HCl,F为FeCl2,据此回答。
(1)据分析,A是Fe,B是Cl2,C是H2。
(2)由分析可知,反应①为Fe和Cl2反应,其化学方程式为:2Fe+3Cl22FeCl3。
(3)由分析可知,反应③为Fe和HCl反应,化学方程式为:Fe+2HCl=FeCl2+H2↑
12.(1) B A C D E 吸收尾气,防止污染空气
(2) C A
(3)MnO2+4H++2Cl-Mn2++Cl2↑+2H O
(4)2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
【分析】实验室用二氧化锰和浓盐酸在加热的条件下生成氯气,H导出的氯气中含有HCl、水蒸气,先用饱和食盐水除去HCl,再用浓硫酸干燥氯气,采取向上排空气法收集氯气,最后用氢氧化钠溶液吸收多余的氯气,防止污染空气,用氢氧化钠溶液吸收氯气防止倒吸,以此解答。
解析:(1)H导出的氯气中含有HCl、水蒸气,先用饱和食盐水除去HCl,再用浓硫酸干燥氯气,采取向上排空气法收集氯气,最后用氢氧化钠溶液吸收多余的氯气,防止污染空气,用氢氧化钠溶液吸收氯气防止倒吸,各装置中气体应为长进短出,正确的顺序连接装置:H→B→A→C→D→E,最后一个装置的目的是:吸收尾气,防止污染空气。
(2)H导出的氯气中含有HCl、水蒸气,先用饱和食盐水除去HCl,再用浓硫酸干燥氯气,采取向上排空气法收集氯气,最后用氢氧化钠溶液吸收多余的氯气,防止污染空气,故选C;A。
(3)实验室用二氧化锰和浓盐酸在加热的条件下生成氯气,离子方程式为:MnO2+4H++2Cl-Mn2++Cl ↑+2H O。
(4)用氯气和石灰乳制取漂白粉,反应生成氯化钙、次氯酸钙与水,化学方程式为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
