粤教版 初中化学 九下 8.3.3酸和碱的反应课件(共28张PPT)
文档属性
| 名称 | 粤教版 初中化学 九下 8.3.3酸和碱的反应课件(共28张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 科粤版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-07 13:47:47 | ||
图片预览








文档简介
(共28张PPT)
粤教版化学九年级下册课件
第3节 酸和碱的反应
目
录
1
复习巩固
2
新课导入
3
课堂检测
4
延伸拓展
复习巩固
1
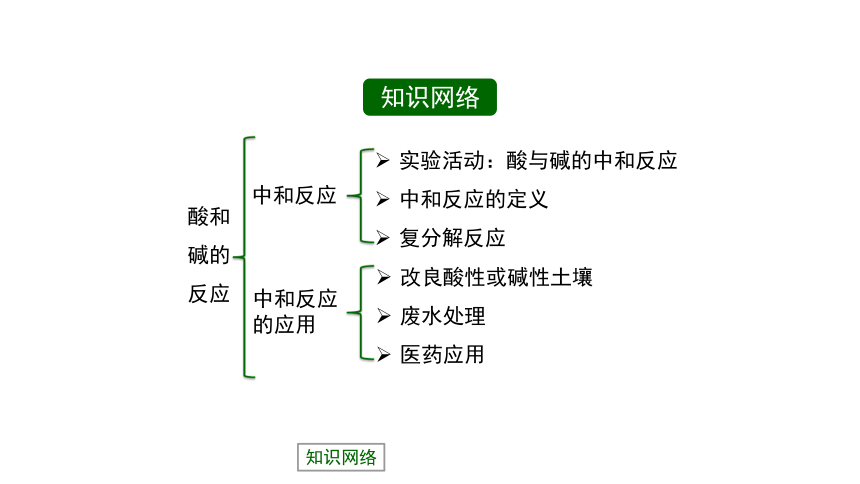
知识网络
知识网络
酸和碱的反应
中和反应
中和反应的应用
实验活动:酸与碱的中和反应
中和反应的定义
复分解反应
改良酸性或碱性土壤
废水处理
医药应用
新课导入
2
知识点1 中和反应
知识回顾
知识回顾
氢氧化钠与稀盐酸反应的实验现象:
在氢氧化钠溶液中滴加酚酞后溶液显______,随着滴加稀盐酸,颜色逐渐消失至_______。
此时的溶液显_______。
发生反应的化学方程式为:______________________。
实验活动一:酸与碱的中和反应
红色
无色
中性
HCl+NaOH == NaCl+H2O
知识回顾
中和反应:_____和_____生成_____和_____。
反应的实质是酸中解离出的____与碱中解离出的____反应生成水:___________________。
酸
碱
盐
水
OH-
H+
H+ + OH- == H2O
【注意】
①不少中和反应没有明显的实验现象(如NaOH溶液与稀盐酸的反应),常需借助指示剂来判断反应的发生。
②发生中和反应时,会放出热量。
③中和反应属于基本反应类型中的复分解反应。
酸的通性
项目 酸的主要化学性质
与指示剂作用 紫色石蕊
无色酚酞
酸碱相互反应
与氧化物反应
与盐反应
与较活泼金属反应
使紫色石蕊溶液变红
使无色酚酞溶液变蓝
酸 + 碱 → 盐 + 水
酸 + 金属氧化物 → 盐 + 水
酸 + 盐 → 新盐 + 新酸
酸 + 较活泼金属 → 盐 + 氢气
知识回顾
碱的通性
项目 碱的主要化学性质
与指示剂作用 紫色石蕊
无色酚酞
酸碱相互反应
与氧化物反应
与盐反应
与较活泼金属反应
使紫色石蕊溶液不变色
使无色酚酞溶液变红
酸 + 碱 → 盐 + 水
碱 + 非金属氧化物 → 盐 + 水
碱 + 盐 → 新盐 + 新碱
知识回顾
像这类由两种化合物互相交换成分,生成另外两种化合物的反应,叫做_______________。
AB + CD == AD + CB
复分解反应
写出硫酸铜与氢氧化钠反应的化学方程式:
_________________________________________,此反应复分解反应吗?_____________。
H2SO4 + 2NaOH === Na2SO4 + 2H2O
是
知识回顾
知识点2 中和反应的应用
知识回顾
1.改良酸性或碱性土壤
(1)向鱼塘撒石灰,中和鱼塘底泥中过多的有机酸,使鱼塘水达到适合鱼苗生长的pH。
(2)利用熟石灰中和土壤和某些水源的过多酸性,以减轻酸雨的危害。
知识回顾
3.医药应用
(1)中和蚊虫叮咬时“注射”的甲酸可以用肥皂水、小苏打水、稀氨水或清凉油;
(2)胃酸过多时可口服碱性“胃舒平”(主要成分为Al(OH)3)或小苏打片(主要成分是NaHCO3)。
2.废水处理
酸性废水必须先用碱性物质(如烧碱、熟石灰)中和后,才可以排放,否则会造成水体污染。
课堂检测
3
例题解析
例题解析
命题角度:通过实验探究判断中和反应过程中的知识。
例1 某化学兴趣小组围绕“酸和碱的中和反应”的学习,进行了如下实验:
实验一:取5mL氢氧化钠溶液于烧杯中,滴入几滴酚酞溶液,可观察到现象为 _________ ,然后加入稀盐酸,用玻璃棒搅拌,溶液褪为无色,有关的反应方程式为 _______________________________。
类型一 中和反应的实验探究
溶液变红
HCl + NaOH == NaCl + H2O
实验二:对实验一反应后溶液中的溶质进行探究.
【提出猜想】
猜想一:只有NaCl
猜想二:有NaCl和NaOH
猜想三:有NaCl和HCl
你认为猜想________不合理,其理由是__________________________________________。
二
此时溶液呈无色,而氢氧化钠能使酚酞试液变红
例题解析
【设计实验】
【拓展应用】我国土壤的酸碱性有“南酸北碱”之说法,你认为需向酸性土壤中加入_____________进行改良。
实验操作 实验现象 实验结论
取反应后的溶液于试管中,加入_____________ __________________ 猜想三成立
碱性物质
石蕊试液
溶液变红
例题解析
例题解析
【解析】实验一:氢氧化钠溶液呈碱性,能使酚酞试液变红,能与盐酸反应生成氯化钠和水;
实验二:由于氢氧化钠呈碱性,能使酚酞试液变红,而此时溶液是无色的,故一定不会有氢氧化钠剩余;设计实验:猜想三中含有盐酸,要证明盐酸的存在,可以加入石蕊试液,盐酸能使石蕊试液变红;
拓展应用:酸和碱能发生中和反应,需向酸性土壤中加入碱性物质进行改良。
命题角度:考查学生对中和反应的认识
例2 下列反应属于中和反应的是( )
A.2NaOH + SO2 == Na2SO3 + H2O
B.Cu(OH)2 + 2HCl == CuCl2 + 2H2O
C.Ca(OH)2 + CO2 == CaCO3↓ + H2O
D.CuO + 2HCl == CuCl2 + H2O
类型二 中和反应的定义
例题解析
B
【解析】判断中和反应时,一看反应物是否是酸和碱,二看生成物是否是盐和水。
例题解析
【变式题】下列物质能和盐酸发生中和反应的是( )
A.硝酸银 B.氧化铜 C.熟石灰 D.锌
【解析】A、硝酸银属于盐,与盐酸发生的反应不是中和反应,错误;
B、氧化铜属于金属氧化物,与盐酸发生的反应不是中和反应,错误;
C、熟石灰是氢氧化钙的俗称,属于碱,可以与盐酸发生中和反应,正确;
D、锌属于金属单质,与盐酸发生的反应不是中和反应,错误。故选C。
C
例题解析
命题角度:考查学生对复分解反应的认识。
例3 在化学实验室,对某种化合物的溶液进行了以下实验:①取少量该溶液加入适量K2SO4溶液,产生白色沉淀,再加入稀硝酸,沉淀不溶解.②另取少量该溶液加入适量AgNO3溶液,产生白色沉淀,再加入稀硝酸,沉淀不溶解.则溶液中的物质一定是( )
A.BaCl2 B.CuCl2 C.Na2CO3 D.Ba(NO3)2
类型三 复分解反应
A
例题解析
【解析】所有的钾盐都会溶于水,加入硫酸钾后生成了不溶于硝酸的白色沉淀只能是硫酸钡,所以原化合物提供了钡离子;加入硝酸银也出现了不溶于硝酸的白色沉淀,只能是氯化银沉淀,所以原溶液提供了氯离子,故选A。
【方法点拨】根据所有的钾盐都会溶于水,不溶于硝酸的白色沉淀有氯化银、硫酸钡进行分析。
延伸拓展
4
命题角度:中和反应在实际生活和生产中的作用。
例4 胃酸能帮助消化,但过多的胃酸会危害健康。可用于治疗胃酸过多的物质是 ( )
A.NaCl B.Al(OH)3
C.CaO D.NaOH
类型四 中和反应的应用
例题解析
B
【解析】 胃酸为酸性,所以要治疗胃酸过多应食用碱性的物质以中和过多的胃酸,所以可以首先排除中性的NaCl,但在食用时还要考虑物质不能有腐蚀性,而CaO、NaOH 都是具有腐蚀性的物质,不能食用,所以答案为B。
例题解析
【变式题】甲化工厂排出的废水中含有少量氢氧化钠和硫酸钠,与乙化工厂排出的废水混合后,测得溶液的pH=7,且只含有氯化钠一种溶质。请填空:
(1)乙化工厂的废水中含有的物质是(填化学式)
__________________________________________;
(2)写出其中一个反应的化学方程式
_______________________________________________
_____________________________________________。
HCl、BaCl2
或Na2SO4+BaCl2===BaSO4↓+2NaCl
HCl+NaOH===NaCl+H2O
结束
例题解析
【解析】废水中的NaOH与盐酸反应生成NaCl和H2O,废水中的Na2SO4与BaCl2溶液反应生成BaSO4沉淀和NaCl,由于NaCl溶液显中性,故测得溶液的pH=7,且只含有氯化钠一种溶质。
结束
例题解析
【解析】废水中的NaOH与盐酸反应生成NaCl和H2O,废水中的Na2SO4与BaCl2溶液反应生成BaSO4沉淀和NaCl,由于NaCl溶液显中性,故测得溶液的pH=7,且只含有氯化钠一种溶质。
粤教版化学九年级下册课件
第3节 酸和碱的反应
粤教版化学九年级下册课件
第3节 酸和碱的反应
目
录
1
复习巩固
2
新课导入
3
课堂检测
4
延伸拓展
复习巩固
1
知识网络
知识网络
酸和碱的反应
中和反应
中和反应的应用
实验活动:酸与碱的中和反应
中和反应的定义
复分解反应
改良酸性或碱性土壤
废水处理
医药应用
新课导入
2
知识点1 中和反应
知识回顾
知识回顾
氢氧化钠与稀盐酸反应的实验现象:
在氢氧化钠溶液中滴加酚酞后溶液显______,随着滴加稀盐酸,颜色逐渐消失至_______。
此时的溶液显_______。
发生反应的化学方程式为:______________________。
实验活动一:酸与碱的中和反应
红色
无色
中性
HCl+NaOH == NaCl+H2O
知识回顾
中和反应:_____和_____生成_____和_____。
反应的实质是酸中解离出的____与碱中解离出的____反应生成水:___________________。
酸
碱
盐
水
OH-
H+
H+ + OH- == H2O
【注意】
①不少中和反应没有明显的实验现象(如NaOH溶液与稀盐酸的反应),常需借助指示剂来判断反应的发生。
②发生中和反应时,会放出热量。
③中和反应属于基本反应类型中的复分解反应。
酸的通性
项目 酸的主要化学性质
与指示剂作用 紫色石蕊
无色酚酞
酸碱相互反应
与氧化物反应
与盐反应
与较活泼金属反应
使紫色石蕊溶液变红
使无色酚酞溶液变蓝
酸 + 碱 → 盐 + 水
酸 + 金属氧化物 → 盐 + 水
酸 + 盐 → 新盐 + 新酸
酸 + 较活泼金属 → 盐 + 氢气
知识回顾
碱的通性
项目 碱的主要化学性质
与指示剂作用 紫色石蕊
无色酚酞
酸碱相互反应
与氧化物反应
与盐反应
与较活泼金属反应
使紫色石蕊溶液不变色
使无色酚酞溶液变红
酸 + 碱 → 盐 + 水
碱 + 非金属氧化物 → 盐 + 水
碱 + 盐 → 新盐 + 新碱
知识回顾
像这类由两种化合物互相交换成分,生成另外两种化合物的反应,叫做_______________。
AB + CD == AD + CB
复分解反应
写出硫酸铜与氢氧化钠反应的化学方程式:
_________________________________________,此反应复分解反应吗?_____________。
H2SO4 + 2NaOH === Na2SO4 + 2H2O
是
知识回顾
知识点2 中和反应的应用
知识回顾
1.改良酸性或碱性土壤
(1)向鱼塘撒石灰,中和鱼塘底泥中过多的有机酸,使鱼塘水达到适合鱼苗生长的pH。
(2)利用熟石灰中和土壤和某些水源的过多酸性,以减轻酸雨的危害。
知识回顾
3.医药应用
(1)中和蚊虫叮咬时“注射”的甲酸可以用肥皂水、小苏打水、稀氨水或清凉油;
(2)胃酸过多时可口服碱性“胃舒平”(主要成分为Al(OH)3)或小苏打片(主要成分是NaHCO3)。
2.废水处理
酸性废水必须先用碱性物质(如烧碱、熟石灰)中和后,才可以排放,否则会造成水体污染。
课堂检测
3
例题解析
例题解析
命题角度:通过实验探究判断中和反应过程中的知识。
例1 某化学兴趣小组围绕“酸和碱的中和反应”的学习,进行了如下实验:
实验一:取5mL氢氧化钠溶液于烧杯中,滴入几滴酚酞溶液,可观察到现象为 _________ ,然后加入稀盐酸,用玻璃棒搅拌,溶液褪为无色,有关的反应方程式为 _______________________________。
类型一 中和反应的实验探究
溶液变红
HCl + NaOH == NaCl + H2O
实验二:对实验一反应后溶液中的溶质进行探究.
【提出猜想】
猜想一:只有NaCl
猜想二:有NaCl和NaOH
猜想三:有NaCl和HCl
你认为猜想________不合理,其理由是__________________________________________。
二
此时溶液呈无色,而氢氧化钠能使酚酞试液变红
例题解析
【设计实验】
【拓展应用】我国土壤的酸碱性有“南酸北碱”之说法,你认为需向酸性土壤中加入_____________进行改良。
实验操作 实验现象 实验结论
取反应后的溶液于试管中,加入_____________ __________________ 猜想三成立
碱性物质
石蕊试液
溶液变红
例题解析
例题解析
【解析】实验一:氢氧化钠溶液呈碱性,能使酚酞试液变红,能与盐酸反应生成氯化钠和水;
实验二:由于氢氧化钠呈碱性,能使酚酞试液变红,而此时溶液是无色的,故一定不会有氢氧化钠剩余;设计实验:猜想三中含有盐酸,要证明盐酸的存在,可以加入石蕊试液,盐酸能使石蕊试液变红;
拓展应用:酸和碱能发生中和反应,需向酸性土壤中加入碱性物质进行改良。
命题角度:考查学生对中和反应的认识
例2 下列反应属于中和反应的是( )
A.2NaOH + SO2 == Na2SO3 + H2O
B.Cu(OH)2 + 2HCl == CuCl2 + 2H2O
C.Ca(OH)2 + CO2 == CaCO3↓ + H2O
D.CuO + 2HCl == CuCl2 + H2O
类型二 中和反应的定义
例题解析
B
【解析】判断中和反应时,一看反应物是否是酸和碱,二看生成物是否是盐和水。
例题解析
【变式题】下列物质能和盐酸发生中和反应的是( )
A.硝酸银 B.氧化铜 C.熟石灰 D.锌
【解析】A、硝酸银属于盐,与盐酸发生的反应不是中和反应,错误;
B、氧化铜属于金属氧化物,与盐酸发生的反应不是中和反应,错误;
C、熟石灰是氢氧化钙的俗称,属于碱,可以与盐酸发生中和反应,正确;
D、锌属于金属单质,与盐酸发生的反应不是中和反应,错误。故选C。
C
例题解析
命题角度:考查学生对复分解反应的认识。
例3 在化学实验室,对某种化合物的溶液进行了以下实验:①取少量该溶液加入适量K2SO4溶液,产生白色沉淀,再加入稀硝酸,沉淀不溶解.②另取少量该溶液加入适量AgNO3溶液,产生白色沉淀,再加入稀硝酸,沉淀不溶解.则溶液中的物质一定是( )
A.BaCl2 B.CuCl2 C.Na2CO3 D.Ba(NO3)2
类型三 复分解反应
A
例题解析
【解析】所有的钾盐都会溶于水,加入硫酸钾后生成了不溶于硝酸的白色沉淀只能是硫酸钡,所以原化合物提供了钡离子;加入硝酸银也出现了不溶于硝酸的白色沉淀,只能是氯化银沉淀,所以原溶液提供了氯离子,故选A。
【方法点拨】根据所有的钾盐都会溶于水,不溶于硝酸的白色沉淀有氯化银、硫酸钡进行分析。
延伸拓展
4
命题角度:中和反应在实际生活和生产中的作用。
例4 胃酸能帮助消化,但过多的胃酸会危害健康。可用于治疗胃酸过多的物质是 ( )
A.NaCl B.Al(OH)3
C.CaO D.NaOH
类型四 中和反应的应用
例题解析
B
【解析】 胃酸为酸性,所以要治疗胃酸过多应食用碱性的物质以中和过多的胃酸,所以可以首先排除中性的NaCl,但在食用时还要考虑物质不能有腐蚀性,而CaO、NaOH 都是具有腐蚀性的物质,不能食用,所以答案为B。
例题解析
【变式题】甲化工厂排出的废水中含有少量氢氧化钠和硫酸钠,与乙化工厂排出的废水混合后,测得溶液的pH=7,且只含有氯化钠一种溶质。请填空:
(1)乙化工厂的废水中含有的物质是(填化学式)
__________________________________________;
(2)写出其中一个反应的化学方程式
_______________________________________________
_____________________________________________。
HCl、BaCl2
或Na2SO4+BaCl2===BaSO4↓+2NaCl
HCl+NaOH===NaCl+H2O
结束
例题解析
【解析】废水中的NaOH与盐酸反应生成NaCl和H2O,废水中的Na2SO4与BaCl2溶液反应生成BaSO4沉淀和NaCl,由于NaCl溶液显中性,故测得溶液的pH=7,且只含有氯化钠一种溶质。
结束
例题解析
【解析】废水中的NaOH与盐酸反应生成NaCl和H2O,废水中的Na2SO4与BaCl2溶液反应生成BaSO4沉淀和NaCl,由于NaCl溶液显中性,故测得溶液的pH=7,且只含有氯化钠一种溶质。
粤教版化学九年级下册课件
第3节 酸和碱的反应
