化学人教版(2019)必修第一册3.2.1铝和铝的化合物(共19张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册3.2.1铝和铝的化合物(共19张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 2.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-07 08:30:12 | ||
图片预览






文档简介
(共19张PPT)
人教版高中化学必修第一册第三章
3.2.1 铝和铝的化合物
1.氧化亚铁、氧化铁、四氧化三铁与盐酸反应;2.硫酸铁溶液与强碱溶液反应的离子方程式;3.白色沉淀在空气中变为灰绿色最后变为红褐色相关化学方程式。
铝和铝的化合物
教学目标:
1、掌握铝、氧化铝、氢氧化铝及铝盐(明矾)的性质。
2、了解氢氧化铝的实验室制法。
3、理解并掌握氧化铝、氢氧化铝的两性,及与强酸、强碱溶液的反应。
重、难点:
氧化铝、氢氧化铝的两性,及与强酸、强碱溶液的反应。
一、铝 1、物理性质:
银白色金属,密度较小,熔点660.5℃,导热性、导电性和延展性好。
易失3个e,还原剂
铝和铝的化合物
Al
探究内容 用坩锅钳夹住一小块铝箔在酒精灯上加热至熔化,轻轻晃动。 再取一块铝箔,用砂纸仔细打磨,除去表面的保护膜,再加热至熔化。
现象
现象解释
结论
铝和铝的化合物
铝箔发红卷缩, 熔化不滴落。
铝箔发红卷缩、变暗,失去光泽,熔化不滴落
铝表面的氧化膜保护了铝。构成薄膜的氧化铝(Al2O3)的熔点(2050℃)高于铝的熔点(660℃),包在铝的外面,使熔化了的铝不会滴落下来。
铝容易被氧化而生成一层致密的氧化膜
4Al + 3 O2 2Al2O3
铝很活泼,除去原来的氧化膜后,很快又会生成一层新的氧化膜。
2、化学性质
(1)与氧气的反应
我们将铝片放入盛有盐酸溶液的试管中,可以观察到铝片逐渐溶解,有无色气泡冒出,再将点燃的木条放到试管口,可以听到爆鸣声。
铝和铝的化合物
(2) 与酸反应
2Al+6HCl 2AlCl3+3H2↑ 2Al+6H+ 2Al3++3H2↑
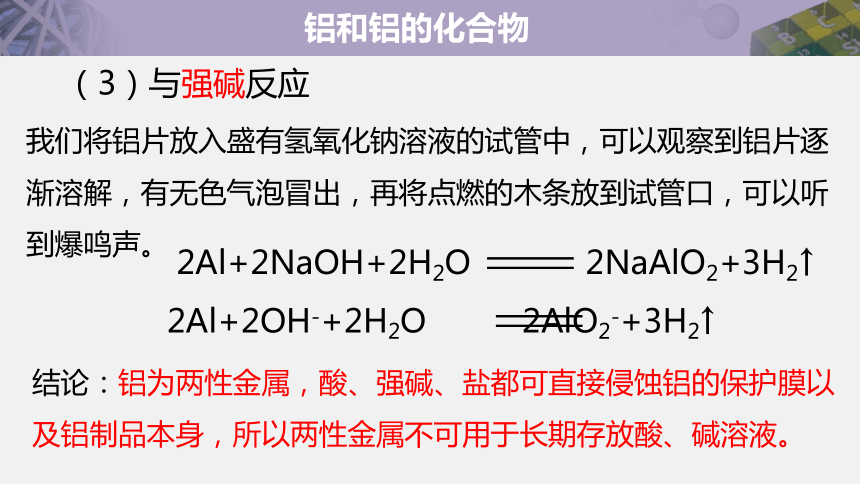
2Al+2NaOH+2H2O 2NaAlO2+3H2↑ 2Al+2OH-+2H2O 2AlO2-+3H2↑
铝和铝的化合物
(3)与强碱反应
我们将铝片放入盛有氢氧化钠溶液的试管中,可以观察到铝片逐渐溶解,有无色气泡冒出,再将点燃的木条放到试管口,可以听到爆鸣声。
结论:铝为两性金属,酸、强碱、盐都可直接侵蚀铝的保护膜以及铝制品本身,所以两性金属不可用于长期存放酸、碱溶液。
二、氧化铝
1、物理性质 氧化铝是一种白色固体,难溶于水,熔沸点高、硬度大的物质,可用来制造耐火坩埚、耐火管和耐高温的实验仪器等。
铝和铝的化合物
精美的氧化铝陶瓷制品
耐火坩埚
燃器具点火瓷头
耐火砖
陶瓷
Al2O3+2NaOH 2NaAlO2+H2O
Al2O3+2OH- 2AlO2-+H2O
铝和铝的化合物
(2)与NaOH溶液反应:
总结:氧化铝是一种两性氧化物,它只与强酸或强碱发生反应,生成盐和水,不与弱酸、弱碱发生反应。
2、化学性质
(1)与盐酸反应:
Al2O3+6HCl 2AlCl3+3H2O
Al2O3+6H+ 2Al3++3H2O
实验:取一些Al(OH)3沉淀,分装在2支试管里,一支试管里滴加2mol/L的盐酸,另一支试管里滴加2mol/L NaOH溶液。边加边振荡,观察现象。观察到的现象是白色沉淀逐渐溶解。
铝和铝的化合物
三、氢氧化铝
1. 物理性质
白色固体,几乎不溶于水,但能凝聚水中的悬浮物,并能吸附色素。
总结:氢氧化铝既能与强酸反应,又能与强碱溶液反应,生成盐和水,所以氢氧化铝具有两性。它只与强酸或强碱发生反应,生成盐和水,不与弱酸弱碱发生反应。
铝和铝的化合物
2. 化学性质
(1)与盐酸反应:
3HCl+Al(OH)3=AlCl3+3H2O
3H++Al(OH)3=Al3++3H2O
(2)与氢氧化钠溶液反应:
NaOH+Al(OH)3=NaAlO2 2H2O
OH-+Al(OH)3=AlO2-+2H2O
(3)不稳定性:受热易分解
2Al(OH)3 Al2O3+3H2O
3、制备Al(OH)3 :
(1)在实验室里,常用铝盐溶液与氨水反应制取氢氧化铝。
操作 现象 化学方程式
往Al2(SO4)3 中滴加氨水
生成白色
胶状沉淀
Al2(SO4)3 + 6NH3·H2O
= Al(OH)3↓ + 3(NH4)2SO4
离子方程式:Al3+ + 3NH3·H2O = Al(OH)3↓ + 3NH4+
探
铝和铝的化合物
(2)向偏铝酸钠溶液中,持续不断地通入CO2,也可以得到氢氧化铝沉淀:
AlO2-+CO2+2H2O Al(OH)3↓+HCO3-
4、用途
胃舒平又名复方氢氧化铝,是由能中和胃酸的氢氧化铝和三硅酸镁两药合用,并组合解痉止痛药颠茄浸膏而成。
明矾(十二水合硫酸铝钾),化学式:KAl(SO4)2·12H2O,无色晶体,可溶于水。用作净水剂。原因是其在水中生成氢氧化铝胶体可以和悬浮在水中的泥沙形成絮状不溶物沉降下来。
铝和铝的化合物
四、铝盐
KAl(SO4)2 K++Al3++2 SO42-
Al3++3H2O Al(OH)3(胶体) + 3H+
1.下列说法正确的是( )A.Al2O3难溶于水,不跟水反应,所以它不是Al(OH)3对应的氧化物B.因为Al2O3是金属氧化物,所以它是碱性氧化物C.Al2O3能跟所有的酸、碱溶液反应D.Al2O3能跟强的酸、碱溶液反应
D
铝和铝的化合物
2.氧化铝的熔点很高,常用于制造耐火材料,例如制作耐火坩埚。下列操作不能在氧化铝坩埚中进行的是( )A.加热使CuSO4·5H2O失水B.加热使KMnO4分解C.加热熔化烧碱D.加热分解碱式碳酸铜
C
3.(1)用氯化铝溶液与氢氧化钠溶液反应时,当Al3+的物质的量与OH-的物质的量之比(以下均填物质的量之比)为________时,Al(OH)3沉淀量最多;________时,Al(OH)3全部溶解;________或________时,Al(OH)3沉淀量为最多沉淀量的一半。(2)偏铝酸钠溶液与盐酸反应时,AlO2-的物质的量与H+物质的量之比为________时,Al(OH)3沉淀量最多;________时,Al(OH)3全部溶解;________或________时,生成的Al(OH)3的量为最多沉淀量的一半。
1:3
1:4
2:3
2:7
1:4
1:1
2:5
2:1
铝和铝的化合物
4、向NaAlO2溶液中滴加盐酸至过量:
n(HCl)
n[Al(OH)3]
铝和铝的化合物
下节过关内容
1.金属铝分别与强酸和强碱反应的离子方程式
2.写出三种制备氢氧化铝的离子方程式
3.氧化铝分别与强酸、强碱的离子方程式
4.氢氧化铝分别与强酸、强碱的离子方程式
人教版高中化学必修第一册第三章
3.2.1 铝和铝的化合物
1.氧化亚铁、氧化铁、四氧化三铁与盐酸反应;2.硫酸铁溶液与强碱溶液反应的离子方程式;3.白色沉淀在空气中变为灰绿色最后变为红褐色相关化学方程式。
铝和铝的化合物
教学目标:
1、掌握铝、氧化铝、氢氧化铝及铝盐(明矾)的性质。
2、了解氢氧化铝的实验室制法。
3、理解并掌握氧化铝、氢氧化铝的两性,及与强酸、强碱溶液的反应。
重、难点:
氧化铝、氢氧化铝的两性,及与强酸、强碱溶液的反应。
一、铝 1、物理性质:
银白色金属,密度较小,熔点660.5℃,导热性、导电性和延展性好。
易失3个e,还原剂
铝和铝的化合物
Al
探究内容 用坩锅钳夹住一小块铝箔在酒精灯上加热至熔化,轻轻晃动。 再取一块铝箔,用砂纸仔细打磨,除去表面的保护膜,再加热至熔化。
现象
现象解释
结论
铝和铝的化合物
铝箔发红卷缩, 熔化不滴落。
铝箔发红卷缩、变暗,失去光泽,熔化不滴落
铝表面的氧化膜保护了铝。构成薄膜的氧化铝(Al2O3)的熔点(2050℃)高于铝的熔点(660℃),包在铝的外面,使熔化了的铝不会滴落下来。
铝容易被氧化而生成一层致密的氧化膜
4Al + 3 O2 2Al2O3
铝很活泼,除去原来的氧化膜后,很快又会生成一层新的氧化膜。
2、化学性质
(1)与氧气的反应
我们将铝片放入盛有盐酸溶液的试管中,可以观察到铝片逐渐溶解,有无色气泡冒出,再将点燃的木条放到试管口,可以听到爆鸣声。
铝和铝的化合物
(2) 与酸反应
2Al+6HCl 2AlCl3+3H2↑ 2Al+6H+ 2Al3++3H2↑
2Al+2NaOH+2H2O 2NaAlO2+3H2↑ 2Al+2OH-+2H2O 2AlO2-+3H2↑
铝和铝的化合物
(3)与强碱反应
我们将铝片放入盛有氢氧化钠溶液的试管中,可以观察到铝片逐渐溶解,有无色气泡冒出,再将点燃的木条放到试管口,可以听到爆鸣声。
结论:铝为两性金属,酸、强碱、盐都可直接侵蚀铝的保护膜以及铝制品本身,所以两性金属不可用于长期存放酸、碱溶液。
二、氧化铝
1、物理性质 氧化铝是一种白色固体,难溶于水,熔沸点高、硬度大的物质,可用来制造耐火坩埚、耐火管和耐高温的实验仪器等。
铝和铝的化合物
精美的氧化铝陶瓷制品
耐火坩埚
燃器具点火瓷头
耐火砖
陶瓷
Al2O3+2NaOH 2NaAlO2+H2O
Al2O3+2OH- 2AlO2-+H2O
铝和铝的化合物
(2)与NaOH溶液反应:
总结:氧化铝是一种两性氧化物,它只与强酸或强碱发生反应,生成盐和水,不与弱酸、弱碱发生反应。
2、化学性质
(1)与盐酸反应:
Al2O3+6HCl 2AlCl3+3H2O
Al2O3+6H+ 2Al3++3H2O
实验:取一些Al(OH)3沉淀,分装在2支试管里,一支试管里滴加2mol/L的盐酸,另一支试管里滴加2mol/L NaOH溶液。边加边振荡,观察现象。观察到的现象是白色沉淀逐渐溶解。
铝和铝的化合物
三、氢氧化铝
1. 物理性质
白色固体,几乎不溶于水,但能凝聚水中的悬浮物,并能吸附色素。
总结:氢氧化铝既能与强酸反应,又能与强碱溶液反应,生成盐和水,所以氢氧化铝具有两性。它只与强酸或强碱发生反应,生成盐和水,不与弱酸弱碱发生反应。
铝和铝的化合物
2. 化学性质
(1)与盐酸反应:
3HCl+Al(OH)3=AlCl3+3H2O
3H++Al(OH)3=Al3++3H2O
(2)与氢氧化钠溶液反应:
NaOH+Al(OH)3=NaAlO2 2H2O
OH-+Al(OH)3=AlO2-+2H2O
(3)不稳定性:受热易分解
2Al(OH)3 Al2O3+3H2O
3、制备Al(OH)3 :
(1)在实验室里,常用铝盐溶液与氨水反应制取氢氧化铝。
操作 现象 化学方程式
往Al2(SO4)3 中滴加氨水
生成白色
胶状沉淀
Al2(SO4)3 + 6NH3·H2O
= Al(OH)3↓ + 3(NH4)2SO4
离子方程式:Al3+ + 3NH3·H2O = Al(OH)3↓ + 3NH4+
探
铝和铝的化合物
(2)向偏铝酸钠溶液中,持续不断地通入CO2,也可以得到氢氧化铝沉淀:
AlO2-+CO2+2H2O Al(OH)3↓+HCO3-
4、用途
胃舒平又名复方氢氧化铝,是由能中和胃酸的氢氧化铝和三硅酸镁两药合用,并组合解痉止痛药颠茄浸膏而成。
明矾(十二水合硫酸铝钾),化学式:KAl(SO4)2·12H2O,无色晶体,可溶于水。用作净水剂。原因是其在水中生成氢氧化铝胶体可以和悬浮在水中的泥沙形成絮状不溶物沉降下来。
铝和铝的化合物
四、铝盐
KAl(SO4)2 K++Al3++2 SO42-
Al3++3H2O Al(OH)3(胶体) + 3H+
1.下列说法正确的是( )A.Al2O3难溶于水,不跟水反应,所以它不是Al(OH)3对应的氧化物B.因为Al2O3是金属氧化物,所以它是碱性氧化物C.Al2O3能跟所有的酸、碱溶液反应D.Al2O3能跟强的酸、碱溶液反应
D
铝和铝的化合物
2.氧化铝的熔点很高,常用于制造耐火材料,例如制作耐火坩埚。下列操作不能在氧化铝坩埚中进行的是( )A.加热使CuSO4·5H2O失水B.加热使KMnO4分解C.加热熔化烧碱D.加热分解碱式碳酸铜
C
3.(1)用氯化铝溶液与氢氧化钠溶液反应时,当Al3+的物质的量与OH-的物质的量之比(以下均填物质的量之比)为________时,Al(OH)3沉淀量最多;________时,Al(OH)3全部溶解;________或________时,Al(OH)3沉淀量为最多沉淀量的一半。(2)偏铝酸钠溶液与盐酸反应时,AlO2-的物质的量与H+物质的量之比为________时,Al(OH)3沉淀量最多;________时,Al(OH)3全部溶解;________或________时,生成的Al(OH)3的量为最多沉淀量的一半。
1:3
1:4
2:3
2:7
1:4
1:1
2:5
2:1
铝和铝的化合物
4、向NaAlO2溶液中滴加盐酸至过量:
n(HCl)
n[Al(OH)3]
铝和铝的化合物
下节过关内容
1.金属铝分别与强酸和强碱反应的离子方程式
2.写出三种制备氢氧化铝的离子方程式
3.氧化铝分别与强酸、强碱的离子方程式
4.氢氧化铝分别与强酸、强碱的离子方程式
