氧化还原反应优质说课稿备赛稿(共25张PPT)
文档属性
| 名称 | 氧化还原反应优质说课稿备赛稿(共25张PPT) |  | |
| 格式 | ppt | ||
| 文件大小 | 1.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-07 09:13:52 | ||
图片预览








文档简介
(共25张PPT)
氧化还原反应 第一课时
高中化学优质课说课方案
说学情
三
说教法和学法
六
说教材
3
一
说教学过程
3
七
说板书设计
八
说 课 目 录
说考情
3
二
说教学目标
3
四
说教学重难点
3
五
本节是人教版高中化学必修1第二章第三节的第1课时 ,在课本第
35页
第一章 从实验学化学
第二章 化学物质及其变化
第一节 物质的分类
第二节 离子反应
第三节 氧化还原反应
第三章 金属及其化合物
第四章 非金属及其化合物
一 、说教材
原子的结构
氧化还原反应
承 前
启 后
元素化合物知识
简单的氧化还原反应
一、说教材
离子的形成
表
里
二、说考情
高频考点 常考题型 高考热度
氧化还原反应 可以在选择题中独立出现,也可以在实验题、计算题中结合其他考点出现. ★★★★
(2008全国Ⅱ理综,11题)下列氧化还原反应中,水作为氧化剂的是 ( )
A.
CO + H2O 高温 ===CO2 + H2
B. 3NO2 + H2O === 2HNO3
C. 2Na2O2 + 2H2O === 4NaOH + O2
D. 2F2 + 2H2O === 4HF + O2
(2009,辽宁,8题)依据2Fe2+ + Cl2===2Fe3+ +2Cl-;
HClO+HCl===Cl2+H2O;2Fe3++Cu===2Fe2+ +Cu2+;
Fe+Cu2+===Fe2++Cu判断下列氧化剂氧化性强弱顺序正确的是()
A. Fe3+>HClO>Cl2>Fe2+>Cu2+
B. HClO>Cl2>Fe3+>Cu2+>Fe2+
C. Cl2>HClO>Fe3+>Cu2+>Fe2+
D. HClO>Fe3+>Cl2>Cu2+>Fe2+
(2011 江苏 7题)在一定条件下,RO3n-和氟气可发生如下反应:RO3n-+F2+2OH-===RO4-+2F-+H2O。从而可知在RO3n-中,元素R的化合价是()
A.+4 B.+5 C.+6 D.+7
(2010全国卷Ⅱ,5题)若(NH4)2SO4在强热时分解的产物是SO2、N2、NH3和H2O,则该反应中化合价发生变化和未发生变化的N原子数之比为( )。
A.1∶4 B.1∶2 C.2∶1 D.4∶1
(2012 上海高考化学)某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X。
(1)已知KBrO3在反应中得到电子,则该反应的还原剂是________。
(2)已知0.2 mol KBrO3在反应中得到1 mol电子生成X,则X的化学式为________。
(2013·新课标卷Ⅱ·27) 氧化锌为白色粉末,可用于湿疹、癣等皮肤病的治疗。纯化工业级氧化锌(含有 Fe(Ⅱ), Mn(Ⅱ), Ni(Ⅱ)等杂质)的流程如下: 工业ZnO 浸出液 滤液 滤液 滤饼 ZnO 提示:在本实脸条件下,Ni(Ⅱ)不能被氧化:高锰酸钾的还原产物是MnO2 回答下列问题:
(1)反应②中除掉的杂质离子是————— ,发生反应的离子方程式为———— ; 加高锰酸钾溶液前,若pH 较低,对除杂的影响是———————— ;
(2)反应③的反应类型为———— .过滤得到的滤渣中,除了过量的锌外还有—— ;
(3)反应④形成的沉淀要用水洗,检验沉淀是否洗涤干净的方法是—————— 。
(4)反应④中产物的成分可能是ZnCO3·xZn(OH)2 .取干操后的滤饼11.2g,煅烧后可得到产 品8.1 g. 则x 等于——
(2014 全国大纲版理综化学卷,13题)已知:将Cl2通人适量KOH溶液,产物中可能有KCl、KClO、KClO3,且 的值与温度高低有关。当n(KOH)=amol时,下列有关说法错误的是 A.若某温度下,反应后 =11,则溶液中 = B. 参加反应的氯气的物质的量等于 amol C.改变温度,反应中转移电子的物质的量ne的范围: amol≤ne≤ amol D.改变温度,产物中KC1O3的最大理论产量为 amol
学生
情绪和心理上都
处于比较兴奋、好奇的状态
学生已经从得失氧的角度掌握了简单的氧化还原反应
存在较多
认知障碍
认知
能力
知识
心理
掌握了较低层次的判断氧化还原反应的技能
三、说 学 情
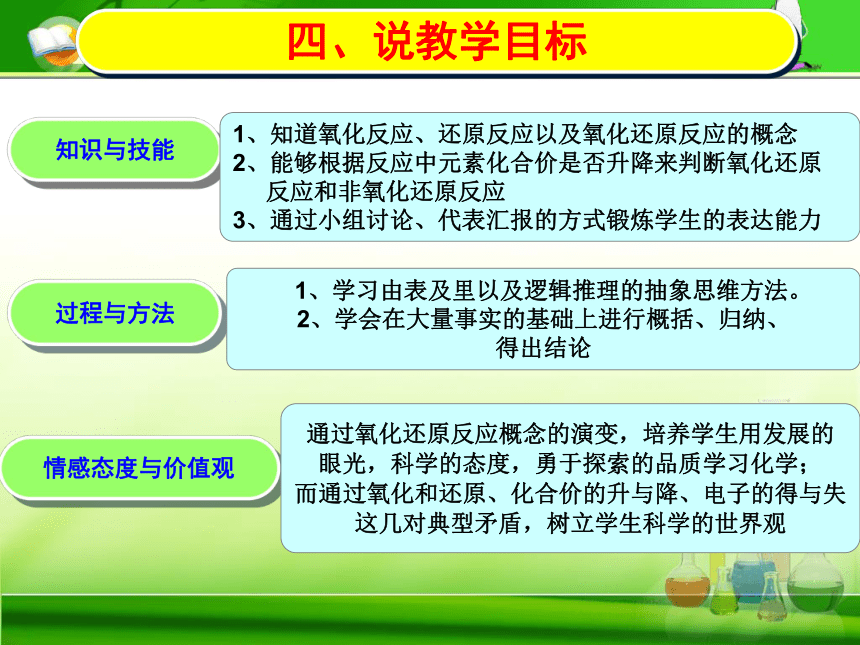
四、说教学目标
知识与技能
1、知道氧化反应、还原反应以及氧化还原反应的概念
2、能够根据反应中元素化合价是否升降来判断氧化还原
反应和非氧化还原反应
3、通过小组讨论、代表汇报的方式锻炼学生的表达能力
过程与方法
1、学习由表及里以及逻辑推理的抽象思维方法。
2、学会在大量事实的基础上进行概括、归纳、
得出结论
情感态度与价值观
通过氧化还原反应概念的演变,培养学生用发展的
眼光,科学的态度,勇于探索的品质学习化学;
而通过氧化和还原、化合价的升与降、电子的得与失
这几对典型矛盾,树立学生科学的世界观
五、说教学重难点
突
破
方
法
1、让学生课前复习初中学过的氧化反应、还原反应以及化合价概念,在课堂上通过分析一氧化碳跟氧化铁的反应 ,钠在氯气中燃烧等例子,从得氧失氧、化合价的升降、电子转移一环扣一环地由表及里地揭示反应的实质,从而形成氧化还原反应的概念。
2、课堂上要有计划地留出充分的时间给学生进行练习巩固,并在此过程中注意培养学生运用概念分析问题和解决问题的能力。
从化合价变化的角度认识氧化还原反应,既是本节课的重点又是本节课的难点。
提出问题、
激发兴趣、
分组讨论、
共同归纳、
层层推进、
自主学习。
学法
设置问题,
探索引申,
分析讨论,
逐步深入理解
同时选择多媒体教学手段作为辅助
教法
六、说教法和学法
整体思路:
- 温习旧识,引入新课 - 问题引导,概念小结
- 定义概念,理解实质
- 加深练习,应用生活
七、说教学设计
依照教材的安排和特点,结合学生的实际水平,在教学中应以让学生掌握有关氧化还原反应的基本概念和常见反应为主,不宜把问题向纵深引申。鉴于此,我对本节课的整体思路安排如下:
温习旧识
问题一 我们在初中学过哪些基本反应类型, 能否举例说明?
问题引导
问题二
Fe2O3+3CO==2Fe+3CO2属于四大基本反应类型中的哪一种 (设立矛盾)
问题三
请从氧化反应和还原反应角度分析Fe2O3+3CO==2Fe+3CO2属于那种反应类型?(引导学生)
加热
加热
Fe2O3 失氧,被还原,发生还原反应
CO 得氧,被氧化,发生氧化反应
在发生了氧化反应的同时也发生了还原反应,也就是说氧化还原反应是同时发生同时存在的,它们是对立统一,不能分开的。而我们也就把这样的反应称为氧化还原反应。凡有得氧失氧发生的化学反应称为氧化还原反应。
概念小结(得氧失氧)
问题四
2Na+Cl2=2NaCl
H2+Cl2=2HCl
上述两个反应中没有得氧失氧,那么它们是否是氧化还原反应?
问题引导
点燃
点燃
回答:不是
④
(事实上,这个是氧化还原反应,以此激发学生思维的矛盾点,引出对氧化还原反应的进一步认识。)
分组讨论:请同学们将① ② ③ ④ ⑤五个反应进行比较,找出它们的共同点,老师可提示从化合价的角度分析。
结论:① ② ⑤元素化合价都有升降
2Na + Cl2 === 2NaCl
0
-1
+1
化合价升高,被氧化(氧化反应)
化合价降低,被还原(还原反应)
0
凡有化合价升降的化学反应称为氧化还原反应。
概念小结(化合价升降)
氧化还原反应的概念
从得氧失氧的角度(原始特征)
凡有得氧失氧发生的化学反应
2. 从化合价升降的角度(表面现象)凡有化合价升降的化学反应
定义概念
问题五(预习)
是什么原因引起了氧化还原反应中元素化合价的升降呢?请从电子得失角度分析。
课后思考:在氧化还原反应中元素化合价升降的原因是什么?这个问题下节课来解答。
问题引导
练习题1(巩固练习使学生的思维不再局限在得氧和失氧)
判断下列方程式哪些是氧化还原反应
Zn+2HCl=ZnCl2+H2↑
Cl2 + 2NaOH = NaCl + NaClO + H2O
2Na2O2 + 2H2O = 4NaOH + O2 ↑
2H2S + SO2 = 2H2O + 3S↓
5NH4NO3 = 4N2↑ + 2HNO3 + 9H2O
加深练习
【习题2 为氧化还原反应与四大基本反应之间的关系打下伏笔】
下列反应中属于氧化还原反应的是( )
A
B
C
D
潜质生有吃的
中等生吃得饱
优等生吃得好
精选少量练习题,对氧化还原反应进行巩固和练习
家庭实验
布置作业
课本习题4题、6题
作业设计以落实教材为主,强化基础,目的是提高学生解决问题的能力
第一章 化学反应及其能量变化
第一节 氧化还原反应
一、氧化还原反应
1.概念:从得失氧分析
2.特征:从化合价的变化分析
Fe2O3+3CO=2Fe+3CO2
CO : 得氧 化合价升高 氧化反应
Fe2O3 :失氧 化合价降低 还原反应
八、说板书设计
氧化还原反应 第一课时
高中化学优质课说课方案
说学情
三
说教法和学法
六
说教材
3
一
说教学过程
3
七
说板书设计
八
说 课 目 录
说考情
3
二
说教学目标
3
四
说教学重难点
3
五
本节是人教版高中化学必修1第二章第三节的第1课时 ,在课本第
35页
第一章 从实验学化学
第二章 化学物质及其变化
第一节 物质的分类
第二节 离子反应
第三节 氧化还原反应
第三章 金属及其化合物
第四章 非金属及其化合物
一 、说教材
原子的结构
氧化还原反应
承 前
启 后
元素化合物知识
简单的氧化还原反应
一、说教材
离子的形成
表
里
二、说考情
高频考点 常考题型 高考热度
氧化还原反应 可以在选择题中独立出现,也可以在实验题、计算题中结合其他考点出现. ★★★★
(2008全国Ⅱ理综,11题)下列氧化还原反应中,水作为氧化剂的是 ( )
A.
CO + H2O 高温 ===CO2 + H2
B. 3NO2 + H2O === 2HNO3
C. 2Na2O2 + 2H2O === 4NaOH + O2
D. 2F2 + 2H2O === 4HF + O2
(2009,辽宁,8题)依据2Fe2+ + Cl2===2Fe3+ +2Cl-;
HClO+HCl===Cl2+H2O;2Fe3++Cu===2Fe2+ +Cu2+;
Fe+Cu2+===Fe2++Cu判断下列氧化剂氧化性强弱顺序正确的是()
A. Fe3+>HClO>Cl2>Fe2+>Cu2+
B. HClO>Cl2>Fe3+>Cu2+>Fe2+
C. Cl2>HClO>Fe3+>Cu2+>Fe2+
D. HClO>Fe3+>Cl2>Cu2+>Fe2+
(2011 江苏 7题)在一定条件下,RO3n-和氟气可发生如下反应:RO3n-+F2+2OH-===RO4-+2F-+H2O。从而可知在RO3n-中,元素R的化合价是()
A.+4 B.+5 C.+6 D.+7
(2010全国卷Ⅱ,5题)若(NH4)2SO4在强热时分解的产物是SO2、N2、NH3和H2O,则该反应中化合价发生变化和未发生变化的N原子数之比为( )。
A.1∶4 B.1∶2 C.2∶1 D.4∶1
(2012 上海高考化学)某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X。
(1)已知KBrO3在反应中得到电子,则该反应的还原剂是________。
(2)已知0.2 mol KBrO3在反应中得到1 mol电子生成X,则X的化学式为________。
(2013·新课标卷Ⅱ·27) 氧化锌为白色粉末,可用于湿疹、癣等皮肤病的治疗。纯化工业级氧化锌(含有 Fe(Ⅱ), Mn(Ⅱ), Ni(Ⅱ)等杂质)的流程如下: 工业ZnO 浸出液 滤液 滤液 滤饼 ZnO 提示:在本实脸条件下,Ni(Ⅱ)不能被氧化:高锰酸钾的还原产物是MnO2 回答下列问题:
(1)反应②中除掉的杂质离子是————— ,发生反应的离子方程式为———— ; 加高锰酸钾溶液前,若pH 较低,对除杂的影响是———————— ;
(2)反应③的反应类型为———— .过滤得到的滤渣中,除了过量的锌外还有—— ;
(3)反应④形成的沉淀要用水洗,检验沉淀是否洗涤干净的方法是—————— 。
(4)反应④中产物的成分可能是ZnCO3·xZn(OH)2 .取干操后的滤饼11.2g,煅烧后可得到产 品8.1 g. 则x 等于——
(2014 全国大纲版理综化学卷,13题)已知:将Cl2通人适量KOH溶液,产物中可能有KCl、KClO、KClO3,且 的值与温度高低有关。当n(KOH)=amol时,下列有关说法错误的是 A.若某温度下,反应后 =11,则溶液中 = B. 参加反应的氯气的物质的量等于 amol C.改变温度,反应中转移电子的物质的量ne的范围: amol≤ne≤ amol D.改变温度,产物中KC1O3的最大理论产量为 amol
学生
情绪和心理上都
处于比较兴奋、好奇的状态
学生已经从得失氧的角度掌握了简单的氧化还原反应
存在较多
认知障碍
认知
能力
知识
心理
掌握了较低层次的判断氧化还原反应的技能
三、说 学 情
四、说教学目标
知识与技能
1、知道氧化反应、还原反应以及氧化还原反应的概念
2、能够根据反应中元素化合价是否升降来判断氧化还原
反应和非氧化还原反应
3、通过小组讨论、代表汇报的方式锻炼学生的表达能力
过程与方法
1、学习由表及里以及逻辑推理的抽象思维方法。
2、学会在大量事实的基础上进行概括、归纳、
得出结论
情感态度与价值观
通过氧化还原反应概念的演变,培养学生用发展的
眼光,科学的态度,勇于探索的品质学习化学;
而通过氧化和还原、化合价的升与降、电子的得与失
这几对典型矛盾,树立学生科学的世界观
五、说教学重难点
突
破
方
法
1、让学生课前复习初中学过的氧化反应、还原反应以及化合价概念,在课堂上通过分析一氧化碳跟氧化铁的反应 ,钠在氯气中燃烧等例子,从得氧失氧、化合价的升降、电子转移一环扣一环地由表及里地揭示反应的实质,从而形成氧化还原反应的概念。
2、课堂上要有计划地留出充分的时间给学生进行练习巩固,并在此过程中注意培养学生运用概念分析问题和解决问题的能力。
从化合价变化的角度认识氧化还原反应,既是本节课的重点又是本节课的难点。
提出问题、
激发兴趣、
分组讨论、
共同归纳、
层层推进、
自主学习。
学法
设置问题,
探索引申,
分析讨论,
逐步深入理解
同时选择多媒体教学手段作为辅助
教法
六、说教法和学法
整体思路:
- 温习旧识,引入新课 - 问题引导,概念小结
- 定义概念,理解实质
- 加深练习,应用生活
七、说教学设计
依照教材的安排和特点,结合学生的实际水平,在教学中应以让学生掌握有关氧化还原反应的基本概念和常见反应为主,不宜把问题向纵深引申。鉴于此,我对本节课的整体思路安排如下:
温习旧识
问题一 我们在初中学过哪些基本反应类型, 能否举例说明?
问题引导
问题二
Fe2O3+3CO==2Fe+3CO2属于四大基本反应类型中的哪一种 (设立矛盾)
问题三
请从氧化反应和还原反应角度分析Fe2O3+3CO==2Fe+3CO2属于那种反应类型?(引导学生)
加热
加热
Fe2O3 失氧,被还原,发生还原反应
CO 得氧,被氧化,发生氧化反应
在发生了氧化反应的同时也发生了还原反应,也就是说氧化还原反应是同时发生同时存在的,它们是对立统一,不能分开的。而我们也就把这样的反应称为氧化还原反应。凡有得氧失氧发生的化学反应称为氧化还原反应。
概念小结(得氧失氧)
问题四
2Na+Cl2=2NaCl
H2+Cl2=2HCl
上述两个反应中没有得氧失氧,那么它们是否是氧化还原反应?
问题引导
点燃
点燃
回答:不是
④
(事实上,这个是氧化还原反应,以此激发学生思维的矛盾点,引出对氧化还原反应的进一步认识。)
分组讨论:请同学们将① ② ③ ④ ⑤五个反应进行比较,找出它们的共同点,老师可提示从化合价的角度分析。
结论:① ② ⑤元素化合价都有升降
2Na + Cl2 === 2NaCl
0
-1
+1
化合价升高,被氧化(氧化反应)
化合价降低,被还原(还原反应)
0
凡有化合价升降的化学反应称为氧化还原反应。
概念小结(化合价升降)
氧化还原反应的概念
从得氧失氧的角度(原始特征)
凡有得氧失氧发生的化学反应
2. 从化合价升降的角度(表面现象)凡有化合价升降的化学反应
定义概念
问题五(预习)
是什么原因引起了氧化还原反应中元素化合价的升降呢?请从电子得失角度分析。
课后思考:在氧化还原反应中元素化合价升降的原因是什么?这个问题下节课来解答。
问题引导
练习题1(巩固练习使学生的思维不再局限在得氧和失氧)
判断下列方程式哪些是氧化还原反应
Zn+2HCl=ZnCl2+H2↑
Cl2 + 2NaOH = NaCl + NaClO + H2O
2Na2O2 + 2H2O = 4NaOH + O2 ↑
2H2S + SO2 = 2H2O + 3S↓
5NH4NO3 = 4N2↑ + 2HNO3 + 9H2O
加深练习
【习题2 为氧化还原反应与四大基本反应之间的关系打下伏笔】
下列反应中属于氧化还原反应的是( )
A
B
C
D
潜质生有吃的
中等生吃得饱
优等生吃得好
精选少量练习题,对氧化还原反应进行巩固和练习
家庭实验
布置作业
课本习题4题、6题
作业设计以落实教材为主,强化基础,目的是提高学生解决问题的能力
第一章 化学反应及其能量变化
第一节 氧化还原反应
一、氧化还原反应
1.概念:从得失氧分析
2.特征:从化合价的变化分析
Fe2O3+3CO=2Fe+3CO2
CO : 得氧 化合价升高 氧化反应
Fe2O3 :失氧 化合价降低 还原反应
八、说板书设计
