第九单元溶液 (含解析)九年级化学人教版下册
文档属性
| 名称 | 第九单元溶液 (含解析)九年级化学人教版下册 |  | |
| 格式 | docx | ||
| 文件大小 | 158.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-07 15:03:04 | ||
图片预览


文档简介
第九单元溶液 九年级化学人教版下册
一、单选题
1.加入足量的水搅拌能形成溶液的是( )
A.泥沙 B.植物油 C.白砂糖 D.粉笔灰
2.把少量下列物质分别放入水中,充分搅拌,能得到溶液的是( )
A.氯化钠 B.植物油 C.面粉 D.泥沙
3.下列说法正确的是( )
A.均一稳定的液体一定是溶液 B.饱和溶液一定是浓溶液
C.汽油洗涤油污属于乳化现象 D.浓H2SO4稀释后,溶液温度升高
4.在水中能形成溶液的是( )
A.食盐 B.面粉 C.泥沙 D.花生油
5.下列对生活中的一些现象解释错误的是( )
A.“遥知不是雪,为有暗香来”,因为分子在不断的运动
B.喝汽水时容易打嗝,因为气体的溶解度随温度升高而减小
C.吃松花蛋时可加入少量食醋,因为食醋能消除蛋中所含碱性物质的涩味
D.滴加洗涤剂能将餐具上的油污洗掉,因为洗涤剂能溶解油污
6.配制100g质量分数为5%的氯化钠溶液,操作顺序正确的是( )
A.计算→称取、量取→溶解 B.计算→溶解→称取、量取
C.称取、量取→计算→溶解 D.溶解→计算→称取、量取
7.室温下,饱和食盐水露置在干燥的空气中,过一段时间后有少量固体析出,这是因为()
A.氯化钠的溶解度减小了 B.溶液中溶质的质量分数减小了
C.溶剂质量减小了 D.溶液变成不饱和溶液了
8.生产、生活中会用到不同的“洗涤”,下列“洗涤”方法不能达到目的是( )
A.在水中加入洗涤剂清洗餐盘 B.用汽油清洗油漆
C.用氢氧化钠溶液清洗排油烟机 D.用食盐水清洗金属表面的铁锈
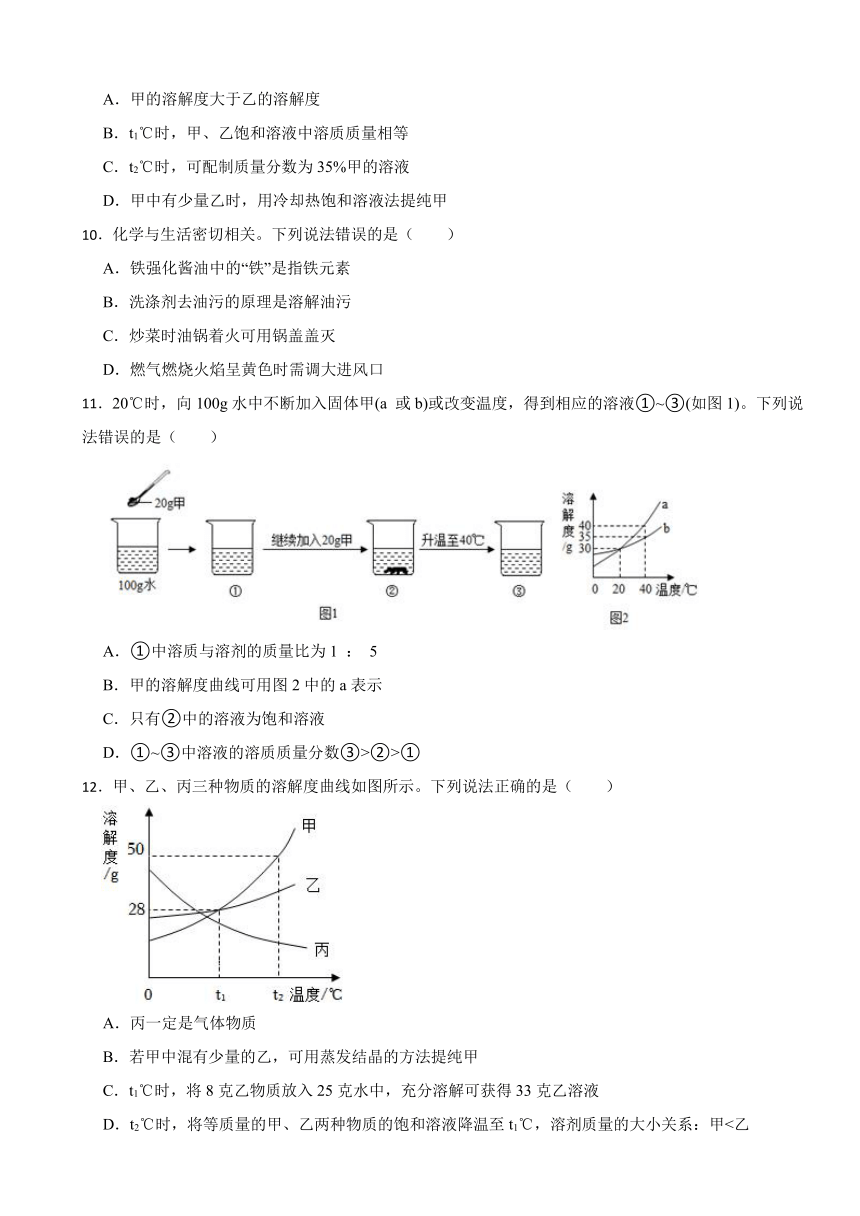
9.甲、乙两种固体的溶解度曲线如图所示,下列说法正确的是( )
A.甲的溶解度大于乙的溶解度
B.t1℃时,甲、乙饱和溶液中溶质质量相等
C.t2℃时,可配制质量分数为35%甲的溶液
D.甲中有少量乙时,用冷却热饱和溶液法提纯甲
10.化学与生活密切相关。下列说法错误的是( )
A.铁强化酱油中的“铁”是指铁元素
B.洗涤剂去油污的原理是溶解油污
C.炒菜时油锅着火可用锅盖盖灭
D.燃气燃烧火焰呈黄色时需调大进风口
11.20℃时,向100g水中不断加入固体甲(a 或b)或改变温度,得到相应的溶液①~③(如图1)。下列说法错误的是( )
A.①中溶质与溶剂的质量比为1 : 5
B.甲的溶解度曲线可用图2中的a表示
C.只有②中的溶液为饱和溶液
D.①~③中溶液的溶质质量分数③>②>①
12.甲、乙、丙三种物质的溶解度曲线如图所示。下列说法正确的是( )
A.丙一定是气体物质
B.若甲中混有少量的乙,可用蒸发结晶的方法提纯甲
C.t1℃时,将8克乙物质放入25克水中,充分溶解可获得33克乙溶液
D.t2℃时,将等质量的甲、乙两种物质的饱和溶液降温至t1℃,溶剂质量的大小关系:甲<乙
二、填空题
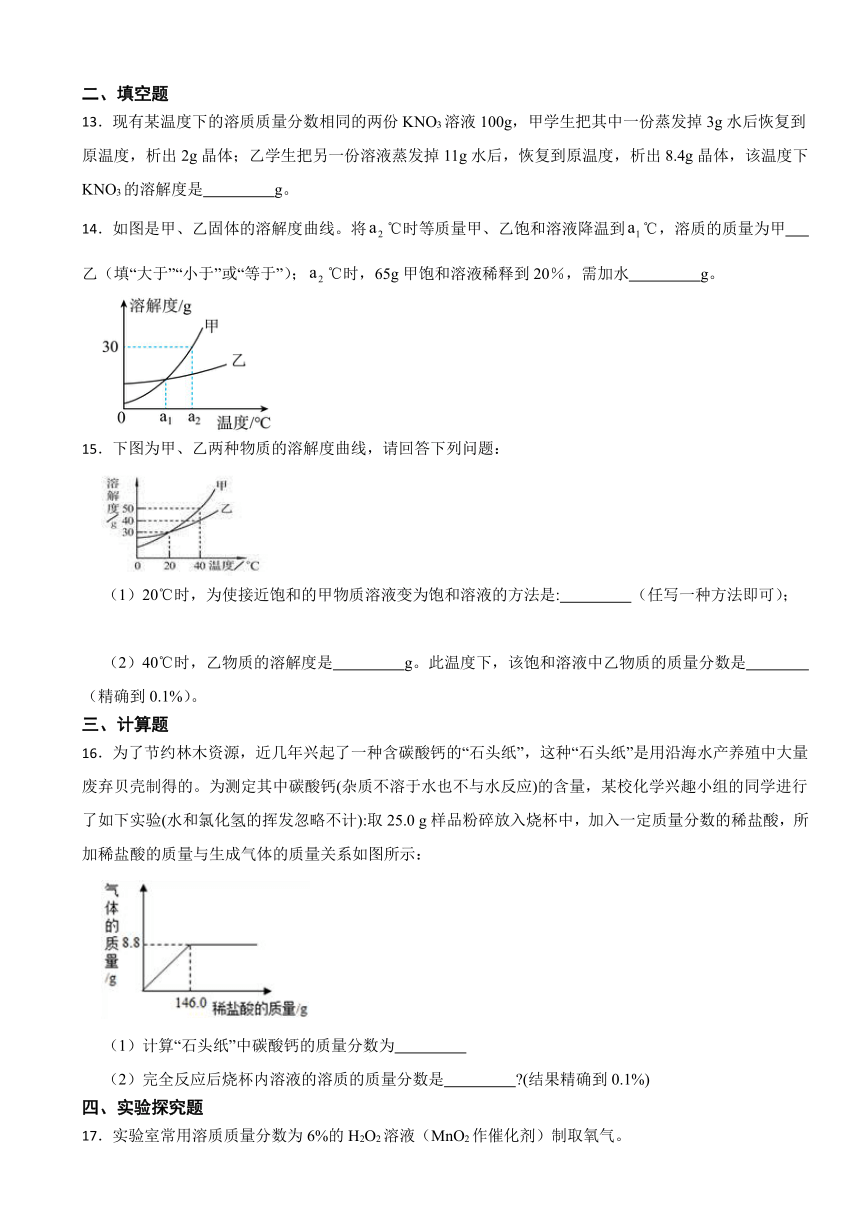
13.现有某温度下的溶质质量分数相同的两份KNO3溶液100g,甲学生把其中一份蒸发掉3g水后恢复到原温度,析出2g晶体;乙学生把另一份溶液蒸发掉11g水后,恢复到原温度,析出8.4g晶体,该温度下KNO3的溶解度是 g。
14.如图是甲、乙固体的溶解度曲线。将℃时等质量甲、乙饱和溶液降温到℃,溶质的质量为甲 乙(填“大于”“小于”或“等于”);℃时,65g甲饱和溶液稀释到20%,需加水 g。
15.下图为甲、乙两种物质的溶解度曲线,请回答下列问题:
(1)20℃时,为使接近饱和的甲物质溶液变为饱和溶液的方法是: (任写一种方法即可);
(2)40℃时,乙物质的溶解度是 g。此温度下,该饱和溶液中乙物质的质量分数是 (精确到0.1%)。
三、计算题
16.为了节约林木资源,近几年兴起了一种含碳酸钙的“石头纸”,这种“石头纸”是用沿海水产养殖中大量废弃贝壳制得的。为测定其中碳酸钙(杂质不溶于水也不与水反应)的含量,某校化学兴趣小组的同学进行了如下实验(水和氯化氢的挥发忽略不计):取25.0 g样品粉碎放入烧杯中,加入一定质量分数的稀盐酸,所加稀盐酸的质量与生成气体的质量关系如图所示:
(1)计算“石头纸”中碳酸钙的质量分数为
(2)完全反应后烧杯内溶液的溶质的质量分数是 (结果精确到0.1%)
四、实验探究题
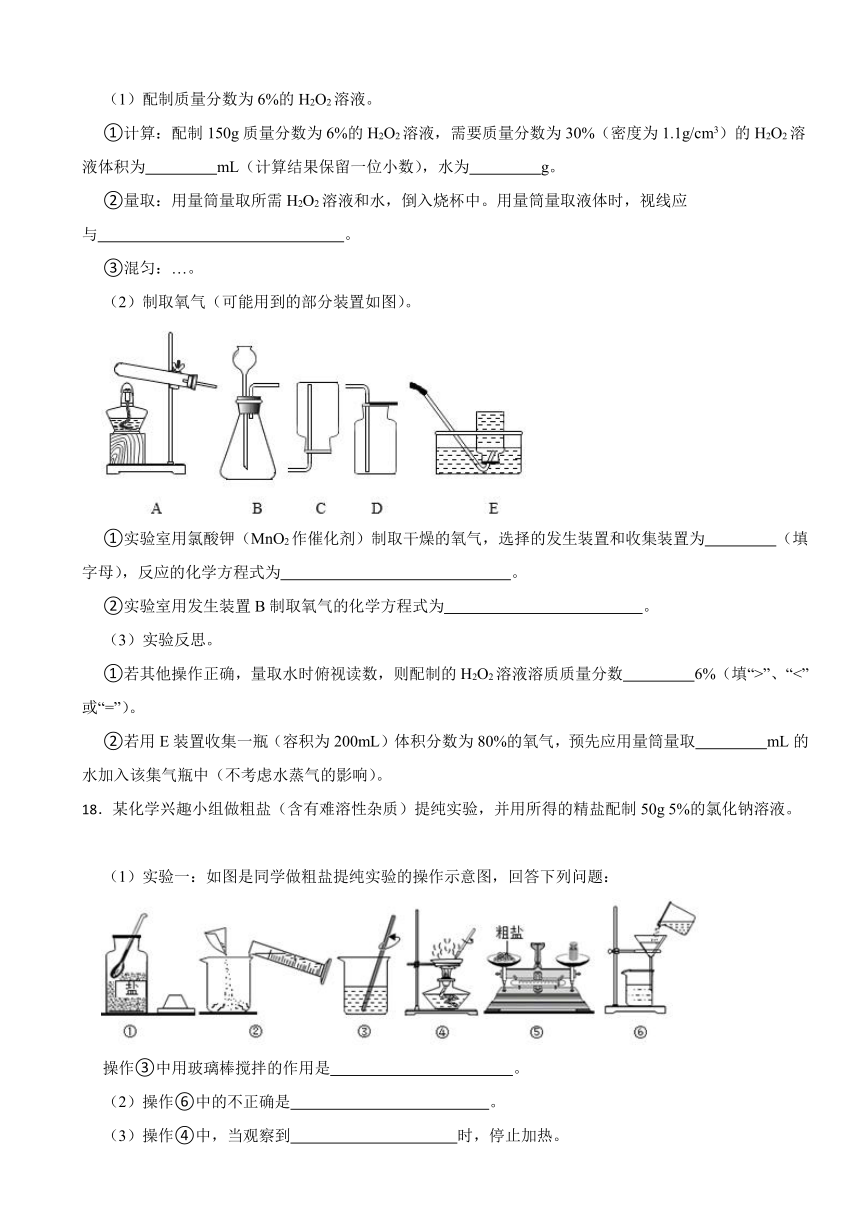
17.实验室常用溶质质量分数为6%的H2O2溶液(MnO2作催化剂)制取氧气。
(1)配制质量分数为6%的H2O2溶液。
①计算:配制150g质量分数为6%的H2O2溶液,需要质量分数为30%(密度为1.1g/cm3)的H2O2溶液体积为 mL(计算结果保留一位小数),水为 g。
②量取:用量筒量取所需H2O2溶液和水,倒入烧杯中。用量筒量取液体时,视线应与 。
③混匀:…。
(2)制取氧气(可能用到的部分装置如图)。
①实验室用氯酸钾(MnO2作催化剂)制取干燥的氧气,选择的发生装置和收集装置为 (填字母),反应的化学方程式为 。
②实验室用发生装置B制取氧气的化学方程式为 。
(3)实验反思。
①若其他操作正确,量取水时俯视读数,则配制的H2O2溶液溶质质量分数 6%(填“>”、“<”或“=”)。
②若用E装置收集一瓶(容积为200mL)体积分数为80%的氧气,预先应用量筒量取 mL的水加入该集气瓶中(不考虑水蒸气的影响)。
18.某化学兴趣小组做粗盐(含有难溶性杂质)提纯实验,并用所得的精盐配制50g 5%的氯化钠溶液。
(1)实验一:如图是同学做粗盐提纯实验的操作示意图,回答下列问题:
操作③中用玻璃棒搅拌的作用是 。
(2)操作⑥中的不正确是 。
(3)操作④中,当观察到 时,停止加热。
(4)实验二:用提纯得到的精盐配制50g 5%的氯化钠溶液,经检测,所配溶液溶质质量分数偏小,其原因可能有 (填序号)。
①氯化钠固体仍然不纯 ②量取水时,仰视读数 ③配好装瓶时,有少量溶液洒出
答案解析部分
1.【答案】C
【解析】【解答】A. 泥沙不溶于水,与水混合形成悬浊液;
B. 植物油不溶于水,与水混合形成乳浊液;
C. 白砂糖易溶于水,形成均一、稳定的混合物,属于溶液;
D. 粉笔灰不溶于水,与水混合形成悬浊液。
故答案为:C。
【分析】溶液是混合物,具有均一性,稳定性。
2.【答案】A
【解析】【解答】A. 氯化钠能溶于水形成均一、稳定的混合物,即形成溶液,故符合题意;
B. 植物油不溶于水,加入水中不能形成溶液,故不符合题意;
C. 面粉不溶于水,加入水中不能形成溶液,故不符合题意;
D. 泥沙不溶于水,加入水中不能形成溶液,故不符合题意。
故答案为:A。
【分析】溶液是具有均一性、稳定性的混合物。
3.【答案】D
【解析】【解答】A、均一稳定的液体不一定是溶液,均一稳定的混合物才是溶液,错误;A不符合题意;
B、饱和溶液不一定是弄溶液,不饱和溶液也不一定是不饱和溶液,错误;B不符合题意;
C、汽油洗涤油污利用了汽油的溶解功能,错误;C不符合题意;
D、浓硫酸溶液水放出大量的热量,温度升高,正确。D符合题意;
故答案为:D。
【分析】溶液的特征是:均一。稳定的混合物;饱和溶液,不饱和溶液与溶液的浓稀没有直接关系;汽油洗涤油污属于溶解现象;
4.【答案】A
【解析】【解答】
A、食盐可以溶解在水中,形成均一的、稳定的混合物,故食盐在水中能形成溶液,故A正确;
B、面粉不可以溶解在水中,故面粉在水中不能形成溶液,故B错误;
C、泥沙不溶于水,在水中会沉降到底部,固体和液体分层,故泥沙在水中不能形成溶液,故C错误;
D、花生油不溶于水,在水中会浮在水面上,液体和液体分层,故花生油在水中不能形成溶液,故D错误。
故选:A。
【分析】
溶液是一定条件下溶质分散到溶剂中形成的是均一稳定的混合物,据此分析。
5.【答案】D
【解析】【解答】A. “遥知不是雪,为有暗香来”,因为分子在不断的运动,正确;A不符合题意;
B. 喝汽水时容易打嗝,因为气体的溶解度随温度升高而减小,正确;B不符合题意;
C. 吃松花蛋时可加入少量食醋,因为食醋能消除蛋中所含碱性物质的涩味,正确;C不符合题意;
D. 滴加洗涤剂能将餐具上的油污洗掉,因为洗涤剂中含有乳化剂,能将大的油珠分散成无数小的油滴而随水流走,错误。D符合题意;
故答案为:D。
【分析】洗涤剂清洗油污是因为洗涤剂有乳化功能;
6.【答案】A
【解析】【解答】配制一定溶质质量分数溶液的一般步骤:取样、称量、量取、溶解,转移,贴签,故答案为A。
【分析】配制一定溶质质量分数溶液的一般步骤:计算、称量、量取、溶解,转移,贴签;在溶解过程中,玻璃棒的作用:搅拌、加速溶解,据此解答。
7.【答案】C
【解析】【解答】A、温度不变溶质的溶解度不变,不符合题意;
B、析出溶质后溶液仍为这一温度下的饱和溶液,溶质质量分数不变,不符合题意;
C、饱和食盐水露置在干燥的空气中,水分会不断蒸发减小,符合题意;
D、析出溶质的溶液所剩溶液一定饱和,不符合题意。
故答案为:C。
【分析】饱和食盐水敞口放置在空气中,溶液中的水分会蒸发,导致溶剂减少,由于温度不变,氯化钠的溶解度不变,因此剩余水中能溶解的氯化钠固体减少。
8.【答案】D
【解析】【解答】A. 由于洗涤剂有乳化作用,在水中加入洗涤剂清洗餐盘,能洗去油污.故A不·符合题意;
B. 由于汽油能溶解油漆.所以,用汽油清洗油漆.故B不符合题意;
C. 由于氢氧化钠能与油污反应,所以,用氢氧化钠溶液清洗排油烟机.故C不符合题意;
D. 由于氯化钠不能与铁锈反应.不能用用食盐水清洗金属表面的铁锈.故D符合题意.
故答案为:D。
【分析】A、根据洗涤剂有乳化作用分析。
B、根据汽油能溶解油漆分析。
C、根据氢氧化钠能与油污反应分析。
D、根据氯化钠不能与铁锈反应分析。
9.【答案】D
【解析】【解答】A、温度不确定,无法比较甲乙两种物质的溶解度,故A不符合题意;
B、t1℃时,甲乙饱和溶液质量没有说明,无法确定溶质质量是否相等,故B不符合题意;
C、t2℃时,100g水中最多溶解甲的质量为50g,所以质量分数为: ,故C不符合题意;
D、甲物质随着温度的升高而升高,比乙变化明显,因此可以降温得到甲物质,故D符合题意;
故答案为:D。
【分析】A、溶解度与温度有关,在一定的温度下,才能比较不同物质的溶解度大小;
B、相同温度下,根据不同饱和溶液的质量大小来比较溶质的质量大小;
C、溶质质量分数=溶质质量÷溶液质量;
D、物质的溶解度受温度的影响比较大时,用冷却热饱和溶液的方法提纯;物质的溶解度受温度的影响比较小时,用蒸发结晶的方法提纯该物质。
10.【答案】B
【解析】【解答】A.物质由元素组成,铁强化酱油中的“铁”是指铁元素,A说法不符合题意;
B.洗涤剂去除油污,是利用了洗涤剂具有乳化作用,能将大的油滴分散成细小的油滴随水冲走,是利用了乳化作用,B说法符合题意;
C.炒菜时油锅着火可用锅盖盖灭,利用隔绝空气(或氧气)来达到灭火的目的,C说法不符合题意;
D.燃气燃烧不充分火焰呈现黄色时,说明是氧气(空气)量不足,可增大空气的进气量,D说法不符合题意。
故答案为:B。
【分析】A、根据物质是由元素组成分析
B、根据洗涤剂具有乳化作用分析
C、根据灭火的方法分析
D、根据促进燃烧的方法分析
11.【答案】C
【解析】【解答】A、①中溶质与溶剂的质量比=20g:100g=1:5故不符合题意;
B、甲的溶解度曲线可用图2中的a表示,因为升温到40℃,固体全部溶解,故不符合题意;
C、40℃时,物质甲的溶解度为40g,只有②中的溶液为饱和溶液不符合题意,因为③恰好饱和,故符合题意;
D、①~③中溶液溶质质量③>②>①,溶剂质量相等,故溶质质量分数③>②>①,故不符合题意;
故答案为:C。
【分析】本考点考查了溶解度曲线及其应用,通过溶解度曲线我们可以获得很多信息;还考查了有关溶液的计算和溶质质量分数的变化等,有关的计算要准确,本考点主要出现在选择题和填空题中。
12.【答案】D
【解析】【解答】根据固体物质溶解度曲线图可知,甲的溶解度随温度变化明显,乙随温度变化不明显,丙与温度成反比。
A、丙是固体氢氧化钙的溶解度曲线图,不符合题意;
B、若甲中混有少量的乙,提纯甲最好采用冷却热饱和溶液,乙中有甲,提纯乙可用蒸发结晶的方法,B错误,不符合题意;
C、t1℃时,乙的溶解度是28克,那么将8克乙物质放入25克水中还剩余1克乙未溶解,充分溶解可获得32克乙溶液 ,C错误,不符合题意;
D、t2℃时,将等质量的甲、乙两种物质的饱和溶液降温至t1℃,溶剂质量的大小关系:甲<乙 ,正确,符合题意。
故答案为:D.
【分析】根据固体物质溶解度曲线图可知,甲的溶解度随温度变化明显,乙随温度变化不明显,丙与温度成反比,提纯甲采用冷却热饱和溶液,提纯乙可用蒸发结晶的方法,根据不同温度时溶解度来解答。
13.【答案】80
【解析】【解答】溶液蒸发掉3g水析出2g晶体,蒸发掉11g水析出8.4g晶体,可知8g水中最多溶解KNO3 的质量为8.4g-2g=6.4g ,所以该温度下KNO3的溶解度是6.4g÷8g×100g=80g
【分析】根据溶解度的概念进行分析
14.【答案】小于;10
15.【答案】(1)降温
(2)40;28.6%
【解析】【解答】(1)20℃时,为使接近饱和的甲物质溶液变为饱和溶液的方法是降温或者是增加溶质等。
(2)40℃时,乙物质的溶解度是40克,该饱和溶液中乙物质的质量分数=40g/140g×100%=28.6%。
【分析】(1)根据使接近饱和的甲物质溶液变为饱和溶液的方法进行分析。
(2)根据溶解度曲线图可知,40℃时,乙物质的溶解度,计算。
16.【答案】80% ⑵完全反应后烧杯内溶液的溶质的质量分数是_________________ (结果精确到0.1%) 14.1%
(1)80%
(2)14.1%
【解析】【解答】(1)设碳酸钙的质量为x,生成氯化钙的质量为y,
CaCO3+ 2HCl= CaCl2+H2O+ CO2↑
100
111 44
x
y 8.8g
100/x=111/y=44/8.8g
X=20g y=22.2g
“石头纸”中碳酸钙的质量分数20g÷25g×100%=80%
(2)完全反应后烧杯内溶液的溶质的质量分数是 =14.1%
答:略
【分析】根据化学方程式进行计算,各物质之间的质量比是固定不变的,已知量为CO2的质量8.8g,利用物之间的比例可以求出参加反应的碳酸钙和所得溶液中溶质的质量,再利用溶质质量分数的公式求出反应后所得溶液的溶质质量分数。
17.【答案】(1)27.3;120;液体凹液面的最低处保持水平
(2)AD;;
(3)>;50
【解析】【解答】(1)①加水稀释前后,溶液中的溶质质量不变,由于溶质质量=溶液质量×溶质质量分数,设需要质量分数为30%的H2O2溶液的质量为x,则: ,x=30g,体积为 ,即所需要质量分数为30%的H2O2溶液的体积为27.3mL,水为150g-30g=120g;
②用量筒量取液体时,视线应与液体凹液面的最低处保持水平。
(2)①用氯酸钾制取氧气时,氯酸钾在二氧化锰的催化作用下加热生成氯化钾和氧气,反应物是固体,反应条件是加热,故发生装置为A,若想收集较干燥的氧气,应选用排空气法,又由于氧气的密度比空气大,则收集装置为D;反应的化学方程式为 ;
②发生装置B为固液常温装置,实验室用发生装置B制取氧气时,选用的药品为过氧化氢和二氧化猛,原理为 。
(3)①量取水时俯视读数,则量取的水的体积偏小,则配制的H2O2溶液溶质质量分数>6%;
②若用E装置收集一瓶(容积为200mL)体积分数为80%的氧气,设预先应用量筒量取水的体积为x,由于空气中氧气约占空气体积的五分之一,则 ,则x=50mL。
【分析】(1)①根据浓溶液加水配制成稀溶液过程中溶质质量不变的原则,可以求出所需质量分数为30%的浓溶液的质量,利用,可以算出所需质量分数为30%的过氧化氢溶液的体积;稀溶液的质量减去浓溶液的质量等于所加水的质量;②用量筒量取液体时,视线要与量筒内液体凹液面的最低处保持水平;
(2)①实验室用氯酸钾(MnO2作催化剂)制取干燥的氧气,反应物是固体且需要加热,发生装置选择A;要收集较干燥的氧气,需要用排空气法。氧气的密度比空气略大,收集装置可以选择D;②实验室用发生装置B制取氧气,试剂用过氧化氢溶液和二氧化锰,过氧化氢在二氧化锰的催化作用下分解成水和氧气;
(3)①若其他操作正确,量取水时俯视读数,会使所配制溶液的溶质质量分数偏大;②氧气约战占空气体积的五分之一,通过计算可知若用E装置收集一瓶(容积为200mL)体积分数为80%的氧气,预先应用量筒量取50mL的水加入该集气瓶中。
18.【答案】(1)加快粗盐的溶解速率
(2)没有用玻璃棒进行引流
(3)出现较多量的固体
(4)①②
【解析】【解答】实验一:
(1)在溶解过程中,玻璃棒搅拌的目的是加快粗盐的溶解速率;
(2)图示操作中,没有用玻璃棒进行引流;
(3)在蒸发结晶的过程中,当观察到出现较多量的固体时,停止加热;
(4)实验二:
①氯化钠固体仍然不纯时,会使氯化钠的质量减小,从而导致溶质质量分数偏小;
②量取水时,仰视读数会使量取的水偏多,从而导致溶质质量分数偏小;
③由于溶液的均一性,配好装瓶时,有少量溶液洒出,对溶质质量分数无影响。
故填:①②;
【分析】(1)根据溶解过程中,玻璃棒搅拌是加快粗盐的溶解速率,进行分析。
(2)根据过滤操作的注意事项,进行分析。
(3)根据蒸发结晶操作的注意事项,进行分析。
(4)读取量筒的示数时,如果俯视, 读出的示数比实际值偏大;如果仰视,读出的示数比实际值偏小,因此正确的方法是视线与凹液面的最低处相平。
一、单选题
1.加入足量的水搅拌能形成溶液的是( )
A.泥沙 B.植物油 C.白砂糖 D.粉笔灰
2.把少量下列物质分别放入水中,充分搅拌,能得到溶液的是( )
A.氯化钠 B.植物油 C.面粉 D.泥沙
3.下列说法正确的是( )
A.均一稳定的液体一定是溶液 B.饱和溶液一定是浓溶液
C.汽油洗涤油污属于乳化现象 D.浓H2SO4稀释后,溶液温度升高
4.在水中能形成溶液的是( )
A.食盐 B.面粉 C.泥沙 D.花生油
5.下列对生活中的一些现象解释错误的是( )
A.“遥知不是雪,为有暗香来”,因为分子在不断的运动
B.喝汽水时容易打嗝,因为气体的溶解度随温度升高而减小
C.吃松花蛋时可加入少量食醋,因为食醋能消除蛋中所含碱性物质的涩味
D.滴加洗涤剂能将餐具上的油污洗掉,因为洗涤剂能溶解油污
6.配制100g质量分数为5%的氯化钠溶液,操作顺序正确的是( )
A.计算→称取、量取→溶解 B.计算→溶解→称取、量取
C.称取、量取→计算→溶解 D.溶解→计算→称取、量取
7.室温下,饱和食盐水露置在干燥的空气中,过一段时间后有少量固体析出,这是因为()
A.氯化钠的溶解度减小了 B.溶液中溶质的质量分数减小了
C.溶剂质量减小了 D.溶液变成不饱和溶液了
8.生产、生活中会用到不同的“洗涤”,下列“洗涤”方法不能达到目的是( )
A.在水中加入洗涤剂清洗餐盘 B.用汽油清洗油漆
C.用氢氧化钠溶液清洗排油烟机 D.用食盐水清洗金属表面的铁锈
9.甲、乙两种固体的溶解度曲线如图所示,下列说法正确的是( )
A.甲的溶解度大于乙的溶解度
B.t1℃时,甲、乙饱和溶液中溶质质量相等
C.t2℃时,可配制质量分数为35%甲的溶液
D.甲中有少量乙时,用冷却热饱和溶液法提纯甲
10.化学与生活密切相关。下列说法错误的是( )
A.铁强化酱油中的“铁”是指铁元素
B.洗涤剂去油污的原理是溶解油污
C.炒菜时油锅着火可用锅盖盖灭
D.燃气燃烧火焰呈黄色时需调大进风口
11.20℃时,向100g水中不断加入固体甲(a 或b)或改变温度,得到相应的溶液①~③(如图1)。下列说法错误的是( )
A.①中溶质与溶剂的质量比为1 : 5
B.甲的溶解度曲线可用图2中的a表示
C.只有②中的溶液为饱和溶液
D.①~③中溶液的溶质质量分数③>②>①
12.甲、乙、丙三种物质的溶解度曲线如图所示。下列说法正确的是( )
A.丙一定是气体物质
B.若甲中混有少量的乙,可用蒸发结晶的方法提纯甲
C.t1℃时,将8克乙物质放入25克水中,充分溶解可获得33克乙溶液
D.t2℃时,将等质量的甲、乙两种物质的饱和溶液降温至t1℃,溶剂质量的大小关系:甲<乙
二、填空题
13.现有某温度下的溶质质量分数相同的两份KNO3溶液100g,甲学生把其中一份蒸发掉3g水后恢复到原温度,析出2g晶体;乙学生把另一份溶液蒸发掉11g水后,恢复到原温度,析出8.4g晶体,该温度下KNO3的溶解度是 g。
14.如图是甲、乙固体的溶解度曲线。将℃时等质量甲、乙饱和溶液降温到℃,溶质的质量为甲 乙(填“大于”“小于”或“等于”);℃时,65g甲饱和溶液稀释到20%,需加水 g。
15.下图为甲、乙两种物质的溶解度曲线,请回答下列问题:
(1)20℃时,为使接近饱和的甲物质溶液变为饱和溶液的方法是: (任写一种方法即可);
(2)40℃时,乙物质的溶解度是 g。此温度下,该饱和溶液中乙物质的质量分数是 (精确到0.1%)。
三、计算题
16.为了节约林木资源,近几年兴起了一种含碳酸钙的“石头纸”,这种“石头纸”是用沿海水产养殖中大量废弃贝壳制得的。为测定其中碳酸钙(杂质不溶于水也不与水反应)的含量,某校化学兴趣小组的同学进行了如下实验(水和氯化氢的挥发忽略不计):取25.0 g样品粉碎放入烧杯中,加入一定质量分数的稀盐酸,所加稀盐酸的质量与生成气体的质量关系如图所示:
(1)计算“石头纸”中碳酸钙的质量分数为
(2)完全反应后烧杯内溶液的溶质的质量分数是 (结果精确到0.1%)
四、实验探究题
17.实验室常用溶质质量分数为6%的H2O2溶液(MnO2作催化剂)制取氧气。
(1)配制质量分数为6%的H2O2溶液。
①计算:配制150g质量分数为6%的H2O2溶液,需要质量分数为30%(密度为1.1g/cm3)的H2O2溶液体积为 mL(计算结果保留一位小数),水为 g。
②量取:用量筒量取所需H2O2溶液和水,倒入烧杯中。用量筒量取液体时,视线应与 。
③混匀:…。
(2)制取氧气(可能用到的部分装置如图)。
①实验室用氯酸钾(MnO2作催化剂)制取干燥的氧气,选择的发生装置和收集装置为 (填字母),反应的化学方程式为 。
②实验室用发生装置B制取氧气的化学方程式为 。
(3)实验反思。
①若其他操作正确,量取水时俯视读数,则配制的H2O2溶液溶质质量分数 6%(填“>”、“<”或“=”)。
②若用E装置收集一瓶(容积为200mL)体积分数为80%的氧气,预先应用量筒量取 mL的水加入该集气瓶中(不考虑水蒸气的影响)。
18.某化学兴趣小组做粗盐(含有难溶性杂质)提纯实验,并用所得的精盐配制50g 5%的氯化钠溶液。
(1)实验一:如图是同学做粗盐提纯实验的操作示意图,回答下列问题:
操作③中用玻璃棒搅拌的作用是 。
(2)操作⑥中的不正确是 。
(3)操作④中,当观察到 时,停止加热。
(4)实验二:用提纯得到的精盐配制50g 5%的氯化钠溶液,经检测,所配溶液溶质质量分数偏小,其原因可能有 (填序号)。
①氯化钠固体仍然不纯 ②量取水时,仰视读数 ③配好装瓶时,有少量溶液洒出
答案解析部分
1.【答案】C
【解析】【解答】A. 泥沙不溶于水,与水混合形成悬浊液;
B. 植物油不溶于水,与水混合形成乳浊液;
C. 白砂糖易溶于水,形成均一、稳定的混合物,属于溶液;
D. 粉笔灰不溶于水,与水混合形成悬浊液。
故答案为:C。
【分析】溶液是混合物,具有均一性,稳定性。
2.【答案】A
【解析】【解答】A. 氯化钠能溶于水形成均一、稳定的混合物,即形成溶液,故符合题意;
B. 植物油不溶于水,加入水中不能形成溶液,故不符合题意;
C. 面粉不溶于水,加入水中不能形成溶液,故不符合题意;
D. 泥沙不溶于水,加入水中不能形成溶液,故不符合题意。
故答案为:A。
【分析】溶液是具有均一性、稳定性的混合物。
3.【答案】D
【解析】【解答】A、均一稳定的液体不一定是溶液,均一稳定的混合物才是溶液,错误;A不符合题意;
B、饱和溶液不一定是弄溶液,不饱和溶液也不一定是不饱和溶液,错误;B不符合题意;
C、汽油洗涤油污利用了汽油的溶解功能,错误;C不符合题意;
D、浓硫酸溶液水放出大量的热量,温度升高,正确。D符合题意;
故答案为:D。
【分析】溶液的特征是:均一。稳定的混合物;饱和溶液,不饱和溶液与溶液的浓稀没有直接关系;汽油洗涤油污属于溶解现象;
4.【答案】A
【解析】【解答】
A、食盐可以溶解在水中,形成均一的、稳定的混合物,故食盐在水中能形成溶液,故A正确;
B、面粉不可以溶解在水中,故面粉在水中不能形成溶液,故B错误;
C、泥沙不溶于水,在水中会沉降到底部,固体和液体分层,故泥沙在水中不能形成溶液,故C错误;
D、花生油不溶于水,在水中会浮在水面上,液体和液体分层,故花生油在水中不能形成溶液,故D错误。
故选:A。
【分析】
溶液是一定条件下溶质分散到溶剂中形成的是均一稳定的混合物,据此分析。
5.【答案】D
【解析】【解答】A. “遥知不是雪,为有暗香来”,因为分子在不断的运动,正确;A不符合题意;
B. 喝汽水时容易打嗝,因为气体的溶解度随温度升高而减小,正确;B不符合题意;
C. 吃松花蛋时可加入少量食醋,因为食醋能消除蛋中所含碱性物质的涩味,正确;C不符合题意;
D. 滴加洗涤剂能将餐具上的油污洗掉,因为洗涤剂中含有乳化剂,能将大的油珠分散成无数小的油滴而随水流走,错误。D符合题意;
故答案为:D。
【分析】洗涤剂清洗油污是因为洗涤剂有乳化功能;
6.【答案】A
【解析】【解答】配制一定溶质质量分数溶液的一般步骤:取样、称量、量取、溶解,转移,贴签,故答案为A。
【分析】配制一定溶质质量分数溶液的一般步骤:计算、称量、量取、溶解,转移,贴签;在溶解过程中,玻璃棒的作用:搅拌、加速溶解,据此解答。
7.【答案】C
【解析】【解答】A、温度不变溶质的溶解度不变,不符合题意;
B、析出溶质后溶液仍为这一温度下的饱和溶液,溶质质量分数不变,不符合题意;
C、饱和食盐水露置在干燥的空气中,水分会不断蒸发减小,符合题意;
D、析出溶质的溶液所剩溶液一定饱和,不符合题意。
故答案为:C。
【分析】饱和食盐水敞口放置在空气中,溶液中的水分会蒸发,导致溶剂减少,由于温度不变,氯化钠的溶解度不变,因此剩余水中能溶解的氯化钠固体减少。
8.【答案】D
【解析】【解答】A. 由于洗涤剂有乳化作用,在水中加入洗涤剂清洗餐盘,能洗去油污.故A不·符合题意;
B. 由于汽油能溶解油漆.所以,用汽油清洗油漆.故B不符合题意;
C. 由于氢氧化钠能与油污反应,所以,用氢氧化钠溶液清洗排油烟机.故C不符合题意;
D. 由于氯化钠不能与铁锈反应.不能用用食盐水清洗金属表面的铁锈.故D符合题意.
故答案为:D。
【分析】A、根据洗涤剂有乳化作用分析。
B、根据汽油能溶解油漆分析。
C、根据氢氧化钠能与油污反应分析。
D、根据氯化钠不能与铁锈反应分析。
9.【答案】D
【解析】【解答】A、温度不确定,无法比较甲乙两种物质的溶解度,故A不符合题意;
B、t1℃时,甲乙饱和溶液质量没有说明,无法确定溶质质量是否相等,故B不符合题意;
C、t2℃时,100g水中最多溶解甲的质量为50g,所以质量分数为: ,故C不符合题意;
D、甲物质随着温度的升高而升高,比乙变化明显,因此可以降温得到甲物质,故D符合题意;
故答案为:D。
【分析】A、溶解度与温度有关,在一定的温度下,才能比较不同物质的溶解度大小;
B、相同温度下,根据不同饱和溶液的质量大小来比较溶质的质量大小;
C、溶质质量分数=溶质质量÷溶液质量;
D、物质的溶解度受温度的影响比较大时,用冷却热饱和溶液的方法提纯;物质的溶解度受温度的影响比较小时,用蒸发结晶的方法提纯该物质。
10.【答案】B
【解析】【解答】A.物质由元素组成,铁强化酱油中的“铁”是指铁元素,A说法不符合题意;
B.洗涤剂去除油污,是利用了洗涤剂具有乳化作用,能将大的油滴分散成细小的油滴随水冲走,是利用了乳化作用,B说法符合题意;
C.炒菜时油锅着火可用锅盖盖灭,利用隔绝空气(或氧气)来达到灭火的目的,C说法不符合题意;
D.燃气燃烧不充分火焰呈现黄色时,说明是氧气(空气)量不足,可增大空气的进气量,D说法不符合题意。
故答案为:B。
【分析】A、根据物质是由元素组成分析
B、根据洗涤剂具有乳化作用分析
C、根据灭火的方法分析
D、根据促进燃烧的方法分析
11.【答案】C
【解析】【解答】A、①中溶质与溶剂的质量比=20g:100g=1:5故不符合题意;
B、甲的溶解度曲线可用图2中的a表示,因为升温到40℃,固体全部溶解,故不符合题意;
C、40℃时,物质甲的溶解度为40g,只有②中的溶液为饱和溶液不符合题意,因为③恰好饱和,故符合题意;
D、①~③中溶液溶质质量③>②>①,溶剂质量相等,故溶质质量分数③>②>①,故不符合题意;
故答案为:C。
【分析】本考点考查了溶解度曲线及其应用,通过溶解度曲线我们可以获得很多信息;还考查了有关溶液的计算和溶质质量分数的变化等,有关的计算要准确,本考点主要出现在选择题和填空题中。
12.【答案】D
【解析】【解答】根据固体物质溶解度曲线图可知,甲的溶解度随温度变化明显,乙随温度变化不明显,丙与温度成反比。
A、丙是固体氢氧化钙的溶解度曲线图,不符合题意;
B、若甲中混有少量的乙,提纯甲最好采用冷却热饱和溶液,乙中有甲,提纯乙可用蒸发结晶的方法,B错误,不符合题意;
C、t1℃时,乙的溶解度是28克,那么将8克乙物质放入25克水中还剩余1克乙未溶解,充分溶解可获得32克乙溶液 ,C错误,不符合题意;
D、t2℃时,将等质量的甲、乙两种物质的饱和溶液降温至t1℃,溶剂质量的大小关系:甲<乙 ,正确,符合题意。
故答案为:D.
【分析】根据固体物质溶解度曲线图可知,甲的溶解度随温度变化明显,乙随温度变化不明显,丙与温度成反比,提纯甲采用冷却热饱和溶液,提纯乙可用蒸发结晶的方法,根据不同温度时溶解度来解答。
13.【答案】80
【解析】【解答】溶液蒸发掉3g水析出2g晶体,蒸发掉11g水析出8.4g晶体,可知8g水中最多溶解KNO3 的质量为8.4g-2g=6.4g ,所以该温度下KNO3的溶解度是6.4g÷8g×100g=80g
【分析】根据溶解度的概念进行分析
14.【答案】小于;10
15.【答案】(1)降温
(2)40;28.6%
【解析】【解答】(1)20℃时,为使接近饱和的甲物质溶液变为饱和溶液的方法是降温或者是增加溶质等。
(2)40℃时,乙物质的溶解度是40克,该饱和溶液中乙物质的质量分数=40g/140g×100%=28.6%。
【分析】(1)根据使接近饱和的甲物质溶液变为饱和溶液的方法进行分析。
(2)根据溶解度曲线图可知,40℃时,乙物质的溶解度,计算。
16.【答案】80% ⑵完全反应后烧杯内溶液的溶质的质量分数是_________________ (结果精确到0.1%) 14.1%
(1)80%
(2)14.1%
【解析】【解答】(1)设碳酸钙的质量为x,生成氯化钙的质量为y,
CaCO3+ 2HCl= CaCl2+H2O+ CO2↑
100
111 44
x
y 8.8g
100/x=111/y=44/8.8g
X=20g y=22.2g
“石头纸”中碳酸钙的质量分数20g÷25g×100%=80%
(2)完全反应后烧杯内溶液的溶质的质量分数是 =14.1%
答:略
【分析】根据化学方程式进行计算,各物质之间的质量比是固定不变的,已知量为CO2的质量8.8g,利用物之间的比例可以求出参加反应的碳酸钙和所得溶液中溶质的质量,再利用溶质质量分数的公式求出反应后所得溶液的溶质质量分数。
17.【答案】(1)27.3;120;液体凹液面的最低处保持水平
(2)AD;;
(3)>;50
【解析】【解答】(1)①加水稀释前后,溶液中的溶质质量不变,由于溶质质量=溶液质量×溶质质量分数,设需要质量分数为30%的H2O2溶液的质量为x,则: ,x=30g,体积为 ,即所需要质量分数为30%的H2O2溶液的体积为27.3mL,水为150g-30g=120g;
②用量筒量取液体时,视线应与液体凹液面的最低处保持水平。
(2)①用氯酸钾制取氧气时,氯酸钾在二氧化锰的催化作用下加热生成氯化钾和氧气,反应物是固体,反应条件是加热,故发生装置为A,若想收集较干燥的氧气,应选用排空气法,又由于氧气的密度比空气大,则收集装置为D;反应的化学方程式为 ;
②发生装置B为固液常温装置,实验室用发生装置B制取氧气时,选用的药品为过氧化氢和二氧化猛,原理为 。
(3)①量取水时俯视读数,则量取的水的体积偏小,则配制的H2O2溶液溶质质量分数>6%;
②若用E装置收集一瓶(容积为200mL)体积分数为80%的氧气,设预先应用量筒量取水的体积为x,由于空气中氧气约占空气体积的五分之一,则 ,则x=50mL。
【分析】(1)①根据浓溶液加水配制成稀溶液过程中溶质质量不变的原则,可以求出所需质量分数为30%的浓溶液的质量,利用,可以算出所需质量分数为30%的过氧化氢溶液的体积;稀溶液的质量减去浓溶液的质量等于所加水的质量;②用量筒量取液体时,视线要与量筒内液体凹液面的最低处保持水平;
(2)①实验室用氯酸钾(MnO2作催化剂)制取干燥的氧气,反应物是固体且需要加热,发生装置选择A;要收集较干燥的氧气,需要用排空气法。氧气的密度比空气略大,收集装置可以选择D;②实验室用发生装置B制取氧气,试剂用过氧化氢溶液和二氧化锰,过氧化氢在二氧化锰的催化作用下分解成水和氧气;
(3)①若其他操作正确,量取水时俯视读数,会使所配制溶液的溶质质量分数偏大;②氧气约战占空气体积的五分之一,通过计算可知若用E装置收集一瓶(容积为200mL)体积分数为80%的氧气,预先应用量筒量取50mL的水加入该集气瓶中。
18.【答案】(1)加快粗盐的溶解速率
(2)没有用玻璃棒进行引流
(3)出现较多量的固体
(4)①②
【解析】【解答】实验一:
(1)在溶解过程中,玻璃棒搅拌的目的是加快粗盐的溶解速率;
(2)图示操作中,没有用玻璃棒进行引流;
(3)在蒸发结晶的过程中,当观察到出现较多量的固体时,停止加热;
(4)实验二:
①氯化钠固体仍然不纯时,会使氯化钠的质量减小,从而导致溶质质量分数偏小;
②量取水时,仰视读数会使量取的水偏多,从而导致溶质质量分数偏小;
③由于溶液的均一性,配好装瓶时,有少量溶液洒出,对溶质质量分数无影响。
故填:①②;
【分析】(1)根据溶解过程中,玻璃棒搅拌是加快粗盐的溶解速率,进行分析。
(2)根据过滤操作的注意事项,进行分析。
(3)根据蒸发结晶操作的注意事项,进行分析。
(4)读取量筒的示数时,如果俯视, 读出的示数比实际值偏大;如果仰视,读出的示数比实际值偏小,因此正确的方法是视线与凹液面的最低处相平。
同课章节目录
