4.2.1元素周期律 课件(共43张PPT)2023-2024学年高一上学期人教版(2019)必修第一册
文档属性
| 名称 | 4.2.1元素周期律 课件(共43张PPT)2023-2024学年高一上学期人教版(2019)必修第一册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 2.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-07 00:00:00 | ||
图片预览





文档简介
(共43张PPT)
第四章 物质结构 元素周期律
第二节 元素周期律
4.2.1 元素周期律
1.什么是元素周期律?
【提示】元素的性质随着原子序数的递增而呈现周
期性的变化。
2.元素周期律的实质是什么?
【提示】原子的核外电子排布的周期性变化是元素
周期律的实质。
【知识回顾】
“位--构--性”的关系
3.同一周期元素的金属性和非金属性变化有何规律?
【提示】从左向右,元素的金属性逐渐减弱,非金属
性逐渐增强。
试用结构观点解释为什么有这样的变化规律:
【提示】同一周期元素,电子层数相同。从左向右,
核电荷数增多,原子半径减小,失电子的能力逐渐减
弱,得电子的能力逐渐增强。
【知识回顾】
4.同一主族元素的金属性和非金属性变化有何规律?
【提示】自上而下,元素的金属性逐渐增强,非金属
性逐渐减弱。
试用结构观点解释为什么有这样的变化规律:
【提示】同一主族元素,最外层电子数相同。自上而下,电子层数增多,原子半径增大,失电子的能力逐渐增强,得电子的能力逐渐减弱。
【知识回顾】
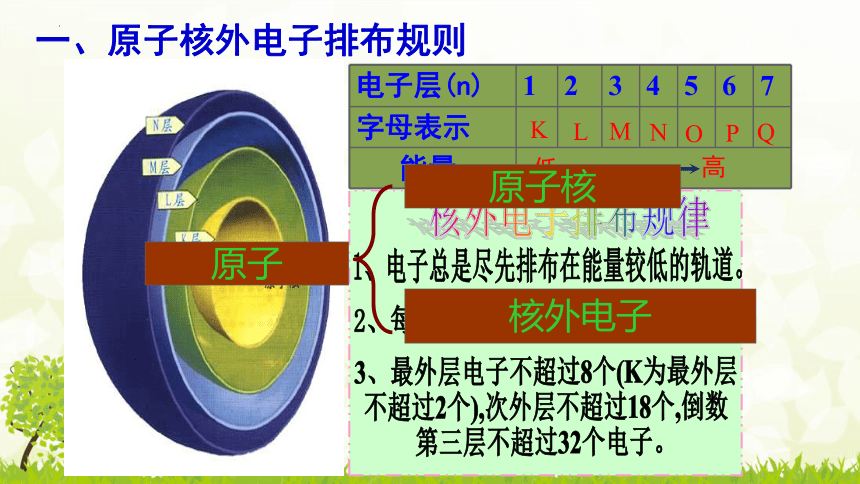
电子层(n) 1 2 3 4 5 6 7
字母表示
能量
K
L
M
N
O
P
Q
低
高
核外电子排布规律
1、电子总是尽先排布在能量较低的轨道。
2、每层最多容纳2n 个电子。
2
3、最外层电子不超过8个(K为最外层
不超过2个),次外层不超过18个,倒数
第三层不超过32个电子。
原子核
核外电子
原子
一、原子核外电子排布规则
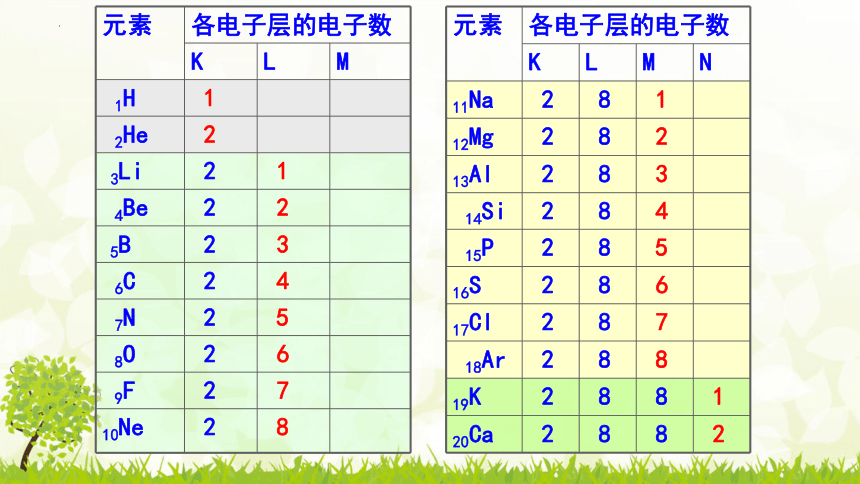
元素 各电子层的电子数
K L M
1H 1
2He 2
3Li 2 1
4Be 2 2
5B 2 3
6C 2 4
7N 2 5
8O 2 6
9F 2 7
10Ne 2 8
元素 各电子层的电子数
K L M N
11Na 2 8 1
12Mg 2 8 2
13Al 2 8 3
14Si 2 8 4
15P 2 8 5
16S 2 8 6
17Cl 2 8 7
18Ar 2 8 8
19K 2 8 8 1
20Ca 2 8 8 2
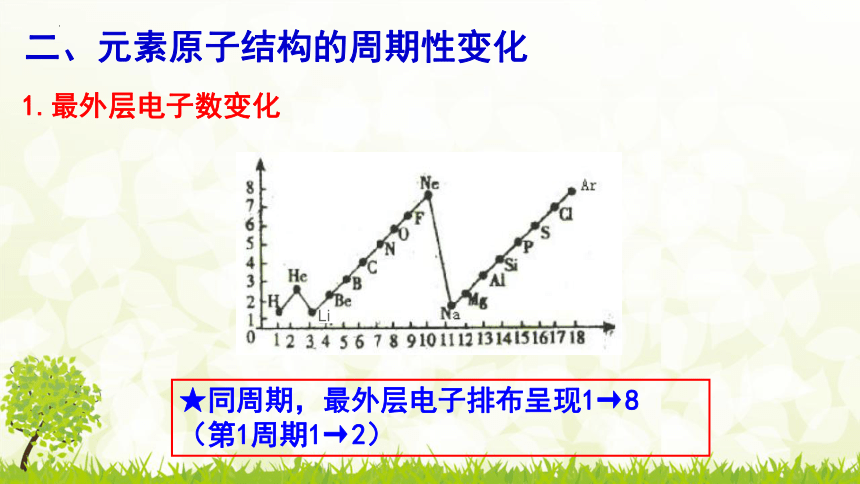
★同周期,最外层电子排布呈现1→8 (第1周期1→2)
二、元素原子结构的周期性变化
1.最外层电子数变化
Li
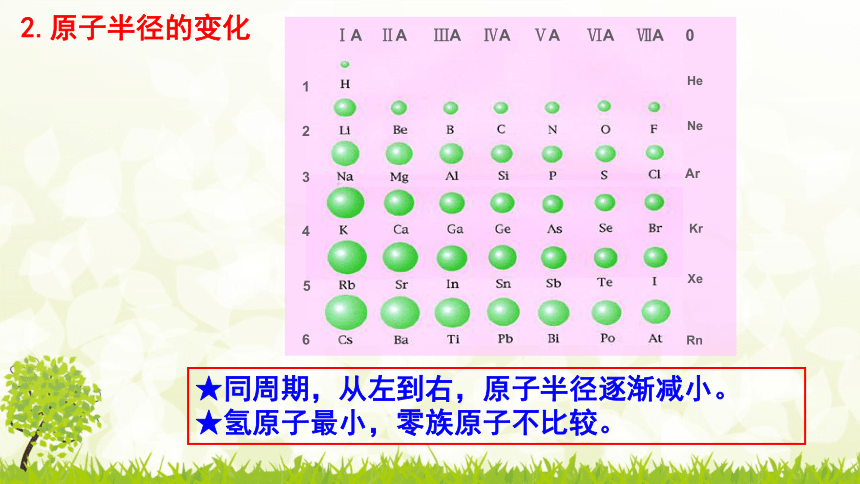
★同周期,从左到右,原子半径逐渐减小。
★氢原子最小,零族原子不比较。
2.原子半径的变化
ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 0
1
He
Ne
Kr
Xe
Rn
Ar
2
3
4
5
6
3
4
5
6
7
8
9
10
锂
铍
硼
碳
氮
氧
氟
氖
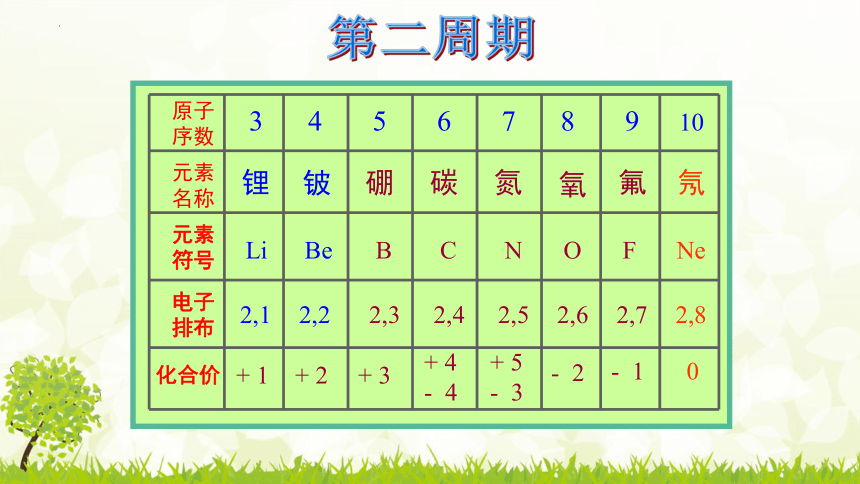
原子序数
元素 名称
元素 符号
电子排布
化合价
Li
Be
B
C
N
O
F
Ne
2,1
2,2
2,3
2,4
2,5
2,6
2,7
2,8
第二周期
+ 1
+ 2
+ 3
+ 4
- 4
+ 5
- 3
- 2
- 1
0
11
12
13
14
15
16
17
18
钠
镁
铝
硅
磷
硫
氯
氩
原子序数
元素 名称
元素 符号
电子排布
化合价
Na
Mg
Al
Si
P
S
Cl
Ar
2, 8, 1
2, 8, 2
2, 8, 3
2, 8, 4
2, 8,5
2, 8, 6
2, 8, 7
2, 8, 8
第三周期
主族元素的最高正化合价与最外层电子数有何关系?
最高正价==
最外层电子数
最低负化合价数 = 8 – 最外层电子数
+ 1
+ 2
+ 3
+ 4
- 4
+ 5
- 3
- 2
- 1
0
+6
+7
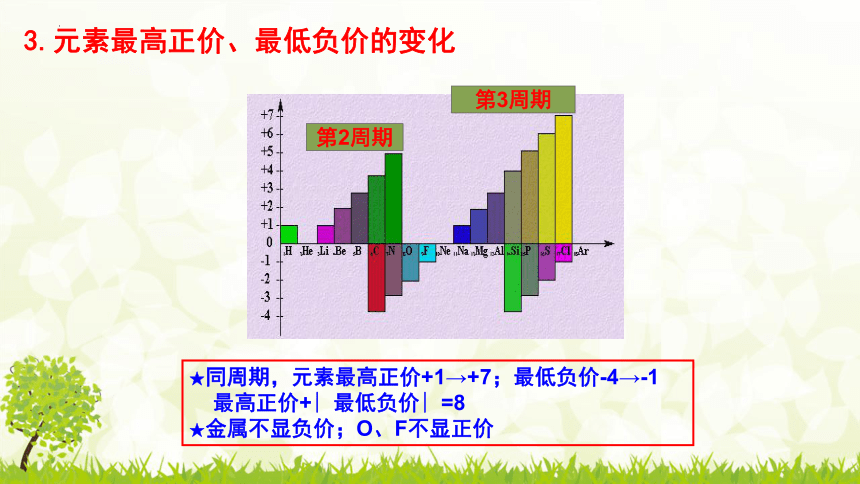
★同周期,元素最高正价+1→+7;最低负价-4→-1
最高正价+∣最低负价∣=8
★金属不显负价;O、F不显正价
第2周期
第3周期
3.元素最高正价、最低负价的变化
1、下列说法中正确的是( )
A.锂的原子结构示意图是
B.原子核外电子离核越近,能量越高
C.某原子L层电子数为K层电子数的3倍,该原子为O
D.某原子M层电子数为L层电子数的4倍
2、(双选)下列叙述正确的是( )
A. 在所有元素中氢原子半径最小
B. Na、Mg、Al 原子半径依次增大
C. P、S、Cl 最高正价依次升高
D.Na→Cl最高正价由+1→+7;最低负价由-7→-1
应用巩固
C
AC
核电荷数=原子序数
结构 电子层数=周期序数 位置
最外层电子数=主族序数
【思考与交流 】原子结构与元素在周期表中的位置有何关系?
根据元素的原子结构我们可以推测它在周期表
中的位置;也可以根据元素在周期表中的位置推测
其结构。
【归纳总结 】
“位--构--性”的关系
最外层电子数=主族元素的最高正价数
︱最低负价数︱+ 最外层电子数 = 8
原子得失
电子的能力
最外层电子数,原子半径
元素的
金属性、
非金属性
强弱
单质的氧化性、
还原性强弱
决定
决定
决定
【思考与交流 】原子的结构与元素的性质有何关系?
结构决定性质,性质反映结构
“位--构--性”的关系
【实验】
放少许镁带于试管中,加2 mL水,滴入2滴酚酞试液,
观察现象;过一会加热至沸腾,再观察现象。
钠、镁、铝与水的反应
镁、铝与盐酸的反应
【实验】
取一片铝片和镁带,擦去氧化膜,分别和2 mL(1 mol/L)
盐酸反应。
三、元素性质的周期性变化
现象:镁与铝均能与盐酸反应产生气泡。但镁反应更剧烈。
Mg + 2HCl === MgCl2 + H2↑
2Al + 6HCl === 2AlCl3+ 3H2↑
现象:镁与冷水反应缓慢,与沸水反应较剧烈,产生较多气泡,溶液变为红色。
Mg + 2H2O ==== Mg(OH)2+H2↑
△
钠、镁、铝与水的反应
镁、铝与盐酸的反应
1.同周期金属性强弱的比较
性质 钠(Na) 镁(Mg) 铝(Al)
与水
与酸
氢氧化物的碱性
冷水、剧烈
冷水、缓慢
剧烈
迅速
NaOH
强碱
Mg(OH)2
中强碱
Al(OH)3
两性氢氧化物
金属性:Na > Mg > Al
剧烈
不反应
2.同周期非金属性强弱的比较
性质
单质与氢气反应条件
含氧酸的酸性
Si
P
S
Cl
高温
H2SiO3
弱酸
磷蒸气与
氢气能反应
H3PO4
中强酸
需加热
H2SO4
强酸
光照或
点燃
HClO4
最强酸
非金属性:Si < P < S < Cl
3.第三周期元素金属性、非金属性的递变规律
金属性逐渐减弱,非金属性逐渐增强
用结构观点解释:
电子层数相同,核电荷数增多
原子半径减小
原子失电子能力
逐渐减弱,得电
子能力逐渐增强
同周期元素
从左到右
原子核对最外层电子的吸引力增强
Na Mg Al Si P S Cl
规律小结
④元素性质的周期性变化
③元素化合价
的周期性变化
②原子半径
的周期性变化
①核外电子排布的周期性变化
原子半径依次减小
原子半径依次减小
原子半径依次增大
原子半径依次增大
失电子能力依次增强
失电子能力依次增强
非金属性依次增强
得电子能力依次增强
得电子能力依次增强
非金属性依次增强
金属性依次增强
金属性依次增强
【回顾】 同周期、同主族元素结构、性质的递变规律
金属性最强的元素是Cs
非金属性最强的元素是
F
“位--构--性”的关系
同周期元素性质的递变性:
从左到右,原子半径变小,非金属性逐渐增强,
金属性逐渐减弱,形成的氢化物稳定性逐渐增强。
同主族元素性质的递变性:
自上而下,原子半径变大,非金属性逐渐减弱,
金属性逐渐增强,形成的氢化物稳定性逐渐减弱,
最高价氧化物的水化物碱性(酸性)逐渐增强(减弱);
同主族元素性质具有相似性和差异性。
根据同周期元素性质的递变性及同主族元素性质具有
相似性和差异性,可以由位置推测性质,也可以由性
质反推原子结构。
“位--构--性”的关系
1.短周期元素A、B、C、D在元素周期表中的相对位置如图所示,其中A所处的周期序数与族序数相等。
下列判断不正确的是( )
A.原子半径:A>B>C
B.非金属性:BC.元素最高正价:C>D
D.A、D的最高价氧化物的水化物可以相互反应
A
B
D
C
Al Si S
N
c
2.原子序数从11依次增加到17,下列递变关系中,错
误的是( )
A.电子层数逐渐增多
B.原子半径逐渐减小
C.最高正化合价数值逐渐增大
D.从Si到Cl,最低负化合价从-4到-1
A
2.下列各组元素性质的递变错误的是( )
A.Li、Be、B原子最外层电子数依次增多
B.P、S、Cl元素的最高正化合价依次升高
C.B、C、N、O、F原子半径依次增大
D.Li、Na、K、Rb的金属性依次增强
c
4.元素性质呈现周期性变化的根本原因是( )
A.原子半径呈周期性变化
B.元素化合价呈周期性变化
C.电子层数逐渐增加
D.元素原子的核外电子排布呈周期性变化
D
5.X、Y、Z 为同周期的三种元素。已知它们最高价氧化物的水化物的酸性由强到弱的顺序为HXO4 > H2YO4 > H3ZO4,则下列判断正确的是( )
A.非金属性:X < Y < Z
B.原子半径:X > Y > Z
C.气态氢化物的稳定性:X > Y > Z
D.原子最外层电子数:X < Y < Z
c
6.今年是门捷列夫诞辰180周年。下列事实不能用元素周期律解释的只有( )
A.碱性:KOH>NaOH B.相对原子质量:Ar>K
C.酸性:HClO4>H2SO4 D.元素的金属性:Mg>Al
B
四、元素周期表和元素周期律的应用
1.元素周期表和元素周期律是学习和研究化学的重要工具:
(1)由元素在周期表中的位置,可确定其结构。如铅(Pb)位于第6周
期第ⅣA族,则可推知铅(Pb)有__个电子层,最外层电子数为__个。
(2)由元素的位置比较元素的性质递变。如同主族元素性质的比较,
同周期元素性质的比较。
6
4
2.根据元素的_________推测它在周期表中的位置。
3.指导新元素的发现及预测它们的原子结构和性质。
4.指导其他与化学相关的科学技术
原子结构
半导体
耐高温
农药
1
B
Al
Si
Ge
As
Sb
Te
2
3
4
5
6
7
ⅠA
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
0
Po
At
观察周期表中金属元素、非金属元素的分区情况。
非金属
金属
稀有气体元素
周期表的元素分区
(1)金属性最强的元素是铯(Cs),非金属性最强的元素是氟(F)。
(2)位于分界线附近的元素既有一定的金属性,又有一定的非金属性,如Al、Si、Ge等。
【小结】
周期表的元素分区
根据元素周期表1~20号元素的性质和递变规律,回
答下列问题。
(1)金属性最强的元素与氧反应生成的化合物是_____________________(填两种化合物的化学式);
(2)最高正化合价最高的元素是_________,其最高
正化合价为________。
(3)单质既能与盐酸反应,又能与NaOH溶液反应的是
______,其最高价氧化物对应水化物具有________
(填“酸性”、“碱性”或“两性”)。
(4)推测Si、N最简单氢化物的稳定性________大于
________(填化学式)。
【及时巩固】
K2O、K2O2(KO2也可以)
氯(或Cl)
+7价
Al
两性
NH3
SiH4
3.准确寻找新的物质,指导我们如何进行科学研究和生产实践。
1.科学预言新
元素,指导我
们如何进行化
学研究。
2.较好阐释元素“位-构-性”的关系,指导我们如何学习化学。
元素周期律
元素周期表
1.元素的原子结构决定其性质和在周期表中的位置。
下列说法正确的是
A.元素原子的最外层电子数等于元素的最高化合价
B.同一元素不可能既表现金属性,又表现非金属性
C.P、S、Cl得电子能力和最高价氧化物对应的水化
物的酸性均依次增强
D.元素周期表中位于金属和非金属分界线附近的元
素属于过渡元素
√
过渡元素指的是所有的副族元素,也叫过渡金属
√
2.(2016·上海高考)硼的最高价含氧酸的化学式不
可能是
A.HBO2 B.H2BO3
C.H3BO3 D.H2B4O7
【分析】硼元素的最高化合价为+3,根据化合价代数
和为0进行判断,HBO2、H3BO3和H2B4O7中硼元素均为+3
价,而H2BO3中硼元素为+4价,所以硼的最高价含氧酸
的化学式不可能是H2BO3。
3.应用元素周期律推断,下列说法正确的是
A.Sr(锶)的碳酸盐难溶于水
B.Tl(铊)的氢氧化物是两性氢氧化物
C.H2Se比H2S更稳定
D.H3AsO4酸性比H3PO4强
√
4.四种短周期元素在周期表中的位置如图,其中只有
M为金属元素。下列说法不正确的是
A.原子半径ZB.Y的最高价氧化物对应水化物的酸性比X的弱
C.X的最简单气态氢化物的热稳定性比Z的小
D.Z位于元素周期表中第2周期、第ⅥA族
√
5.(2016·全国卷Ⅱ)a、b、c、d为短周期元素,a的
原子中只有1个电子,b2-和c+离子的电子层结构相同,
d与b同族。下列叙述错误的是
A.a与其他三种元素形成的二元化合物中其化合价均
为+1
B.b与其他三种元素均可形成至少两种二元化合物
C.c的原子半径是这些元素中最大的
D.d和a形成的化合物的溶液呈弱酸性
√
【拓展延伸】
同一元素的“位、构、性”关系可表示如下:
应用“位置、结构、性质”三者的关系解答问题时要注意以下几个方面:
1.原子结构 元素在周期表中的位置
2.原子结构 元素的化学性质
(1)最外层电子数越少,电子层数越多→越易失电子,还原性越强。
(2)最外层电子数越多,电子层数越少→越易得电子,氧化性越强。
3.元素在周期表中的位置 原子结构和元素性质
4.元素“位、构、性”规律中的特例:
(1)绝大多数原子的原子核是由质子和中子构成的,只有氕( )无
中子。
(2)元素周期表中的周期一般都是从金属元素开始,但第1周期例外,
是从氢元素开始的。
(3)所有元素中,碳元素形成的化合物种类最多。
(4)非金属单质一般不导电,但石墨导电,晶体硅是半导体。
(5)氟无正价,氧无最高正价;在Na2O2中氧显-1价,在NaH中氢显-1价。
【警示】(1)只有主族元素的最外层电子数等于主族序数。
(2)难得电子的原子不一定易失电子,如稀有气体原子。
元素“位、构、性”的关系及应用
典题探究:
1.(2014·广东高考改编)甲~辛等元素在周期表中的相对位置如下表。甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁与辛属同周期元素。下列判断不正确的是( )
甲
乙
丙 丁
戊
己
辛 庚
A.金属性:甲>乙>丁 B.原子半径:辛>己>戊
C.丙与庚的原子核外电子数相差13 D.单质己可作半导体材料
【解题指南】解答本题时应注意以下两点:
(1)熟记元素周期律的内容:同主族从上到下,金属性逐渐增强,同周期从左往右金属性逐渐减弱;
(2)原子半径大小的影响因素:电子层数、核电荷数、电子数。
【解析】选A。由戊的一种单质是自然界硬度最大的物质,知戊为C,甲与戊的原子序数相差3,故甲为Li。甲、乙、丙同主族,则乙为Na,丙为K,丁为Ca,金属性:乙>甲,A错误;根据电子层数越多,原子半径越大,电子层数相同时,核电荷数越大,原子半径越小,得原子半径:辛>己>戊,B正确;丙、庚同属第4周期,第4周期有10种过渡元素,甲与戊的原子序数相差3,故丙与庚的原子核外电子数相差13,C正确;己为硅元素,单质硅可作半导体材料,D正确。
2.(2015·山东高考)短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示。已知Y、W的原子序数之和是Z的3倍,下列说法正确的是( )
A.原子半径:XB.气态氢化物的稳定性:X>Z
C.Z、W均可与Mg形成离子化合物
D.最高价氧化物对应水化物的酸性:Y>W
Y Z
X W
【解析】选C。设元素Y的原子序数为y,则y+y+10=3×(y+1),解得y=7,则Y为N、X为Si、Z为O、W为Cl。原子半径:Z
第四章 物质结构 元素周期律
第二节 元素周期律
4.2.1 元素周期律
1.什么是元素周期律?
【提示】元素的性质随着原子序数的递增而呈现周
期性的变化。
2.元素周期律的实质是什么?
【提示】原子的核外电子排布的周期性变化是元素
周期律的实质。
【知识回顾】
“位--构--性”的关系
3.同一周期元素的金属性和非金属性变化有何规律?
【提示】从左向右,元素的金属性逐渐减弱,非金属
性逐渐增强。
试用结构观点解释为什么有这样的变化规律:
【提示】同一周期元素,电子层数相同。从左向右,
核电荷数增多,原子半径减小,失电子的能力逐渐减
弱,得电子的能力逐渐增强。
【知识回顾】
4.同一主族元素的金属性和非金属性变化有何规律?
【提示】自上而下,元素的金属性逐渐增强,非金属
性逐渐减弱。
试用结构观点解释为什么有这样的变化规律:
【提示】同一主族元素,最外层电子数相同。自上而下,电子层数增多,原子半径增大,失电子的能力逐渐增强,得电子的能力逐渐减弱。
【知识回顾】
电子层(n) 1 2 3 4 5 6 7
字母表示
能量
K
L
M
N
O
P
Q
低
高
核外电子排布规律
1、电子总是尽先排布在能量较低的轨道。
2、每层最多容纳2n 个电子。
2
3、最外层电子不超过8个(K为最外层
不超过2个),次外层不超过18个,倒数
第三层不超过32个电子。
原子核
核外电子
原子
一、原子核外电子排布规则
元素 各电子层的电子数
K L M
1H 1
2He 2
3Li 2 1
4Be 2 2
5B 2 3
6C 2 4
7N 2 5
8O 2 6
9F 2 7
10Ne 2 8
元素 各电子层的电子数
K L M N
11Na 2 8 1
12Mg 2 8 2
13Al 2 8 3
14Si 2 8 4
15P 2 8 5
16S 2 8 6
17Cl 2 8 7
18Ar 2 8 8
19K 2 8 8 1
20Ca 2 8 8 2
★同周期,最外层电子排布呈现1→8 (第1周期1→2)
二、元素原子结构的周期性变化
1.最外层电子数变化
Li
★同周期,从左到右,原子半径逐渐减小。
★氢原子最小,零族原子不比较。
2.原子半径的变化
ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 0
1
He
Ne
Kr
Xe
Rn
Ar
2
3
4
5
6
3
4
5
6
7
8
9
10
锂
铍
硼
碳
氮
氧
氟
氖
原子序数
元素 名称
元素 符号
电子排布
化合价
Li
Be
B
C
N
O
F
Ne
2,1
2,2
2,3
2,4
2,5
2,6
2,7
2,8
第二周期
+ 1
+ 2
+ 3
+ 4
- 4
+ 5
- 3
- 2
- 1
0
11
12
13
14
15
16
17
18
钠
镁
铝
硅
磷
硫
氯
氩
原子序数
元素 名称
元素 符号
电子排布
化合价
Na
Mg
Al
Si
P
S
Cl
Ar
2, 8, 1
2, 8, 2
2, 8, 3
2, 8, 4
2, 8,5
2, 8, 6
2, 8, 7
2, 8, 8
第三周期
主族元素的最高正化合价与最外层电子数有何关系?
最高正价==
最外层电子数
最低负化合价数 = 8 – 最外层电子数
+ 1
+ 2
+ 3
+ 4
- 4
+ 5
- 3
- 2
- 1
0
+6
+7
★同周期,元素最高正价+1→+7;最低负价-4→-1
最高正价+∣最低负价∣=8
★金属不显负价;O、F不显正价
第2周期
第3周期
3.元素最高正价、最低负价的变化
1、下列说法中正确的是( )
A.锂的原子结构示意图是
B.原子核外电子离核越近,能量越高
C.某原子L层电子数为K层电子数的3倍,该原子为O
D.某原子M层电子数为L层电子数的4倍
2、(双选)下列叙述正确的是( )
A. 在所有元素中氢原子半径最小
B. Na、Mg、Al 原子半径依次增大
C. P、S、Cl 最高正价依次升高
D.Na→Cl最高正价由+1→+7;最低负价由-7→-1
应用巩固
C
AC
核电荷数=原子序数
结构 电子层数=周期序数 位置
最外层电子数=主族序数
【思考与交流 】原子结构与元素在周期表中的位置有何关系?
根据元素的原子结构我们可以推测它在周期表
中的位置;也可以根据元素在周期表中的位置推测
其结构。
【归纳总结 】
“位--构--性”的关系
最外层电子数=主族元素的最高正价数
︱最低负价数︱+ 最外层电子数 = 8
原子得失
电子的能力
最外层电子数,原子半径
元素的
金属性、
非金属性
强弱
单质的氧化性、
还原性强弱
决定
决定
决定
【思考与交流 】原子的结构与元素的性质有何关系?
结构决定性质,性质反映结构
“位--构--性”的关系
【实验】
放少许镁带于试管中,加2 mL水,滴入2滴酚酞试液,
观察现象;过一会加热至沸腾,再观察现象。
钠、镁、铝与水的反应
镁、铝与盐酸的反应
【实验】
取一片铝片和镁带,擦去氧化膜,分别和2 mL(1 mol/L)
盐酸反应。
三、元素性质的周期性变化
现象:镁与铝均能与盐酸反应产生气泡。但镁反应更剧烈。
Mg + 2HCl === MgCl2 + H2↑
2Al + 6HCl === 2AlCl3+ 3H2↑
现象:镁与冷水反应缓慢,与沸水反应较剧烈,产生较多气泡,溶液变为红色。
Mg + 2H2O ==== Mg(OH)2+H2↑
△
钠、镁、铝与水的反应
镁、铝与盐酸的反应
1.同周期金属性强弱的比较
性质 钠(Na) 镁(Mg) 铝(Al)
与水
与酸
氢氧化物的碱性
冷水、剧烈
冷水、缓慢
剧烈
迅速
NaOH
强碱
Mg(OH)2
中强碱
Al(OH)3
两性氢氧化物
金属性:Na > Mg > Al
剧烈
不反应
2.同周期非金属性强弱的比较
性质
单质与氢气反应条件
含氧酸的酸性
Si
P
S
Cl
高温
H2SiO3
弱酸
磷蒸气与
氢气能反应
H3PO4
中强酸
需加热
H2SO4
强酸
光照或
点燃
HClO4
最强酸
非金属性:Si < P < S < Cl
3.第三周期元素金属性、非金属性的递变规律
金属性逐渐减弱,非金属性逐渐增强
用结构观点解释:
电子层数相同,核电荷数增多
原子半径减小
原子失电子能力
逐渐减弱,得电
子能力逐渐增强
同周期元素
从左到右
原子核对最外层电子的吸引力增强
Na Mg Al Si P S Cl
规律小结
④元素性质的周期性变化
③元素化合价
的周期性变化
②原子半径
的周期性变化
①核外电子排布的周期性变化
原子半径依次减小
原子半径依次减小
原子半径依次增大
原子半径依次增大
失电子能力依次增强
失电子能力依次增强
非金属性依次增强
得电子能力依次增强
得电子能力依次增强
非金属性依次增强
金属性依次增强
金属性依次增强
【回顾】 同周期、同主族元素结构、性质的递变规律
金属性最强的元素是Cs
非金属性最强的元素是
F
“位--构--性”的关系
同周期元素性质的递变性:
从左到右,原子半径变小,非金属性逐渐增强,
金属性逐渐减弱,形成的氢化物稳定性逐渐增强。
同主族元素性质的递变性:
自上而下,原子半径变大,非金属性逐渐减弱,
金属性逐渐增强,形成的氢化物稳定性逐渐减弱,
最高价氧化物的水化物碱性(酸性)逐渐增强(减弱);
同主族元素性质具有相似性和差异性。
根据同周期元素性质的递变性及同主族元素性质具有
相似性和差异性,可以由位置推测性质,也可以由性
质反推原子结构。
“位--构--性”的关系
1.短周期元素A、B、C、D在元素周期表中的相对位置如图所示,其中A所处的周期序数与族序数相等。
下列判断不正确的是( )
A.原子半径:A>B>C
B.非金属性:B
D.A、D的最高价氧化物的水化物可以相互反应
A
B
D
C
Al Si S
N
c
2.原子序数从11依次增加到17,下列递变关系中,错
误的是( )
A.电子层数逐渐增多
B.原子半径逐渐减小
C.最高正化合价数值逐渐增大
D.从Si到Cl,最低负化合价从-4到-1
A
2.下列各组元素性质的递变错误的是( )
A.Li、Be、B原子最外层电子数依次增多
B.P、S、Cl元素的最高正化合价依次升高
C.B、C、N、O、F原子半径依次增大
D.Li、Na、K、Rb的金属性依次增强
c
4.元素性质呈现周期性变化的根本原因是( )
A.原子半径呈周期性变化
B.元素化合价呈周期性变化
C.电子层数逐渐增加
D.元素原子的核外电子排布呈周期性变化
D
5.X、Y、Z 为同周期的三种元素。已知它们最高价氧化物的水化物的酸性由强到弱的顺序为HXO4 > H2YO4 > H3ZO4,则下列判断正确的是( )
A.非金属性:X < Y < Z
B.原子半径:X > Y > Z
C.气态氢化物的稳定性:X > Y > Z
D.原子最外层电子数:X < Y < Z
c
6.今年是门捷列夫诞辰180周年。下列事实不能用元素周期律解释的只有( )
A.碱性:KOH>NaOH B.相对原子质量:Ar>K
C.酸性:HClO4>H2SO4 D.元素的金属性:Mg>Al
B
四、元素周期表和元素周期律的应用
1.元素周期表和元素周期律是学习和研究化学的重要工具:
(1)由元素在周期表中的位置,可确定其结构。如铅(Pb)位于第6周
期第ⅣA族,则可推知铅(Pb)有__个电子层,最外层电子数为__个。
(2)由元素的位置比较元素的性质递变。如同主族元素性质的比较,
同周期元素性质的比较。
6
4
2.根据元素的_________推测它在周期表中的位置。
3.指导新元素的发现及预测它们的原子结构和性质。
4.指导其他与化学相关的科学技术
原子结构
半导体
耐高温
农药
1
B
Al
Si
Ge
As
Sb
Te
2
3
4
5
6
7
ⅠA
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
0
Po
At
观察周期表中金属元素、非金属元素的分区情况。
非金属
金属
稀有气体元素
周期表的元素分区
(1)金属性最强的元素是铯(Cs),非金属性最强的元素是氟(F)。
(2)位于分界线附近的元素既有一定的金属性,又有一定的非金属性,如Al、Si、Ge等。
【小结】
周期表的元素分区
根据元素周期表1~20号元素的性质和递变规律,回
答下列问题。
(1)金属性最强的元素与氧反应生成的化合物是_____________________(填两种化合物的化学式);
(2)最高正化合价最高的元素是_________,其最高
正化合价为________。
(3)单质既能与盐酸反应,又能与NaOH溶液反应的是
______,其最高价氧化物对应水化物具有________
(填“酸性”、“碱性”或“两性”)。
(4)推测Si、N最简单氢化物的稳定性________大于
________(填化学式)。
【及时巩固】
K2O、K2O2(KO2也可以)
氯(或Cl)
+7价
Al
两性
NH3
SiH4
3.准确寻找新的物质,指导我们如何进行科学研究和生产实践。
1.科学预言新
元素,指导我
们如何进行化
学研究。
2.较好阐释元素“位-构-性”的关系,指导我们如何学习化学。
元素周期律
元素周期表
1.元素的原子结构决定其性质和在周期表中的位置。
下列说法正确的是
A.元素原子的最外层电子数等于元素的最高化合价
B.同一元素不可能既表现金属性,又表现非金属性
C.P、S、Cl得电子能力和最高价氧化物对应的水化
物的酸性均依次增强
D.元素周期表中位于金属和非金属分界线附近的元
素属于过渡元素
√
过渡元素指的是所有的副族元素,也叫过渡金属
√
2.(2016·上海高考)硼的最高价含氧酸的化学式不
可能是
A.HBO2 B.H2BO3
C.H3BO3 D.H2B4O7
【分析】硼元素的最高化合价为+3,根据化合价代数
和为0进行判断,HBO2、H3BO3和H2B4O7中硼元素均为+3
价,而H2BO3中硼元素为+4价,所以硼的最高价含氧酸
的化学式不可能是H2BO3。
3.应用元素周期律推断,下列说法正确的是
A.Sr(锶)的碳酸盐难溶于水
B.Tl(铊)的氢氧化物是两性氢氧化物
C.H2Se比H2S更稳定
D.H3AsO4酸性比H3PO4强
√
4.四种短周期元素在周期表中的位置如图,其中只有
M为金属元素。下列说法不正确的是
A.原子半径Z
C.X的最简单气态氢化物的热稳定性比Z的小
D.Z位于元素周期表中第2周期、第ⅥA族
√
5.(2016·全国卷Ⅱ)a、b、c、d为短周期元素,a的
原子中只有1个电子,b2-和c+离子的电子层结构相同,
d与b同族。下列叙述错误的是
A.a与其他三种元素形成的二元化合物中其化合价均
为+1
B.b与其他三种元素均可形成至少两种二元化合物
C.c的原子半径是这些元素中最大的
D.d和a形成的化合物的溶液呈弱酸性
√
【拓展延伸】
同一元素的“位、构、性”关系可表示如下:
应用“位置、结构、性质”三者的关系解答问题时要注意以下几个方面:
1.原子结构 元素在周期表中的位置
2.原子结构 元素的化学性质
(1)最外层电子数越少,电子层数越多→越易失电子,还原性越强。
(2)最外层电子数越多,电子层数越少→越易得电子,氧化性越强。
3.元素在周期表中的位置 原子结构和元素性质
4.元素“位、构、性”规律中的特例:
(1)绝大多数原子的原子核是由质子和中子构成的,只有氕( )无
中子。
(2)元素周期表中的周期一般都是从金属元素开始,但第1周期例外,
是从氢元素开始的。
(3)所有元素中,碳元素形成的化合物种类最多。
(4)非金属单质一般不导电,但石墨导电,晶体硅是半导体。
(5)氟无正价,氧无最高正价;在Na2O2中氧显-1价,在NaH中氢显-1价。
【警示】(1)只有主族元素的最外层电子数等于主族序数。
(2)难得电子的原子不一定易失电子,如稀有气体原子。
元素“位、构、性”的关系及应用
典题探究:
1.(2014·广东高考改编)甲~辛等元素在周期表中的相对位置如下表。甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁与辛属同周期元素。下列判断不正确的是( )
甲
乙
丙 丁
戊
己
辛 庚
A.金属性:甲>乙>丁 B.原子半径:辛>己>戊
C.丙与庚的原子核外电子数相差13 D.单质己可作半导体材料
【解题指南】解答本题时应注意以下两点:
(1)熟记元素周期律的内容:同主族从上到下,金属性逐渐增强,同周期从左往右金属性逐渐减弱;
(2)原子半径大小的影响因素:电子层数、核电荷数、电子数。
【解析】选A。由戊的一种单质是自然界硬度最大的物质,知戊为C,甲与戊的原子序数相差3,故甲为Li。甲、乙、丙同主族,则乙为Na,丙为K,丁为Ca,金属性:乙>甲,A错误;根据电子层数越多,原子半径越大,电子层数相同时,核电荷数越大,原子半径越小,得原子半径:辛>己>戊,B正确;丙、庚同属第4周期,第4周期有10种过渡元素,甲与戊的原子序数相差3,故丙与庚的原子核外电子数相差13,C正确;己为硅元素,单质硅可作半导体材料,D正确。
2.(2015·山东高考)短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示。已知Y、W的原子序数之和是Z的3倍,下列说法正确的是( )
A.原子半径:X
C.Z、W均可与Mg形成离子化合物
D.最高价氧化物对应水化物的酸性:Y>W
Y Z
X W
【解析】选C。设元素Y的原子序数为y,则y+y+10=3×(y+1),解得y=7,则Y为N、X为Si、Z为O、W为Cl。原子半径:Z
