1.1.3化学反应的分类 课件(共31张PPT)2023-2024学年高一化学苏教版必修一
文档属性
| 名称 | 1.1.3化学反应的分类 课件(共31张PPT)2023-2024学年高一化学苏教版必修一 |

|
|
| 格式 | pptx | ||
| 文件大小 | 2.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-07 19:17:27 | ||
图片预览









文档简介
(共31张PPT)
专题1
第一单元 第3课时 化学反应的分类
素养 目标
1.通过复习四种基本反应类型,体现宏观辨识与微观探析的核心素养。
2.通过氧化反应、还原反应相关概念的学习,体现宏观辨识与微观探析的核心素养。
3.通过对氧化还原反应的特征——元素化合价升降的理解,培养变化观念与平衡思想的核心素养。
基础落实·必备知识全过关
重难探究·能力素养全提升
学以致用·随堂检测全达标
目录索引
基础落实·必备知识全过关
自主梳理
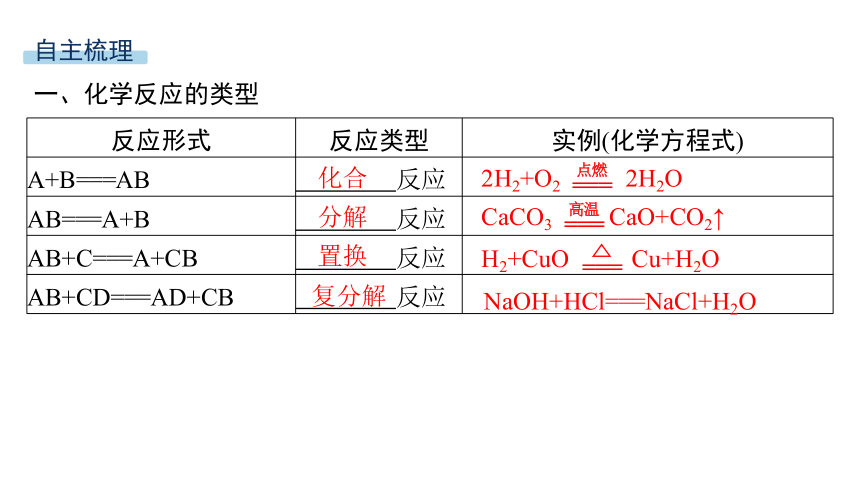
一、化学反应的类型
反应形式 反应类型 实例(化学方程式)
A+B===AB 反应
AB===A+B 反应
AB+C===A+CB 反应
AB+CD===AD+CB 反应
化合
2H2+O2 2H2O
分解
CaCO3 CaO+CO2↑
置换
===
点燃
===
高温
H2+CuO Cu+H2O
===
复分解
NaOH+HCl===NaCl+H2O
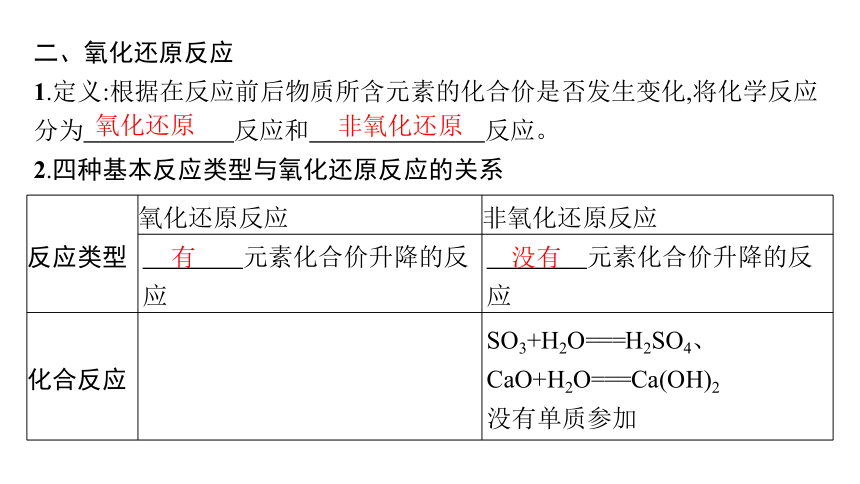
二、氧化还原反应
1.定义:根据在反应前后物质所含元素的化合价是否发生变化,将化学反应分为 反应和 反应。
2.四种基本反应类型与氧化还原反应的关系
反应类型 氧化还原反应 非氧化还原反应
元素化合价升降的反应 元素化合价升降的反应
化合反应 SO3+H2O===H2SO4、CaO+H2O===Ca(OH)2
没有单质参加
氧化还原
非氧化还原
有
没有
生成沉淀、放出气体或生成水
CaCO3 CaO+CO2↑
===
高温
【微思考】有单质参与的化学反应是否一定是氧化还原反应
提示 判断一个化学反应是否是氧化还原反应,其标准是根据反应前后元素的化合价是否发生变化。若一个反应中既有单质,又有化合物,则一定是氧化还原反应;若一个反应中只有单质之间的转化,则该反应是非氧化还原反应(例如:2O3===3O2)。
自我检测
判断下列说法是否正确,正确的画“√”,错误的画“×”。
(1)分解反应一定不属于氧化还原反应。( )
(2)金属铜可与FeSO4溶液发生置换反应。( )
(3)利用稀硫酸或盐酸与块状石灰石反应都可制取CO2。( )
(4)CuO既可发生置换反应,又可发生复分解反应。( )
(5)复分解反应要同时生成沉淀、气体和水。( )
(6)只有中和反应才可生成盐和水。( )
×
×
×
√
×
×
重难探究·能力素养全提升
探究一 氧化还原反应的判断
情境探究
(1)氧化还原反应一定要有氧气参与吗
(2)氧化反应与还原反应是同时存在的还是独立存在的
提示 不一定。只要是有元素化合价发生变化的反应就是氧化还原反应。
提示 氧化反应和还原反应一定是同时发生的。对于H2+CuO Cu+H2O,可以认为H2得氧发生氧化反应的同时,CuO失氧发生还原反应生成Cu,即发生氧化反应的同时,也发生了还原反应。氧化反应和还原反应同时存在于氧化还原反应中,二者既对立又统一。
知识归纳
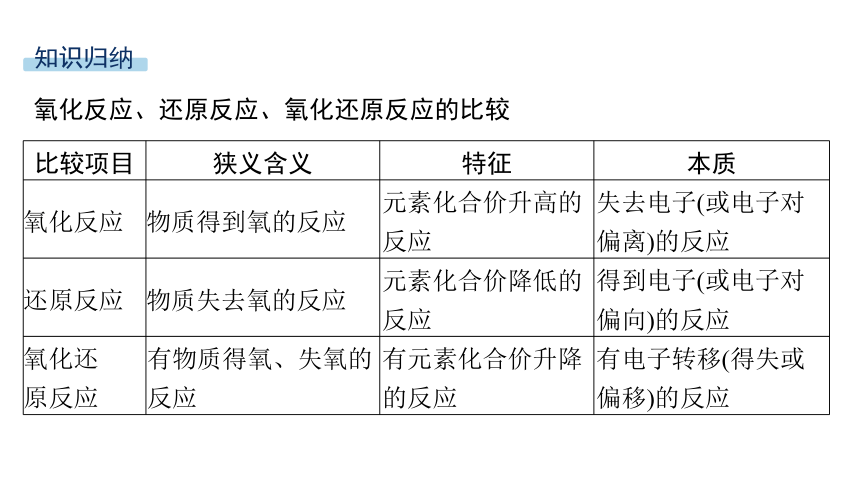
氧化反应、还原反应、氧化还原反应的比较
比较项目 狭义含义 特征 本质
氧化反应 物质得到氧的反应 元素化合价升高的反应 失去电子(或电子对偏离)的反应
还原反应 物质失去氧的反应 元素化合价降低的反应 得到电子(或电子对偏向)的反应
氧化还 原反应 有物质得氧、失氧的反应 有元素化合价升降的反应 有电子转移(得失或偏移)的反应
应用体验
1.下列不属于氧化还原反应的是( )
A.2H2SO4 2SO2↑+O2↑+2H2O
B.4HF+SiO2===SiF4↑+2H2O
C.2Na+2H2O===2NaOH+H2↑
D.6HCl+KClO3===KCl+3Cl2↑+3H2O
B
解析 A项反应中硫、氧两种元素的化合价发生变化,属于氧化还原反应;B项反应中元素的化合价没有发生变化,不属于氧化还原反应;C项反应为置换反应,反应前后钠、氢元素的化合价发生了变化,属于氧化还原反应;D项反应中氯元素的化合价发生了变化,属于氧化还原反应。
2.下列反应中,属于氧化还原反应的是( )
A.Fe+2FeCl3===3FeCl2
B.SO2+2KOH===K2SO3+H2O
C.Na2CO3+CaCl2===CaCO3↓+2NaCl
D.CaCO3 CaO+CO2↑
A
解析 A项反应中Fe单质中Fe元素的化合价为0价,反应后升至+2价,FeCl3中Fe元素的化合价为+3价,反应后降至+2价,属于氧化还原反应,A正确;B、C、D项反应中元素化合价没有发生变化,均不属于氧化还原反应。
3.已知反应:
①SO3+H2O===H2SO4
②3NO2+H2O===2HNO3+NO
③2F2+2H2O===4HF+O2
④2Na2O2+2H2O===4NaOH+O2↑
(提示:Na2O2中O元素显-1价)
⑤SiO2+2NaOH===Na2SiO3+H2O
上述反应中不属于氧化还原反应的有 (填序号)。
①⑤
探究二 氧化还原反应与四种基本反应类型之间的关系
情境探究
(1)四大基本反应类型中哪些一定属于氧化还原反应 哪些一定不属于氧化还原反应
(2)有单质参与的化合反应与分解反应一定属于氧化还原反应吗
提示 置换反应一定属于氧化还原反应;复分解反应一定不属于氧化还原反应。
提示 是的。单质中元素的化合价是0价,有单质参与的化合反应与分解反应中元素化合价一定会发生变化,故一定属于氧化还原反应。
知识归纳
1.氧化还原反应与四种基本反应类型的关系
2.化合反应和分解反应,既有氧化还原反应,也有非氧化还原反应;置换反应全部是氧化还原反应;复分解反应都是非氧化还原反应。
应用体验
1.化合反应、分解反应、置换反应和复分解反应是四种基本化学反应类型。下列变化属于氧化还原反应,但不属于四种基本反应类型的是( )
A
解析 A项反应中有元素化合价变化,属于氧化还原反应,但不符合四种基本反应类型,A正确;B项反应中有元素化合价变化,属于氧化还原反应,同时又是置换反应,B错误;C项反应元素化合价没有变化,不属于氧化还原反应,C错误;D项反应元素化合价有变化,属于氧化还原反应,同时又是化合反应,D错误。
2.下列反应既是氧化还原反应又是分解反应的是( )
A
解析 2H2O2 2H2O+O2↑为分解反应,且氧元素化合价发生变化,属于氧化还原反应,A正确;H2+F2===2HF为化合反应,H、F元素化合价发生变化,属于氧化还原反应,B错误;2Fe(OH)3 Fe2O3+3H2O为分解反应,但元素化合价没有变化,不属于氧化还原反应,C错误;
2Na2O2+2H2O===4NaOH+O2↑反应中氧元素化合价有变化,为氧化还原反应,但不属于分解反应,D错误。
3.氧化还原反应与四种基本反应类型的关系如图所示,则下列化学反应属于区域3的是( )
A.Cl2+2KI===I2+2KCl
C
解析 A项反应属于区域4;B项反应属于区域2以外的分解反应;C项反应属于区域3;D项反应属于区域1。C项反应符合题目要求。
学以致用·随堂检测全达标
1
2
3
4
1.下列反应中有一个与其他三个在分类上不同,该反应是( )
D
解析 四个反应均为化合反应,但A、B、C项中的反应属于氧化还原反应,D项中的反应属于非氧化还原反应。
1
2
3
4
2.以下表示的是碳及其化合物的转化关系,其中涉及的基本反应类型依次是( )
A.化合、置换、分解、复分解
B.置换、复分解、化合、分解
C.置换、化合、分解、复分解
D.置换、化合、复分解、分解
D
1
2
3
4
解析 该转化关系中涉及的化学反应及反应类型为:C+2CuO 2Cu+CO2↑,置换反应;CO2+H2O===H2CO3,化合反应;
H2CO3+Ca(OH)2===CaCO3↓+2H2O,复分解反应;CaCO3 CaO+CO2↑,分解反应。
1
2
3
4
3.下列说法正确的是( )
A.有单质参加或有单质生成的化学反应一定是氧化还原反应
B.置换反应一定是氧化还原反应,复分解反应一定不是氧化还原反应
C.氧化还原反应中一定是不同元素化合价发生变化
D.氧化还原反应一定属于四种基本类型中的一种
B
1
2
3
4
解析 有元素化合价变化的反应为氧化还原反应,置换反应一定为氧化还原反应,但类似2O3 3O2的转化中,元素化合价没有变化,不属于氧化还原反应,A错误;置换反应中一定存在元素化合价的变化,一定为氧化还原反应,复分解反应中元素的化合价没有变化,故不是氧化还原反应,即氧化还原反应不可能是复分解反应,B正确;氧化还原反应中一定有元素化合价发生变化,可能是某一种元素的化合价发生变化,也可能是不同元素的化合价发生变化,C错误;某些氧化还原反应不属于四种基本类型中的任何一种反应,如一氧化碳还原氧化铁的反应,D错误。
1
2
3
4
4.下列反应既属于化合反应又属于氧化还原反应的是( )
A.Fe+2HCl===H2↑+FeCl2
B.2FeCl2+Cl2===2FeCl3
C.CaO+H2O===Ca(OH)2
D.2Fe(OH)3 Fe2O3+3H2O
B
1
2
3
4
解析 A项反应的基本类型是置换反应,由于反应前后有元素化合价的变化,因此该反应属于氧化还原反应,A不符合题意;B项反应的基本类型是化合反应,由于反应前后有元素化合价的变化,因此该反应又属于氧化还原反应,B符合题意;C项反应的基本类型是化合反应,由于反应前后没有元素化合价的变化,因此该反应不属于氧化还原反应,C不符合题意;D项反应的基本类型是分解反应,由于反应前后没有元素化合价的变化,因此该反应不属于氧化还原反应,D不符合题意。
本 课 结 束
专题1
第一单元 第3课时 化学反应的分类
素养 目标
1.通过复习四种基本反应类型,体现宏观辨识与微观探析的核心素养。
2.通过氧化反应、还原反应相关概念的学习,体现宏观辨识与微观探析的核心素养。
3.通过对氧化还原反应的特征——元素化合价升降的理解,培养变化观念与平衡思想的核心素养。
基础落实·必备知识全过关
重难探究·能力素养全提升
学以致用·随堂检测全达标
目录索引
基础落实·必备知识全过关
自主梳理
一、化学反应的类型
反应形式 反应类型 实例(化学方程式)
A+B===AB 反应
AB===A+B 反应
AB+C===A+CB 反应
AB+CD===AD+CB 反应
化合
2H2+O2 2H2O
分解
CaCO3 CaO+CO2↑
置换
===
点燃
===
高温
H2+CuO Cu+H2O
===
复分解
NaOH+HCl===NaCl+H2O
二、氧化还原反应
1.定义:根据在反应前后物质所含元素的化合价是否发生变化,将化学反应分为 反应和 反应。
2.四种基本反应类型与氧化还原反应的关系
反应类型 氧化还原反应 非氧化还原反应
元素化合价升降的反应 元素化合价升降的反应
化合反应 SO3+H2O===H2SO4、CaO+H2O===Ca(OH)2
没有单质参加
氧化还原
非氧化还原
有
没有
生成沉淀、放出气体或生成水
CaCO3 CaO+CO2↑
===
高温
【微思考】有单质参与的化学反应是否一定是氧化还原反应
提示 判断一个化学反应是否是氧化还原反应,其标准是根据反应前后元素的化合价是否发生变化。若一个反应中既有单质,又有化合物,则一定是氧化还原反应;若一个反应中只有单质之间的转化,则该反应是非氧化还原反应(例如:2O3===3O2)。
自我检测
判断下列说法是否正确,正确的画“√”,错误的画“×”。
(1)分解反应一定不属于氧化还原反应。( )
(2)金属铜可与FeSO4溶液发生置换反应。( )
(3)利用稀硫酸或盐酸与块状石灰石反应都可制取CO2。( )
(4)CuO既可发生置换反应,又可发生复分解反应。( )
(5)复分解反应要同时生成沉淀、气体和水。( )
(6)只有中和反应才可生成盐和水。( )
×
×
×
√
×
×
重难探究·能力素养全提升
探究一 氧化还原反应的判断
情境探究
(1)氧化还原反应一定要有氧气参与吗
(2)氧化反应与还原反应是同时存在的还是独立存在的
提示 不一定。只要是有元素化合价发生变化的反应就是氧化还原反应。
提示 氧化反应和还原反应一定是同时发生的。对于H2+CuO Cu+H2O,可以认为H2得氧发生氧化反应的同时,CuO失氧发生还原反应生成Cu,即发生氧化反应的同时,也发生了还原反应。氧化反应和还原反应同时存在于氧化还原反应中,二者既对立又统一。
知识归纳
氧化反应、还原反应、氧化还原反应的比较
比较项目 狭义含义 特征 本质
氧化反应 物质得到氧的反应 元素化合价升高的反应 失去电子(或电子对偏离)的反应
还原反应 物质失去氧的反应 元素化合价降低的反应 得到电子(或电子对偏向)的反应
氧化还 原反应 有物质得氧、失氧的反应 有元素化合价升降的反应 有电子转移(得失或偏移)的反应
应用体验
1.下列不属于氧化还原反应的是( )
A.2H2SO4 2SO2↑+O2↑+2H2O
B.4HF+SiO2===SiF4↑+2H2O
C.2Na+2H2O===2NaOH+H2↑
D.6HCl+KClO3===KCl+3Cl2↑+3H2O
B
解析 A项反应中硫、氧两种元素的化合价发生变化,属于氧化还原反应;B项反应中元素的化合价没有发生变化,不属于氧化还原反应;C项反应为置换反应,反应前后钠、氢元素的化合价发生了变化,属于氧化还原反应;D项反应中氯元素的化合价发生了变化,属于氧化还原反应。
2.下列反应中,属于氧化还原反应的是( )
A.Fe+2FeCl3===3FeCl2
B.SO2+2KOH===K2SO3+H2O
C.Na2CO3+CaCl2===CaCO3↓+2NaCl
D.CaCO3 CaO+CO2↑
A
解析 A项反应中Fe单质中Fe元素的化合价为0价,反应后升至+2价,FeCl3中Fe元素的化合价为+3价,反应后降至+2价,属于氧化还原反应,A正确;B、C、D项反应中元素化合价没有发生变化,均不属于氧化还原反应。
3.已知反应:
①SO3+H2O===H2SO4
②3NO2+H2O===2HNO3+NO
③2F2+2H2O===4HF+O2
④2Na2O2+2H2O===4NaOH+O2↑
(提示:Na2O2中O元素显-1价)
⑤SiO2+2NaOH===Na2SiO3+H2O
上述反应中不属于氧化还原反应的有 (填序号)。
①⑤
探究二 氧化还原反应与四种基本反应类型之间的关系
情境探究
(1)四大基本反应类型中哪些一定属于氧化还原反应 哪些一定不属于氧化还原反应
(2)有单质参与的化合反应与分解反应一定属于氧化还原反应吗
提示 置换反应一定属于氧化还原反应;复分解反应一定不属于氧化还原反应。
提示 是的。单质中元素的化合价是0价,有单质参与的化合反应与分解反应中元素化合价一定会发生变化,故一定属于氧化还原反应。
知识归纳
1.氧化还原反应与四种基本反应类型的关系
2.化合反应和分解反应,既有氧化还原反应,也有非氧化还原反应;置换反应全部是氧化还原反应;复分解反应都是非氧化还原反应。
应用体验
1.化合反应、分解反应、置换反应和复分解反应是四种基本化学反应类型。下列变化属于氧化还原反应,但不属于四种基本反应类型的是( )
A
解析 A项反应中有元素化合价变化,属于氧化还原反应,但不符合四种基本反应类型,A正确;B项反应中有元素化合价变化,属于氧化还原反应,同时又是置换反应,B错误;C项反应元素化合价没有变化,不属于氧化还原反应,C错误;D项反应元素化合价有变化,属于氧化还原反应,同时又是化合反应,D错误。
2.下列反应既是氧化还原反应又是分解反应的是( )
A
解析 2H2O2 2H2O+O2↑为分解反应,且氧元素化合价发生变化,属于氧化还原反应,A正确;H2+F2===2HF为化合反应,H、F元素化合价发生变化,属于氧化还原反应,B错误;2Fe(OH)3 Fe2O3+3H2O为分解反应,但元素化合价没有变化,不属于氧化还原反应,C错误;
2Na2O2+2H2O===4NaOH+O2↑反应中氧元素化合价有变化,为氧化还原反应,但不属于分解反应,D错误。
3.氧化还原反应与四种基本反应类型的关系如图所示,则下列化学反应属于区域3的是( )
A.Cl2+2KI===I2+2KCl
C
解析 A项反应属于区域4;B项反应属于区域2以外的分解反应;C项反应属于区域3;D项反应属于区域1。C项反应符合题目要求。
学以致用·随堂检测全达标
1
2
3
4
1.下列反应中有一个与其他三个在分类上不同,该反应是( )
D
解析 四个反应均为化合反应,但A、B、C项中的反应属于氧化还原反应,D项中的反应属于非氧化还原反应。
1
2
3
4
2.以下表示的是碳及其化合物的转化关系,其中涉及的基本反应类型依次是( )
A.化合、置换、分解、复分解
B.置换、复分解、化合、分解
C.置换、化合、分解、复分解
D.置换、化合、复分解、分解
D
1
2
3
4
解析 该转化关系中涉及的化学反应及反应类型为:C+2CuO 2Cu+CO2↑,置换反应;CO2+H2O===H2CO3,化合反应;
H2CO3+Ca(OH)2===CaCO3↓+2H2O,复分解反应;CaCO3 CaO+CO2↑,分解反应。
1
2
3
4
3.下列说法正确的是( )
A.有单质参加或有单质生成的化学反应一定是氧化还原反应
B.置换反应一定是氧化还原反应,复分解反应一定不是氧化还原反应
C.氧化还原反应中一定是不同元素化合价发生变化
D.氧化还原反应一定属于四种基本类型中的一种
B
1
2
3
4
解析 有元素化合价变化的反应为氧化还原反应,置换反应一定为氧化还原反应,但类似2O3 3O2的转化中,元素化合价没有变化,不属于氧化还原反应,A错误;置换反应中一定存在元素化合价的变化,一定为氧化还原反应,复分解反应中元素的化合价没有变化,故不是氧化还原反应,即氧化还原反应不可能是复分解反应,B正确;氧化还原反应中一定有元素化合价发生变化,可能是某一种元素的化合价发生变化,也可能是不同元素的化合价发生变化,C错误;某些氧化还原反应不属于四种基本类型中的任何一种反应,如一氧化碳还原氧化铁的反应,D错误。
1
2
3
4
4.下列反应既属于化合反应又属于氧化还原反应的是( )
A.Fe+2HCl===H2↑+FeCl2
B.2FeCl2+Cl2===2FeCl3
C.CaO+H2O===Ca(OH)2
D.2Fe(OH)3 Fe2O3+3H2O
B
1
2
3
4
解析 A项反应的基本类型是置换反应,由于反应前后有元素化合价的变化,因此该反应属于氧化还原反应,A不符合题意;B项反应的基本类型是化合反应,由于反应前后有元素化合价的变化,因此该反应又属于氧化还原反应,B符合题意;C项反应的基本类型是化合反应,由于反应前后没有元素化合价的变化,因此该反应不属于氧化还原反应,C不符合题意;D项反应的基本类型是分解反应,由于反应前后没有元素化合价的变化,因此该反应不属于氧化还原反应,D不符合题意。
本 课 结 束
