1.2.2 气体摩尔体积 课件(共37张PPT)2023-2024学年高一化学苏教版必修一
文档属性
| 名称 | 1.2.2 气体摩尔体积 课件(共37张PPT)2023-2024学年高一化学苏教版必修一 |  | |
| 格式 | pptx | ||
| 文件大小 | 2.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-07 19:18:00 | ||
图片预览









文档简介
(共37张PPT)
专题1
第二单元 第2课时 气体摩尔体积
素养 目标
1.由决定物质体积大小的三个因素出发,讨论1 mol不同状态物质体积大小的决定因素,最终形成气体摩尔体积的概念,体现宏观辨识与微观探析的核心素养。
2.由公式Vm= 建立气体体积与气体物质的量间的换算关系,熟练掌握“22.4 L·mol-1”的应用,体现证据推理与模型认知的核心素养。
3.初步了解阿伏加德罗定律及简单推论,并能将该推论应用于有关气体体积、压强、物质的量间的关系判断或计算,体现科学探究与创新意识的核心素养。
基础落实·必备知识全过关
重难探究·能力素养全提升
学以致用·随堂检测全达标
目录索引
基础落实·必备知识全过关
自主梳理
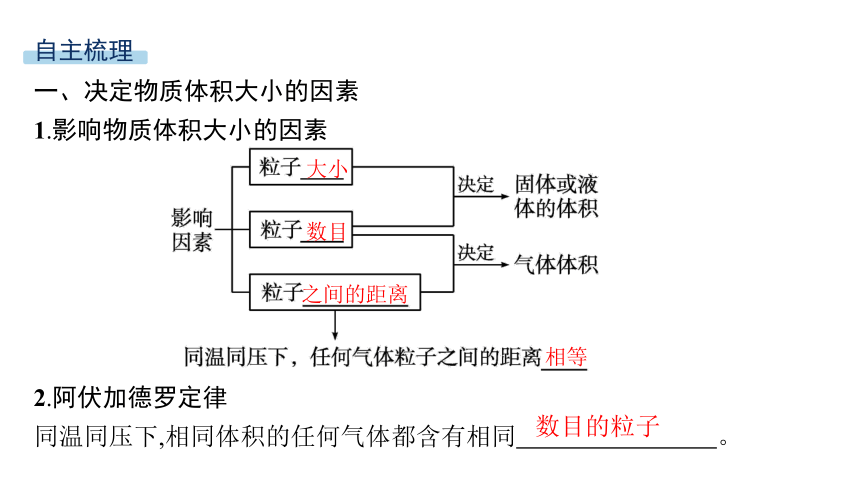
一、决定物质体积大小的因素
1.影响物质体积大小的因素
2.阿伏加德罗定律
同温同压下,相同体积的任何气体都含有相同 。
大小
数目
之间的距离
相等
数目的粒子
【微思考1】决定气体粒子间距离的因素有哪些 如何影响
提示 决定气体粒子间距离的因素是温度和压强。温度越高,压强越小,气体粒子间距离越大。
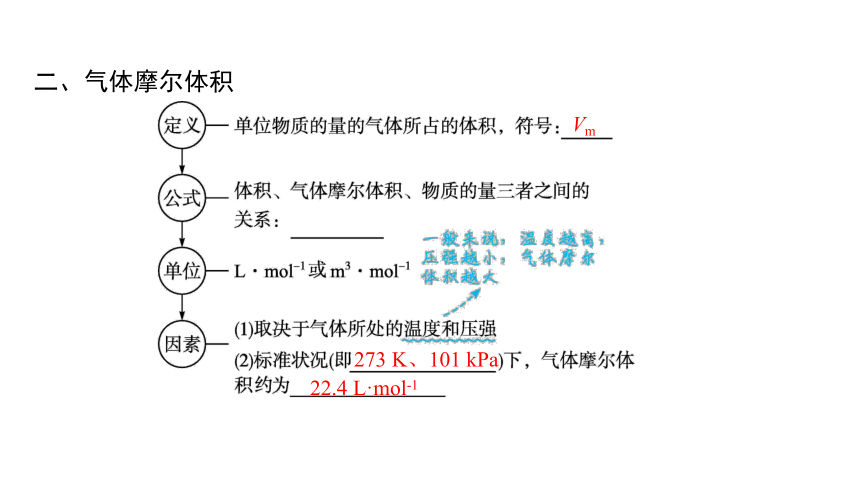
二、气体摩尔体积
Vm
273 K、101 kPa
22.4 L·mol-1
【微思考2】“22.4 L·mol-1”的使用条件是什么
提示 标准状况下的任意气体,既可以是单一气体,也可以是混合气体。
自我检测
判断下列说法是否正确,正确的画“√”,错误的画“×”。
(1)一定温度、压强下,气体体积由其分子的大小和数目决定。( )
(2)固态物质和液态物质的体积决定于粒子大小和粒子数目。( )
(3)1 mol任何气体的体积均约为22.4 L。( )
(4)在标准状况下,1 mol水的体积约为22.4 L。( )
(5)同温同压下,1 mol O2的体积与1 mol CO和CO2混合气体的体积相同。
( )
(6)只有在标准状况下,1 mol 气体的体积才是22.4 L。( )
×
√
×
×
√
×
重难探究·能力素养全提升
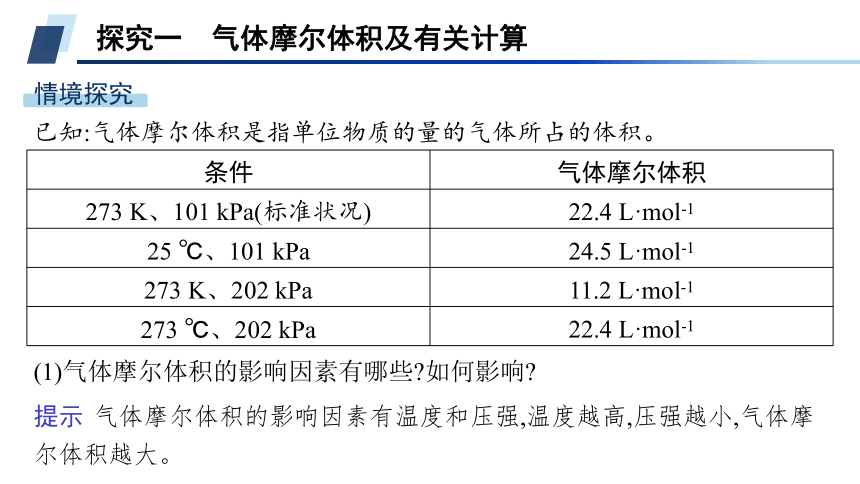
探究一 气体摩尔体积及有关计算
情境探究
已知:气体摩尔体积是指单位物质的量的气体所占的体积。
条件 气体摩尔体积
273 K、101 kPa(标准状况) 22.4 L·mol-1
25 ℃、101 kPa 24.5 L·mol-1
273 K、202 kPa 11.2 L·mol-1
273 ℃、202 kPa 22.4 L·mol-1
(1)气体摩尔体积的影响因素有哪些 如何影响
提示 气体摩尔体积的影响因素有温度和压强,温度越高,压强越小,气体摩尔体积越大。
(2)根据表中数据判断,气体摩尔体积约为22.4 L·mol-1时,一定是在标准状况下吗
(3)在标准状况下,混合气体的气体摩尔体积也是22.4 L·mol-1吗 为什么
提示 不一定。同时改变温度和压强,气体摩尔体积可能保持不变,如升高温度的同时增大压强。
提示 是。在标准状况下,混合气体中不同气体分子之间的距离相同,故1 mol 混合气体的体积与1 mol 单一气体体积相同,均约为22.4 L。
知识归纳
1.使用“Vm=22.4 L·mol-1”应注意的问题
(1)
(2)使用“Vm=22.4 L·mol-1”时的易错点。
序号 易错点
(1) 忽视外界条件是标准状况
如常温、常压下,1 mol H2的体积不是22.4 L
(2) 温度越高、压强越小,Vm越大;温度、压强不同时Vm不同;温度、压强相同时Vm相等,但不一定是22.4 L·mol-1
(3) 忽视研究对象是气体,如标准状况下,H2O、酒精等不是气体
(4) 将1 mol 气体的体积与气体摩尔体积的单位混淆,前者单位为L,后者单位为L·mol-1
应用体验
1.决定气体物质体积大小的因素是( )
①温度 ②所含微粒数目
③微粒本身大小 ④压强
A.②③ B.①②④
C.①③ D.②④
B
解析 对于气体来说,温度和压强不同,气体分子之间的距离不同,而微粒本身大小远小于微粒间的距离,故微粒本身大小可忽略不计。一定条件下,微粒数目越多,则体积越大,所以影响气体体积的因素有:温度、压强及气体所含微粒数目,B正确。
2.[2023河北邢台第一中学高一月考]下列说法正确的是( )
A.1 mol O2和1 mol N2所占的体积约为22.4 L
B.标准状况下,H2的气体摩尔体积约为22.4 L
C.标准状况下,22.4 L由N2、N2O组成的混合气体中所含有的氮原子的物质的量约为2 mol
D.标准状况下,1 mol H2和1 mol H2O所占的体积都约为22.4 L
C
解析 A.二者的物质的量都是1 mol,但由于气体所处的外界条件未知,因此不能确定气体体积的大小,错误;B.标准状况下,H2的气体摩尔体积约为22.4 L·mol-1,错误;C.标准状况下,22.4 L由N2、N2O组成的混合气体的物质的量约为1 mol,由于每个N2、N2O的分子中都含有2个氮原子,故1 mol该混合气体中含有的氮原子的物质的量为2 mol,正确;D.标准状况下水不是气体,不能使用气体摩尔体积进行有关计算,错误。
3.如果a g某气体中含有的分子数为b,则c g该气体在标准状况下占有的体积可表示为(式中NA为阿伏加德罗常数的值)( )
A
探究二 阿伏加德罗定律及其推论
情境探究
(1)同温同压下,1 mol O2和1 mol H2所含的分子数是否相等 气体体积是否相等
(2)根据密度的计算公式ρ= ,推断同温同压下,不同气体的密度之比与气体摩尔质量有何关系。
提示 均相等。同温同压下,气体的物质的量之比等于气体分子个数之比,也等于气体体积之比。
提示 同温同压下,气体的密度之比等于其摩尔质量之比。
(3)同温同压下,向两个容积相同的密闭容器中分别充满O2、O3气体,则两种气体的质量之比为多少 物质的量之比为多少 密度之比为多少
提示 2∶3;1∶1;2∶3。
知识归纳
1.阿伏加德罗定律
相同温度、相同压强下,相同体积的任何气体都含有相同数目的粒子(分子)。
2.阿伏加德罗定律的推论
推论 公式
同温同压下,气体的体积之比等于其物质的量之比
同温同体积时,气体的压强之比等于其物质的量之比
推论 公式 注意事项
同温同压下,任何气体的密度之比等于其摩尔质量之比 (1)阿伏加德罗定律既适用于单一气体,也适用于混合气体
(2)同温、同压、同体积和同分子数,共同存在,相互制约,只要“三同”成立,第四“同”必定成立
(3)解答相关问题时,要注意气体分子的组成。如Ar是单原子分子,O2是双原子分子,O3是三原子分子
(4)可以利用理想气体状态方程确定有关比例
相同温度下,等物质的量气体的压强与体积成反比
应用体验
1.同温同压下,等体积的下列气体中,质量最大的是( )
A.H2 B.N2
C.CO D.SO2
D
解析 同温同压下,气体体积相等则气体物质的量相等,根据m=nM可知,气体的摩尔质量越大,气体的质量越大。H2、N2、CO、SO2的摩尔质量依次为2 g·mol-1、28 g·mol-1、28 g·mol-1、64 g·mol-1,故二氧化硫的质量最大,D正确。
【变式设问】
在标准状况下,相同质量的下列气体,占有体积由大到小的顺序是( )
①Cl2 ②H2 ③N2 ④CO2 ⑤O2
A.③②④⑤① B.⑤②④③①
C.①④⑤②③ D.②③⑤④①
D
解析 根据阿伏加德罗定律,在相同条件下,气体的物质的量相同时所占体积相同。根据n= 可知,当气体的质量相等时,气体的摩尔质量越大,其物质的量就越小,则其所占体积就越小。五种气体的摩尔质量分别是71 g·mol-1、2 g·mol-1、28 g·mol-1、44 g·mol-1、32 g·mol-1,故D正确。
2.同温同压下,相同质量的C2H6和NO两种气体,下列选项中不是1∶1的是
( )
A.分子数之比
B.原子数之比
C.体积比
D.密度比
B
解析 同温同压下,相同质量的C2H6和NO两种气体,C2H6的相对分子质量为30,NO的相对分子质量也为30,根据n= ,所以二者的物质的量相等,依此来解析。结合N=nNA可知,物质的量相等的C2H6和NO含有的分子数相同,二者分子数之比为1∶1,A不符合题意;C2H6和NO分子中含有的原子数不同,物质的量相等的C2H6和NO含有的分子数相同,但含有的原子数不同,二者原子数之比是4∶1,B符合题意;同温同压下,Vm相同,结合V=nVm可知,物质的量相等的C2H6和NO,二者的体积比为1∶1,C不符合题意;C2H6和NO二者的摩尔质量都是30 g·mol-1,根据ρ= 可知,同温同压下气体的密度之比等于其摩尔质量之比,其密度之比为1∶1,D不符合题意。
学以致用·随堂检测全达标
1
2
3
4
5
1.下列说法正确的是( )
A.1 mol 气体的体积主要由微粒的大小决定
B.标准状况下,气体摩尔体积约为22.4 L
C.若1 mol CH4的体积约为22.4 L,则一定处于标准状况下
D.20 ℃、101 kPa时,气体摩尔体积大于22.4 L·mol-1
D
解析 由于气体分子间的间隔远大于气体分子的大小,故1 mol 气体的体积主要由气体分子间间隔决定,A错误;标准状况下,气体摩尔体积约为22.4 L·mol-1,B错误;由于气体摩尔体积受温度和压强共同影响,故1 mol CH4的体积约为22.4 L时,不一定处于标准状况,C错误;同压下,温度越高气体摩尔体积越大,D正确。
1
2
3
4
5
2.下列关于气体摩尔体积的说法正确的是( )
A.22.4 L任何气体,其物质的量均为1 mol
B.非标准状况下,1 mol任何气体体积一定不是22.4 L
C.0.6 mol H2、0.2 mol O2和0.2 mol CO2组成的混合气体,在标准状况下所占体积约为22.4 L
D.气体摩尔体积指的是在标准状况下1 mol 气体的体积
C
1
2
3
4
5
解析 体积一定,影响气体物质的量的因素有温度、压强,22.4 L任何气体的物质的量可能为1 mol,也可能不是1 mol,A错误;非标准状况下,1 mol气体可能占有22.4 L体积,B错误;标准状况下,气体摩尔体积是22.4 L·mol-1,0.6 mol H2、0.2 mol O2和0.2 mol CO2组成的混合气体共1 mol,混合气体的体积约为22.4 L,C正确;气体摩尔体积是单位物质的量的气体所占的体积,不一定是在标准状况下,D错误。
1
2
3
4
5
3.下列叙述正确的是( )
A.NH3的摩尔质量为17 g
B.22.4 L O2的质量为32 g
C.44 g CO2的物质的量是1 mol
D.1 mol水含有2个氢原子和1个氧原子
C
解析 摩尔质量的单位为g·mol-1,A错误;未指明气体所处温度、压强,气体摩尔体积未知,无法计算质量,B错误;44 g二氧化碳的物质的量为 =1 mol,C正确;设NA为阿伏加德罗常数的值,1 mol H2O含有2 mol氢原子、1 mol氧原子,含氢原子个数为2NA、氧原子个数为NA,D错误。
1
2
3
4
5
4.下列说法正确的是( )
A.1 mol 任何气体所占体积都约为22.4 L
B.1 mol H2O在标准状况下的体积约为22.4 L
C.1 mol 气体体积若为22.4 L,则一定是标准状况
D.气体摩尔体积不一定是22.4 L·mol-1
D
解析 标准状况下,1 mol 任何气体的体积约为22.4 L,A错误;标准状况下,22.4 L的任何气体的物质的量都是1 mol,在标准状况下的水不是气体,B错误;温度和压强都能影响气体的体积,所以,不是在标准状况下,1 mol 气体的体积也有可能为22.4 L,C错误;气体摩尔体积是单位物质的量的气体所占有的体积,非标准状况下,气体摩尔体积不一定是22.4 L·mol-1,D正确。
1
2
3
4
5
5.(1)2 mol O3和3 mol O2的质量之比为 ,分子数之比为 ,同温同压下的密度之比为 ,含氧原子数之比为 ,体积之比为 。
(2)在标准状况下,由CO和CO2组成的混合气体6.72 L,质量为12 g。此混合物中CO和CO2物质的量之比是 ,混合气体的平均相对分子质量是 ,对氢气的相对密度是 。
答案 (1)1∶1 2∶3 3∶2 1∶1 2∶3
(2)1∶3 40 20
1
2
3
4
5
解析 (1)臭氧的摩尔质量为48 g·mol-1,氧气的摩尔质量为32 g·mol-1,根据m=nM知,其质量之比=(48 g·mol-1×2 mol)∶(32 g·mol-1×3 mol)=1∶1;根据N=nNA知,其分子数之比等于其物质的量之比=2∶3;相同条件下,气体摩尔
1个臭氧分子中含有3个氧原子,1个氧气分子中含有2个氧原子,其分子数之比为2∶3,结合每个分子中含有的氧原子个数知,其原子个数之比为1∶1;在相同条件下,气体物质的量之比等于其体积之比,故体积之比为2∶3。
1
2
3
4
5
对分子质量在数值上相等,所以其相对分子质量为40;相同条件下气体的密度之比等于其摩尔质量之比,所以该混合气体对于氢气的相对密度是20。
本 课 结 束
专题1
第二单元 第2课时 气体摩尔体积
素养 目标
1.由决定物质体积大小的三个因素出发,讨论1 mol不同状态物质体积大小的决定因素,最终形成气体摩尔体积的概念,体现宏观辨识与微观探析的核心素养。
2.由公式Vm= 建立气体体积与气体物质的量间的换算关系,熟练掌握“22.4 L·mol-1”的应用,体现证据推理与模型认知的核心素养。
3.初步了解阿伏加德罗定律及简单推论,并能将该推论应用于有关气体体积、压强、物质的量间的关系判断或计算,体现科学探究与创新意识的核心素养。
基础落实·必备知识全过关
重难探究·能力素养全提升
学以致用·随堂检测全达标
目录索引
基础落实·必备知识全过关
自主梳理
一、决定物质体积大小的因素
1.影响物质体积大小的因素
2.阿伏加德罗定律
同温同压下,相同体积的任何气体都含有相同 。
大小
数目
之间的距离
相等
数目的粒子
【微思考1】决定气体粒子间距离的因素有哪些 如何影响
提示 决定气体粒子间距离的因素是温度和压强。温度越高,压强越小,气体粒子间距离越大。
二、气体摩尔体积
Vm
273 K、101 kPa
22.4 L·mol-1
【微思考2】“22.4 L·mol-1”的使用条件是什么
提示 标准状况下的任意气体,既可以是单一气体,也可以是混合气体。
自我检测
判断下列说法是否正确,正确的画“√”,错误的画“×”。
(1)一定温度、压强下,气体体积由其分子的大小和数目决定。( )
(2)固态物质和液态物质的体积决定于粒子大小和粒子数目。( )
(3)1 mol任何气体的体积均约为22.4 L。( )
(4)在标准状况下,1 mol水的体积约为22.4 L。( )
(5)同温同压下,1 mol O2的体积与1 mol CO和CO2混合气体的体积相同。
( )
(6)只有在标准状况下,1 mol 气体的体积才是22.4 L。( )
×
√
×
×
√
×
重难探究·能力素养全提升
探究一 气体摩尔体积及有关计算
情境探究
已知:气体摩尔体积是指单位物质的量的气体所占的体积。
条件 气体摩尔体积
273 K、101 kPa(标准状况) 22.4 L·mol-1
25 ℃、101 kPa 24.5 L·mol-1
273 K、202 kPa 11.2 L·mol-1
273 ℃、202 kPa 22.4 L·mol-1
(1)气体摩尔体积的影响因素有哪些 如何影响
提示 气体摩尔体积的影响因素有温度和压强,温度越高,压强越小,气体摩尔体积越大。
(2)根据表中数据判断,气体摩尔体积约为22.4 L·mol-1时,一定是在标准状况下吗
(3)在标准状况下,混合气体的气体摩尔体积也是22.4 L·mol-1吗 为什么
提示 不一定。同时改变温度和压强,气体摩尔体积可能保持不变,如升高温度的同时增大压强。
提示 是。在标准状况下,混合气体中不同气体分子之间的距离相同,故1 mol 混合气体的体积与1 mol 单一气体体积相同,均约为22.4 L。
知识归纳
1.使用“Vm=22.4 L·mol-1”应注意的问题
(1)
(2)使用“Vm=22.4 L·mol-1”时的易错点。
序号 易错点
(1) 忽视外界条件是标准状况
如常温、常压下,1 mol H2的体积不是22.4 L
(2) 温度越高、压强越小,Vm越大;温度、压强不同时Vm不同;温度、压强相同时Vm相等,但不一定是22.4 L·mol-1
(3) 忽视研究对象是气体,如标准状况下,H2O、酒精等不是气体
(4) 将1 mol 气体的体积与气体摩尔体积的单位混淆,前者单位为L,后者单位为L·mol-1
应用体验
1.决定气体物质体积大小的因素是( )
①温度 ②所含微粒数目
③微粒本身大小 ④压强
A.②③ B.①②④
C.①③ D.②④
B
解析 对于气体来说,温度和压强不同,气体分子之间的距离不同,而微粒本身大小远小于微粒间的距离,故微粒本身大小可忽略不计。一定条件下,微粒数目越多,则体积越大,所以影响气体体积的因素有:温度、压强及气体所含微粒数目,B正确。
2.[2023河北邢台第一中学高一月考]下列说法正确的是( )
A.1 mol O2和1 mol N2所占的体积约为22.4 L
B.标准状况下,H2的气体摩尔体积约为22.4 L
C.标准状况下,22.4 L由N2、N2O组成的混合气体中所含有的氮原子的物质的量约为2 mol
D.标准状况下,1 mol H2和1 mol H2O所占的体积都约为22.4 L
C
解析 A.二者的物质的量都是1 mol,但由于气体所处的外界条件未知,因此不能确定气体体积的大小,错误;B.标准状况下,H2的气体摩尔体积约为22.4 L·mol-1,错误;C.标准状况下,22.4 L由N2、N2O组成的混合气体的物质的量约为1 mol,由于每个N2、N2O的分子中都含有2个氮原子,故1 mol该混合气体中含有的氮原子的物质的量为2 mol,正确;D.标准状况下水不是气体,不能使用气体摩尔体积进行有关计算,错误。
3.如果a g某气体中含有的分子数为b,则c g该气体在标准状况下占有的体积可表示为(式中NA为阿伏加德罗常数的值)( )
A
探究二 阿伏加德罗定律及其推论
情境探究
(1)同温同压下,1 mol O2和1 mol H2所含的分子数是否相等 气体体积是否相等
(2)根据密度的计算公式ρ= ,推断同温同压下,不同气体的密度之比与气体摩尔质量有何关系。
提示 均相等。同温同压下,气体的物质的量之比等于气体分子个数之比,也等于气体体积之比。
提示 同温同压下,气体的密度之比等于其摩尔质量之比。
(3)同温同压下,向两个容积相同的密闭容器中分别充满O2、O3气体,则两种气体的质量之比为多少 物质的量之比为多少 密度之比为多少
提示 2∶3;1∶1;2∶3。
知识归纳
1.阿伏加德罗定律
相同温度、相同压强下,相同体积的任何气体都含有相同数目的粒子(分子)。
2.阿伏加德罗定律的推论
推论 公式
同温同压下,气体的体积之比等于其物质的量之比
同温同体积时,气体的压强之比等于其物质的量之比
推论 公式 注意事项
同温同压下,任何气体的密度之比等于其摩尔质量之比 (1)阿伏加德罗定律既适用于单一气体,也适用于混合气体
(2)同温、同压、同体积和同分子数,共同存在,相互制约,只要“三同”成立,第四“同”必定成立
(3)解答相关问题时,要注意气体分子的组成。如Ar是单原子分子,O2是双原子分子,O3是三原子分子
(4)可以利用理想气体状态方程确定有关比例
相同温度下,等物质的量气体的压强与体积成反比
应用体验
1.同温同压下,等体积的下列气体中,质量最大的是( )
A.H2 B.N2
C.CO D.SO2
D
解析 同温同压下,气体体积相等则气体物质的量相等,根据m=nM可知,气体的摩尔质量越大,气体的质量越大。H2、N2、CO、SO2的摩尔质量依次为2 g·mol-1、28 g·mol-1、28 g·mol-1、64 g·mol-1,故二氧化硫的质量最大,D正确。
【变式设问】
在标准状况下,相同质量的下列气体,占有体积由大到小的顺序是( )
①Cl2 ②H2 ③N2 ④CO2 ⑤O2
A.③②④⑤① B.⑤②④③①
C.①④⑤②③ D.②③⑤④①
D
解析 根据阿伏加德罗定律,在相同条件下,气体的物质的量相同时所占体积相同。根据n= 可知,当气体的质量相等时,气体的摩尔质量越大,其物质的量就越小,则其所占体积就越小。五种气体的摩尔质量分别是71 g·mol-1、2 g·mol-1、28 g·mol-1、44 g·mol-1、32 g·mol-1,故D正确。
2.同温同压下,相同质量的C2H6和NO两种气体,下列选项中不是1∶1的是
( )
A.分子数之比
B.原子数之比
C.体积比
D.密度比
B
解析 同温同压下,相同质量的C2H6和NO两种气体,C2H6的相对分子质量为30,NO的相对分子质量也为30,根据n= ,所以二者的物质的量相等,依此来解析。结合N=nNA可知,物质的量相等的C2H6和NO含有的分子数相同,二者分子数之比为1∶1,A不符合题意;C2H6和NO分子中含有的原子数不同,物质的量相等的C2H6和NO含有的分子数相同,但含有的原子数不同,二者原子数之比是4∶1,B符合题意;同温同压下,Vm相同,结合V=nVm可知,物质的量相等的C2H6和NO,二者的体积比为1∶1,C不符合题意;C2H6和NO二者的摩尔质量都是30 g·mol-1,根据ρ= 可知,同温同压下气体的密度之比等于其摩尔质量之比,其密度之比为1∶1,D不符合题意。
学以致用·随堂检测全达标
1
2
3
4
5
1.下列说法正确的是( )
A.1 mol 气体的体积主要由微粒的大小决定
B.标准状况下,气体摩尔体积约为22.4 L
C.若1 mol CH4的体积约为22.4 L,则一定处于标准状况下
D.20 ℃、101 kPa时,气体摩尔体积大于22.4 L·mol-1
D
解析 由于气体分子间的间隔远大于气体分子的大小,故1 mol 气体的体积主要由气体分子间间隔决定,A错误;标准状况下,气体摩尔体积约为22.4 L·mol-1,B错误;由于气体摩尔体积受温度和压强共同影响,故1 mol CH4的体积约为22.4 L时,不一定处于标准状况,C错误;同压下,温度越高气体摩尔体积越大,D正确。
1
2
3
4
5
2.下列关于气体摩尔体积的说法正确的是( )
A.22.4 L任何气体,其物质的量均为1 mol
B.非标准状况下,1 mol任何气体体积一定不是22.4 L
C.0.6 mol H2、0.2 mol O2和0.2 mol CO2组成的混合气体,在标准状况下所占体积约为22.4 L
D.气体摩尔体积指的是在标准状况下1 mol 气体的体积
C
1
2
3
4
5
解析 体积一定,影响气体物质的量的因素有温度、压强,22.4 L任何气体的物质的量可能为1 mol,也可能不是1 mol,A错误;非标准状况下,1 mol气体可能占有22.4 L体积,B错误;标准状况下,气体摩尔体积是22.4 L·mol-1,0.6 mol H2、0.2 mol O2和0.2 mol CO2组成的混合气体共1 mol,混合气体的体积约为22.4 L,C正确;气体摩尔体积是单位物质的量的气体所占的体积,不一定是在标准状况下,D错误。
1
2
3
4
5
3.下列叙述正确的是( )
A.NH3的摩尔质量为17 g
B.22.4 L O2的质量为32 g
C.44 g CO2的物质的量是1 mol
D.1 mol水含有2个氢原子和1个氧原子
C
解析 摩尔质量的单位为g·mol-1,A错误;未指明气体所处温度、压强,气体摩尔体积未知,无法计算质量,B错误;44 g二氧化碳的物质的量为 =1 mol,C正确;设NA为阿伏加德罗常数的值,1 mol H2O含有2 mol氢原子、1 mol氧原子,含氢原子个数为2NA、氧原子个数为NA,D错误。
1
2
3
4
5
4.下列说法正确的是( )
A.1 mol 任何气体所占体积都约为22.4 L
B.1 mol H2O在标准状况下的体积约为22.4 L
C.1 mol 气体体积若为22.4 L,则一定是标准状况
D.气体摩尔体积不一定是22.4 L·mol-1
D
解析 标准状况下,1 mol 任何气体的体积约为22.4 L,A错误;标准状况下,22.4 L的任何气体的物质的量都是1 mol,在标准状况下的水不是气体,B错误;温度和压强都能影响气体的体积,所以,不是在标准状况下,1 mol 气体的体积也有可能为22.4 L,C错误;气体摩尔体积是单位物质的量的气体所占有的体积,非标准状况下,气体摩尔体积不一定是22.4 L·mol-1,D正确。
1
2
3
4
5
5.(1)2 mol O3和3 mol O2的质量之比为 ,分子数之比为 ,同温同压下的密度之比为 ,含氧原子数之比为 ,体积之比为 。
(2)在标准状况下,由CO和CO2组成的混合气体6.72 L,质量为12 g。此混合物中CO和CO2物质的量之比是 ,混合气体的平均相对分子质量是 ,对氢气的相对密度是 。
答案 (1)1∶1 2∶3 3∶2 1∶1 2∶3
(2)1∶3 40 20
1
2
3
4
5
解析 (1)臭氧的摩尔质量为48 g·mol-1,氧气的摩尔质量为32 g·mol-1,根据m=nM知,其质量之比=(48 g·mol-1×2 mol)∶(32 g·mol-1×3 mol)=1∶1;根据N=nNA知,其分子数之比等于其物质的量之比=2∶3;相同条件下,气体摩尔
1个臭氧分子中含有3个氧原子,1个氧气分子中含有2个氧原子,其分子数之比为2∶3,结合每个分子中含有的氧原子个数知,其原子个数之比为1∶1;在相同条件下,气体物质的量之比等于其体积之比,故体积之比为2∶3。
1
2
3
4
5
对分子质量在数值上相等,所以其相对分子质量为40;相同条件下气体的密度之比等于其摩尔质量之比,所以该混合气体对于氢气的相对密度是20。
本 课 结 束
