1.2.1物质的量 课件(共30张PPT)2023-2024学年高一化学苏教版必修一
文档属性
| 名称 | 1.2.1物质的量 课件(共30张PPT)2023-2024学年高一化学苏教版必修一 |

|
|
| 格式 | pptx | ||
| 文件大小 | 2.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-07 19:18:47 | ||
图片预览











文档简介
(共30张PPT)
专题1
第二单元 第1课时 物质的量
素养 目标
1.通过类比已熟悉的物理量及其常用单位,领会物质的量及其单位——摩尔的含义及标准,培养证据推理与模型认知的核心素养。
2.在领会物质的量概念的基础上,逐步建立微粒数和宏观物质质量间的联系,搭建起宏观物质与微观粒子间的桥梁,培养宏观辨识与微观探析的核心素养。
基础落实·必备知识全过关
重难探究·能力素养全提升
学以致用·随堂检测全达标
目录索引
基础落实·必备知识全过关
自主梳理
一、物质的量
1.物质的量
物质的量是国际单位制中的基本物理量之一,符号为 ,常用单位为 。
联系宏观物质与微观粒子的“桥梁”
2.摩尔
(1)标准:1 mol某种微粒集合体中所含的微粒数约为 。
(2)符号: 。
(3)计量对象:原子、分子、离子、原子团、电子、质子、中子等微观粒子。
n
摩尔
6.02×1023
mol
3.阿伏加德罗常数
4.物质的量、阿伏加德罗常数与粒子数(N)的关系: 。
1 mol某种微粒集合体中所含的微粒数(0.012 kg 12C中所含的原子数)
NA
6.02×1023 mol-1
N=n·NA
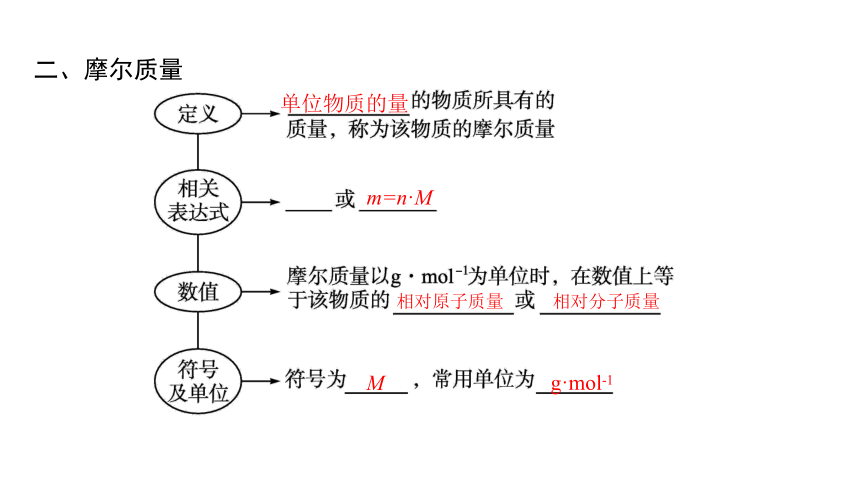
二、摩尔质量
单位物质的量
m=n·M
相对原子质量
相对分子质量
M
g·mol-1
【微思考】某微粒的摩尔质量与其相对原子质量(或相对分子质量)在数值上一定相等吗
提示 不一定。当摩尔质量以g·mol-1为单位时,其在数值上才等于该微粒的相对原子质量(或相对分子质量)。
自我检测
判断下列说法是否正确,正确的画“√”,错误的画“×”。
(1)物质的量可以理解为物质的微观粒子数目。( )
(2)摩尔是国际单位制中七个基本物理量之一。( )
(3)1 mol氧气中约含有6.02×1023个原子。( )
(4)1 mol任何粒子所含有的粒子数相等。( )
(5)阿伏加德罗常数就是6.02×1023。( )
(6)H2O的摩尔质量(以g·mol-1为单位时)在数值上等于18。( )
×
×
×
√
×
√
重难探究·能力素养全提升
探究一 有关物质的量等基本概念的应用
情境探究
“物质的量”是描述微观粒子集合体的物理量,是联系物质质量与微观粒子数目之间的桥梁。“物质的量”不能理解为“物质的质量”,“物质的量”是一个整体,不能拆开理解,同其他物理量如长度、时间、质量等类似。
(1)“物质的量”与“物质的质量”有何不同 试从定义、研究对象、单位等方面进行比较。
提示 ①定义不同:“物质的量”是度量物质所含微观粒子集合体的多少的物理量,而“物质的质量”是描述物体所含物质多少的物理量。②研究对象不同:“物质的量”的研究对象是微观粒子;“物质的质量”的研究对象可以是宏观物质也可以是微观粒子。③单位不同:“物质的量”的常用单位是mol(摩尔),“物质的质量”的单位一般是g(克)或kg(千克)。
(2)1 mol鸡蛋和1 mol氧这两种说法是否正确
(3)阿伏加德罗常数有单位吗 它与6.02×1023是什么关系
(4)1 mol SO3中含有多少个分子,多少个原子,多少个电子
提示 不正确。物质的量的描述对象不是宏观物质,而是微观具有可数性的“基本单元”——微粒或特定组合;用物质的量进行描述时,必须指明粒子种类。
提示 阿伏加德罗常数带有单位,其单位是mol-1;6.02×1023是它的近似值。
提示 NA个分子;4NA个原子;40NA个电子。
知识归纳
1.对“物质的量”的理解——“四化”
2.对“摩尔质量”的理解
应用体验
1.下列关于摩尔质量的说法正确的是( )
A.水的摩尔质量是18 g
B.2 mol 水的摩尔质量是1 mol 水的摩尔质量的2倍
C.任何物质的摩尔质量都等于它的相对原子(或分子)质量
D.水的摩尔质量是氢气的摩尔质量的9倍
D
解析 摩尔质量的单位是g·mol-1,水的摩尔质量是18 g·mol-1,A错误;摩尔质量是定值,不随物质的物质的量的多少而改变,B错误;摩尔质量的单位是g·mol-1,相对分子质量或相对原子质量的单位是“1”,所以摩尔质量和相对分子质量或相对原子质量只是数值相同,C错误;水的摩尔质量是18 g·mol-1,氢气的摩尔质量是2 g·mol-1,所以水的摩尔质量是氢气的摩尔质量的9倍,D正确。
2.截至2022年,我国共有313个地区获得“中国天然氧吧”称号,其原因是空气中的自由电子附着在分子或原子上形成空气负离子,被称为“空气维生素”。 就是一种空气负离子,其摩尔质量为( )
A.32 g B.33 g
C.32 g·mol-1 D.33 g·mol-1
C
解析 当物质的摩尔质量以g·mol-1为单位时,摩尔质量与物质的相对原子质量或相对分子质量数值上相等。由于电子的质量可以忽略不计,O2的相对分子质量为32,故 的摩尔质量为32 g·mol-1。
3.在11 g某化合物X2S中,含S2-0.1 mol,则X的相对原子质量为( )
A.23 B.24
C.39 D.40
C
解析 含S2-0.1 mol,则X2S的摩尔质量为 =110 g·mol-1,设X的相对原子质量为Ar,则2Ar+32=110,解得Ar=39,C正确。
探究二 物质的量、物质的质量、粒子数目之间的相关计算
情境探究
(1)摩尔质量与相对原子质量或相对分子质量有何不同
(2)一种微粒的摩尔质量就是1 mol该微粒的质量,这种说法对吗 已知1个氧原子的质量为2.657×10-26 kg,请计算O2的摩尔质量。
提示 摩尔质量的单位是g·mol-1或kg·mol-1等,同种物质的摩尔质量因单位不同而数值不同;相对原子质量或相对分子质量的单位为1,同种原子或分子的相对原子质量或相对分子质量相同。
提示 不对;摩尔质量的常用单位是g·mol-1,物质质量的常用单位是g,两者的意义不同。O2的摩尔质量为2×2.657×10-26 kg×103 g·kg-1×6.02×1023 mol-1≈32 g·mol-1。
知识归纳
n、N、m、M之间的换算
关系式 主要应用 注意事项
n= 在n、N和NA中,已知任意两项可求第三项 ①NA有单位:mol-1
②求n或N时,概念性问题用NA,数字性问题用6.02×1023 mol-1
M= ①在M、n和m中,已知任意两项可求第三项 ②求出M,可知相对原子(或分子)质量 M的单位取g·mol-1,m的单位取g
关系式 主要应用 注意事项
m n N ①在m、M、NA和N中已知任意三项可求第四项 ②以n恒等列代数方程式,可以解决较复杂的问题 与N有关的问题莫忽视微粒的组成和种类
应用体验
1.现有CO、CO2、O3(臭氧)三种气体,它们分别都含有1 mol 氧原子,则三种气体的物质的量之比为( )
A.1∶1∶1 B.1∶2∶3
C.3∶2∶1 D.6∶3∶2
D
解析 设三种气体的物质的量分别是a、b、c,因这三种气体分别都含有1
【变式设问】
物质的量相等的CO和CO2相比较,下列有关叙述正确的是( )
①它们所含的分子数目之比为1∶1 ②它们所含的氧原子数目之比为1∶2 ③它们所含的原子总数目之比为2∶3 ④它们所含的碳原子数目之比为1∶1
A.①④ B.②③ C.④ D.①②③④
D
解析 根据N=nNA可知,相等物质的量的CO和CO2含有的分子数目之比为1∶1,①正确;相等物质的量的CO和CO2含有氧原子数目之比为1∶2,②正确;相等物质的量的CO和CO2含有原子总数目之比为2∶3,③正确;相等物质的量的CO和CO2含有碳原子数目之比为1∶1,④正确,故选D。
2.若1 g N2含a个原子,则阿伏加德罗常数可表示为( )
B
学以致用·随堂检测全达标
1
2
3
4
1.下列说法正确的是( )
A.摩尔是可以把物质的质量与微观粒子数联系起来的一个基本物理量
B.0.012 kg 12C中所含的碳原子数为NA
C.物质的摩尔质量等于其相对分子(或原子)质量
D.1 mol任何物质都含有约6.02×1023个原子
B
解析 物质的量是把宏观物质质量和微观粒子数联系起来的一个基本物理量,摩尔是物质的量的单位,A错误;规定阿伏加德罗常数是0.012 kg 12C中所含的原子数,B正确;摩尔质量以g·mol-1为单位时,在数值上等于物质的相对原子质量或相对分子质量,C错误;1 mol 任何微粒含有的微粒数约是6.02×1023,但有的物质是由分子构成,如氧气,1 mol 氧气中含有的氧原子数约为2×6.02×1023,D错误。
1
2
3
4
2.下列物理量单位不正确的是( )
A.物质的量:mol
B.摩尔质量:g·mol-1
C.阿伏加德罗常数:mol-1
D.相对原子质量:g
D
解析 物质的量的单位为mol,A项正确;摩尔质量的单位为g·mol-1,B项正确;阿伏加德罗常数的单位为mol-1,C项正确;相对原子质量是一个质量比,单位为1,常省略,D项不正确。
1
2
3
4
3.[2023河北石家庄高一调研]下列说法正确的是( )
A.1 mol O2的质量为32 g·mol-1
B.CO2的摩尔质量为44 g·mol-1
C.阿伏加德罗常数的准确值为6.02×1023
D.1 mol氮气所含的原子数目为NA
B
解析 O2的摩尔质量为32 g·mol-1,所以1 mol O2的质量为32 g,A错误;CO2的摩尔质量为44 g·mol-1,B正确;阿伏加德罗常数近似为6.02×1023 mol-1,C错误;1 mol氮气所含的原子数目为2NA,D错误。
1
2
3
4
4.(1)4.5 g水与 g硫酸所含的分子数相等,它们所含氧原子数之比是 ,氢原子数之比是 。
(2)已知8 g A能与32 g B恰好完全反应,生成22 g C和一定量的D,现将16 g A与70 g B的混合物充分反应后,生成2 mol D和一定量的C,则D的摩尔质量是 。
答案 (1)24.5 1∶4 1∶1 (2)18 g·mol-1
1
2
3
4
本 课 结 束
专题1
第二单元 第1课时 物质的量
素养 目标
1.通过类比已熟悉的物理量及其常用单位,领会物质的量及其单位——摩尔的含义及标准,培养证据推理与模型认知的核心素养。
2.在领会物质的量概念的基础上,逐步建立微粒数和宏观物质质量间的联系,搭建起宏观物质与微观粒子间的桥梁,培养宏观辨识与微观探析的核心素养。
基础落实·必备知识全过关
重难探究·能力素养全提升
学以致用·随堂检测全达标
目录索引
基础落实·必备知识全过关
自主梳理
一、物质的量
1.物质的量
物质的量是国际单位制中的基本物理量之一,符号为 ,常用单位为 。
联系宏观物质与微观粒子的“桥梁”
2.摩尔
(1)标准:1 mol某种微粒集合体中所含的微粒数约为 。
(2)符号: 。
(3)计量对象:原子、分子、离子、原子团、电子、质子、中子等微观粒子。
n
摩尔
6.02×1023
mol
3.阿伏加德罗常数
4.物质的量、阿伏加德罗常数与粒子数(N)的关系: 。
1 mol某种微粒集合体中所含的微粒数(0.012 kg 12C中所含的原子数)
NA
6.02×1023 mol-1
N=n·NA
二、摩尔质量
单位物质的量
m=n·M
相对原子质量
相对分子质量
M
g·mol-1
【微思考】某微粒的摩尔质量与其相对原子质量(或相对分子质量)在数值上一定相等吗
提示 不一定。当摩尔质量以g·mol-1为单位时,其在数值上才等于该微粒的相对原子质量(或相对分子质量)。
自我检测
判断下列说法是否正确,正确的画“√”,错误的画“×”。
(1)物质的量可以理解为物质的微观粒子数目。( )
(2)摩尔是国际单位制中七个基本物理量之一。( )
(3)1 mol氧气中约含有6.02×1023个原子。( )
(4)1 mol任何粒子所含有的粒子数相等。( )
(5)阿伏加德罗常数就是6.02×1023。( )
(6)H2O的摩尔质量(以g·mol-1为单位时)在数值上等于18。( )
×
×
×
√
×
√
重难探究·能力素养全提升
探究一 有关物质的量等基本概念的应用
情境探究
“物质的量”是描述微观粒子集合体的物理量,是联系物质质量与微观粒子数目之间的桥梁。“物质的量”不能理解为“物质的质量”,“物质的量”是一个整体,不能拆开理解,同其他物理量如长度、时间、质量等类似。
(1)“物质的量”与“物质的质量”有何不同 试从定义、研究对象、单位等方面进行比较。
提示 ①定义不同:“物质的量”是度量物质所含微观粒子集合体的多少的物理量,而“物质的质量”是描述物体所含物质多少的物理量。②研究对象不同:“物质的量”的研究对象是微观粒子;“物质的质量”的研究对象可以是宏观物质也可以是微观粒子。③单位不同:“物质的量”的常用单位是mol(摩尔),“物质的质量”的单位一般是g(克)或kg(千克)。
(2)1 mol鸡蛋和1 mol氧这两种说法是否正确
(3)阿伏加德罗常数有单位吗 它与6.02×1023是什么关系
(4)1 mol SO3中含有多少个分子,多少个原子,多少个电子
提示 不正确。物质的量的描述对象不是宏观物质,而是微观具有可数性的“基本单元”——微粒或特定组合;用物质的量进行描述时,必须指明粒子种类。
提示 阿伏加德罗常数带有单位,其单位是mol-1;6.02×1023是它的近似值。
提示 NA个分子;4NA个原子;40NA个电子。
知识归纳
1.对“物质的量”的理解——“四化”
2.对“摩尔质量”的理解
应用体验
1.下列关于摩尔质量的说法正确的是( )
A.水的摩尔质量是18 g
B.2 mol 水的摩尔质量是1 mol 水的摩尔质量的2倍
C.任何物质的摩尔质量都等于它的相对原子(或分子)质量
D.水的摩尔质量是氢气的摩尔质量的9倍
D
解析 摩尔质量的单位是g·mol-1,水的摩尔质量是18 g·mol-1,A错误;摩尔质量是定值,不随物质的物质的量的多少而改变,B错误;摩尔质量的单位是g·mol-1,相对分子质量或相对原子质量的单位是“1”,所以摩尔质量和相对分子质量或相对原子质量只是数值相同,C错误;水的摩尔质量是18 g·mol-1,氢气的摩尔质量是2 g·mol-1,所以水的摩尔质量是氢气的摩尔质量的9倍,D正确。
2.截至2022年,我国共有313个地区获得“中国天然氧吧”称号,其原因是空气中的自由电子附着在分子或原子上形成空气负离子,被称为“空气维生素”。 就是一种空气负离子,其摩尔质量为( )
A.32 g B.33 g
C.32 g·mol-1 D.33 g·mol-1
C
解析 当物质的摩尔质量以g·mol-1为单位时,摩尔质量与物质的相对原子质量或相对分子质量数值上相等。由于电子的质量可以忽略不计,O2的相对分子质量为32,故 的摩尔质量为32 g·mol-1。
3.在11 g某化合物X2S中,含S2-0.1 mol,则X的相对原子质量为( )
A.23 B.24
C.39 D.40
C
解析 含S2-0.1 mol,则X2S的摩尔质量为 =110 g·mol-1,设X的相对原子质量为Ar,则2Ar+32=110,解得Ar=39,C正确。
探究二 物质的量、物质的质量、粒子数目之间的相关计算
情境探究
(1)摩尔质量与相对原子质量或相对分子质量有何不同
(2)一种微粒的摩尔质量就是1 mol该微粒的质量,这种说法对吗 已知1个氧原子的质量为2.657×10-26 kg,请计算O2的摩尔质量。
提示 摩尔质量的单位是g·mol-1或kg·mol-1等,同种物质的摩尔质量因单位不同而数值不同;相对原子质量或相对分子质量的单位为1,同种原子或分子的相对原子质量或相对分子质量相同。
提示 不对;摩尔质量的常用单位是g·mol-1,物质质量的常用单位是g,两者的意义不同。O2的摩尔质量为2×2.657×10-26 kg×103 g·kg-1×6.02×1023 mol-1≈32 g·mol-1。
知识归纳
n、N、m、M之间的换算
关系式 主要应用 注意事项
n= 在n、N和NA中,已知任意两项可求第三项 ①NA有单位:mol-1
②求n或N时,概念性问题用NA,数字性问题用6.02×1023 mol-1
M= ①在M、n和m中,已知任意两项可求第三项 ②求出M,可知相对原子(或分子)质量 M的单位取g·mol-1,m的单位取g
关系式 主要应用 注意事项
m n N ①在m、M、NA和N中已知任意三项可求第四项 ②以n恒等列代数方程式,可以解决较复杂的问题 与N有关的问题莫忽视微粒的组成和种类
应用体验
1.现有CO、CO2、O3(臭氧)三种气体,它们分别都含有1 mol 氧原子,则三种气体的物质的量之比为( )
A.1∶1∶1 B.1∶2∶3
C.3∶2∶1 D.6∶3∶2
D
解析 设三种气体的物质的量分别是a、b、c,因这三种气体分别都含有1
【变式设问】
物质的量相等的CO和CO2相比较,下列有关叙述正确的是( )
①它们所含的分子数目之比为1∶1 ②它们所含的氧原子数目之比为1∶2 ③它们所含的原子总数目之比为2∶3 ④它们所含的碳原子数目之比为1∶1
A.①④ B.②③ C.④ D.①②③④
D
解析 根据N=nNA可知,相等物质的量的CO和CO2含有的分子数目之比为1∶1,①正确;相等物质的量的CO和CO2含有氧原子数目之比为1∶2,②正确;相等物质的量的CO和CO2含有原子总数目之比为2∶3,③正确;相等物质的量的CO和CO2含有碳原子数目之比为1∶1,④正确,故选D。
2.若1 g N2含a个原子,则阿伏加德罗常数可表示为( )
B
学以致用·随堂检测全达标
1
2
3
4
1.下列说法正确的是( )
A.摩尔是可以把物质的质量与微观粒子数联系起来的一个基本物理量
B.0.012 kg 12C中所含的碳原子数为NA
C.物质的摩尔质量等于其相对分子(或原子)质量
D.1 mol任何物质都含有约6.02×1023个原子
B
解析 物质的量是把宏观物质质量和微观粒子数联系起来的一个基本物理量,摩尔是物质的量的单位,A错误;规定阿伏加德罗常数是0.012 kg 12C中所含的原子数,B正确;摩尔质量以g·mol-1为单位时,在数值上等于物质的相对原子质量或相对分子质量,C错误;1 mol 任何微粒含有的微粒数约是6.02×1023,但有的物质是由分子构成,如氧气,1 mol 氧气中含有的氧原子数约为2×6.02×1023,D错误。
1
2
3
4
2.下列物理量单位不正确的是( )
A.物质的量:mol
B.摩尔质量:g·mol-1
C.阿伏加德罗常数:mol-1
D.相对原子质量:g
D
解析 物质的量的单位为mol,A项正确;摩尔质量的单位为g·mol-1,B项正确;阿伏加德罗常数的单位为mol-1,C项正确;相对原子质量是一个质量比,单位为1,常省略,D项不正确。
1
2
3
4
3.[2023河北石家庄高一调研]下列说法正确的是( )
A.1 mol O2的质量为32 g·mol-1
B.CO2的摩尔质量为44 g·mol-1
C.阿伏加德罗常数的准确值为6.02×1023
D.1 mol氮气所含的原子数目为NA
B
解析 O2的摩尔质量为32 g·mol-1,所以1 mol O2的质量为32 g,A错误;CO2的摩尔质量为44 g·mol-1,B正确;阿伏加德罗常数近似为6.02×1023 mol-1,C错误;1 mol氮气所含的原子数目为2NA,D错误。
1
2
3
4
4.(1)4.5 g水与 g硫酸所含的分子数相等,它们所含氧原子数之比是 ,氢原子数之比是 。
(2)已知8 g A能与32 g B恰好完全反应,生成22 g C和一定量的D,现将16 g A与70 g B的混合物充分反应后,生成2 mol D和一定量的C,则D的摩尔质量是 。
答案 (1)24.5 1∶4 1∶1 (2)18 g·mol-1
1
2
3
4
本 课 结 束
