1.3.1常见的分散系 课件(共26张PPT)2023-2024学年高一化学苏教版必修一
文档属性
| 名称 | 1.3.1常见的分散系 课件(共26张PPT)2023-2024学年高一化学苏教版必修一 |  | |
| 格式 | pptx | ||
| 文件大小 | 1.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-07 19:19:24 | ||
图片预览








文档简介
(共26张PPT)
专题1
第三单元 第1课时 常见的分散系
素养 目标
1.了解分散系的含义及分类,体现宏观辨识与微观探析的核心素养。
2.知道胶体是一种常见的分散系,了解丁达尔效应。
3.理解胶体的制备及性质,体现科学探究与创新意识的核心素养。
基础落实·必备知识全过关
重难探究·能力素养全提升
学以致用·随堂检测全达标
目录索引
基础落实·必备知识全过关
自主梳理
一、分散系及其分类
1.定义及组成
(1)定义:把由一种或几种物质(称为 )分散到另一种物质(称为 )中形成的混合物体系称为分散系。
分散系都是混合物,至少含有两种物质
(2)溶液就是一种 、 的分散系,其中溶质就是溶液分散系的 ,而溶剂就是该分散系的 。
分散质
分散剂
均一
稳定
分散质
分散剂
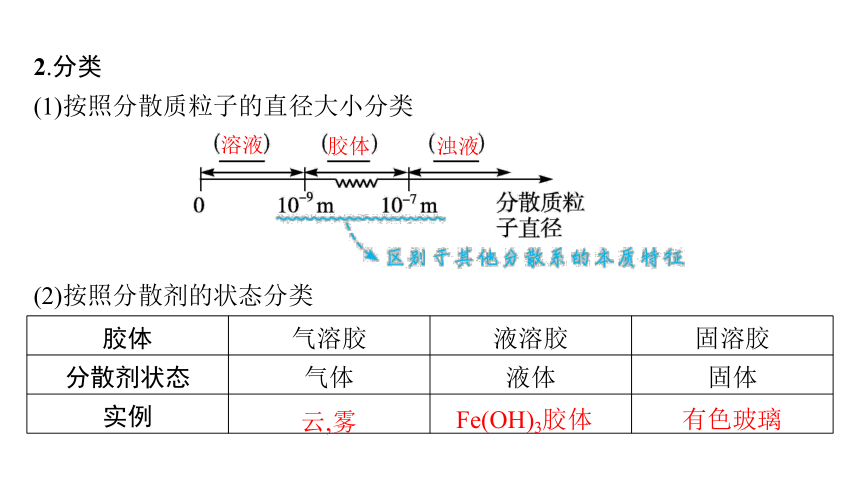
2.分类
(1)按照分散质粒子的直径大小分类
(2)按照分散剂的状态分类
胶体 气溶胶 液溶胶 固溶胶
分散剂状态 气体 液体 固体
实例
溶液
胶体
浊液
云,雾
Fe(OH)3胶体
有色玻璃
二、胶体
1.胶体的性质
(1)丁达尔效应:当光束通过盛有Fe(OH)3胶体的烧杯时,从与光束________ 方向观察,可以看到 ,这个现象称为丁达尔效应。
(2)丁达尔效应是由于胶体微粒对可见光的 形成的,丁达尔效应可用于区别溶液和胶体。
2.胶体的制备
Fe(OH)3胶体的制备:向40 mL 中逐滴加入5~6滴FeCl3饱和溶液,继续煮沸至溶液呈 色,停止加热。
垂直的
一条光亮的通路
散射
沸水
红褐
【微思考】(1)Fe(OH)3胶体与FeCl3溶液的根本区别是什么
(2)区别Fe(OH)3胶体与FeCl3溶液除了用丁达尔效应外,比较简单直观的区别方法是什么
提示 分散质粒子的直径大小不同。
提示 观察液体的颜色,Fe(OH)3胶体呈红褐色,而FeCl3溶液呈(棕)黄色。
自我检测
判断下列说法是否正确,正确的画“√”,错误的画“×”。
(1)分散系都是混合物。( )
(2)油水混合物属于悬浊液。( )
(3)豆浆、烟雾均为胶体。( )
(4)胶体区别于其他分散系的本质特征就是能发生丁达尔效应。( )
(5)溶液比较稳定。( )
(6)Fe(OH)3胶体就是Fe(OH)3悬浊液。( )
√
×
√
×
√
×
重难探究·能力素养全提升
探究 溶液、胶体、浊液三种分散系的比较
情境探究
(1)能否发生丁达尔效应是胶体和溶液的本质区别吗
(2)溶液、胶体、浊液三种分散系中的分散质粒子能否透过滤纸和半透膜
提示 不是。胶体和溶液的本质区别是分散质粒子的直径大小不同。
提示 溶液中的分散质粒子可以透过滤纸和半透膜;胶体中的分散质粒子可以透过滤纸但不能透过半透膜;浊液中分散质粒子既不能透过滤纸,也不能透过半透膜。
(3)清晨去公园或树林锻炼身体,可以看到一束束光柱透过树叶的缝隙射入林间,在电影院可以看到光束射到银幕上时产生光柱,试解释产生光柱的原因。
提示 这是因为悬浮颗粒扩散到空气中形成了气溶胶,当光束通过时,就会产生丁达尔效应。
知识归纳
1.三种分散系的比较
分散系 溶液 胶体 浊液
分散质粒子直径 <10-9 m 10-9~10-7 m之间 >10-7 m
外观 均一、透明 较均一、透明 不均一、不透明
分散质微粒 分子、离子 较多分子的集合体或高分子 大量分子的集合体
能否透过滤纸 能 能 不能
能否透过半透膜 能 不能 不能
稳定性 稳定 较稳定 不稳定
实例 食盐水、碘酒 氢氧化铁胶体、淀粉溶液 泥水
2.胶体性质实验
实验操作 实验现象 结论
当用光束照射时,盛Fe(OH)3胶体的烧杯中有一条光亮的通路,盛CuSO4溶液的烧杯中无此现象 胶体能够产生丁达尔效应,溶液无此性质
过滤Fe(OH)3胶体的滤纸上无残留物;过滤泥水的滤纸上有残留物 胶体中的分散质粒子能透过滤纸孔隙,浊液中的分散质粒子不能
3.胶体的应用
(1)改进材料的机械性能和光学性能:如制作有色玻璃。
(2)农业上的应用:如土壤的保肥作用。
(3)日常生活中的应用:如明矾净水、制豆腐等。
(4)解释某些自然现象:如江河入海口形成三角洲。
4.Fe(OH)3胶体的制备方法、原理及注意事项
制备方法 向沸水中滴加FeCl3饱和溶液,并加热至液体呈红褐色
制备原理 FeCl3+3H2O Fe(OH)3(胶体)+3HCl
注意事项 ①必须用饱和FeCl3溶液而不能用FeCl3稀溶液;②向沸水中滴加饱和FeCl3溶液,而不是直接加热饱和FeCl3溶液;③必须用蒸馏水而不能用自来水;④不宜长时间加热煮沸或搅拌
应用体验
1.溶液、胶体和浊液这三种分散系的根本区别是( )
A.分散质粒子是否为大量分子或离子的集合体
B.分散质是否能透过滤纸
C.分散质粒子直径的大小
D.是否均一、透明、稳定
C
解析 溶液、胶体和浊液这三种分散系的根本区别是分散质粒子直径的大小不同,大于10-7 m为浊液,10-9~10-7 m为胶体,小于10-9 m为溶液,C正确。
2.下列选项中的两种物质,可以用丁达尔效应区分的是( )
A.Na2CO3溶液和NaOH溶液
B.FeCl3溶液和Fe(OH)3胶体
C.CuSO4溶液和CuCl2溶液
D.碳酸钙固体和硫酸钡固体
B
解析 利用丁达尔效应可鉴别胶体与溶液。Na2CO3溶液和NaOH溶液均为溶液,均不能产生丁达尔效应,A错误;FeCl3溶液和Fe(OH)3胶体可利用丁达尔效应鉴别,其中Fe(OH)3胶体可产生丁达尔效应,B正确;CuSO4溶液和CuCl2溶液均为溶液,均不能产生丁达尔效应,C错误;碳酸钙固体和硫酸钡固体,均为固体纯物质,均不能产生丁达尔效应,D错误。
学以致用·随堂检测全达标
1
2
3
4
5
1.下列分散系能产生丁达尔效应的是( )
A.氢氧化铝胶体 B.酒精溶液
C.稀盐酸 D.CuSO4溶液
A
解析 胶体会产生丁达尔效应而溶液不会,在给出的四种物质中只有氢氧化铝胶体属于胶体,其余均为溶液,故A项正确。
1
2
3
4
5
2.下列关于Fe(OH)3胶体的说法不正确的是( )
A.分散质粒子直径在10-9~10-7 m之间
B.是一种纯净物
C.具有丁达尔效应
D.具有净水作用
B
解析 氢氧化铁胶体粒子的直径在10-9~10-7 m之间,A正确;氢氧化铁胶体是混合物,B错误;胶体具有丁达尔效应,C正确;氢氧化铁胶体能吸附水中的悬浮物形成沉淀,有净水的作用,D正确。
1
2
3
4
5
3.科学家用DNA制造出一种臂长只有7 nm的纳米级镊子,这种镊子能钳起分子或原子,并对它们进行组合。下列分散系中分散质粒子直径与纳米粒子具有相同数量级的是( )
A.溶液 B.胶体
C.悬浊液 D.乳浊液
B
解析 按照分散系中分散质粒子直径的大小将分散系分为:溶液、胶体、浊液,溶液中分散质粒子直径小于10-9 m(1 nm);胶体中分散质粒子直径在10-9~107 m(1~100 nm)之间;悬浊液、乳浊液中分散质粒子直径大于10-7 m(100 nm),B正确。
1
2
3
4
5
4.当光束通过下列物质时,会出现丁达尔效应的是( )
①氢氧化铁胶体 ②氯水 ③有色玻璃 ④氯化钠溶液 ⑤云、雾
A.①②③ B.③④⑤
C.①③⑤ D.①④⑤
C
解析 丁达尔效应为胶体特有的性质,①氢氧化铁胶体、③有色玻璃和⑤云、雾均属于胶体,②氯水和④氯化钠溶液属于溶液,综上所述答案为C。
1
2
3
4
5
5.现有甲、乙、丙三名同学分别进行Fe(OH)3胶体的制备实验:
Ⅰ.甲同学向1 mol·L-1氯化铁溶液中加入少量的NaOH溶液。
Ⅱ.乙同学直接加热饱和FeCl3溶液。
Ⅲ.丙同学向25 mL沸水中逐滴加入5~6滴FeCl3饱和溶液,继续煮沸至溶液呈红褐色,停止加热。
试回答下列问题:
(1)其中操作正确的同学是 。写出此过程中反应的化学方程式: 。
(2)证明有Fe(OH)3胶体生成的最简单实验操作是 。
(3)欲除去Fe(OH)3胶体中混有的NaCl,必须用的物品是 ;操作名称是 。
1
2
3
4
5
答案 (1)丙 FeCl3+3H2O Fe(OH)3(胶体)+3HCl (2)用激光笔照射,液体中有一条光亮的通路 (3)半透膜 渗析
解析 (1)实验室制备氢氧化铁胶体是在沸腾的蒸馏水中滴入饱和氯化铁溶液,当溶液变为红褐色时立即停止加热,反应的化学方程式为FeCl3+3H2O
Fe(OH)3(胶体)+3HCl。甲、乙同学的操作得到的是氢氧化铁沉淀,操作正确的是丙同学。(2)胶体具有丁达尔效应,当用激光笔照射时,从垂直于光线的方向上观察,会看到一条光亮的通路,因此,证明制得的红褐色液体属于胶体,最简单实验操作是用激光笔照射,若有一条光亮的通路,说明有胶体生成。(3)由于胶体粒子不能透过半透膜,溶液可以透过半透膜,因此,欲除去Fe(OH)3胶体中混有的NaCl,必须用的物品是半透膜,操作名称是渗析。
本 课 结 束
专题1
第三单元 第1课时 常见的分散系
素养 目标
1.了解分散系的含义及分类,体现宏观辨识与微观探析的核心素养。
2.知道胶体是一种常见的分散系,了解丁达尔效应。
3.理解胶体的制备及性质,体现科学探究与创新意识的核心素养。
基础落实·必备知识全过关
重难探究·能力素养全提升
学以致用·随堂检测全达标
目录索引
基础落实·必备知识全过关
自主梳理
一、分散系及其分类
1.定义及组成
(1)定义:把由一种或几种物质(称为 )分散到另一种物质(称为 )中形成的混合物体系称为分散系。
分散系都是混合物,至少含有两种物质
(2)溶液就是一种 、 的分散系,其中溶质就是溶液分散系的 ,而溶剂就是该分散系的 。
分散质
分散剂
均一
稳定
分散质
分散剂
2.分类
(1)按照分散质粒子的直径大小分类
(2)按照分散剂的状态分类
胶体 气溶胶 液溶胶 固溶胶
分散剂状态 气体 液体 固体
实例
溶液
胶体
浊液
云,雾
Fe(OH)3胶体
有色玻璃
二、胶体
1.胶体的性质
(1)丁达尔效应:当光束通过盛有Fe(OH)3胶体的烧杯时,从与光束________ 方向观察,可以看到 ,这个现象称为丁达尔效应。
(2)丁达尔效应是由于胶体微粒对可见光的 形成的,丁达尔效应可用于区别溶液和胶体。
2.胶体的制备
Fe(OH)3胶体的制备:向40 mL 中逐滴加入5~6滴FeCl3饱和溶液,继续煮沸至溶液呈 色,停止加热。
垂直的
一条光亮的通路
散射
沸水
红褐
【微思考】(1)Fe(OH)3胶体与FeCl3溶液的根本区别是什么
(2)区别Fe(OH)3胶体与FeCl3溶液除了用丁达尔效应外,比较简单直观的区别方法是什么
提示 分散质粒子的直径大小不同。
提示 观察液体的颜色,Fe(OH)3胶体呈红褐色,而FeCl3溶液呈(棕)黄色。
自我检测
判断下列说法是否正确,正确的画“√”,错误的画“×”。
(1)分散系都是混合物。( )
(2)油水混合物属于悬浊液。( )
(3)豆浆、烟雾均为胶体。( )
(4)胶体区别于其他分散系的本质特征就是能发生丁达尔效应。( )
(5)溶液比较稳定。( )
(6)Fe(OH)3胶体就是Fe(OH)3悬浊液。( )
√
×
√
×
√
×
重难探究·能力素养全提升
探究 溶液、胶体、浊液三种分散系的比较
情境探究
(1)能否发生丁达尔效应是胶体和溶液的本质区别吗
(2)溶液、胶体、浊液三种分散系中的分散质粒子能否透过滤纸和半透膜
提示 不是。胶体和溶液的本质区别是分散质粒子的直径大小不同。
提示 溶液中的分散质粒子可以透过滤纸和半透膜;胶体中的分散质粒子可以透过滤纸但不能透过半透膜;浊液中分散质粒子既不能透过滤纸,也不能透过半透膜。
(3)清晨去公园或树林锻炼身体,可以看到一束束光柱透过树叶的缝隙射入林间,在电影院可以看到光束射到银幕上时产生光柱,试解释产生光柱的原因。
提示 这是因为悬浮颗粒扩散到空气中形成了气溶胶,当光束通过时,就会产生丁达尔效应。
知识归纳
1.三种分散系的比较
分散系 溶液 胶体 浊液
分散质粒子直径 <10-9 m 10-9~10-7 m之间 >10-7 m
外观 均一、透明 较均一、透明 不均一、不透明
分散质微粒 分子、离子 较多分子的集合体或高分子 大量分子的集合体
能否透过滤纸 能 能 不能
能否透过半透膜 能 不能 不能
稳定性 稳定 较稳定 不稳定
实例 食盐水、碘酒 氢氧化铁胶体、淀粉溶液 泥水
2.胶体性质实验
实验操作 实验现象 结论
当用光束照射时,盛Fe(OH)3胶体的烧杯中有一条光亮的通路,盛CuSO4溶液的烧杯中无此现象 胶体能够产生丁达尔效应,溶液无此性质
过滤Fe(OH)3胶体的滤纸上无残留物;过滤泥水的滤纸上有残留物 胶体中的分散质粒子能透过滤纸孔隙,浊液中的分散质粒子不能
3.胶体的应用
(1)改进材料的机械性能和光学性能:如制作有色玻璃。
(2)农业上的应用:如土壤的保肥作用。
(3)日常生活中的应用:如明矾净水、制豆腐等。
(4)解释某些自然现象:如江河入海口形成三角洲。
4.Fe(OH)3胶体的制备方法、原理及注意事项
制备方法 向沸水中滴加FeCl3饱和溶液,并加热至液体呈红褐色
制备原理 FeCl3+3H2O Fe(OH)3(胶体)+3HCl
注意事项 ①必须用饱和FeCl3溶液而不能用FeCl3稀溶液;②向沸水中滴加饱和FeCl3溶液,而不是直接加热饱和FeCl3溶液;③必须用蒸馏水而不能用自来水;④不宜长时间加热煮沸或搅拌
应用体验
1.溶液、胶体和浊液这三种分散系的根本区别是( )
A.分散质粒子是否为大量分子或离子的集合体
B.分散质是否能透过滤纸
C.分散质粒子直径的大小
D.是否均一、透明、稳定
C
解析 溶液、胶体和浊液这三种分散系的根本区别是分散质粒子直径的大小不同,大于10-7 m为浊液,10-9~10-7 m为胶体,小于10-9 m为溶液,C正确。
2.下列选项中的两种物质,可以用丁达尔效应区分的是( )
A.Na2CO3溶液和NaOH溶液
B.FeCl3溶液和Fe(OH)3胶体
C.CuSO4溶液和CuCl2溶液
D.碳酸钙固体和硫酸钡固体
B
解析 利用丁达尔效应可鉴别胶体与溶液。Na2CO3溶液和NaOH溶液均为溶液,均不能产生丁达尔效应,A错误;FeCl3溶液和Fe(OH)3胶体可利用丁达尔效应鉴别,其中Fe(OH)3胶体可产生丁达尔效应,B正确;CuSO4溶液和CuCl2溶液均为溶液,均不能产生丁达尔效应,C错误;碳酸钙固体和硫酸钡固体,均为固体纯物质,均不能产生丁达尔效应,D错误。
学以致用·随堂检测全达标
1
2
3
4
5
1.下列分散系能产生丁达尔效应的是( )
A.氢氧化铝胶体 B.酒精溶液
C.稀盐酸 D.CuSO4溶液
A
解析 胶体会产生丁达尔效应而溶液不会,在给出的四种物质中只有氢氧化铝胶体属于胶体,其余均为溶液,故A项正确。
1
2
3
4
5
2.下列关于Fe(OH)3胶体的说法不正确的是( )
A.分散质粒子直径在10-9~10-7 m之间
B.是一种纯净物
C.具有丁达尔效应
D.具有净水作用
B
解析 氢氧化铁胶体粒子的直径在10-9~10-7 m之间,A正确;氢氧化铁胶体是混合物,B错误;胶体具有丁达尔效应,C正确;氢氧化铁胶体能吸附水中的悬浮物形成沉淀,有净水的作用,D正确。
1
2
3
4
5
3.科学家用DNA制造出一种臂长只有7 nm的纳米级镊子,这种镊子能钳起分子或原子,并对它们进行组合。下列分散系中分散质粒子直径与纳米粒子具有相同数量级的是( )
A.溶液 B.胶体
C.悬浊液 D.乳浊液
B
解析 按照分散系中分散质粒子直径的大小将分散系分为:溶液、胶体、浊液,溶液中分散质粒子直径小于10-9 m(1 nm);胶体中分散质粒子直径在10-9~107 m(1~100 nm)之间;悬浊液、乳浊液中分散质粒子直径大于10-7 m(100 nm),B正确。
1
2
3
4
5
4.当光束通过下列物质时,会出现丁达尔效应的是( )
①氢氧化铁胶体 ②氯水 ③有色玻璃 ④氯化钠溶液 ⑤云、雾
A.①②③ B.③④⑤
C.①③⑤ D.①④⑤
C
解析 丁达尔效应为胶体特有的性质,①氢氧化铁胶体、③有色玻璃和⑤云、雾均属于胶体,②氯水和④氯化钠溶液属于溶液,综上所述答案为C。
1
2
3
4
5
5.现有甲、乙、丙三名同学分别进行Fe(OH)3胶体的制备实验:
Ⅰ.甲同学向1 mol·L-1氯化铁溶液中加入少量的NaOH溶液。
Ⅱ.乙同学直接加热饱和FeCl3溶液。
Ⅲ.丙同学向25 mL沸水中逐滴加入5~6滴FeCl3饱和溶液,继续煮沸至溶液呈红褐色,停止加热。
试回答下列问题:
(1)其中操作正确的同学是 。写出此过程中反应的化学方程式: 。
(2)证明有Fe(OH)3胶体生成的最简单实验操作是 。
(3)欲除去Fe(OH)3胶体中混有的NaCl,必须用的物品是 ;操作名称是 。
1
2
3
4
5
答案 (1)丙 FeCl3+3H2O Fe(OH)3(胶体)+3HCl (2)用激光笔照射,液体中有一条光亮的通路 (3)半透膜 渗析
解析 (1)实验室制备氢氧化铁胶体是在沸腾的蒸馏水中滴入饱和氯化铁溶液,当溶液变为红褐色时立即停止加热,反应的化学方程式为FeCl3+3H2O
Fe(OH)3(胶体)+3HCl。甲、乙同学的操作得到的是氢氧化铁沉淀,操作正确的是丙同学。(2)胶体具有丁达尔效应,当用激光笔照射时,从垂直于光线的方向上观察,会看到一条光亮的通路,因此,证明制得的红褐色液体属于胶体,最简单实验操作是用激光笔照射,若有一条光亮的通路,说明有胶体生成。(3)由于胶体粒子不能透过半透膜,溶液可以透过半透膜,因此,欲除去Fe(OH)3胶体中混有的NaCl,必须用的物品是半透膜,操作名称是渗析。
本 课 结 束
