1.3.2电解质溶液 课件(共36张PPT)2023-2024学年高一化学苏教版必修一
文档属性
| 名称 | 1.3.2电解质溶液 课件(共36张PPT)2023-2024学年高一化学苏教版必修一 |  | |
| 格式 | pptx | ||
| 文件大小 | 2.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-07 19:20:00 | ||
图片预览











文档简介
(共36张PPT)
专题1
第三单元 第2课时 电解质溶液
素养 目标
1.通过实验,以变化观念领会电离的概念,从而掌握电解质概念的内涵和外延,体现科学探究与创新意识的核心素养。
2.通过对电解质和电离概念的认识,能从宏观和微观相结合的视角重新认识酸、碱、盐的概念,体现宏观辨识与微观探析的核心素养。
3.通过归纳总结,学会用电离方程式表示某些酸、碱、盐的电离,体现证据推理与模型认知的核心素养。
基础落实·必备知识全过关
重难探究·能力素养全提升
学以致用·随堂检测全达标
目录索引
基础落实·必备知识全过关
自主梳理
一、电解质
1.定义
在 或熔融状态下能导电的 。如HCl、 、NaOH、 、NaCl、 等。
温馨提示 在水溶液和熔融状态下都不能导电的化合物,叫非电解质。如蔗糖、酒精等。
水溶液
化合物
H2SO4
Ca(OH)2
KNO3
2.电解质溶液或熔融电解质导电的原因(以NaCl为例)
在电场作用下,离子定向移动形成电流
(1)电解质导电必须具备的条件:有 的离子。
(2)NaCl属于电解质,固体中含有带电微粒Na+、Cl-,但这些离子 自由移动,故氯化钠固体 导电。
(3)NaCl固体溶于水时,在 的作用下,Na+、Cl-进入水中,形成了能够 的带电粒子,故NaCl溶液 导电。
(4)氯化钠固体受热熔化时,离子的运动随 而加快,熔化后克服了离子间的相互作用,产生了能够自由移动的 和 ,故熔融NaCl也能导电。
自由移动
不能
不
水分子
自由移动
能
温度升高
Na+
Cl-
【微思考1】(1)NaCl溶液能导电,NaCl溶液是电解质吗
(2)纯H2SO4在液态时不导电,H2SO4不是电解质吗
提示 (1)NaCl溶液是混合物,不是电解质。
(2)H2SO4在水溶液中能导电,所以H2SO4是电解质。
二、电解质的电离
1.定义
电解质在水溶液中或熔融状态下产生 的过程。
2.表示方法——电离方程式
(1)酸的电离(如H2SO4): 。
(2)碱的电离(如NaOH): 。
(3)盐的电离(如CuSO4): 。
自由移动的离子
NaOH===Na++OH-
3.从电离的角度认识酸、碱、盐
类别 电离特征
酸 电离时生成的阳离子 是 的化合物
碱 电离时生成的阴离子 是 的化合物
盐 由金属阳离子或铵根离子( )与酸根阴离子组成的化合物
【微思考2】凡是能电离出H+的物质一定是酸吗
全部
全部
氢离子(H+)
氢氧根离子(OH-)
提示 不一定。如NaHSO4在溶液中可电离出H+:NaHSO4===Na++H++ 。但NaHSO4属于酸式盐。
自我检测
判断下列说法是否正确,正确的画“√”,错误的画“×”。
(1)在水溶液和熔融状态下都能导电的化合物是电解质。( )
(2)在水中能导电的化合物一定是电解质。( )
(3)电解质发生电离需要通电条件。( )
(4)电解质是化合物,电解质溶液是混合物。( )
(5)溶于水能电离出H+的电解质一定属于酸。( )
(6)氯化钠晶体不能导电,是由于其中不含离子。( )
√
×
×
√
×
×
重难探究·能力素养全提升
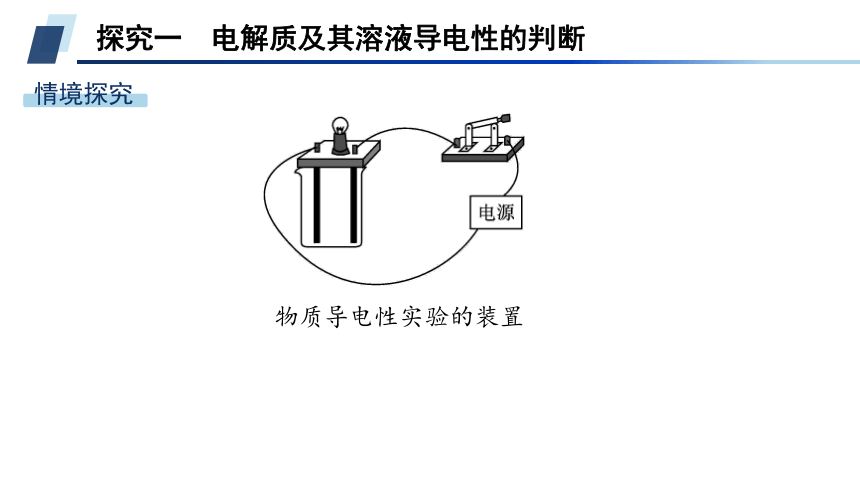
探究一 电解质及其溶液导电性的判断
情境探究
物质导电性实验的装置
(1)上图所示装置为物质导电性实验的装置,在干燥的烧杯中依次分别加入下列物质,观察灯泡是否变亮,判断加入烧杯中的物质是否为电解质。将对应答案填入空格:
实验 物质 实验现象 物质的导电性 是否为电解质
实验1 干燥的NaCl固体
实验2 熔融NaCl
实验3 NaCl溶液
灯泡不亮
不导电
是
灯泡亮
导电
是
灯泡亮
导电
不是
(2)通过以上实验,讨论:电解质本身是否一定导电 电解质导电的环境一般是什么环境
(3)如果将无水酒精或酒精水溶液放入上面的烧杯中,灯泡都不亮,则酒精是否属于电解质
提示 电解质本身不一定能导电,电解质导电的环境为在水溶液中或熔融状态下。
提示 酒精不属于电解质,而是一种非电解质。
知识归纳
判断化合物是电解质还是非电解质,主要看该化合物在溶于水或熔融状态时自身能否电离出阴、阳离子,能电离的属于电解质,不能电离的属于非电解质,水溶液能否导电,只能作为判断是不是电解质的参考因素。如:
(1)SO2、SO3、NH3的水溶液能导电,但导电是由与水反应后的生成物(H2SO3、H2SO4、NH3·H2O)电离所致,并非自身电离出自由移动的离子,所以SO2、SO3、NH3等为非电解质,而H2SO3、H2SO4、NH3·H2O则是电解质。
(2)有些物质由于很难溶解,致使电离产生的离子浓度太小,难以测出其导电性,但却是电解质,如CaCO3、BaSO4等。这是因为这类化合物在水中被溶解的那部分是完全电离的,且在熔融状态下也是完全电离。
(3)应当特别注意的是离子型氧化物,如Na2O、CaO、Na2O2等,它们虽然溶于水后不是自身电离出自由离子,但在熔融状态下却可以电离,故这些物质属于电解质。
应用体验
1.下列状态的物质,既能导电又属于电解质的是( )
A.熔融的NaOH B.固体铜
C.KCl溶液 D.蔗糖溶液
A
解析 NaOH是强碱,熔融状态下可以导电,属于电解质,A正确;铜是单质,既不是电解质也不是非电解质,B错误;KCl是电解质,但KCl溶液是混合物,既不是电解质也不是非电解质,C错误;蔗糖是非电解质,但蔗糖溶液是混合物,既不是电解质也不是非电解质,D错误。
易错警示 解答此类试题要注意,电解质和非电解质都是化合物,单质和混合物既不属于电解质,也不属于非电解质。
2.[2023河北石家庄第二中学高一检测]下列叙述中,正确的是( )
A.铜丝、石墨均能导电,所以二者都是电解质
B.NaCl溶于水,在通电条件下才能发生电离
C.熔融的MgCl2能导电,所以MgCl2是电解质
D.KNO3固体不导电,所以KNO3不是电解质
C
解析 铜丝、石墨都是单质,单质既不是电解质也不是非电解质,故A错误;氯化钠在水溶液中能电离出自由移动的钠离子和氯离子,不需要通电,故B错误;熔融的氯化镁能电离出自由移动的镁离子和氯离子,能导电,属于电解质,故C正确;硝酸钾固体中不存在自由移动的离子,在熔融状态或水溶液中能电离出自由移动的钾离子和硝酸根离子,属于电解质,故D错误。
3.下列含硫物质属于非电解质的是( )
A.S B.SO2
C.H2SO4 D.Na2SO4
B
解析 S是单质,既不是电解质也不是非电解质,故A错误;SO2本身不能导电,属于非电解质,故B正确;H2SO4在水溶液中能导电,属于电解质,故C错误;Na2SO4在水溶液中能导电,属于电解质,故D错误。
探究二 电离方程式的书写
情境探究
根据探究一中的【情境探究】可知:NaCl固体不导电,NaCl溶液或熔融NaCl可导电,据此探究下列问题:
(1)用电离方程式表示NaCl在水溶液或熔融状态下的变化。
(2)写出Ca(OH)2在水溶液中的电离方程式。
提示 NaCl===Na++Cl-。
提示 Ca(OH)2===Ca2++2OH-。
1.电解质电离的表示方法——电离方程式
(1)电离方程式左边书写电解质的化学式,表示电解质还未电离时的状态;右边书写离子符号,表示电解质电离产生的离子。离子所带电荷数必须等于该元素或原子团在该化合物中的化合价。离子的个数用“2”“3”等标在离子符号之前。
(2)书写时要遵循质量守恒(即方程式两边原子种类和个数必须相同)和电荷守恒(即电离产生的阳离子所带的正电荷总数等于阴离子所带的负电荷总数)。
(3)书写电离方程式必须以事实为依据,不能臆造。
知识归纳
2.从电离角度认识酸、碱、盐
(1)酸:电离时生成的阳离子全部是H+的化合物叫作酸,例如:
酸的电离通式一般为:酸→H++酸根离子。
(2)碱:电离时生成的阴离子全部是OH-的化合物叫作碱,例如:
碱的电离通式一般为:碱→金属离子(或 )+OH-。
(3)盐:电离时,生成金属阳离子(或 )和酸根阴离子的化合物叫作盐,例如:
应用体验
1.写出下列物质的电离方程式。
(1)NaOH: 。
(2)CuCl2: 。
(3)Fe2(SO4)3: 。
NaOH===Na++OH-
CuCl2===Cu2++2Cl-
2.下列电离方程式正确的是( )
A.CaCl2===Ca2++
B.CH3CH2OH(乙醇) ===CH3CH2O-+H+
C.Na2SO4===2Na++
D.KMnO4===K++Mn2++4O2-
C
解析 氯化钙属于盐,电离方程式是CaCl2===Ca2++2Cl-,A错误;CH3CH2OH是非电解质,不能发生电离,B错误;高锰酸钾是盐,电离方程式是KMnO4===K++ ,D错误。
3.下列物质溶于水时的电离方程式书写错误的是( )
A.BaCl2===Ba2++2Cl-
B
解析 Ba(OH)2的电离方程式应为Ba(OH)2===Ba2++2OH-,B项符合题目要求。
学以致用·随堂检测全达标
1
2
3
4
1.下列物质的水溶液能导电,但不属于电解质的是( )
A.CaO B.CO2
C.NH4NO3 D.HNO3
B
解析 CaO与水反应生成氢氧化钙,氢氧化钙电离出离子,可以导电,CaO在熔融状态下能电离出阴、阳离子,故属于电解质,A不符合题意;CO2溶于水生成碳酸,碳酸电离出离子,可以导电,但CO2属于非电解质,B符合题意;NH4NO3是盐,在水溶液中自身电离出离子,能导电,属于电解质,C不符合题意;HNO3是强酸,在水溶液中自身电离出离子,能导电,属于电解质,D不符合题意。
1
2
3
4
2.下列电离方程式书写正确的是( )
A.NaOH===Na++O2-+H+
D
1
2
3
4
1
2
3
4
3.[2023河北沧州高一联考]日常生活中常用“84”消毒液进行杀菌、消毒,实验室中可利用下列反应制备“84”消毒液:Cl2+2NaOH===NaCl+NaClO+H2O。下列说法正确的是( )
A.NaCl和NaClO都是电解质,Cl2是非电解质
B.NaClO的电离方程式为NaClO===Na++Cl-+O2-
C.“84”消毒液能够导电,故“84”消毒液属于电解质
D.“84”消毒液中含自由移动的Na+、Cl-、ClO-等,故能够导电
D
解析 Cl2是非金属单质,不是非电解质,A错误;NaClO属于盐,电离生成Na+和ClO-,B错误;“84”消毒液是混合物,含有NaCl、NaClO和H2O等,故不属于电解质,C错误;“84”消毒液中含自由移动的Na+、Cl-、ClO-等,通电时能发生定向移动,故能够导电,D正确。
1
2
3
4
4.有下列物质:Ba(OH)2、C2H5OH、KHSO4、CO2、HNO3、Na2CO3、C6H12O6。
(1)按酸、碱、盐分类,其中,属于酸的是 (填化学式,下同),属于碱的是 ,属于盐的是 。
(2)以上物质属于电解质的是 ,
属于非电解质的是 。
(3)写出下列物质在水溶液中的电离方程式。
①KHSO4: 。
②Na2CO3: 。
1
2
3
4
答案 (1)HNO3 Ba(OH)2 KHSO4、Na2CO3
(2)Ba(OH)2、KHSO4、HNO3、Na2CO3 C2H5OH、CO2、C6H12O6
解析 Ba(OH)2是碱,属于电解质;C2H5OH是有机化合物,属于非电解质;KHSO4是盐,属于电解质;CO2是酸性氧化物,属于非电解质;HNO3是酸,属于电解质;Na2CO3是盐,属于电解质;C6H12O6是有机化合物,属于非电解质。(1)按酸、碱、盐分类,其中,属于酸的是HNO3;属于碱的是Ba(OH)2;属于盐的是KHSO4和Na2CO3。
1
2
3
4
(2)属于电解质的是Ba(OH)2、KHSO4、HNO3、Na2CO3;属于非电解质的是C2H5OH、CO2、C6H12O6。
本 课 结 束
专题1
第三单元 第2课时 电解质溶液
素养 目标
1.通过实验,以变化观念领会电离的概念,从而掌握电解质概念的内涵和外延,体现科学探究与创新意识的核心素养。
2.通过对电解质和电离概念的认识,能从宏观和微观相结合的视角重新认识酸、碱、盐的概念,体现宏观辨识与微观探析的核心素养。
3.通过归纳总结,学会用电离方程式表示某些酸、碱、盐的电离,体现证据推理与模型认知的核心素养。
基础落实·必备知识全过关
重难探究·能力素养全提升
学以致用·随堂检测全达标
目录索引
基础落实·必备知识全过关
自主梳理
一、电解质
1.定义
在 或熔融状态下能导电的 。如HCl、 、NaOH、 、NaCl、 等。
温馨提示 在水溶液和熔融状态下都不能导电的化合物,叫非电解质。如蔗糖、酒精等。
水溶液
化合物
H2SO4
Ca(OH)2
KNO3
2.电解质溶液或熔融电解质导电的原因(以NaCl为例)
在电场作用下,离子定向移动形成电流
(1)电解质导电必须具备的条件:有 的离子。
(2)NaCl属于电解质,固体中含有带电微粒Na+、Cl-,但这些离子 自由移动,故氯化钠固体 导电。
(3)NaCl固体溶于水时,在 的作用下,Na+、Cl-进入水中,形成了能够 的带电粒子,故NaCl溶液 导电。
(4)氯化钠固体受热熔化时,离子的运动随 而加快,熔化后克服了离子间的相互作用,产生了能够自由移动的 和 ,故熔融NaCl也能导电。
自由移动
不能
不
水分子
自由移动
能
温度升高
Na+
Cl-
【微思考1】(1)NaCl溶液能导电,NaCl溶液是电解质吗
(2)纯H2SO4在液态时不导电,H2SO4不是电解质吗
提示 (1)NaCl溶液是混合物,不是电解质。
(2)H2SO4在水溶液中能导电,所以H2SO4是电解质。
二、电解质的电离
1.定义
电解质在水溶液中或熔融状态下产生 的过程。
2.表示方法——电离方程式
(1)酸的电离(如H2SO4): 。
(2)碱的电离(如NaOH): 。
(3)盐的电离(如CuSO4): 。
自由移动的离子
NaOH===Na++OH-
3.从电离的角度认识酸、碱、盐
类别 电离特征
酸 电离时生成的阳离子 是 的化合物
碱 电离时生成的阴离子 是 的化合物
盐 由金属阳离子或铵根离子( )与酸根阴离子组成的化合物
【微思考2】凡是能电离出H+的物质一定是酸吗
全部
全部
氢离子(H+)
氢氧根离子(OH-)
提示 不一定。如NaHSO4在溶液中可电离出H+:NaHSO4===Na++H++ 。但NaHSO4属于酸式盐。
自我检测
判断下列说法是否正确,正确的画“√”,错误的画“×”。
(1)在水溶液和熔融状态下都能导电的化合物是电解质。( )
(2)在水中能导电的化合物一定是电解质。( )
(3)电解质发生电离需要通电条件。( )
(4)电解质是化合物,电解质溶液是混合物。( )
(5)溶于水能电离出H+的电解质一定属于酸。( )
(6)氯化钠晶体不能导电,是由于其中不含离子。( )
√
×
×
√
×
×
重难探究·能力素养全提升
探究一 电解质及其溶液导电性的判断
情境探究
物质导电性实验的装置
(1)上图所示装置为物质导电性实验的装置,在干燥的烧杯中依次分别加入下列物质,观察灯泡是否变亮,判断加入烧杯中的物质是否为电解质。将对应答案填入空格:
实验 物质 实验现象 物质的导电性 是否为电解质
实验1 干燥的NaCl固体
实验2 熔融NaCl
实验3 NaCl溶液
灯泡不亮
不导电
是
灯泡亮
导电
是
灯泡亮
导电
不是
(2)通过以上实验,讨论:电解质本身是否一定导电 电解质导电的环境一般是什么环境
(3)如果将无水酒精或酒精水溶液放入上面的烧杯中,灯泡都不亮,则酒精是否属于电解质
提示 电解质本身不一定能导电,电解质导电的环境为在水溶液中或熔融状态下。
提示 酒精不属于电解质,而是一种非电解质。
知识归纳
判断化合物是电解质还是非电解质,主要看该化合物在溶于水或熔融状态时自身能否电离出阴、阳离子,能电离的属于电解质,不能电离的属于非电解质,水溶液能否导电,只能作为判断是不是电解质的参考因素。如:
(1)SO2、SO3、NH3的水溶液能导电,但导电是由与水反应后的生成物(H2SO3、H2SO4、NH3·H2O)电离所致,并非自身电离出自由移动的离子,所以SO2、SO3、NH3等为非电解质,而H2SO3、H2SO4、NH3·H2O则是电解质。
(2)有些物质由于很难溶解,致使电离产生的离子浓度太小,难以测出其导电性,但却是电解质,如CaCO3、BaSO4等。这是因为这类化合物在水中被溶解的那部分是完全电离的,且在熔融状态下也是完全电离。
(3)应当特别注意的是离子型氧化物,如Na2O、CaO、Na2O2等,它们虽然溶于水后不是自身电离出自由离子,但在熔融状态下却可以电离,故这些物质属于电解质。
应用体验
1.下列状态的物质,既能导电又属于电解质的是( )
A.熔融的NaOH B.固体铜
C.KCl溶液 D.蔗糖溶液
A
解析 NaOH是强碱,熔融状态下可以导电,属于电解质,A正确;铜是单质,既不是电解质也不是非电解质,B错误;KCl是电解质,但KCl溶液是混合物,既不是电解质也不是非电解质,C错误;蔗糖是非电解质,但蔗糖溶液是混合物,既不是电解质也不是非电解质,D错误。
易错警示 解答此类试题要注意,电解质和非电解质都是化合物,单质和混合物既不属于电解质,也不属于非电解质。
2.[2023河北石家庄第二中学高一检测]下列叙述中,正确的是( )
A.铜丝、石墨均能导电,所以二者都是电解质
B.NaCl溶于水,在通电条件下才能发生电离
C.熔融的MgCl2能导电,所以MgCl2是电解质
D.KNO3固体不导电,所以KNO3不是电解质
C
解析 铜丝、石墨都是单质,单质既不是电解质也不是非电解质,故A错误;氯化钠在水溶液中能电离出自由移动的钠离子和氯离子,不需要通电,故B错误;熔融的氯化镁能电离出自由移动的镁离子和氯离子,能导电,属于电解质,故C正确;硝酸钾固体中不存在自由移动的离子,在熔融状态或水溶液中能电离出自由移动的钾离子和硝酸根离子,属于电解质,故D错误。
3.下列含硫物质属于非电解质的是( )
A.S B.SO2
C.H2SO4 D.Na2SO4
B
解析 S是单质,既不是电解质也不是非电解质,故A错误;SO2本身不能导电,属于非电解质,故B正确;H2SO4在水溶液中能导电,属于电解质,故C错误;Na2SO4在水溶液中能导电,属于电解质,故D错误。
探究二 电离方程式的书写
情境探究
根据探究一中的【情境探究】可知:NaCl固体不导电,NaCl溶液或熔融NaCl可导电,据此探究下列问题:
(1)用电离方程式表示NaCl在水溶液或熔融状态下的变化。
(2)写出Ca(OH)2在水溶液中的电离方程式。
提示 NaCl===Na++Cl-。
提示 Ca(OH)2===Ca2++2OH-。
1.电解质电离的表示方法——电离方程式
(1)电离方程式左边书写电解质的化学式,表示电解质还未电离时的状态;右边书写离子符号,表示电解质电离产生的离子。离子所带电荷数必须等于该元素或原子团在该化合物中的化合价。离子的个数用“2”“3”等标在离子符号之前。
(2)书写时要遵循质量守恒(即方程式两边原子种类和个数必须相同)和电荷守恒(即电离产生的阳离子所带的正电荷总数等于阴离子所带的负电荷总数)。
(3)书写电离方程式必须以事实为依据,不能臆造。
知识归纳
2.从电离角度认识酸、碱、盐
(1)酸:电离时生成的阳离子全部是H+的化合物叫作酸,例如:
酸的电离通式一般为:酸→H++酸根离子。
(2)碱:电离时生成的阴离子全部是OH-的化合物叫作碱,例如:
碱的电离通式一般为:碱→金属离子(或 )+OH-。
(3)盐:电离时,生成金属阳离子(或 )和酸根阴离子的化合物叫作盐,例如:
应用体验
1.写出下列物质的电离方程式。
(1)NaOH: 。
(2)CuCl2: 。
(3)Fe2(SO4)3: 。
NaOH===Na++OH-
CuCl2===Cu2++2Cl-
2.下列电离方程式正确的是( )
A.CaCl2===Ca2++
B.CH3CH2OH(乙醇) ===CH3CH2O-+H+
C.Na2SO4===2Na++
D.KMnO4===K++Mn2++4O2-
C
解析 氯化钙属于盐,电离方程式是CaCl2===Ca2++2Cl-,A错误;CH3CH2OH是非电解质,不能发生电离,B错误;高锰酸钾是盐,电离方程式是KMnO4===K++ ,D错误。
3.下列物质溶于水时的电离方程式书写错误的是( )
A.BaCl2===Ba2++2Cl-
B
解析 Ba(OH)2的电离方程式应为Ba(OH)2===Ba2++2OH-,B项符合题目要求。
学以致用·随堂检测全达标
1
2
3
4
1.下列物质的水溶液能导电,但不属于电解质的是( )
A.CaO B.CO2
C.NH4NO3 D.HNO3
B
解析 CaO与水反应生成氢氧化钙,氢氧化钙电离出离子,可以导电,CaO在熔融状态下能电离出阴、阳离子,故属于电解质,A不符合题意;CO2溶于水生成碳酸,碳酸电离出离子,可以导电,但CO2属于非电解质,B符合题意;NH4NO3是盐,在水溶液中自身电离出离子,能导电,属于电解质,C不符合题意;HNO3是强酸,在水溶液中自身电离出离子,能导电,属于电解质,D不符合题意。
1
2
3
4
2.下列电离方程式书写正确的是( )
A.NaOH===Na++O2-+H+
D
1
2
3
4
1
2
3
4
3.[2023河北沧州高一联考]日常生活中常用“84”消毒液进行杀菌、消毒,实验室中可利用下列反应制备“84”消毒液:Cl2+2NaOH===NaCl+NaClO+H2O。下列说法正确的是( )
A.NaCl和NaClO都是电解质,Cl2是非电解质
B.NaClO的电离方程式为NaClO===Na++Cl-+O2-
C.“84”消毒液能够导电,故“84”消毒液属于电解质
D.“84”消毒液中含自由移动的Na+、Cl-、ClO-等,故能够导电
D
解析 Cl2是非金属单质,不是非电解质,A错误;NaClO属于盐,电离生成Na+和ClO-,B错误;“84”消毒液是混合物,含有NaCl、NaClO和H2O等,故不属于电解质,C错误;“84”消毒液中含自由移动的Na+、Cl-、ClO-等,通电时能发生定向移动,故能够导电,D正确。
1
2
3
4
4.有下列物质:Ba(OH)2、C2H5OH、KHSO4、CO2、HNO3、Na2CO3、C6H12O6。
(1)按酸、碱、盐分类,其中,属于酸的是 (填化学式,下同),属于碱的是 ,属于盐的是 。
(2)以上物质属于电解质的是 ,
属于非电解质的是 。
(3)写出下列物质在水溶液中的电离方程式。
①KHSO4: 。
②Na2CO3: 。
1
2
3
4
答案 (1)HNO3 Ba(OH)2 KHSO4、Na2CO3
(2)Ba(OH)2、KHSO4、HNO3、Na2CO3 C2H5OH、CO2、C6H12O6
解析 Ba(OH)2是碱,属于电解质;C2H5OH是有机化合物,属于非电解质;KHSO4是盐,属于电解质;CO2是酸性氧化物,属于非电解质;HNO3是酸,属于电解质;Na2CO3是盐,属于电解质;C6H12O6是有机化合物,属于非电解质。(1)按酸、碱、盐分类,其中,属于酸的是HNO3;属于碱的是Ba(OH)2;属于盐的是KHSO4和Na2CO3。
1
2
3
4
(2)属于电解质的是Ba(OH)2、KHSO4、HNO3、Na2CO3;属于非电解质的是C2H5OH、CO2、C6H12O6。
本 课 结 束
