4.3 防治二氧化硫对环境的污染 课件(共37张PPT)2023-2024学年高一化学苏教版(2019)必修一
文档属性
| 名称 | 4.3 防治二氧化硫对环境的污染 课件(共37张PPT)2023-2024学年高一化学苏教版(2019)必修一 |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-07 21:21:58 | ||
图片预览










文档简介
(共37张PPT)
专题4
第三单元 防治二氧化硫对环境的污染
素养 目标
1.学会防治二氧化硫所导致的空气污染的方法。了解空气质量指数。
2.形成良好的环境保护意识,了解可持续发展的重大意义。通过研究硫的化合物的污染问题,提高学生的科学态度与社会责任感。
基础落实·必备知识全过关
重难探究·能力素养全提升
学以致用·随堂检测全达标
目录索引
基础落实·必备知识全过关
自主梳理
一、酸雨及其治理
1.SO2的来源
(1)化石燃料如 等的燃烧;(2) ;(3)硫酸厂的 。
煤、石油
含硫金属矿石的冶炼
工业废气
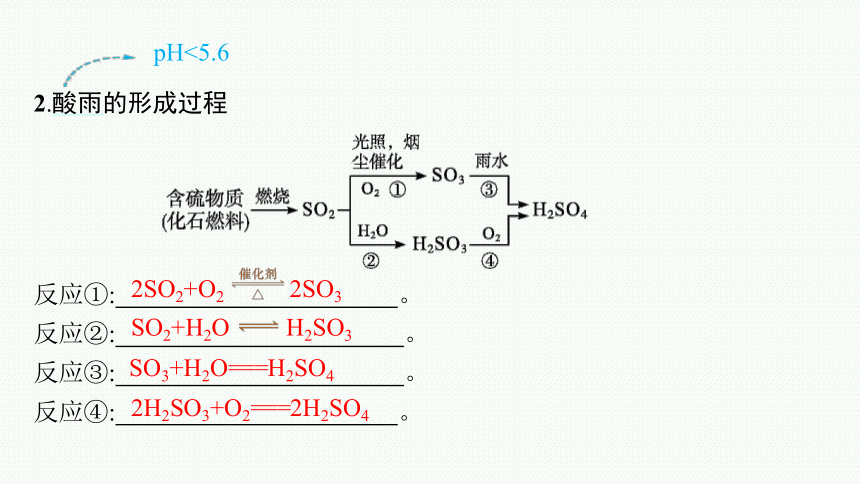
2.酸雨的形成过程
pH<5.6
反应①: 。
反应②: 。
反应③: 。
反应④: 。
2SO2+O2 2SO3
SO2+H2O H2SO3
SO3+H2O===H2SO4
2H2SO3+O2===2H2SO4
【微思考1】酸雨的pH随时间增长而变小,原因是什么
提示 由于酸雨中的H2SO3被氧化为H2SO4,酸性增强。
3.酸雨的危害
(1) ,危害水生生物。
(2)酸化土壤,降低土壤肥力,影响作物生长。
(3)腐蚀建筑物。
4.酸雨的防治
(1)消除 ,研究开发 (如氢能、太阳能、核能等)。
(2)对含硫燃料预先进行 处理,并对SO2废气进行处理或回收利用。如用熟石灰吸收SO2的化学方程式为 。
酸化湖泊
污染源
新能源
脱硫
Ca(OH)2+SO2===CaSO3↓+H2O
【微思考2】酸雨对土壤有哪些危害
提示 酸雨渗透至土壤中,使土壤中的钙、镁、磷等营养元素溶出而流失,导致土壤肥力下降,植被遭到破坏,危害农作物生长。
二、空气质量评价
1.空气质量指数
空气质量指数(AQI)中有 、 、
、二氧化氮(NO2)、臭氧(O3)、一氧化碳(CO)六大检测项目。
2.AQI作为衡量空气质量好坏的指标,其数值越小,空气质量越 ,对人体健康的危害就越 。
3.空气质量指数的确定
(1)测定该地区空气中 的浓度。
(2)将各种污染物的浓度换算为 。
(3)选取污染指数最大的污染物为 , 的质量指数即为该地区的空气质量指数。
细颗粒物(PM2.5)
可吸入颗粒物(PM10)
二氧化硫(SO2)
好
小
各种污染物
质量指数
首要污染物
首要污染物
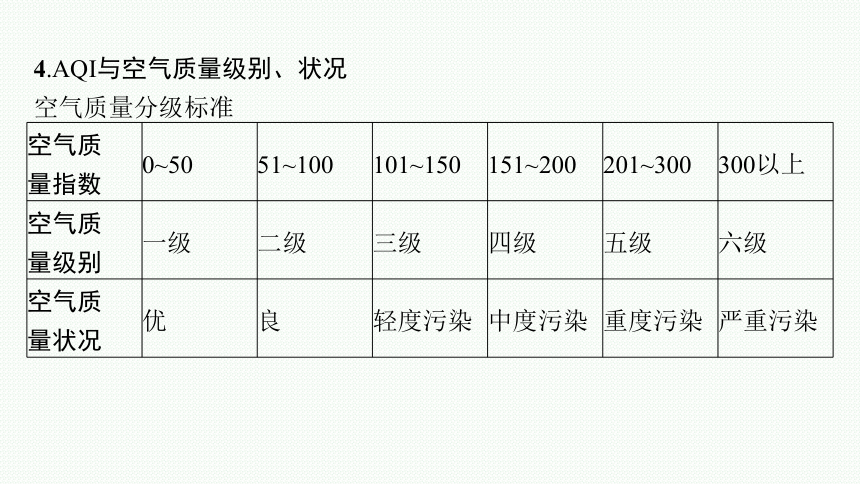
4.AQI与空气质量级别、状况
空气质量分级标准
空气质 量指数 0~50 51~100 101~150 151~200 201~300 300以上
空气质 量级别 一级 二级 三级 四级 五级 六级
空气质 量状况 优 良 轻度污染 中度污染 重度污染 严重污染
【微思考3】PM2.5与PM10是什么意义
提示 PM2.5指直径小于2.5 μm的悬浮颗粒物,PM10指直径小于10 μm的悬浮颗粒物。
自我检测
判断下列说法是否正确,正确的画“√”,错误的画“×”。
(1)SO2的含量指数是空气质量日报的重要指标。( )
(2)一般把pH<5.6的雨水称为酸雨,酸雨中一般含有硝酸、硫酸等强酸。
( )
(3)大气污染物主要有SO2、CO2和可吸入颗粒物。( )
(4)空气质量指数是指各污染物质量指数之和。( )
(5)PM2.5指直径小于2.5 μm的悬浮颗粒物,PM10指直径小于10 μm的悬浮颗粒物。( )
(6)化石燃料的使用是产生CO2的主要原因。( )
√
√
×
×
√
√
重难探究·能力素养全提升
探究一 酸雨的危害及防治措施
情境探究
酸雨能加速土壤矿物质营养元素的流失:在酸雨的作用下,土壤中的营养元素钙、镁、磷等会溶出,并随着雨水被淋溶掉。所以长期的酸雨会使土壤中大量的营养元素流失,造成土壤中营养元素的严重不足,从而使土壤变得贫瘠。
(1)写出上图转化中所涉及的化学方程式: 。
(2)为防治酸雨,降低煤燃烧时向大气排放的SO2,工业上将生石灰和含硫煤混合后使用。请写出燃烧时,有关“固硫”(不使含硫化合物进入大气)反应的化学方程式: 。
提示 SO2+H2O H2SO3,2H2SO3+O2===2H2SO4
提示 CaO+SO2 CaSO3,2CaSO3+O2===2CaSO4
知识归纳
含二氧化硫烟气的脱硫
1.在燃煤中加入生石灰就可减少二氧化硫的排放[SO2+CaO CaSO3,
2CaSO3+O2===2CaSO4(形成煤渣)]。
2.氨脱硫法[SO2+2NH3+H2O=== (NH4)2SO3,2(NH4)2SO3+O2===2(NH4)2SO4(一种化肥)]。
3.石灰石—石膏法[SO2+CaCO3===CaSO3+CO2,2CaSO3+O2===2CaSO4(形成石膏:CaSO4·2H2O)]。
4.提高全民的环保意识,加强国际的合作,共同努力以减少硫酸型酸雨的产生。
应用体验
1.SO2能与硫化氢、氧气、氯气、过氧化氢、酸性KMnO4溶液等物质反应,如2SO2+O2 2SO3。燃煤、金属冶炼和硫酸生产等产生的尾气中都会含有SO2,容易造成酸雨、土壤酸化等环境问题。下列说法正确的是
( )
A.工业上制硫酸时,用水吸收生成的SO3
B.将工厂烟囱建高可减少硫酸型酸雨的产生
C.溶有SO2的雨水不会对土壤、水源产生污染
D.可用“石灰乳+氧气”吸收法除去尾气中的SO2
D
解析 吸收塔中SO3如果用水吸收,发生反应:SO3+H2O===H2SO4,该反应为放热反应,放出的热量易导致酸雾形成,阻隔在三氧化硫和水之间,阻碍水对三氧化硫的吸收;而浓硫酸的沸点高,难以汽化,不会形成酸雾,同时三氧化硫易溶于浓硫酸,所以工业上从吸收塔顶部喷洒浓硫酸作吸收液,最终得到“发烟”硫酸,故A错误;将工厂烟囱建高不能减少污染物的生成,所以不能减少环境污染,故B错误;溶有SO2的雨水pH<5.6,是酸雨,会对土壤、水源产生污染,故C错误;用“石灰乳+氧气”吸收含SO2的尾气,二氧化硫被氧化生成硫酸钙,也能减少二氧化硫的排放,故D正确。
2.下列为防止产生雾霾的措施中不可行的是( )
A.停止冬季供暖,减少有害物质排放
B.对锅炉和汽车等产生的有害气体和烟尘等进行处理
C.退耕还林,改善生态环境
D.寻找新能源,减少化石燃料的使用
A
解析 停止冬季供暖,虽然减少有害物质的排放,但不符合客观实际,A项错误;对锅炉和汽车等产生的有害气体和烟尘等进行处理可以减少雾霾的产生,B项正确;退耕还林,改善生态环境有利于节能减排,可以防止雾霾的产生,C项正确;寻找新能源,减少化石燃料的使用,有利于节约能源,且可以减少雾霾的生成,D项正确。
3.农业因遭受酸雨而造成的损失每年高达15亿元,为了有效控制酸雨,目前国务院已批准了《酸雨控制区和二氧化硫污染控制区划分方案》等法规。
(1)现有雨水样品1份,每隔一段时间测定该雨水样品的pH,所得数据如下表:
测试时间 0 1 2 3 4
雨水的pH 4.73 4.62 4.56 4.55 4.55
分析数据,说明雨水样品的pH变化的原因是(用化学反应方程式表示) 。
(2)你认为减少酸雨可采取的措施是( )
①少用煤作燃料 ②把工厂烟囱造高 ③燃料脱硫 ④在已酸化的土壤中加石灰 ⑤开发新能源
A.①②③ B.②③④⑤ C.①③⑤ D.①③④⑤
(3)在英国进行的一个研究结果表明:高烟囱可以有效地降低地面SO2的浓度。在20世纪的60~70年代的10年间,由发电厂排放出的SO2增加了35%,但由于建造高烟囱的结果,地面SO2的浓度降低了30%之多,请你从全球环境保护的角度,分析这种方法是否可取 简述理由: 。
答案 (1)2H2SO3+O2===2H2SO4
(2)C
(3)不可取,因为SO2的排放总量没有减少,所以形成的酸雨对全球造成的危害没有降低
解析 (1)酸雨放置一段时间,pH变小,是因为雨水中的H2SO3(弱酸)被空气中的氧气氧化为H2SO4(强酸)。
(2)把工厂烟囱造高,并不能减少SO2的排放总量,只是将SO2排放到了较高的空中,②不可取。在已酸化的土壤中加石灰,是改造酸雨造成的危害的一种措施,并没有减少酸雨的形成,故④不可取。①③⑤可减少SO2的排放,从而减少酸雨的形成。
(3)高烟囱只是将产生的SO2从低空转移到了高空,并没有减少SO2的排放总量,高空中的SO2飘移到其他地方,也会形成酸雨。
探究二 空气质量指数
情境探究
下表是某城市空气质量某日公布的内容:
项目 质量指数 空气质量级别 空气质量
可吸入颗粒物 52 二 良
二氧化硫 7
二氧化氮 24
(1)该城市的首要污染物是什么
提示 可吸入颗粒物。
(2)有的同学认为该城市的空气质量指数应为52+7+24=83,这种观点正确吗
提示 不正确。首要污染物的质量指数,即为当日空气质量指数。该城市在当日的空气质量指数为52。
知识归纳
环境污染的主要类别
类别 大气污染 水污染 土壤污染
污染的 定义 当大气中某些有毒、有害物质的含量超过正常值或大气的自净能力时,就发生了大气污染 排放的污染物使水和水体的物理、化学性质以及生物群落组成发生变化,降低了水体的使用价值 进入土壤中的污染物的数量超过了土壤的净化能力,引起了土壤质量下降的现象
类别 大气污染 水污染 土壤污染
污染物 及来源 主要有颗粒物、飘尘、硫和氮的氧化物、碳的氧化物、碳氢化合物以及含卤素的化合物、放射性物质等 重金属、酸、碱、盐等无机物;耗氧物质、植物营养物质、合成洗涤剂;石油污染;难降解有机物污染;病原体等其他污染 城市污水,工业废水,含汞、铅、砷、酚、氰化物等的污染物,垃圾和工矿企业固体废弃物;化肥、农药
类别 大气污染 水污染 土壤污染
防治的 方法 综合治理:调整能源结构,合理规划工业发展和城市建设布局,开发新能源,运用科学技术防治污染,充分利用大气自净能力等 控制污水的任意排放;利用物理方法、化学方法、生物方法等进行综合治理 控制和减少污染物的排放;加强工矿企业固体废弃物的回收利用和城市垃圾的处理
应用体验
1.某地区空气质量检测的结果显示,二氧化硫的质量指数是40,二氧化氮的质量指数是60,可吸入颗粒物的质量指数是140。以下是对该地区空气状况的评价,其中错误的是( )
A.空气中的首要污染物是可吸入颗粒物
B.空气的质量指数是240
C.空气的质量指数是140
D.空气的质量状况为轻度污染
B
解析 每一种空气污染物都有相应的质量指数,首要污染物是各污染物中质量指数最大的污染物。首要污染物的质量指数就是空气质量指数。
2.关于空气污染,下列说法正确的是( )
A.二氧化硫、二氧化氮、一氧化碳和二氧化碳是空气质量报告中涉及的主要污染物
B.正常雨水的pH等于7
C.二氧化硫和二氧化氮是引起酸雨的主要气体
D.秸秆焚烧总体来说对庄稼是有益的,值得提倡
C
解析 二氧化碳不是空气质量报告中涉及的污染物,A项错误;正常雨水中因为溶有二氧化碳而显酸性,pH约为5.6,B项错误;二氧化硫可以形成硫酸型酸雨,二氧化氮可以形成硝酸型酸雨,C项正确;秸秆焚烧不但会引起空气污染,还破坏了土壤的结构,造成农田质量下降,同时容易引起火灾,引发安全事故,必须禁止,D项错误。
学以致用·随堂检测全达标
1
2
3
4
1.下列物质不属于“城市空气质量日报”报道的是( )
A.二氧化硫 B.氮氧化物
C.三氧化硫 D.悬浮颗粒
C
解析 二氧化硫、氮氧化物、悬浮颗粒均可引起空气污染且属于空气质量评价的检测项目,不属于“城市空气质量日报”报道的是三氧化硫。
1
2
3
4
2.SO2是常见的大气污染物之一,我国规定空气中SO2的含量不得超过0.02 mg·L-1。下列措施中,不能减少SO2排放量的是( )
A.用天然气代替煤炭作民用燃料
B.大力植树造林
C.硫酸厂采取措施提高尾气的吸收率
D.燃煤中加入生石灰
B
解析 天然气是一种清洁燃料,煤炭中含有硫元素,燃烧会产生SO2,所以A项能减少SO2的排放量;某些树木能吸收SO2,但不能减少SO2的排放量;提高SO2的吸收率,就可以减少向大气中的排放量;煤炭中加入的生石灰可以与产生的SO2反应生成CaSO3,从而减少SO2的排放量;故选B项。
1
2
3
4
3.SO2和H2SO4在生产、生活和科学研究中有着广泛的应用。下列关于SO2的说法错误的是( )
A.食品中添加适量的SO2可以起到漂白、防腐和抗氧化等作用
B.工业制备硫酸产生的含SO2的尾气大量排放至空气中会形成酸雨
C.SO2具有较强的还原性,浓硫酸具有强氧化性,不能用浓硫酸干燥SO2气体
D.SO2使品红溶液褪色后,加热可使溶液再次变红
C
1
2
3
4
解析 SO2具有漂白性、还原性,食品中添加适量的SO2可以起到漂白、防腐和抗氧化等作用,故A正确;SO2与水反应生成H2SO3,H2SO3会进一步被O2氧化成H2SO4,工业制备硫酸产生的含SO2的尾气大量排放至空气中会形成酸雨,故B正确;SO2与H2SO4中的S元素没有中间价,浓硫酸不能氧化SO2,能用浓硫酸干燥SO2气体,故C错误;二氧化硫使品红溶液褪色,是因为生成了不稳定的无色物质,加热后,不稳定的无色物质又分解,溶液再次变红,故D正确。
1
2
3
4
4.在下列情况下,可能引起大气污染的是( )
①煤的燃烧 ②焚烧树叶 ③燃放鞭炮
④飞机、汽车尾气排放 ⑤天然气泄漏
⑥房屋装修 ⑦吸烟
A.除④⑥ B.除①②③ C.除⑤⑦ D.全是
D
解析 煤燃烧能产生大量的二氧化硫和一氧化碳;焚烧树叶能产生一氧化碳;燃放鞭炮也能产生二氧化硫和一氧化碳;飞机和汽车尾气的排放能产生大量的二氧化硫及氮氧化物;天然气中主要含甲烷;房屋装修中所用的胶黏剂中含有苯和甲醛等物质;吸烟会产生一氧化碳等。
本 课 结 束
专题4
第三单元 防治二氧化硫对环境的污染
素养 目标
1.学会防治二氧化硫所导致的空气污染的方法。了解空气质量指数。
2.形成良好的环境保护意识,了解可持续发展的重大意义。通过研究硫的化合物的污染问题,提高学生的科学态度与社会责任感。
基础落实·必备知识全过关
重难探究·能力素养全提升
学以致用·随堂检测全达标
目录索引
基础落实·必备知识全过关
自主梳理
一、酸雨及其治理
1.SO2的来源
(1)化石燃料如 等的燃烧;(2) ;(3)硫酸厂的 。
煤、石油
含硫金属矿石的冶炼
工业废气
2.酸雨的形成过程
pH<5.6
反应①: 。
反应②: 。
反应③: 。
反应④: 。
2SO2+O2 2SO3
SO2+H2O H2SO3
SO3+H2O===H2SO4
2H2SO3+O2===2H2SO4
【微思考1】酸雨的pH随时间增长而变小,原因是什么
提示 由于酸雨中的H2SO3被氧化为H2SO4,酸性增强。
3.酸雨的危害
(1) ,危害水生生物。
(2)酸化土壤,降低土壤肥力,影响作物生长。
(3)腐蚀建筑物。
4.酸雨的防治
(1)消除 ,研究开发 (如氢能、太阳能、核能等)。
(2)对含硫燃料预先进行 处理,并对SO2废气进行处理或回收利用。如用熟石灰吸收SO2的化学方程式为 。
酸化湖泊
污染源
新能源
脱硫
Ca(OH)2+SO2===CaSO3↓+H2O
【微思考2】酸雨对土壤有哪些危害
提示 酸雨渗透至土壤中,使土壤中的钙、镁、磷等营养元素溶出而流失,导致土壤肥力下降,植被遭到破坏,危害农作物生长。
二、空气质量评价
1.空气质量指数
空气质量指数(AQI)中有 、 、
、二氧化氮(NO2)、臭氧(O3)、一氧化碳(CO)六大检测项目。
2.AQI作为衡量空气质量好坏的指标,其数值越小,空气质量越 ,对人体健康的危害就越 。
3.空气质量指数的确定
(1)测定该地区空气中 的浓度。
(2)将各种污染物的浓度换算为 。
(3)选取污染指数最大的污染物为 , 的质量指数即为该地区的空气质量指数。
细颗粒物(PM2.5)
可吸入颗粒物(PM10)
二氧化硫(SO2)
好
小
各种污染物
质量指数
首要污染物
首要污染物
4.AQI与空气质量级别、状况
空气质量分级标准
空气质 量指数 0~50 51~100 101~150 151~200 201~300 300以上
空气质 量级别 一级 二级 三级 四级 五级 六级
空气质 量状况 优 良 轻度污染 中度污染 重度污染 严重污染
【微思考3】PM2.5与PM10是什么意义
提示 PM2.5指直径小于2.5 μm的悬浮颗粒物,PM10指直径小于10 μm的悬浮颗粒物。
自我检测
判断下列说法是否正确,正确的画“√”,错误的画“×”。
(1)SO2的含量指数是空气质量日报的重要指标。( )
(2)一般把pH<5.6的雨水称为酸雨,酸雨中一般含有硝酸、硫酸等强酸。
( )
(3)大气污染物主要有SO2、CO2和可吸入颗粒物。( )
(4)空气质量指数是指各污染物质量指数之和。( )
(5)PM2.5指直径小于2.5 μm的悬浮颗粒物,PM10指直径小于10 μm的悬浮颗粒物。( )
(6)化石燃料的使用是产生CO2的主要原因。( )
√
√
×
×
√
√
重难探究·能力素养全提升
探究一 酸雨的危害及防治措施
情境探究
酸雨能加速土壤矿物质营养元素的流失:在酸雨的作用下,土壤中的营养元素钙、镁、磷等会溶出,并随着雨水被淋溶掉。所以长期的酸雨会使土壤中大量的营养元素流失,造成土壤中营养元素的严重不足,从而使土壤变得贫瘠。
(1)写出上图转化中所涉及的化学方程式: 。
(2)为防治酸雨,降低煤燃烧时向大气排放的SO2,工业上将生石灰和含硫煤混合后使用。请写出燃烧时,有关“固硫”(不使含硫化合物进入大气)反应的化学方程式: 。
提示 SO2+H2O H2SO3,2H2SO3+O2===2H2SO4
提示 CaO+SO2 CaSO3,2CaSO3+O2===2CaSO4
知识归纳
含二氧化硫烟气的脱硫
1.在燃煤中加入生石灰就可减少二氧化硫的排放[SO2+CaO CaSO3,
2CaSO3+O2===2CaSO4(形成煤渣)]。
2.氨脱硫法[SO2+2NH3+H2O=== (NH4)2SO3,2(NH4)2SO3+O2===2(NH4)2SO4(一种化肥)]。
3.石灰石—石膏法[SO2+CaCO3===CaSO3+CO2,2CaSO3+O2===2CaSO4(形成石膏:CaSO4·2H2O)]。
4.提高全民的环保意识,加强国际的合作,共同努力以减少硫酸型酸雨的产生。
应用体验
1.SO2能与硫化氢、氧气、氯气、过氧化氢、酸性KMnO4溶液等物质反应,如2SO2+O2 2SO3。燃煤、金属冶炼和硫酸生产等产生的尾气中都会含有SO2,容易造成酸雨、土壤酸化等环境问题。下列说法正确的是
( )
A.工业上制硫酸时,用水吸收生成的SO3
B.将工厂烟囱建高可减少硫酸型酸雨的产生
C.溶有SO2的雨水不会对土壤、水源产生污染
D.可用“石灰乳+氧气”吸收法除去尾气中的SO2
D
解析 吸收塔中SO3如果用水吸收,发生反应:SO3+H2O===H2SO4,该反应为放热反应,放出的热量易导致酸雾形成,阻隔在三氧化硫和水之间,阻碍水对三氧化硫的吸收;而浓硫酸的沸点高,难以汽化,不会形成酸雾,同时三氧化硫易溶于浓硫酸,所以工业上从吸收塔顶部喷洒浓硫酸作吸收液,最终得到“发烟”硫酸,故A错误;将工厂烟囱建高不能减少污染物的生成,所以不能减少环境污染,故B错误;溶有SO2的雨水pH<5.6,是酸雨,会对土壤、水源产生污染,故C错误;用“石灰乳+氧气”吸收含SO2的尾气,二氧化硫被氧化生成硫酸钙,也能减少二氧化硫的排放,故D正确。
2.下列为防止产生雾霾的措施中不可行的是( )
A.停止冬季供暖,减少有害物质排放
B.对锅炉和汽车等产生的有害气体和烟尘等进行处理
C.退耕还林,改善生态环境
D.寻找新能源,减少化石燃料的使用
A
解析 停止冬季供暖,虽然减少有害物质的排放,但不符合客观实际,A项错误;对锅炉和汽车等产生的有害气体和烟尘等进行处理可以减少雾霾的产生,B项正确;退耕还林,改善生态环境有利于节能减排,可以防止雾霾的产生,C项正确;寻找新能源,减少化石燃料的使用,有利于节约能源,且可以减少雾霾的生成,D项正确。
3.农业因遭受酸雨而造成的损失每年高达15亿元,为了有效控制酸雨,目前国务院已批准了《酸雨控制区和二氧化硫污染控制区划分方案》等法规。
(1)现有雨水样品1份,每隔一段时间测定该雨水样品的pH,所得数据如下表:
测试时间 0 1 2 3 4
雨水的pH 4.73 4.62 4.56 4.55 4.55
分析数据,说明雨水样品的pH变化的原因是(用化学反应方程式表示) 。
(2)你认为减少酸雨可采取的措施是( )
①少用煤作燃料 ②把工厂烟囱造高 ③燃料脱硫 ④在已酸化的土壤中加石灰 ⑤开发新能源
A.①②③ B.②③④⑤ C.①③⑤ D.①③④⑤
(3)在英国进行的一个研究结果表明:高烟囱可以有效地降低地面SO2的浓度。在20世纪的60~70年代的10年间,由发电厂排放出的SO2增加了35%,但由于建造高烟囱的结果,地面SO2的浓度降低了30%之多,请你从全球环境保护的角度,分析这种方法是否可取 简述理由: 。
答案 (1)2H2SO3+O2===2H2SO4
(2)C
(3)不可取,因为SO2的排放总量没有减少,所以形成的酸雨对全球造成的危害没有降低
解析 (1)酸雨放置一段时间,pH变小,是因为雨水中的H2SO3(弱酸)被空气中的氧气氧化为H2SO4(强酸)。
(2)把工厂烟囱造高,并不能减少SO2的排放总量,只是将SO2排放到了较高的空中,②不可取。在已酸化的土壤中加石灰,是改造酸雨造成的危害的一种措施,并没有减少酸雨的形成,故④不可取。①③⑤可减少SO2的排放,从而减少酸雨的形成。
(3)高烟囱只是将产生的SO2从低空转移到了高空,并没有减少SO2的排放总量,高空中的SO2飘移到其他地方,也会形成酸雨。
探究二 空气质量指数
情境探究
下表是某城市空气质量某日公布的内容:
项目 质量指数 空气质量级别 空气质量
可吸入颗粒物 52 二 良
二氧化硫 7
二氧化氮 24
(1)该城市的首要污染物是什么
提示 可吸入颗粒物。
(2)有的同学认为该城市的空气质量指数应为52+7+24=83,这种观点正确吗
提示 不正确。首要污染物的质量指数,即为当日空气质量指数。该城市在当日的空气质量指数为52。
知识归纳
环境污染的主要类别
类别 大气污染 水污染 土壤污染
污染的 定义 当大气中某些有毒、有害物质的含量超过正常值或大气的自净能力时,就发生了大气污染 排放的污染物使水和水体的物理、化学性质以及生物群落组成发生变化,降低了水体的使用价值 进入土壤中的污染物的数量超过了土壤的净化能力,引起了土壤质量下降的现象
类别 大气污染 水污染 土壤污染
污染物 及来源 主要有颗粒物、飘尘、硫和氮的氧化物、碳的氧化物、碳氢化合物以及含卤素的化合物、放射性物质等 重金属、酸、碱、盐等无机物;耗氧物质、植物营养物质、合成洗涤剂;石油污染;难降解有机物污染;病原体等其他污染 城市污水,工业废水,含汞、铅、砷、酚、氰化物等的污染物,垃圾和工矿企业固体废弃物;化肥、农药
类别 大气污染 水污染 土壤污染
防治的 方法 综合治理:调整能源结构,合理规划工业发展和城市建设布局,开发新能源,运用科学技术防治污染,充分利用大气自净能力等 控制污水的任意排放;利用物理方法、化学方法、生物方法等进行综合治理 控制和减少污染物的排放;加强工矿企业固体废弃物的回收利用和城市垃圾的处理
应用体验
1.某地区空气质量检测的结果显示,二氧化硫的质量指数是40,二氧化氮的质量指数是60,可吸入颗粒物的质量指数是140。以下是对该地区空气状况的评价,其中错误的是( )
A.空气中的首要污染物是可吸入颗粒物
B.空气的质量指数是240
C.空气的质量指数是140
D.空气的质量状况为轻度污染
B
解析 每一种空气污染物都有相应的质量指数,首要污染物是各污染物中质量指数最大的污染物。首要污染物的质量指数就是空气质量指数。
2.关于空气污染,下列说法正确的是( )
A.二氧化硫、二氧化氮、一氧化碳和二氧化碳是空气质量报告中涉及的主要污染物
B.正常雨水的pH等于7
C.二氧化硫和二氧化氮是引起酸雨的主要气体
D.秸秆焚烧总体来说对庄稼是有益的,值得提倡
C
解析 二氧化碳不是空气质量报告中涉及的污染物,A项错误;正常雨水中因为溶有二氧化碳而显酸性,pH约为5.6,B项错误;二氧化硫可以形成硫酸型酸雨,二氧化氮可以形成硝酸型酸雨,C项正确;秸秆焚烧不但会引起空气污染,还破坏了土壤的结构,造成农田质量下降,同时容易引起火灾,引发安全事故,必须禁止,D项错误。
学以致用·随堂检测全达标
1
2
3
4
1.下列物质不属于“城市空气质量日报”报道的是( )
A.二氧化硫 B.氮氧化物
C.三氧化硫 D.悬浮颗粒
C
解析 二氧化硫、氮氧化物、悬浮颗粒均可引起空气污染且属于空气质量评价的检测项目,不属于“城市空气质量日报”报道的是三氧化硫。
1
2
3
4
2.SO2是常见的大气污染物之一,我国规定空气中SO2的含量不得超过0.02 mg·L-1。下列措施中,不能减少SO2排放量的是( )
A.用天然气代替煤炭作民用燃料
B.大力植树造林
C.硫酸厂采取措施提高尾气的吸收率
D.燃煤中加入生石灰
B
解析 天然气是一种清洁燃料,煤炭中含有硫元素,燃烧会产生SO2,所以A项能减少SO2的排放量;某些树木能吸收SO2,但不能减少SO2的排放量;提高SO2的吸收率,就可以减少向大气中的排放量;煤炭中加入的生石灰可以与产生的SO2反应生成CaSO3,从而减少SO2的排放量;故选B项。
1
2
3
4
3.SO2和H2SO4在生产、生活和科学研究中有着广泛的应用。下列关于SO2的说法错误的是( )
A.食品中添加适量的SO2可以起到漂白、防腐和抗氧化等作用
B.工业制备硫酸产生的含SO2的尾气大量排放至空气中会形成酸雨
C.SO2具有较强的还原性,浓硫酸具有强氧化性,不能用浓硫酸干燥SO2气体
D.SO2使品红溶液褪色后,加热可使溶液再次变红
C
1
2
3
4
解析 SO2具有漂白性、还原性,食品中添加适量的SO2可以起到漂白、防腐和抗氧化等作用,故A正确;SO2与水反应生成H2SO3,H2SO3会进一步被O2氧化成H2SO4,工业制备硫酸产生的含SO2的尾气大量排放至空气中会形成酸雨,故B正确;SO2与H2SO4中的S元素没有中间价,浓硫酸不能氧化SO2,能用浓硫酸干燥SO2气体,故C错误;二氧化硫使品红溶液褪色,是因为生成了不稳定的无色物质,加热后,不稳定的无色物质又分解,溶液再次变红,故D正确。
1
2
3
4
4.在下列情况下,可能引起大气污染的是( )
①煤的燃烧 ②焚烧树叶 ③燃放鞭炮
④飞机、汽车尾气排放 ⑤天然气泄漏
⑥房屋装修 ⑦吸烟
A.除④⑥ B.除①②③ C.除⑤⑦ D.全是
D
解析 煤燃烧能产生大量的二氧化硫和一氧化碳;焚烧树叶能产生一氧化碳;燃放鞭炮也能产生二氧化硫和一氧化碳;飞机和汽车尾气的排放能产生大量的二氧化硫及氮氧化物;天然气中主要含甲烷;房屋装修中所用的胶黏剂中含有苯和甲醛等物质;吸烟会产生一氧化碳等。
本 课 结 束
