3.3.2 从海水中提取镁 从海带中提取碘 课件(共35张PPT)2023-2024学年高一化学苏教版必修一
文档属性
| 名称 | 3.3.2 从海水中提取镁 从海带中提取碘 课件(共35张PPT)2023-2024学年高一化学苏教版必修一 |  | |
| 格式 | pptx | ||
| 文件大小 | 2.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-07 21:22:14 | ||
图片预览






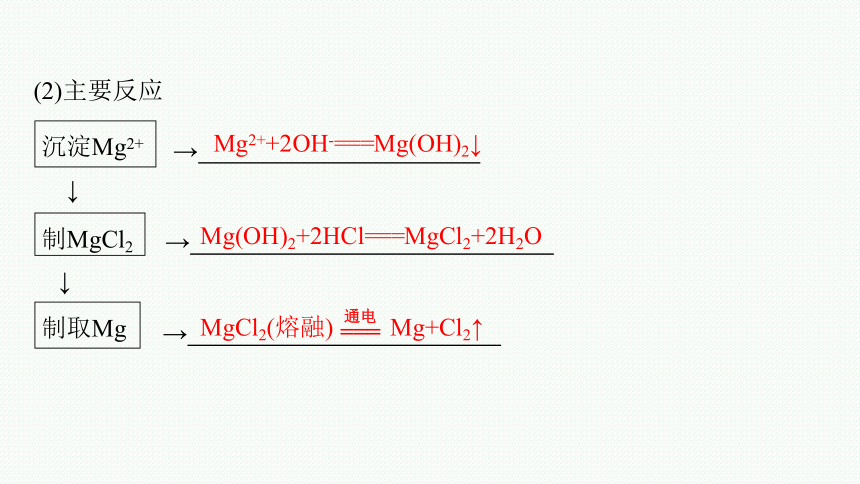




文档简介
(共35张PPT)
专题3
第三单元 第2课时 从海水中提取镁 从海带中提取碘
素养 目标
1.了解海水提镁的化学原理与过程。
2.了解镁的性质和用途。
3.了解海带提碘的化学原理与过程。
基础落实·必备知识全过关
重难探究·能力素养全提升
学以致用·随堂检测全达标
目录索引
基础落实·必备知识全过关
自主梳理
1.镁的性质
(1)物理性质
颜色 密度 硬度 熔点
色 较 较 较
银白
小
小
低
(2)化学性质
镁原子最外层有2个电子,在化学反应中容易失去
Mg+2H+===Mg2++H2↑
2Mg+O2 2MgO
===
点燃
剧烈燃烧,发出耀眼的白光
2Mg+CO2 2MgO+C
===
点燃
剧烈燃烧,发出耀眼的白光
黑色
白色粉末
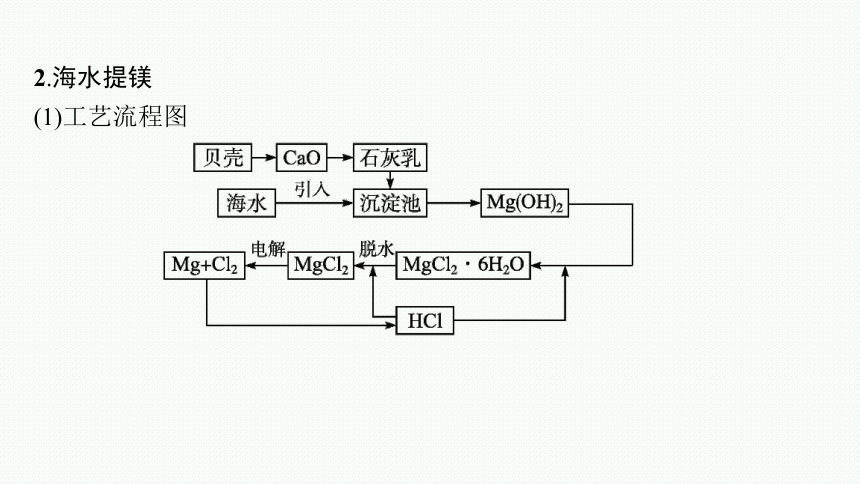
2.海水提镁
(1)工艺流程图
(2)主要反应
沉淀Mg2+
→
↓
制MgCl2
→
↓
制取Mg
→
Mg2++2OH-===Mg(OH)2↓
Mg(OH)2+2HCl===MgCl2+2H2O
MgCl2(熔融) Mg+Cl2↑
===
通电
3.海带提碘
海带中所含的碘元素在浸泡时以 的形式进入水中,再用
反应把碘离子 为 。
人体必需的微量元素
碘离子
氧化还原
氧化
碘单质
自我检测
判断下列说法是否正确,正确的画“√”,错误的画“×”。
(1)镁在自然界中主要以游离态存在于地壳中,以化合态存在于海水中。
( )
(2)石灰乳可由海边的贝壳煅烧直接得到。( )
(3)六水合氯化镁晶体在空气中加热可生成无水氯化镁。( )
(4)电解氯化镁溶液可生成金属镁。( )
(5)Mg是较活泼金属,一定条件下易燃,一旦着火,可以用CO2灭火。( )
(6)海水中含有大量的碘离子,向海水中通入双氧水即可生成碘单质,然后加入有机溶剂萃取可得碘单质。( )
(7)碘是人体必需的微量元素,人体缺碘会引起碘缺乏病。( )
×
×
×
×
×
×
√
重难探究·能力素养全提升
探究一 海水提镁及镁的性质
情境探究
(1)参考教材从海水中提取镁的工业生产流程图,回答以下问题:
①向海水沉淀池中加入的物质是石灰乳,为什么不加石灰水 石灰乳怎样得到
提示 海水中镁离子浓度小,由于Ca(OH)2微溶于水,故石灰水浓度也较小,用澄清石灰水会降低生产效率;用石灰乳可以得到较多的氢氧化镁沉淀。煅烧海边的贝壳生成生石灰,生石灰与水作用可生成石灰乳。
(2)工业电解熔融MgCl2得到的镁,一般在H2氛围中冷却,不能在空气中冷却,为什么
②流程图中被电解的物质是什么 写出电解反应的化学方程式。
提示 被电解的物质是熔融氯化镁,电解反应的化学方程式为MgCl2(熔融)
提示 Mg是活泼的金属,有较强的还原性。镁在高温或点燃条件下能与空气中的某些气体反应,如与N2反应,化学方程式为3Mg+N2 Mg3N2;与O2反应,化学方程式为2Mg+O2 2MgO;与CO2反应,化学方程式为2Mg+CO2 2MgO+C。故得到的镁不能在空气中冷却。
知识归纳
从海水中提取镁的工艺流程中的注意事项
由MgCl2·6H2O加热脱水制MgCl2应该在HCl气体氛围中进行;工业上通过电解熔融的氯化镁制取镁,而不是电解熔融的氧化镁制取镁,因为氧化镁熔点比氯化镁高得多,使氧化镁熔融需要消耗更多的能量。
应用体验
1.无水氯化镁在工业生产中有多种用途,以下是一种工业制备无水氯化镁的工艺流程(每步加入的物质均过量)。
下列说法错误的是( )
A.工业上常用电解熔融MgCl2制备金属镁
B.“氯化”过程中可能生成一种可燃性气体
C.“沉镁”过程只发生复分解反应
D.“氯化”所得固体在空气中高温加热可除去杂质
C
解析 镁是较活泼金属,工业上常用电解熔融氯化镁制备金属镁,故A正确;煅烧后的产物中主要成分为MgO,“氯化”过程中加入碳和氯气反应后生成了氯化镁和CO,CO为可燃性气体,故B正确;“沉镁”过程不只发生复分解反应,还发生化合反应CaO+H2O===Ca(OH)2,故C错误;“氯化”所得固体是MgCl2,在空气中高温加热可除去过量的碳杂质,故D正确。
2.海水开发利用的部分过程如下图所示。
(1)富集溴一般先用热空气或水蒸气吹出单质溴,再用SO2的水溶液将其还原吸收,发生反应的化学方程式为 。
(2)为了使Mg2+转化为Mg(OH)2,试剂①可以用 (填化学式)。
(3)无水MgCl2在熔融状态下通电后会产生Mg和Cl2,该反应的化学方程式为 。
(4)下列有关海水综合利用的说法错误的是 (填字母)。
A.粗盐可采用除杂后蒸发结晶进行提纯
B.电解MgCl2溶液可制得金属镁
C.向滤液中通入Cl2是为了氧化Br-
D.海水提镁过程中涉及复分解反应
答案 (1)Br2+SO2+2H2O===2HBr+H2SO4
(2)Ca(OH)2
(3)MgCl2(熔融) Mg+Cl2↑
(4)B
解析 (1)发生反应的化学方程式为Br2+SO2+2H2O===2HBr+H2SO4。
(2)为了使Mg2+转化为Mg(OH)2,试剂①常用Ca(OH)2。
(3)反应的化学方程式为MgCl2(熔融) Mg+Cl2↑。
(4)粗盐中含有Ca2+、Mg2+、 等杂质,精制时可在溶液中依次加入过量的BaCl2溶液、过量的NaOH溶液和过量的Na2CO3溶液,过滤后向滤液中加入盐酸至溶液呈中性,再进行蒸发结晶进行提纯,A正确;电解MgCl2溶液生成的是氯气、氢气和氢氧化镁,电解熔融氯化镁生成镁和氯气,B错误;向滤液中通入Cl2是为了氧化Br-,反应的离子方程式为Cl2+2Br-===2Cl-+Br2,C正确;海水提镁过程中生成氢氧化镁的反应Ca(OH)2+MgCl2===Mg(OH)2↓+CaCl2及氢氧化镁与盐酸的反应Mg(OH)2+2HCl===MgCl2+2H2O均为复分解反应,D正确。
探究二 从海带中提取碘
情境探究
下图是实验室从海带中提取碘的流程:
(1)海带灰用水浸泡、过滤目的是什么
提示 使海带灰中的可溶性物质溶于水,过滤除去滤渣,得到的滤液中含有碘离子。
(2)酸化、氧化一般可加入稀硫酸、双氧水,加双氧水的目的是什么
(3)向含碘单质的水溶液中加入CCl4进行萃取、分液后怎样分离出碘单质
提示 向滤液中加入稀硫酸酸化,滴入双氧水可将滤液中的碘离子(I-)氧化为碘单质(I2)。
提示 从分液漏斗的下口分离出碘的四氯化碳溶液,然后将碘的四氯化碳溶液进行蒸馏可得碘单质。
知识归纳
海带提碘工艺流程与原理
加入氢氧化钠溶液碱化的目的是使溶液中某些离子形成沉淀除去;氧化常用双氧水或氯气作氧化剂,发生反应的化学方程式分别为H2O2+2KI+H2SO4===I2+K2SO4+2H2O,2KI+Cl2===I2+2KCl;粗碘提纯可以用升华法。
应用体验
1.某同学取海带灰加蒸馏水煮沸2~3 min,冷却,过滤,获得含I-的溶液,并设计以下实验从中提取I2。
(1)反应1中硫酸的作用是提供酸性环境,则试剂a的作用是 。
(2)试剂b应选择 (填字母)。
A.CCl4
B.苯(一种有机溶剂,与水互不相溶,密度比水的小)
C.酒精
D.醋酸
(3)操作1的名称是 。实验室里进行操作1需要的玻璃仪器除烧杯外,还需要 。
(4)反应2为3I2+6NaOH===5NaI+NaIO3+3H2O,用双线桥标出此反应中电子转移的方向和数目: 。此反应中的氧化剂是 ,氧化产物是 。
(5)反应3的离子方程式是 。
答案 (1)将I-氧化成I2(或作氧化剂)
(2)A
(3)萃取、分液 分液漏斗
解析 (1)反应1中硫酸的作用是提供酸性环境,试剂a用来氧化碘离子,则其作用是将I-氧化成I2,即氧化剂。
(2)结合后续实验操作可知,碘的有机溶液中加入氢氧化钠溶液发生反应生成碘化钠、碘酸钠,分液后碘单质在上层溶液中,则b为萃取剂且密度大于水,试剂b应选择四氯化碳。
(3)操作1是萃取、分液得到含碘单质的有机溶液,实验室里进行操作1需要的玻璃仪器除烧杯外,还需要分液漏斗。
(4)反应2为3I2+6NaOH===5NaI+NaIO3+3H2O,反应中碘元素化合价部分从0价升高到+5价,部分降低到-1价,根据电子得失守恒可知转移电子数是5,
用双线桥表示此反应电子转移为 。反应中的氧化剂是I2,氧化产物是NaIO3。
(5)反应3是碘离子与碘酸根离子在酸性溶液中发生归中反应生成碘单质,反应的离子方程式为5I-+ +6H+===3I2+3H2O。
2.海带中含有碘元素,可通过以下步骤提取碘单质:①灼烧 ②溶解 ③过滤 ④氧化 ⑤萃取分液等。以上步骤不需要用到的仪器是( )
A
解析 ①灼烧使用坩埚,②溶解使用烧杯,③过滤使用漏斗,⑤萃取分液使用分液漏斗,故不需要的仪器为A。
学以致用·随堂检测全达标
1
2
3
4
1.海水是镁的重要来源,从海水中提取镁的步骤是MgCl2→Mg(OH)2→MgCl2·6H2O→MgCl2→Mg。其中没有发生的反应类型是( )
A.氧化还原反应 B.化合反应
C.中和反应 D.分解反应
B
1
2
3
4
2.下列有关海水综合利用的说法正确的是( )
A.电解饱和食盐水可制得金属钠
B.海带提碘属于物理变化
C.海水提溴涉及氧化还原反应
D.海水提镁不涉及复分解反应
C
1
2
3
4
3.下列说法不正确的是( )
A.通过电解熔融的无水MgCl2可以制得金属镁
B.镁条在空气中燃烧所得的固体物质是混合物
C.氧化镁是优质的耐火材料
D.金属镁质地柔软,不适宜制作高强度的合金材料
D
解析 Mg是活泼金属,工业上采用电解熔融MgCl2的方法冶炼Mg,A项正确;Mg在空气中燃烧生成MgO、Mg3N2,Mg还能与CO2反应生成MgO和C,所以镁条在空气中燃烧所得的固体物质是混合物,B项正确;MgO熔点很高,所以氧化镁是优质的耐火材料,常常作耐火砖,C项正确;虽然Mg质地柔软,但密度小,是重要的合金材料,如镁铝合金广泛应用于航天器材中,D项错误。
1
2
3
4
4.下列关于海水资源综合利用的说法正确的是( )
A.海水晒盐是提取海水中淡水资源的一条途径
B.只通过物理变化即可提取海水中的溴单质
C.从海带灰中提取I-,需加入CCl4萃取
D.利用海水可以制取多种重要化工产品
D
解析 蒸馏法、反渗透法和电渗析法是海水淡化的主要方法,A错误;海水中溴元素以溴离子形式存在,海水中溴离子转化为溴单质的过程属于化学变化,B错误;从海带灰中提取I-,需加水溶解、过滤,C错误;海水中含有80多种元素,是重要的资源,利用海水可以制取多种重要的化工产品,D正确。
本 课 结 束
专题3
第三单元 第2课时 从海水中提取镁 从海带中提取碘
素养 目标
1.了解海水提镁的化学原理与过程。
2.了解镁的性质和用途。
3.了解海带提碘的化学原理与过程。
基础落实·必备知识全过关
重难探究·能力素养全提升
学以致用·随堂检测全达标
目录索引
基础落实·必备知识全过关
自主梳理
1.镁的性质
(1)物理性质
颜色 密度 硬度 熔点
色 较 较 较
银白
小
小
低
(2)化学性质
镁原子最外层有2个电子,在化学反应中容易失去
Mg+2H+===Mg2++H2↑
2Mg+O2 2MgO
===
点燃
剧烈燃烧,发出耀眼的白光
2Mg+CO2 2MgO+C
===
点燃
剧烈燃烧,发出耀眼的白光
黑色
白色粉末
2.海水提镁
(1)工艺流程图
(2)主要反应
沉淀Mg2+
→
↓
制MgCl2
→
↓
制取Mg
→
Mg2++2OH-===Mg(OH)2↓
Mg(OH)2+2HCl===MgCl2+2H2O
MgCl2(熔融) Mg+Cl2↑
===
通电
3.海带提碘
海带中所含的碘元素在浸泡时以 的形式进入水中,再用
反应把碘离子 为 。
人体必需的微量元素
碘离子
氧化还原
氧化
碘单质
自我检测
判断下列说法是否正确,正确的画“√”,错误的画“×”。
(1)镁在自然界中主要以游离态存在于地壳中,以化合态存在于海水中。
( )
(2)石灰乳可由海边的贝壳煅烧直接得到。( )
(3)六水合氯化镁晶体在空气中加热可生成无水氯化镁。( )
(4)电解氯化镁溶液可生成金属镁。( )
(5)Mg是较活泼金属,一定条件下易燃,一旦着火,可以用CO2灭火。( )
(6)海水中含有大量的碘离子,向海水中通入双氧水即可生成碘单质,然后加入有机溶剂萃取可得碘单质。( )
(7)碘是人体必需的微量元素,人体缺碘会引起碘缺乏病。( )
×
×
×
×
×
×
√
重难探究·能力素养全提升
探究一 海水提镁及镁的性质
情境探究
(1)参考教材从海水中提取镁的工业生产流程图,回答以下问题:
①向海水沉淀池中加入的物质是石灰乳,为什么不加石灰水 石灰乳怎样得到
提示 海水中镁离子浓度小,由于Ca(OH)2微溶于水,故石灰水浓度也较小,用澄清石灰水会降低生产效率;用石灰乳可以得到较多的氢氧化镁沉淀。煅烧海边的贝壳生成生石灰,生石灰与水作用可生成石灰乳。
(2)工业电解熔融MgCl2得到的镁,一般在H2氛围中冷却,不能在空气中冷却,为什么
②流程图中被电解的物质是什么 写出电解反应的化学方程式。
提示 被电解的物质是熔融氯化镁,电解反应的化学方程式为MgCl2(熔融)
提示 Mg是活泼的金属,有较强的还原性。镁在高温或点燃条件下能与空气中的某些气体反应,如与N2反应,化学方程式为3Mg+N2 Mg3N2;与O2反应,化学方程式为2Mg+O2 2MgO;与CO2反应,化学方程式为2Mg+CO2 2MgO+C。故得到的镁不能在空气中冷却。
知识归纳
从海水中提取镁的工艺流程中的注意事项
由MgCl2·6H2O加热脱水制MgCl2应该在HCl气体氛围中进行;工业上通过电解熔融的氯化镁制取镁,而不是电解熔融的氧化镁制取镁,因为氧化镁熔点比氯化镁高得多,使氧化镁熔融需要消耗更多的能量。
应用体验
1.无水氯化镁在工业生产中有多种用途,以下是一种工业制备无水氯化镁的工艺流程(每步加入的物质均过量)。
下列说法错误的是( )
A.工业上常用电解熔融MgCl2制备金属镁
B.“氯化”过程中可能生成一种可燃性气体
C.“沉镁”过程只发生复分解反应
D.“氯化”所得固体在空气中高温加热可除去杂质
C
解析 镁是较活泼金属,工业上常用电解熔融氯化镁制备金属镁,故A正确;煅烧后的产物中主要成分为MgO,“氯化”过程中加入碳和氯气反应后生成了氯化镁和CO,CO为可燃性气体,故B正确;“沉镁”过程不只发生复分解反应,还发生化合反应CaO+H2O===Ca(OH)2,故C错误;“氯化”所得固体是MgCl2,在空气中高温加热可除去过量的碳杂质,故D正确。
2.海水开发利用的部分过程如下图所示。
(1)富集溴一般先用热空气或水蒸气吹出单质溴,再用SO2的水溶液将其还原吸收,发生反应的化学方程式为 。
(2)为了使Mg2+转化为Mg(OH)2,试剂①可以用 (填化学式)。
(3)无水MgCl2在熔融状态下通电后会产生Mg和Cl2,该反应的化学方程式为 。
(4)下列有关海水综合利用的说法错误的是 (填字母)。
A.粗盐可采用除杂后蒸发结晶进行提纯
B.电解MgCl2溶液可制得金属镁
C.向滤液中通入Cl2是为了氧化Br-
D.海水提镁过程中涉及复分解反应
答案 (1)Br2+SO2+2H2O===2HBr+H2SO4
(2)Ca(OH)2
(3)MgCl2(熔融) Mg+Cl2↑
(4)B
解析 (1)发生反应的化学方程式为Br2+SO2+2H2O===2HBr+H2SO4。
(2)为了使Mg2+转化为Mg(OH)2,试剂①常用Ca(OH)2。
(3)反应的化学方程式为MgCl2(熔融) Mg+Cl2↑。
(4)粗盐中含有Ca2+、Mg2+、 等杂质,精制时可在溶液中依次加入过量的BaCl2溶液、过量的NaOH溶液和过量的Na2CO3溶液,过滤后向滤液中加入盐酸至溶液呈中性,再进行蒸发结晶进行提纯,A正确;电解MgCl2溶液生成的是氯气、氢气和氢氧化镁,电解熔融氯化镁生成镁和氯气,B错误;向滤液中通入Cl2是为了氧化Br-,反应的离子方程式为Cl2+2Br-===2Cl-+Br2,C正确;海水提镁过程中生成氢氧化镁的反应Ca(OH)2+MgCl2===Mg(OH)2↓+CaCl2及氢氧化镁与盐酸的反应Mg(OH)2+2HCl===MgCl2+2H2O均为复分解反应,D正确。
探究二 从海带中提取碘
情境探究
下图是实验室从海带中提取碘的流程:
(1)海带灰用水浸泡、过滤目的是什么
提示 使海带灰中的可溶性物质溶于水,过滤除去滤渣,得到的滤液中含有碘离子。
(2)酸化、氧化一般可加入稀硫酸、双氧水,加双氧水的目的是什么
(3)向含碘单质的水溶液中加入CCl4进行萃取、分液后怎样分离出碘单质
提示 向滤液中加入稀硫酸酸化,滴入双氧水可将滤液中的碘离子(I-)氧化为碘单质(I2)。
提示 从分液漏斗的下口分离出碘的四氯化碳溶液,然后将碘的四氯化碳溶液进行蒸馏可得碘单质。
知识归纳
海带提碘工艺流程与原理
加入氢氧化钠溶液碱化的目的是使溶液中某些离子形成沉淀除去;氧化常用双氧水或氯气作氧化剂,发生反应的化学方程式分别为H2O2+2KI+H2SO4===I2+K2SO4+2H2O,2KI+Cl2===I2+2KCl;粗碘提纯可以用升华法。
应用体验
1.某同学取海带灰加蒸馏水煮沸2~3 min,冷却,过滤,获得含I-的溶液,并设计以下实验从中提取I2。
(1)反应1中硫酸的作用是提供酸性环境,则试剂a的作用是 。
(2)试剂b应选择 (填字母)。
A.CCl4
B.苯(一种有机溶剂,与水互不相溶,密度比水的小)
C.酒精
D.醋酸
(3)操作1的名称是 。实验室里进行操作1需要的玻璃仪器除烧杯外,还需要 。
(4)反应2为3I2+6NaOH===5NaI+NaIO3+3H2O,用双线桥标出此反应中电子转移的方向和数目: 。此反应中的氧化剂是 ,氧化产物是 。
(5)反应3的离子方程式是 。
答案 (1)将I-氧化成I2(或作氧化剂)
(2)A
(3)萃取、分液 分液漏斗
解析 (1)反应1中硫酸的作用是提供酸性环境,试剂a用来氧化碘离子,则其作用是将I-氧化成I2,即氧化剂。
(2)结合后续实验操作可知,碘的有机溶液中加入氢氧化钠溶液发生反应生成碘化钠、碘酸钠,分液后碘单质在上层溶液中,则b为萃取剂且密度大于水,试剂b应选择四氯化碳。
(3)操作1是萃取、分液得到含碘单质的有机溶液,实验室里进行操作1需要的玻璃仪器除烧杯外,还需要分液漏斗。
(4)反应2为3I2+6NaOH===5NaI+NaIO3+3H2O,反应中碘元素化合价部分从0价升高到+5价,部分降低到-1价,根据电子得失守恒可知转移电子数是5,
用双线桥表示此反应电子转移为 。反应中的氧化剂是I2,氧化产物是NaIO3。
(5)反应3是碘离子与碘酸根离子在酸性溶液中发生归中反应生成碘单质,反应的离子方程式为5I-+ +6H+===3I2+3H2O。
2.海带中含有碘元素,可通过以下步骤提取碘单质:①灼烧 ②溶解 ③过滤 ④氧化 ⑤萃取分液等。以上步骤不需要用到的仪器是( )
A
解析 ①灼烧使用坩埚,②溶解使用烧杯,③过滤使用漏斗,⑤萃取分液使用分液漏斗,故不需要的仪器为A。
学以致用·随堂检测全达标
1
2
3
4
1.海水是镁的重要来源,从海水中提取镁的步骤是MgCl2→Mg(OH)2→MgCl2·6H2O→MgCl2→Mg。其中没有发生的反应类型是( )
A.氧化还原反应 B.化合反应
C.中和反应 D.分解反应
B
1
2
3
4
2.下列有关海水综合利用的说法正确的是( )
A.电解饱和食盐水可制得金属钠
B.海带提碘属于物理变化
C.海水提溴涉及氧化还原反应
D.海水提镁不涉及复分解反应
C
1
2
3
4
3.下列说法不正确的是( )
A.通过电解熔融的无水MgCl2可以制得金属镁
B.镁条在空气中燃烧所得的固体物质是混合物
C.氧化镁是优质的耐火材料
D.金属镁质地柔软,不适宜制作高强度的合金材料
D
解析 Mg是活泼金属,工业上采用电解熔融MgCl2的方法冶炼Mg,A项正确;Mg在空气中燃烧生成MgO、Mg3N2,Mg还能与CO2反应生成MgO和C,所以镁条在空气中燃烧所得的固体物质是混合物,B项正确;MgO熔点很高,所以氧化镁是优质的耐火材料,常常作耐火砖,C项正确;虽然Mg质地柔软,但密度小,是重要的合金材料,如镁铝合金广泛应用于航天器材中,D项错误。
1
2
3
4
4.下列关于海水资源综合利用的说法正确的是( )
A.海水晒盐是提取海水中淡水资源的一条途径
B.只通过物理变化即可提取海水中的溴单质
C.从海带灰中提取I-,需加入CCl4萃取
D.利用海水可以制取多种重要化工产品
D
解析 蒸馏法、反渗透法和电渗析法是海水淡化的主要方法,A错误;海水中溴元素以溴离子形式存在,海水中溴离子转化为溴单质的过程属于化学变化,B错误;从海带灰中提取I-,需加水溶解、过滤,C错误;海水中含有80多种元素,是重要的资源,利用海水可以制取多种重要的化工产品,D正确。
本 课 结 束
