5.2.1 离子键 共价键 课件(共46张PPT)2023-2024学年高一化学苏教版必修一
文档属性
| 名称 | 5.2.1 离子键 共价键 课件(共46张PPT)2023-2024学年高一化学苏教版必修一 |

|
|
| 格式 | pptx | ||
| 文件大小 | 3.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-07 21:22:40 | ||
图片预览











文档简介
(共46张PPT)
专题5
第二单元 第1课时 离子键 共价键
素养 目标
1.了解化学键、离子键、共价键的概念,从微观角度分析宏观物质的形成过程,培养宏观辨识与微观探析的化学核心素养。
2.了解离子键的形成过程和形成条件,并能熟练运用电子式表示离子化合物的形成过程。
3.初步了解共价键的形成,能判断等电子体、分子中原子的8电子结构,加深对电子配对法的理解。
4.认识分子的电子式、结构式、球棍模型、空间填充模型。
基础落实·必备知识全过关
重难探究·能力素养全提升
学以致用·随堂检测全达标
目录索引
基础落实·必备知识全过关
自主梳理
1.离子键
(1)离子键与离子化合物
活泼金属与活泼非金属化合时, 易失去电子形成阳离子,
易得到电子形成阴离子,阴、阳离子通过 作用形成离子键。由 构成的化合物称为离子化合物。
(2)氯化钠的形成过程
钠原子与氯原子形成氯化钠的过程中,Na原子最外层的一个电子转移给氯原子,使得两者最外层都形成 的稳定结构。
微观角度
活泼金属
活泼非金属
静电
阴、阳离子
8电子
(3)电子式:在元素符号周围用“·”或“×”来表示原子的 的式子。
原子的电子式:在元素符号周围用小黑点表示 ,小黑点数目等于 ,如钠原子电子式为 ,氯原子电子式为 。
金属阳离子电子式:一般用 表示,如钠离子电子式为 ,镁离子电子式为 。
简单非金属阴离子一般形成稳定结构,在表示最外层电子数的小黑点外面再加 ,并标注出离子所带的负电荷数目,如Cl-的电子式为 。
氯化钠、氟化镁是离子化合物,其电子式分别为 、
。
最外层电子
最外层电子
最外层电子数
Na·
离子符号
Na+
Mg2+
[ ]
2.共价键
(1)共价键:原子间通过 形成的 的相互作用。分子中原子之间全部以 结合的分子称为共价分子。HCl、H2O、
CO2、N2的电子式分别为 。
用电子式表示H2O分子中共价键的形成过程: 。
用结构式表示共价分子HCl、H2O、N2: 。
(2)原子间只含有 键的化合物属于共价化合物。
(3)共价分子中各原子间有一定的连接方式,分子有一定的空间结构,可以用 模型、 模型表示共价分子的 。
共用电子对
强烈
共价键
H—Cl、H—O—H、N≡N
共价
球棍
空间填充
空间结构
自我检测
判断下列说法是否正确,正确的画“√”,错误的画“×”。
(1)物质中原子或离子之间存在的引力作用叫作化学键。( )
(2)金属和非金属原子之间强烈的静电作用称为离子键。( )
(3)金属原子和非金属原子形成的化合物称为离子化合物。( )
(4)含有共价键的物质称为共价化合物。( )
(5)原子间通过共用最外层上的电子,形成共用电子对,以达到稳定的电子层结构,这种通过共用电子对形成的强烈的相互作用称为共价键。( )
(6)共价分子均为共价化合物。( )
(7)共价分子中各原子最外层都达到8电子稳定结构。( )
(8)球棍模型、空间填充模型可以表示共价分子的空间结构。( )
×
×
×
×
√
×
×
√
重难探究·能力素养全提升
探究一 离子键、离子化合物
情境探究
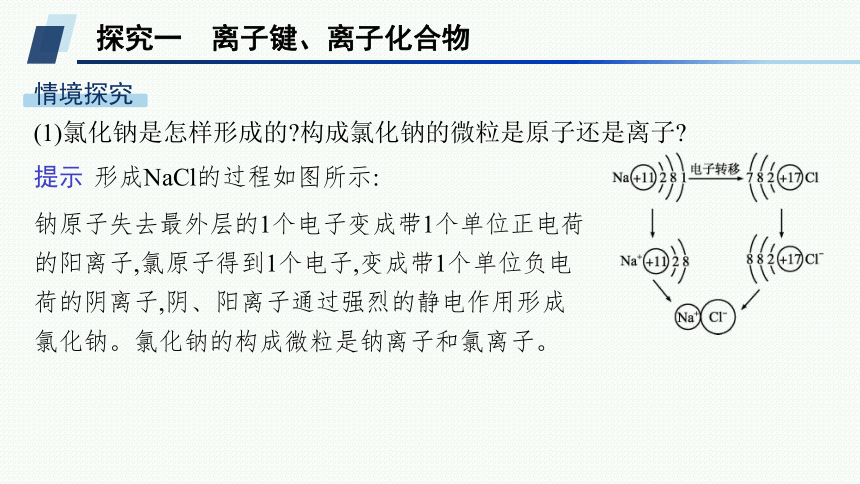
(1)氯化钠是怎样形成的 构成氯化钠的微粒是原子还是离子
提示 形成NaCl的过程如图所示:
钠原子失去最外层的1个电子变成带1个单位正电荷的阳离子,氯原子得到1个电子,变成带1个单位负电荷的阴离子,阴、阳离子通过强烈的静电作用形成氯化钠。氯化钠的构成微粒是钠离子和氯离子。
(2)什么是离子键 什么是离子化合物 离子化合物中一定含有离子键吗
提示 阴、阳离子通过强烈的静电作用形成离子键。含离子键的化合物称为离子化合物。离子化合物中一定含离子键。
知识归纳
1.离子键的影响因素
离子所带的电荷数越多,离子半径越小,则离子键越强。
2.离子键的形成条件
活泼金属与活泼的非金属化合时,一般形成离子键,从而形成离子化合物。
元素周期表中ⅠA族、ⅡA族的活泼金属与ⅥA族、ⅦA族的活泼非金属化合时,一般都能形成离子键。强碱及大多数的盐都含有离子键。
3.离子化合物与离子键的关系
三个“一定”:①离子化合物中一定含有离子键;②含有离子键的物质一定是离子化合物;③离子化合物中一定含有阴离子和阳离子。
两个“不一定”:①离子化合物中不一定含有金属元素,如NH4Cl、NH4NO3等;②含有金属元素的化合物不一定是离子化合物,如AlCl3。
应用体验
1.关于离子键的下列说法正确的是( )
A.阴、阳离子之间的相互吸引作用称为离子键
B.只有金属阳离子与其他阴离子之间才能形成离子键
C.含有离子键的物质一定是化合物
D.金属卤化物中一定含有离子键
C
解析 阴、阳离子之间的静电作用包括相互吸引和相互排斥两个方面,A项错误;并不只是金属阳离子与其他阴离子之间才能形成离子键,NH4Cl不含金属元素, 与Cl-之间也形成了离子键,B项错误;含离子键的物质一定含有阴、阳离子,至少含有两种元素,一定是化合物,C项正确;金属卤化物不一定含有离子键,D项错误。
易错警示 活泼金属与活泼非金属形成的化合物一般是离子化合物,其中含离子键,但AlCl3不属于离子化合物,不含离子键。
2.A元素原子的核电荷数为11,B元素的原子中质子数为8,A和B化合形成化合物Z,下列说法错误的是( )
A.A形成+1价阳离子
B.Z一定与水反应
C.Z一定是MO型离子化合物
D.Z中含有离子键
C
解析 A是Na,B是O,二者可以形成Na2O或Na2O2,Na2O和Na2O2均可以与水反应,均含有离子键,C项符合题目要求。
3.[2023河北保定定州第二中学高一月考]短周期主族元素X、Y、Z在元素周期表中的位置关系如图所示,X、Z两元素的原子核外电子数之和等于Y原子的质子数,下列说法正确的是( )
A.简单离子半径:Y>Z>X
B.最简单氢化物的稳定性:Z>X
C.元素的最高正化合价:Z>Y>X
D.仅由X和氢元素不可能形成离子化合物
X Z
Y
B
解析 短周期主族元素X、Y、Z在元素周期表中的位置关系如题图所示,设X质子数是x,则Y的质子数是x+9,Z的质子数是x+2,由于X、Z两元素的原子核外电子数之和等于Y原子的质子数,则x+x+2=x+9,解得x=7,因此X是N,Y是S,Z是F。
核外电子层数越多离子半径越大,核外电子排布相同时离子半径随原子序数的增大而减小,则简单离子半径:S2->N3->F-,A错误;非金属性越强,简单氢化物越稳定,非金属性:F>N,则最简单氢化物的稳定性:HF>NH3,B正确;F没有正价,则元素的最高正化合价:S>N>F,C错误;仅由N和氢元素能形成离子化合物,例如NH4H,D错误。
探究二 共价键和共价分子
情境探究
(1)什么是共价键 含共价键的物质就是共价分子吗
(2)共价分子中的原子都形成8电子稳定结构吗
提示 原子间通过共用电子对所形成的强烈的相互作用叫作共价键。含共价键的物质不一定是共价分子,某些离子化合物中也含共价键,如NaOH、CaCO3等。
提示 不是。例如共价分子中的氢原子不是8电子稳定结构。
(3)共价分子可以用结构式表示,用结构式表示时,所有电子对都用短线表示吗
(4)观察教材中的NH3和CH4的球棍模型,NH3、CH4分子的空间结构是什么形状
提示 不是。在结构式中,只有共用电子对用短线表示,其他电子对不能列出。
提示 NH3的空间结构是三角锥形,CH4分子的空间结构是正四面体形。
知识归纳
1.共价键与共价化合物
只含共价键的化合物属于共价化合物。共价化合物中一定含有共价键,一定不含离子键。含离子键的化合物一定是离子化合物,离子化合物中一定含有离子键,也可能含有共价键。
共价分子不一定是共价化合物,共价化合物也不一定是共价分子。如Cl2、H2属于共价分子,但不属于共价化合物;SiO2属于共价化合物,由于不是由分子构成,故不属于共价分子。
2.离子键与共价键的比较
类型 离子键 共价键
定义 阴、阳离子之间强烈的静电作用叫作离子键 原子之间通过共用电子对所形成的强烈的相互作用叫作共价键
成键粒子 阴、阳离子 原子
成键元素 一般是活泼金属元素与活泼非金属元素 一般是非金属元素原子之间
3.离子化合物与共价化合物的比较
类型 离子化合物 共价化合物
化学键 离子键或离子键与共价键 共价键
定义 由离子键构成的化合物叫作离子化合物 原子之间通过共用电子对形成的化合物叫作共价化合物
达到稳定 结构的途径 通过电子得失达到稳定结构 通过形成共用电子对达到稳定结构
构成微粒 阴、阳离子 原子
组成元素 一般为活泼金属元素与活泼非金属元素 一般为不同种非金属元素
类型 离子化合物 共价化合物
表示方法
应用体验
1.[2023河北邯郸高一期末]下列物质中,属于共价化合物的是( )
A.NH4Cl B.MgCl2
C.CO2 D.Cl2
C
解析 NH4Cl含离子键,属于离子化合物,故A错误;MgCl2含离子键,属于离子化合物,故B错误;CO2只含共价键,属于共价化合物,故C正确;Cl2只含共价键,属于单质,故D错误。
2.下列说法正确的是( )
A.含有共价键的物质一定是共价化合物
B.只含有共价键的物质一定是共价化合物
C.离子化合物中可能存在共价键
D.氦分子中含有共价键
C
解析 许多单质、离子化合物中含有共价键,A错误;只含有共价键的物质也可能是单质,B错误;离子化合物中可能含有共价键,C项正确;氦是单原子分子,不存在化学键,D项错误。
规律方法 共价键一般存在于非金属原子之间,离子化合物中若含有原子团,则一定含共价键;共价分子可能是单质,也可能是化合物;共价化合物中一定含有共价键。
3.下列各组物质中所含的化学键均只有共价键的是( )
A.NaCl和K2O2
B.HCl和H2O
C.HNO3与NH4NO3
D.K2SO4与SO3
B
解析 NaCl只含有离子键,K2O2含有离子键和共价键,A错误;HCl和H2O分子中只含有共价键,B正确;HNO3只含有共价键,NH4NO3含有离子键和共价键,C错误;K2SO4含有离子键和共价键,SO3中只含有共价键,D错误。
探究三 电子式、结构式、分子结构模型和分子空间结构
情境探究
(1)原子的电子式需要把原子中的电子都表示出来吗
提示 不需要。电子式中只表示出原子最外层的电子。常把原子最外层电
(2)离子的电子式都是用离子符号表示吗
提示 不一定。简单阳离子用阳离子符号表示,如Na+、Li+、Ca2+、Al3+等;但阴离子的电子式不但要画出最外层电子,而且还要用中括号“[ ]”括起
的离子符号表示;书写原子团的电子式时,不仅要画出各原子最外层电子数,而且还要用中括号“[ ]”括起来,并在右上角标出“n-”或“n+”电荷字样,如
(3)书写电子式时,离子化合物中相同的离子能否合并
(4)氯气和氮气的电子式如下,分子中为什么分别是单键和三键
提示 不能。离子化合物的电子式是由阳离子和带中括号的阴离子组成,简单的阳离子不写最外层电子,而阴离子要标明最外层电子;离子化合物中带同种电荷的离子相互排斥,故不能合并表示。
提示 氯气分子中,两个氯原子之间共用一对电子就能达到8电子稳定结构;氮气分子中,两个氮原子之间需要共用三对电子才能达到8电子稳定结构。
知识归纳
常见共价分子的表示方法
应用体验
1.化学用语是表示物质组成、结构和变化规律的一种具有国际性、科学性和规范性的书面语言,化学用语具有简便、确切地表达化学知识和化学科学思维的特点。下列化学用语表达正确的是( )
B
2.下列微粒的电子式错误的是( )
B
3.下列有关化学用语的表述正确的是( )
B
学以致用·随堂检测全达标
1
2
3
4
1.下列图示中的物质不是离子化合物的是( )
B
1
2
3
4
2.下列分子的电子式中,书写正确的是( )
C
1
2
3
4
解析 在氨分子电子式中,氮原子上的未成键电子对不能遗漏,A项错误;CCl4电子式中,氯原子上的未成键电子对不能遗漏,B项错误;CO2分子中,碳氧之间共用两对电子,D项错误。
1
2
3
4
3.[2023河北唐山乐亭第二中学高一期末]化学科学需要借助化学专用语言描述,下列有关化学用语正确的是( )
B
1
2
3
4
解析 HCl为共价化合物,选项错写成离子化合物形式的电子式,故A错误;Cl-的结构示意图正确,故B正确;HClO的结构式为H—O—Cl,故C错误;质量数为37的氯原子符号为 ,故D错误。
1
2
3
4
4.下列说法正确的是( )
A.含有离子键的化合物不一定是离子化合物
B.含有共价键的化合物就是共价化合物
C.共价化合物可能含有离子键
D.含有离子键的化合物一定是离子化合物
D
解析 含有离子键的化合物必是离子化合物,A项错误;离子化合物中可能含有共价键,如氢氧化钠中含共价键,B项错误;共价化合物中一定不含离子键,C项错误。
本 课 结 束
专题5
第二单元 第1课时 离子键 共价键
素养 目标
1.了解化学键、离子键、共价键的概念,从微观角度分析宏观物质的形成过程,培养宏观辨识与微观探析的化学核心素养。
2.了解离子键的形成过程和形成条件,并能熟练运用电子式表示离子化合物的形成过程。
3.初步了解共价键的形成,能判断等电子体、分子中原子的8电子结构,加深对电子配对法的理解。
4.认识分子的电子式、结构式、球棍模型、空间填充模型。
基础落实·必备知识全过关
重难探究·能力素养全提升
学以致用·随堂检测全达标
目录索引
基础落实·必备知识全过关
自主梳理
1.离子键
(1)离子键与离子化合物
活泼金属与活泼非金属化合时, 易失去电子形成阳离子,
易得到电子形成阴离子,阴、阳离子通过 作用形成离子键。由 构成的化合物称为离子化合物。
(2)氯化钠的形成过程
钠原子与氯原子形成氯化钠的过程中,Na原子最外层的一个电子转移给氯原子,使得两者最外层都形成 的稳定结构。
微观角度
活泼金属
活泼非金属
静电
阴、阳离子
8电子
(3)电子式:在元素符号周围用“·”或“×”来表示原子的 的式子。
原子的电子式:在元素符号周围用小黑点表示 ,小黑点数目等于 ,如钠原子电子式为 ,氯原子电子式为 。
金属阳离子电子式:一般用 表示,如钠离子电子式为 ,镁离子电子式为 。
简单非金属阴离子一般形成稳定结构,在表示最外层电子数的小黑点外面再加 ,并标注出离子所带的负电荷数目,如Cl-的电子式为 。
氯化钠、氟化镁是离子化合物,其电子式分别为 、
。
最外层电子
最外层电子
最外层电子数
Na·
离子符号
Na+
Mg2+
[ ]
2.共价键
(1)共价键:原子间通过 形成的 的相互作用。分子中原子之间全部以 结合的分子称为共价分子。HCl、H2O、
CO2、N2的电子式分别为 。
用电子式表示H2O分子中共价键的形成过程: 。
用结构式表示共价分子HCl、H2O、N2: 。
(2)原子间只含有 键的化合物属于共价化合物。
(3)共价分子中各原子间有一定的连接方式,分子有一定的空间结构,可以用 模型、 模型表示共价分子的 。
共用电子对
强烈
共价键
H—Cl、H—O—H、N≡N
共价
球棍
空间填充
空间结构
自我检测
判断下列说法是否正确,正确的画“√”,错误的画“×”。
(1)物质中原子或离子之间存在的引力作用叫作化学键。( )
(2)金属和非金属原子之间强烈的静电作用称为离子键。( )
(3)金属原子和非金属原子形成的化合物称为离子化合物。( )
(4)含有共价键的物质称为共价化合物。( )
(5)原子间通过共用最外层上的电子,形成共用电子对,以达到稳定的电子层结构,这种通过共用电子对形成的强烈的相互作用称为共价键。( )
(6)共价分子均为共价化合物。( )
(7)共价分子中各原子最外层都达到8电子稳定结构。( )
(8)球棍模型、空间填充模型可以表示共价分子的空间结构。( )
×
×
×
×
√
×
×
√
重难探究·能力素养全提升
探究一 离子键、离子化合物
情境探究
(1)氯化钠是怎样形成的 构成氯化钠的微粒是原子还是离子
提示 形成NaCl的过程如图所示:
钠原子失去最外层的1个电子变成带1个单位正电荷的阳离子,氯原子得到1个电子,变成带1个单位负电荷的阴离子,阴、阳离子通过强烈的静电作用形成氯化钠。氯化钠的构成微粒是钠离子和氯离子。
(2)什么是离子键 什么是离子化合物 离子化合物中一定含有离子键吗
提示 阴、阳离子通过强烈的静电作用形成离子键。含离子键的化合物称为离子化合物。离子化合物中一定含离子键。
知识归纳
1.离子键的影响因素
离子所带的电荷数越多,离子半径越小,则离子键越强。
2.离子键的形成条件
活泼金属与活泼的非金属化合时,一般形成离子键,从而形成离子化合物。
元素周期表中ⅠA族、ⅡA族的活泼金属与ⅥA族、ⅦA族的活泼非金属化合时,一般都能形成离子键。强碱及大多数的盐都含有离子键。
3.离子化合物与离子键的关系
三个“一定”:①离子化合物中一定含有离子键;②含有离子键的物质一定是离子化合物;③离子化合物中一定含有阴离子和阳离子。
两个“不一定”:①离子化合物中不一定含有金属元素,如NH4Cl、NH4NO3等;②含有金属元素的化合物不一定是离子化合物,如AlCl3。
应用体验
1.关于离子键的下列说法正确的是( )
A.阴、阳离子之间的相互吸引作用称为离子键
B.只有金属阳离子与其他阴离子之间才能形成离子键
C.含有离子键的物质一定是化合物
D.金属卤化物中一定含有离子键
C
解析 阴、阳离子之间的静电作用包括相互吸引和相互排斥两个方面,A项错误;并不只是金属阳离子与其他阴离子之间才能形成离子键,NH4Cl不含金属元素, 与Cl-之间也形成了离子键,B项错误;含离子键的物质一定含有阴、阳离子,至少含有两种元素,一定是化合物,C项正确;金属卤化物不一定含有离子键,D项错误。
易错警示 活泼金属与活泼非金属形成的化合物一般是离子化合物,其中含离子键,但AlCl3不属于离子化合物,不含离子键。
2.A元素原子的核电荷数为11,B元素的原子中质子数为8,A和B化合形成化合物Z,下列说法错误的是( )
A.A形成+1价阳离子
B.Z一定与水反应
C.Z一定是MO型离子化合物
D.Z中含有离子键
C
解析 A是Na,B是O,二者可以形成Na2O或Na2O2,Na2O和Na2O2均可以与水反应,均含有离子键,C项符合题目要求。
3.[2023河北保定定州第二中学高一月考]短周期主族元素X、Y、Z在元素周期表中的位置关系如图所示,X、Z两元素的原子核外电子数之和等于Y原子的质子数,下列说法正确的是( )
A.简单离子半径:Y>Z>X
B.最简单氢化物的稳定性:Z>X
C.元素的最高正化合价:Z>Y>X
D.仅由X和氢元素不可能形成离子化合物
X Z
Y
B
解析 短周期主族元素X、Y、Z在元素周期表中的位置关系如题图所示,设X质子数是x,则Y的质子数是x+9,Z的质子数是x+2,由于X、Z两元素的原子核外电子数之和等于Y原子的质子数,则x+x+2=x+9,解得x=7,因此X是N,Y是S,Z是F。
核外电子层数越多离子半径越大,核外电子排布相同时离子半径随原子序数的增大而减小,则简单离子半径:S2->N3->F-,A错误;非金属性越强,简单氢化物越稳定,非金属性:F>N,则最简单氢化物的稳定性:HF>NH3,B正确;F没有正价,则元素的最高正化合价:S>N>F,C错误;仅由N和氢元素能形成离子化合物,例如NH4H,D错误。
探究二 共价键和共价分子
情境探究
(1)什么是共价键 含共价键的物质就是共价分子吗
(2)共价分子中的原子都形成8电子稳定结构吗
提示 原子间通过共用电子对所形成的强烈的相互作用叫作共价键。含共价键的物质不一定是共价分子,某些离子化合物中也含共价键,如NaOH、CaCO3等。
提示 不是。例如共价分子中的氢原子不是8电子稳定结构。
(3)共价分子可以用结构式表示,用结构式表示时,所有电子对都用短线表示吗
(4)观察教材中的NH3和CH4的球棍模型,NH3、CH4分子的空间结构是什么形状
提示 不是。在结构式中,只有共用电子对用短线表示,其他电子对不能列出。
提示 NH3的空间结构是三角锥形,CH4分子的空间结构是正四面体形。
知识归纳
1.共价键与共价化合物
只含共价键的化合物属于共价化合物。共价化合物中一定含有共价键,一定不含离子键。含离子键的化合物一定是离子化合物,离子化合物中一定含有离子键,也可能含有共价键。
共价分子不一定是共价化合物,共价化合物也不一定是共价分子。如Cl2、H2属于共价分子,但不属于共价化合物;SiO2属于共价化合物,由于不是由分子构成,故不属于共价分子。
2.离子键与共价键的比较
类型 离子键 共价键
定义 阴、阳离子之间强烈的静电作用叫作离子键 原子之间通过共用电子对所形成的强烈的相互作用叫作共价键
成键粒子 阴、阳离子 原子
成键元素 一般是活泼金属元素与活泼非金属元素 一般是非金属元素原子之间
3.离子化合物与共价化合物的比较
类型 离子化合物 共价化合物
化学键 离子键或离子键与共价键 共价键
定义 由离子键构成的化合物叫作离子化合物 原子之间通过共用电子对形成的化合物叫作共价化合物
达到稳定 结构的途径 通过电子得失达到稳定结构 通过形成共用电子对达到稳定结构
构成微粒 阴、阳离子 原子
组成元素 一般为活泼金属元素与活泼非金属元素 一般为不同种非金属元素
类型 离子化合物 共价化合物
表示方法
应用体验
1.[2023河北邯郸高一期末]下列物质中,属于共价化合物的是( )
A.NH4Cl B.MgCl2
C.CO2 D.Cl2
C
解析 NH4Cl含离子键,属于离子化合物,故A错误;MgCl2含离子键,属于离子化合物,故B错误;CO2只含共价键,属于共价化合物,故C正确;Cl2只含共价键,属于单质,故D错误。
2.下列说法正确的是( )
A.含有共价键的物质一定是共价化合物
B.只含有共价键的物质一定是共价化合物
C.离子化合物中可能存在共价键
D.氦分子中含有共价键
C
解析 许多单质、离子化合物中含有共价键,A错误;只含有共价键的物质也可能是单质,B错误;离子化合物中可能含有共价键,C项正确;氦是单原子分子,不存在化学键,D项错误。
规律方法 共价键一般存在于非金属原子之间,离子化合物中若含有原子团,则一定含共价键;共价分子可能是单质,也可能是化合物;共价化合物中一定含有共价键。
3.下列各组物质中所含的化学键均只有共价键的是( )
A.NaCl和K2O2
B.HCl和H2O
C.HNO3与NH4NO3
D.K2SO4与SO3
B
解析 NaCl只含有离子键,K2O2含有离子键和共价键,A错误;HCl和H2O分子中只含有共价键,B正确;HNO3只含有共价键,NH4NO3含有离子键和共价键,C错误;K2SO4含有离子键和共价键,SO3中只含有共价键,D错误。
探究三 电子式、结构式、分子结构模型和分子空间结构
情境探究
(1)原子的电子式需要把原子中的电子都表示出来吗
提示 不需要。电子式中只表示出原子最外层的电子。常把原子最外层电
(2)离子的电子式都是用离子符号表示吗
提示 不一定。简单阳离子用阳离子符号表示,如Na+、Li+、Ca2+、Al3+等;但阴离子的电子式不但要画出最外层电子,而且还要用中括号“[ ]”括起
的离子符号表示;书写原子团的电子式时,不仅要画出各原子最外层电子数,而且还要用中括号“[ ]”括起来,并在右上角标出“n-”或“n+”电荷字样,如
(3)书写电子式时,离子化合物中相同的离子能否合并
(4)氯气和氮气的电子式如下,分子中为什么分别是单键和三键
提示 不能。离子化合物的电子式是由阳离子和带中括号的阴离子组成,简单的阳离子不写最外层电子,而阴离子要标明最外层电子;离子化合物中带同种电荷的离子相互排斥,故不能合并表示。
提示 氯气分子中,两个氯原子之间共用一对电子就能达到8电子稳定结构;氮气分子中,两个氮原子之间需要共用三对电子才能达到8电子稳定结构。
知识归纳
常见共价分子的表示方法
应用体验
1.化学用语是表示物质组成、结构和变化规律的一种具有国际性、科学性和规范性的书面语言,化学用语具有简便、确切地表达化学知识和化学科学思维的特点。下列化学用语表达正确的是( )
B
2.下列微粒的电子式错误的是( )
B
3.下列有关化学用语的表述正确的是( )
B
学以致用·随堂检测全达标
1
2
3
4
1.下列图示中的物质不是离子化合物的是( )
B
1
2
3
4
2.下列分子的电子式中,书写正确的是( )
C
1
2
3
4
解析 在氨分子电子式中,氮原子上的未成键电子对不能遗漏,A项错误;CCl4电子式中,氯原子上的未成键电子对不能遗漏,B项错误;CO2分子中,碳氧之间共用两对电子,D项错误。
1
2
3
4
3.[2023河北唐山乐亭第二中学高一期末]化学科学需要借助化学专用语言描述,下列有关化学用语正确的是( )
B
1
2
3
4
解析 HCl为共价化合物,选项错写成离子化合物形式的电子式,故A错误;Cl-的结构示意图正确,故B正确;HClO的结构式为H—O—Cl,故C错误;质量数为37的氯原子符号为 ,故D错误。
1
2
3
4
4.下列说法正确的是( )
A.含有离子键的化合物不一定是离子化合物
B.含有共价键的化合物就是共价化合物
C.共价化合物可能含有离子键
D.含有离子键的化合物一定是离子化合物
D
解析 含有离子键的化合物必是离子化合物,A项错误;离子化合物中可能含有共价键,如氢氧化钠中含共价键,B项错误;共价化合物中一定不含离子键,C项错误。
本 课 结 束
