3.3.1 粗盐提纯 从海水中提取溴 课件(共31张PPT)2023-2024学年高一化学苏教版必修一
文档属性
| 名称 | 3.3.1 粗盐提纯 从海水中提取溴 课件(共31张PPT)2023-2024学年高一化学苏教版必修一 |  | |
| 格式 | pptx | ||
| 文件大小 | 2.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-07 21:23:57 | ||
图片预览










文档简介
(共31张PPT)
专题3
第三单元 第1课时 粗盐提纯 从海水中提取溴
素养 目标
1.了解物质分离提纯的物理方法,了解化学沉淀法去除粗盐中杂质离子的原理与方法,培养科学探究与创新意识的核心素养。
2.了解从海水中提取溴单质的基本原理和方法,了解溴在生产、生活中的应用。
3.认识物质及其转化在海洋资源综合利用和环境保护中的重要价值。
基础落实·必备知识全过关
重难探究·能力素养全提升
学以致用·随堂检测全达标
目录索引
基础落实·必备知识全过关
自主梳理
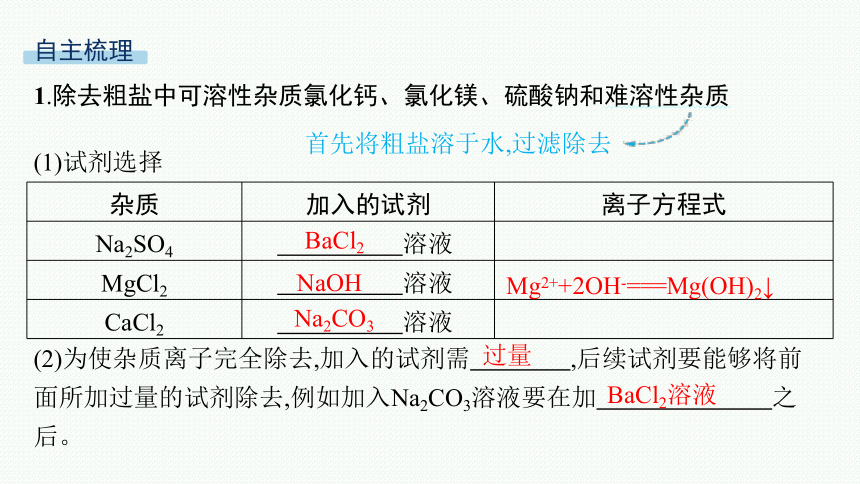
1.除去粗盐中可溶性杂质氯化钙、氯化镁、硫酸钠和难溶性杂质
首先将粗盐溶于水,过滤除去
(1)试剂选择
杂质 加入的试剂 离子方程式
Na2SO4 溶液
MgCl2 溶液
CaCl2 溶液
(2)为使杂质离子完全除去,加入的试剂需 ,后续试剂要能够将前面所加过量的试剂除去,例如加入Na2CO3溶液要在加 之后。
BaCl2
NaOH
Mg2++2OH-===Mg(OH)2↓
Na2CO3
过量
BaCl2溶液
2.提溴基本原理与操作
(1)主要原理: 。
(2)生成的溴单质用热空气或水蒸气吹出,利用了溴的 性。
(3)变色玻璃的变色原理: ,
。
Cl2+2Br-===Br2+2Cl-
挥发
2AgBr 2Ag+Br2
===
光
2Ag+Br2 2AgBr
===
CuO
自我检测
判断下列说法是否正确,正确的画“√”,错误的画“×”。
(1)海洋是一个巨大的宝库,海水是一种取之不尽的资源。( )
(2)通过海水晒盐获得的粗盐可直接食用,但不能直接用于工业生产。
( )
(3)提纯粗盐时先将粗盐溶于水,再依次加入碳酸钠、氢氧化钠、氯化钡溶液,过滤,可除去其中的可溶性杂质。( )
(4)粗盐提纯过程中加入过量饱和碳酸钠溶液的目的是将溶液中的钙离子完全除去。( )
(5)工业上海水提溴是向海水中通入氯气,置换出溴单质。( )
(6)溴化银可用作医疗上X射线胶片上的感光剂。( )
(7)变色玻璃中常加入少量的溴化银、氧化铜。( )
√
×
×
×
×
√
√
重难探究·能力素养全提升
探究一 粗盐精制
情境探究
(1)下面是粗盐提纯实验加入试剂(均为溶液)的顺序:
过滤一般在哪一步之前进行 为什么
提示 过滤一般在加入盐酸之前进行,防止生成的沉淀被盐酸部分溶解。
(2)加入的三种试剂均需稍过量,碳酸钠溶液稍过量的作用是什么 最后加入盐酸的目的是什么
(3)怎样检验溶液中是否含有 、Cl-
提示 将溶液中的钙离子和过量的钡离子完全除去;加入盐酸可除去过量的氢氧化钠和碳酸钠。
提示 检验 的方法是先加入适量的盐酸(排除Ag+、 的干扰),若出现沉淀,则应过滤,保留滤液,滤出沉淀;向滤液中或未出现白色沉淀的溶液中加入BaCl2溶液,观察是否有白色沉淀生成,若产生白色沉淀,可证明溶液中含 。检验Cl-的方法是滴加稀硝酸和硝酸银溶液,观察是否有白色沉淀生成,若产生白色沉淀,证明溶液中含有Cl-。
知识归纳
1.物质分离提纯的基本原则与注意事项
基本原则:(1)不增(不引入新杂质);(2)不减(不减少被提纯物质);(3)易分离(被提纯物与杂质易分离);(4)易复原(被提纯物易复原)。
注意事项:(1)除杂试剂要过量;(2)过量试剂要除尽;(3)去除多种杂质时要考虑加入试剂的顺序;(4)选择最佳的除杂途径。
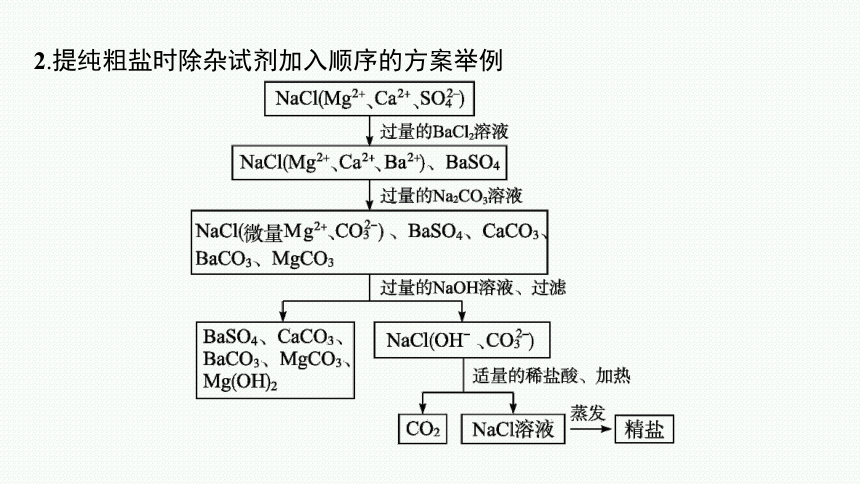
2.提纯粗盐时除杂试剂加入顺序的方案举例
应用体验
1.下列除去粗盐中可溶性杂质(主要杂质为Ca2+、Mg2+、 )的试剂加入顺序正确的是( )
A.BaCl2、NaOH、盐酸、Na2CO3
B.Na2CO3、NaOH、BaCl2、盐酸
C.NaOH、BaCl2、Na2CO3、盐酸
D.BaCl2、Na2CO3、盐酸、NaOH
C
方法点拨 氯化镁和氢氧化钠反应生成氢氧化镁沉淀和氯化钠;氯化钙和碳酸钠反应生成碳酸钙沉淀和氯化钠;硫酸钠和氯化钡反应生成硫酸钡沉淀和氯化钠;碳酸钠和过量的氯化钡反应生成碳酸钡沉淀和氯化钠;稀盐酸和氢氧化钠反应生成氯化钠和水,和碳酸钠反应生成氯化钠、水和二氧化碳。Na2CO3溶液必须在BaCl2溶液后面加入。
【变式设问】
粗盐中除了含有泥沙之外还含有Ca2+、Mg2+、S等杂质,从粗盐获得精盐的一般步骤如下:
加入的试剂①、②分别是: 、 。
答案 BaCl2溶液 Na2CO3溶液
解析 加入氢氧化钠溶液可以除去溶液中的镁离子,加入另外两种试剂的目的是除去钙离子和硫酸根离子,加入氯化钡溶液可除去硫酸根离子,加入碳酸钠溶液可除去钙离子,过量的钡离子需要通过碳酸钠溶液除去,所以碳酸钠溶液必须在氯化钡溶液之后加入。
2.通过海水晾晒可得粗盐,粗盐除NaCl外,还含有MgCl2、CaCl2、Na2SO4以及泥沙等杂质,粗盐精制的实验流程如图。下列说法不正确的是( )
A.在第①步中使用玻璃棒搅拌可加速粗盐溶解
B.流程图中的系列操作用到的主要仪器有玻璃棒、烧杯、漏斗、蒸发皿
C.在第②③④⑥步通过加入化学试剂除杂,试剂②可能是Na2CO3溶液
D.除去Mg2+涉及离子反应Mg2++2OH-===Mg(OH)2↓
C
解析 第①步是溶解,使用玻璃棒搅拌可加速粗盐溶解,故A正确;流程图中的系列操作包括过滤、蒸发、结晶等,用到的主要仪器有玻璃棒、烧杯、漏斗、蒸发皿,故B正确;用氢氧化钠除MgCl2,用氯化钡除Na2SO4,用碳酸钠除CaCl2和过量的氯化钡,过滤后用盐酸除去氢氧化钠、碳酸钠,所以要在加入氯化钡溶液后加碳酸钠,试剂②不可能是Na2CO3溶液,故C错误;除去Mg2+涉及离子反应Mg2++2OH-===Mg(OH)2↓,故D正确。
探究二 海水提溴
情境探究
利用下列流程可提取海水中的溴:
(1)从海水中提取溴,通常是将氯气通入提取食盐后的母液中,为什么不直接将氯气通入海水中
提示 海水中溴离子浓度小,提取氯化钠后的母液中溴离子浓度相对较大。
(2)如何将母液中的Br-转化成溴单质 写出反应的化学方程式。鼓入热空气或水蒸气的目的是什么
提示 通入氯气,将溴离子氧化为溴单质,2NaBr+Cl2===2NaCl+Br2;鼓入热空气或水蒸气的目的是使溴挥发出来,通过冷凝得到粗溴。
知识归纳
流程中涉及的反应原理如下。
氧化:Cl2+2Br-===2Cl-+Br2
吹出:用空气或水蒸气将Br2吹出
吸收:SO2+2H2O+Br2===H2SO4+2HBr(富集溴元素)
氧化:Cl2+2Br-===2Cl-+Br2
应用体验
1.海水是巨大的资源宝库,从海水中提取食盐和溴的生产流程如图所示:
(1)请列举海水淡化的一种方法: 。
(2)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,其目的是 。
(3)步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,该反应的离子方程式为 ,
由此反应可知,除保护环境外,在工业生产中还应解决的问题是 。
答案 (1)蒸馏法(或反渗透法、电渗析法等其他合理答案)
(2)富集Br2,提高Br2的浓度
(3)SO2+2H2O+Br2===4H++2Br-+ 强酸和溴对设备的腐蚀
解析 步骤Ⅰ所得溶液中Br2的浓度很小,将Br2吹出后再用SO2吸收,最终用Cl2处理,可富集溴。溴具有强氧化性,可以氧化SO2生成H2SO4,因此还要注意强酸和溴对设备的腐蚀问题。
2.海水中溴的储藏量丰富,含量约为67 mg·L-1。其工业提取方法有:
(1)空气吹出纯碱吸收法。方法是将氯气通入富含溴离子的海水中,把溴置换出来,再用空气将溴吹出,用纯碱溶液吸收,最后用硫酸酸化,即可得到溴单质。该方法涉及的反应有①
+6H+===3Br2+3H2O。其中反应②中氧化剂是 ;还原剂是 。
(2)空气吹出SO2吸收法。该方法基本同(1),只是将溴吹出后是用SO2来吸收的,使溴转化为氢溴酸,然后再用氯气氧化氢溴酸即得单质溴。
(3)溶剂萃取法。该法是利用单质溴在水中和有机溶剂中溶解度的不同进行提取的。实验室中萃取实验用到的仪器名称是 。下列可以用于萃取溴的溶剂是 (填序号)。
①乙醇
②四氯化碳
③硝酸
答案 (1)Cl2+2Br-===2Cl-+Br2 Br2 Br2 (3)分液漏斗 ②
解析 工业上提取溴的反应原理是:将氯气通入富含溴离子的海水中,把溴置换出来,然后被某些溶液吸收,再提纯即可得到成品溴。方法(3)是利用有机溶剂萃取出溴,①③与水互溶,萃取溴的溶剂只能是②四氯化碳。
学以致用·随堂检测全达标
1
2
3
1.“关注海洋健康,守护蔚蓝星球”,是我们每个公民义不容辞的责任。下列有关说法不正确的是( )
A.可通过蒸馏法、反渗透法、电渗析法从海水中获得淡水
B.地球上约99%的溴元素存在于海洋中,溴有“海洋元素”之称
C.从海水中提取的NaCl可进一步用于生产NaOH
D.海水只能提供物质资源,不能提供能量资源
D
1
2
3
解析 海水中含有丰富的资源,从海水中得到淡水的方法有蒸馏法、反渗透法、电渗析法等,故A正确;地球上约99%的溴元素存在于海水中,所以人们也把溴称为“海洋元素”,故B正确;从海水中能提取氯化钠,电解饱和氯化钠溶液可以制得氢氧化钠,故C正确;海洋资源指的是与海水水体及海底、海面本身有着直接关系的物质和能量,海水既能提供物质资源,也能提供能量资源,如波浪、潮汐、潮流等会产生能量,故D错误。
1
2
3
2.下列关于粗盐提纯的说法正确的是( )
A.溶解粗盐时,应尽量让溶液稀些,防止食盐不完全溶解
B.滤去不溶性杂质后,将滤液移至坩埚内加热浓缩
C.当蒸发到剩余少量液体时停止加热,利用余热将液体蒸干
D.将制得的晶体转移到新制过滤器中用大量水进行洗涤
C
1
2
3
3.海水中溴含量为67 mg·L-1。实验室模拟海水中溴的提取。实验方法:将适量新制氯水加入20 mL富含溴离子的海水中(海水可以用0.1 mol·L-1的NaBr溶液代替),把溴置换出来。氯水中的氯气是 剂,反应的离子方程式为 。得到的单质溴可以用有机溶剂萃取富集,得到的有机层显 色。
答案 氧化 Cl2+2Br-===2Cl-+Br2 橙红
解析 把溴离子转化为溴单质时,溴离子发生氧化反应,因此需要氧化剂,氯气可以将Br-氧化为Br2,反应的离子方程式为Cl2+2Br-===2Cl-+Br2。溴单质在有机溶剂中的颜色是橙红色。
本 课 结 束
专题3
第三单元 第1课时 粗盐提纯 从海水中提取溴
素养 目标
1.了解物质分离提纯的物理方法,了解化学沉淀法去除粗盐中杂质离子的原理与方法,培养科学探究与创新意识的核心素养。
2.了解从海水中提取溴单质的基本原理和方法,了解溴在生产、生活中的应用。
3.认识物质及其转化在海洋资源综合利用和环境保护中的重要价值。
基础落实·必备知识全过关
重难探究·能力素养全提升
学以致用·随堂检测全达标
目录索引
基础落实·必备知识全过关
自主梳理
1.除去粗盐中可溶性杂质氯化钙、氯化镁、硫酸钠和难溶性杂质
首先将粗盐溶于水,过滤除去
(1)试剂选择
杂质 加入的试剂 离子方程式
Na2SO4 溶液
MgCl2 溶液
CaCl2 溶液
(2)为使杂质离子完全除去,加入的试剂需 ,后续试剂要能够将前面所加过量的试剂除去,例如加入Na2CO3溶液要在加 之后。
BaCl2
NaOH
Mg2++2OH-===Mg(OH)2↓
Na2CO3
过量
BaCl2溶液
2.提溴基本原理与操作
(1)主要原理: 。
(2)生成的溴单质用热空气或水蒸气吹出,利用了溴的 性。
(3)变色玻璃的变色原理: ,
。
Cl2+2Br-===Br2+2Cl-
挥发
2AgBr 2Ag+Br2
===
光
2Ag+Br2 2AgBr
===
CuO
自我检测
判断下列说法是否正确,正确的画“√”,错误的画“×”。
(1)海洋是一个巨大的宝库,海水是一种取之不尽的资源。( )
(2)通过海水晒盐获得的粗盐可直接食用,但不能直接用于工业生产。
( )
(3)提纯粗盐时先将粗盐溶于水,再依次加入碳酸钠、氢氧化钠、氯化钡溶液,过滤,可除去其中的可溶性杂质。( )
(4)粗盐提纯过程中加入过量饱和碳酸钠溶液的目的是将溶液中的钙离子完全除去。( )
(5)工业上海水提溴是向海水中通入氯气,置换出溴单质。( )
(6)溴化银可用作医疗上X射线胶片上的感光剂。( )
(7)变色玻璃中常加入少量的溴化银、氧化铜。( )
√
×
×
×
×
√
√
重难探究·能力素养全提升
探究一 粗盐精制
情境探究
(1)下面是粗盐提纯实验加入试剂(均为溶液)的顺序:
过滤一般在哪一步之前进行 为什么
提示 过滤一般在加入盐酸之前进行,防止生成的沉淀被盐酸部分溶解。
(2)加入的三种试剂均需稍过量,碳酸钠溶液稍过量的作用是什么 最后加入盐酸的目的是什么
(3)怎样检验溶液中是否含有 、Cl-
提示 将溶液中的钙离子和过量的钡离子完全除去;加入盐酸可除去过量的氢氧化钠和碳酸钠。
提示 检验 的方法是先加入适量的盐酸(排除Ag+、 的干扰),若出现沉淀,则应过滤,保留滤液,滤出沉淀;向滤液中或未出现白色沉淀的溶液中加入BaCl2溶液,观察是否有白色沉淀生成,若产生白色沉淀,可证明溶液中含 。检验Cl-的方法是滴加稀硝酸和硝酸银溶液,观察是否有白色沉淀生成,若产生白色沉淀,证明溶液中含有Cl-。
知识归纳
1.物质分离提纯的基本原则与注意事项
基本原则:(1)不增(不引入新杂质);(2)不减(不减少被提纯物质);(3)易分离(被提纯物与杂质易分离);(4)易复原(被提纯物易复原)。
注意事项:(1)除杂试剂要过量;(2)过量试剂要除尽;(3)去除多种杂质时要考虑加入试剂的顺序;(4)选择最佳的除杂途径。
2.提纯粗盐时除杂试剂加入顺序的方案举例
应用体验
1.下列除去粗盐中可溶性杂质(主要杂质为Ca2+、Mg2+、 )的试剂加入顺序正确的是( )
A.BaCl2、NaOH、盐酸、Na2CO3
B.Na2CO3、NaOH、BaCl2、盐酸
C.NaOH、BaCl2、Na2CO3、盐酸
D.BaCl2、Na2CO3、盐酸、NaOH
C
方法点拨 氯化镁和氢氧化钠反应生成氢氧化镁沉淀和氯化钠;氯化钙和碳酸钠反应生成碳酸钙沉淀和氯化钠;硫酸钠和氯化钡反应生成硫酸钡沉淀和氯化钠;碳酸钠和过量的氯化钡反应生成碳酸钡沉淀和氯化钠;稀盐酸和氢氧化钠反应生成氯化钠和水,和碳酸钠反应生成氯化钠、水和二氧化碳。Na2CO3溶液必须在BaCl2溶液后面加入。
【变式设问】
粗盐中除了含有泥沙之外还含有Ca2+、Mg2+、S等杂质,从粗盐获得精盐的一般步骤如下:
加入的试剂①、②分别是: 、 。
答案 BaCl2溶液 Na2CO3溶液
解析 加入氢氧化钠溶液可以除去溶液中的镁离子,加入另外两种试剂的目的是除去钙离子和硫酸根离子,加入氯化钡溶液可除去硫酸根离子,加入碳酸钠溶液可除去钙离子,过量的钡离子需要通过碳酸钠溶液除去,所以碳酸钠溶液必须在氯化钡溶液之后加入。
2.通过海水晾晒可得粗盐,粗盐除NaCl外,还含有MgCl2、CaCl2、Na2SO4以及泥沙等杂质,粗盐精制的实验流程如图。下列说法不正确的是( )
A.在第①步中使用玻璃棒搅拌可加速粗盐溶解
B.流程图中的系列操作用到的主要仪器有玻璃棒、烧杯、漏斗、蒸发皿
C.在第②③④⑥步通过加入化学试剂除杂,试剂②可能是Na2CO3溶液
D.除去Mg2+涉及离子反应Mg2++2OH-===Mg(OH)2↓
C
解析 第①步是溶解,使用玻璃棒搅拌可加速粗盐溶解,故A正确;流程图中的系列操作包括过滤、蒸发、结晶等,用到的主要仪器有玻璃棒、烧杯、漏斗、蒸发皿,故B正确;用氢氧化钠除MgCl2,用氯化钡除Na2SO4,用碳酸钠除CaCl2和过量的氯化钡,过滤后用盐酸除去氢氧化钠、碳酸钠,所以要在加入氯化钡溶液后加碳酸钠,试剂②不可能是Na2CO3溶液,故C错误;除去Mg2+涉及离子反应Mg2++2OH-===Mg(OH)2↓,故D正确。
探究二 海水提溴
情境探究
利用下列流程可提取海水中的溴:
(1)从海水中提取溴,通常是将氯气通入提取食盐后的母液中,为什么不直接将氯气通入海水中
提示 海水中溴离子浓度小,提取氯化钠后的母液中溴离子浓度相对较大。
(2)如何将母液中的Br-转化成溴单质 写出反应的化学方程式。鼓入热空气或水蒸气的目的是什么
提示 通入氯气,将溴离子氧化为溴单质,2NaBr+Cl2===2NaCl+Br2;鼓入热空气或水蒸气的目的是使溴挥发出来,通过冷凝得到粗溴。
知识归纳
流程中涉及的反应原理如下。
氧化:Cl2+2Br-===2Cl-+Br2
吹出:用空气或水蒸气将Br2吹出
吸收:SO2+2H2O+Br2===H2SO4+2HBr(富集溴元素)
氧化:Cl2+2Br-===2Cl-+Br2
应用体验
1.海水是巨大的资源宝库,从海水中提取食盐和溴的生产流程如图所示:
(1)请列举海水淡化的一种方法: 。
(2)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,其目的是 。
(3)步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,该反应的离子方程式为 ,
由此反应可知,除保护环境外,在工业生产中还应解决的问题是 。
答案 (1)蒸馏法(或反渗透法、电渗析法等其他合理答案)
(2)富集Br2,提高Br2的浓度
(3)SO2+2H2O+Br2===4H++2Br-+ 强酸和溴对设备的腐蚀
解析 步骤Ⅰ所得溶液中Br2的浓度很小,将Br2吹出后再用SO2吸收,最终用Cl2处理,可富集溴。溴具有强氧化性,可以氧化SO2生成H2SO4,因此还要注意强酸和溴对设备的腐蚀问题。
2.海水中溴的储藏量丰富,含量约为67 mg·L-1。其工业提取方法有:
(1)空气吹出纯碱吸收法。方法是将氯气通入富含溴离子的海水中,把溴置换出来,再用空气将溴吹出,用纯碱溶液吸收,最后用硫酸酸化,即可得到溴单质。该方法涉及的反应有①
+6H+===3Br2+3H2O。其中反应②中氧化剂是 ;还原剂是 。
(2)空气吹出SO2吸收法。该方法基本同(1),只是将溴吹出后是用SO2来吸收的,使溴转化为氢溴酸,然后再用氯气氧化氢溴酸即得单质溴。
(3)溶剂萃取法。该法是利用单质溴在水中和有机溶剂中溶解度的不同进行提取的。实验室中萃取实验用到的仪器名称是 。下列可以用于萃取溴的溶剂是 (填序号)。
①乙醇
②四氯化碳
③硝酸
答案 (1)Cl2+2Br-===2Cl-+Br2 Br2 Br2 (3)分液漏斗 ②
解析 工业上提取溴的反应原理是:将氯气通入富含溴离子的海水中,把溴置换出来,然后被某些溶液吸收,再提纯即可得到成品溴。方法(3)是利用有机溶剂萃取出溴,①③与水互溶,萃取溴的溶剂只能是②四氯化碳。
学以致用·随堂检测全达标
1
2
3
1.“关注海洋健康,守护蔚蓝星球”,是我们每个公民义不容辞的责任。下列有关说法不正确的是( )
A.可通过蒸馏法、反渗透法、电渗析法从海水中获得淡水
B.地球上约99%的溴元素存在于海洋中,溴有“海洋元素”之称
C.从海水中提取的NaCl可进一步用于生产NaOH
D.海水只能提供物质资源,不能提供能量资源
D
1
2
3
解析 海水中含有丰富的资源,从海水中得到淡水的方法有蒸馏法、反渗透法、电渗析法等,故A正确;地球上约99%的溴元素存在于海水中,所以人们也把溴称为“海洋元素”,故B正确;从海水中能提取氯化钠,电解饱和氯化钠溶液可以制得氢氧化钠,故C正确;海洋资源指的是与海水水体及海底、海面本身有着直接关系的物质和能量,海水既能提供物质资源,也能提供能量资源,如波浪、潮汐、潮流等会产生能量,故D错误。
1
2
3
2.下列关于粗盐提纯的说法正确的是( )
A.溶解粗盐时,应尽量让溶液稀些,防止食盐不完全溶解
B.滤去不溶性杂质后,将滤液移至坩埚内加热浓缩
C.当蒸发到剩余少量液体时停止加热,利用余热将液体蒸干
D.将制得的晶体转移到新制过滤器中用大量水进行洗涤
C
1
2
3
3.海水中溴含量为67 mg·L-1。实验室模拟海水中溴的提取。实验方法:将适量新制氯水加入20 mL富含溴离子的海水中(海水可以用0.1 mol·L-1的NaBr溶液代替),把溴置换出来。氯水中的氯气是 剂,反应的离子方程式为 。得到的单质溴可以用有机溶剂萃取富集,得到的有机层显 色。
答案 氧化 Cl2+2Br-===2Cl-+Br2 橙红
解析 把溴离子转化为溴单质时,溴离子发生氧化反应,因此需要氧化剂,氯气可以将Br-氧化为Br2,反应的离子方程式为Cl2+2Br-===2Cl-+Br2。溴单质在有机溶剂中的颜色是橙红色。
本 课 结 束
