3.2.2 碳酸钠 碳酸氢钠 课件(共31张PPT)2023-2024学年高一化学苏教版必修一
文档属性
| 名称 | 3.2.2 碳酸钠 碳酸氢钠 课件(共31张PPT)2023-2024学年高一化学苏教版必修一 |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-07 21:24:36 | ||
图片预览











文档简介
(共31张PPT)
专题3
第二单元 第2课时 碳酸钠 碳酸氢钠
素养 目标
1.了解碳酸钠和碳酸氢钠的性质及应用。
2.掌握碳酸钠、碳酸氢钠的鉴别方法,培养科学探究与创新意识的核心素养。
3.了解Na2CO3与NaHCO3的相互转化。
4.了解侯氏制碱法的原理。
基础落实·必备知识全过关
重难探究·能力素养全提升
学以致用·随堂检测全达标
目录索引
基础落实·必备知识全过关
自主梳理
1.碳酸钠的性质及应用
碳酸钠的化学式为 ,俗称 或 。
(1)物理性质:白色固体, 溶于水。
(2)化学性质:
①与盐(CaCl2)溶液反应的化学方程式为 。
②与碱[Ca(OH)2]溶液反应的化学方程式为
。
③与酸(足量盐酸)反应的化学方程式为 。
Na2CO3
纯碱
苏打
易
Na2CO3+CaCl2===CaCO3↓+2NaCl
Na2CO3+Ca(OH)2===CaCO3↓+2NaOH
Na2CO3+2HCl===2NaCl+H2O+CO2↑
④用pH试纸测Na2CO3溶液的pH,可知Na2CO3溶液呈 性,因而Na2CO3被称为 。
⑤Na2CO3溶液中充入CO2,反应的化学方程式为 ;饱和碳酸钠溶液中通入足量CO2时反应的化学方程式为Na2CO3+CO2+H2O===2NaHCO3↓。
(3)应用:①Na2CO3作为重要的化工原料,在制取玻璃、肥皂、合成洗涤剂及造纸、纺织、石油加工等方面有广泛应用。②Na2CO3溶液可以除去炊具表面的 。
碱
纯碱
Na2CO3+CO2+H2O===2NaHCO3
油污
2.碳酸氢钠的性质及应用
碳酸氢钠的化学式为 ,俗称 ,是一种酸式盐。
(1)物理性质:白色固体,易溶于水。
(2)化学性质:
①与NaOH溶液反应的化学方程式为NaHCO3+NaOH===Na2CO3+H2O。
②与盐酸(HCl)反应的化学方程式为 。
③受热分解的化学方程式为 。
④NaHCO3溶液呈 性。
可以利用加热的方法来鉴别碳酸钠和碳酸氢钠固体
NaHCO3
小苏打
NaHCO3+HCl===NaCl+CO2↑+H2O
2NaHCO3 Na2CO3+CO2↑+H2O
===
碱
3.检验溶液中含碳酸根离子的方法:溶液中加氯化钙溶液,若有沉淀,过滤,在沉淀中滴加稀盐酸,若生成无色无味气体且该气体能使澄清石灰水变浑浊,说明溶液中含碳酸根离子。
4.侯氏制碱原理:在氯化钠饱和溶液中先通入氨气,再通入CO2,过滤出生成的沉淀,加热分解可制得纯碱。反应的化学方程式为
, 。
NaCl+NH3+CO2+H2O===NaHCO3↓+NH4Cl
2NaHCO3 Na2CO3+H2O+CO2↑
===
自我检测
判断下列说法是否正确,正确的画“√”,错误的画“×”。
(1)碳酸钠、碳酸氢钠都属于钠盐、碳酸盐。( )
(2)碳酸氢钠可以作为治疗胃酸过多的药物。( )
(3)等浓度的盐酸滴加到浓度相等的碳酸钠、碳酸氢钠溶液中反应现象相同。( )
(4)鉴别碳酸钠、碳酸氢钠固体,可用焰色反应或加稀盐酸。( )
(5)除去碳酸钠溶液中的碳酸氢钠可加稍过量的氢氧化钠溶液。( )
(6)侯氏制碱过程中需先在饱和氯化钠溶液中通入氨气氨化,然后通入CO2。
( )
(7)纯碱、烧碱都是氢氧化钠的俗名。( )
√
√
×
×
×
√
×
重难探究·能力素养全提升
探究 碳酸钠、碳酸氢钠的性质与应用
情境探究
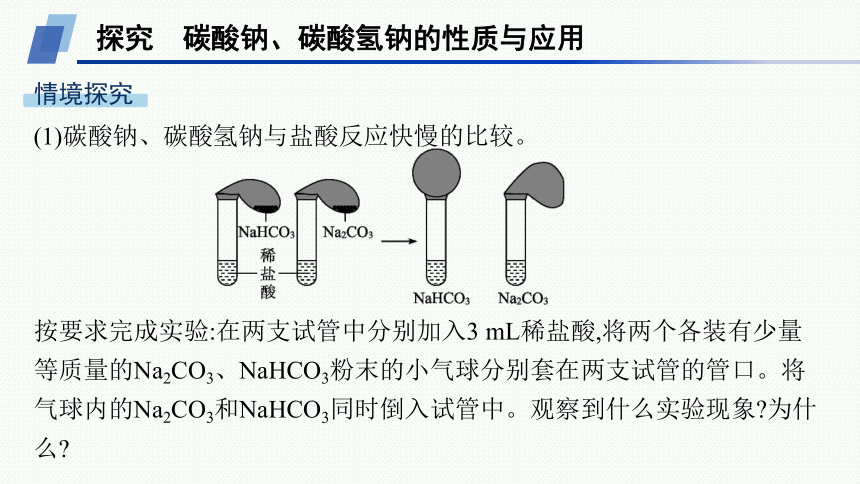
(1)碳酸钠、碳酸氢钠与盐酸反应快慢的比较。
按要求完成实验:在两支试管中分别加入3 mL稀盐酸,将两个各装有少量等质量的Na2CO3、NaHCO3粉末的小气球分别套在两支试管的管口。将气球内的Na2CO3和NaHCO3同时倒入试管中。观察到什么实验现象 为什么
提示 加入碳酸氢钠的试管上方的气球很快变大,另一支试管中仅生成少量气体。碳酸钠粉末倒入稀盐酸中,反应分步进行,反应的化学方程式依次是Na2CO3+HCl===NaHCO3+NaCl,NaHCO3+HCl===NaCl+CO2↑+H2O,反应分两步进行,反应速率较慢;碳酸氢钠可直接与盐酸反应生成气体:NaHCO3+HCl===NaCl+CO2↑+H2O,反应速率较快;计算可知M(Na2CO3)>M(NaHCO3),所以等质量的Na2CO3和NaHCO3粉末,n(NaHCO3)>n(Na2CO3),由Na2CO3~CO2,NaHCO3~CO2可知,等质量的Na2CO3和NaHCO3粉末,NaHCO3放出的气体更多,气球体积更大。
(2)利用如下图所示的“套管实验”,可以比较碳酸钠、碳酸氢钠的热稳定性。
小试管内塞有沾有白色无水硫酸铜粉末的棉花球。点燃酒精灯加热,能观察到的实验现象是小试管中棉花球变蓝色,B烧杯中澄清石灰水变浑浊,A中有少量气泡冒出。该实验可得出什么结论
提示 Na2CO3受热不易分解;NaHCO3受热易分解,生成物中含有CO2和H2O。A中有少量气泡冒出是由于大试管内空气受热膨胀,压强增大,气体逸出,与Na2CO3无关。由此可知,Na2CO3的热稳定性比NaHCO3强。
(3)向饱和Na2CO3溶液中通入CO2气体,有何现象发生 为什么
(4)如何鉴别0.1 mol·L-1的Na2CO3溶液与0.1 mol·L-1的NaHCO3溶液
提示 向饱和碳酸钠溶液中通入CO2气体会发生如下反应:Na2CO3+CO2+H2O===2NaHCO3↓,一定温度时,碳酸钠的溶解度大于碳酸氢钠的溶解度,反应中用掉一部分水,所以溶解度较小的NaHCO3就会从溶液中析出,有晶体析出。另外,反应后生成的碳酸氢钠的质量也大于原碳酸钠溶液中溶质的质量,也是形成碳酸氢钠沉淀的原因之一。
提示 用pH试纸分别测pH,pH大的为Na2CO3溶液;逐滴加入同浓度的盐酸,一开始就有气泡产生的为NaHCO3溶液;分别加入CaCl2溶液,有沉淀产生的为Na2CO3溶液。
(5)如何鉴别Na2CO3和NaHCO3固体 如何除去NaHCO3溶液中的Na2CO3
(6)发酵粉中往往含有什么成分
提示 鉴别方法,分别加热,有使澄清石灰水变浑浊的气体生成的为NaHCO3;向溶液中通入过量CO2气体可除去NaHCO3溶液中的Na2CO3。
提示 碳酸氢钠。
知识归纳
1.碳酸钠、碳酸氢钠的比较
名称 碳酸钠(Na2CO3) 碳酸氢钠(NaHCO3)
俗名 纯碱、苏打 小苏打
物理 性质 颜色状态 白色固体 白色固体
溶液 碱性 水溶液碱性较强 (相同浓度下) 水溶液碱性较弱
(相同浓度下)
水溶性 常温下碳酸钠溶解度大于碳酸氢钠
名称 碳酸钠(Na2CO3) 碳酸氢钠(NaHCO3)
化学 性质 稳定性 稳定 不稳定
滴加 盐酸 开始无气泡,后来有气泡 立即有气泡
碳酸氢钠与HCl反应比碳酸钠与HCl反应快
与澄清 石灰水 反应 Na2CO3+Ca(OH)2===CaCO3↓+ 2NaOH NaHCO3+Ca(OH)2(过量) ===CaCO3↓+H2O+NaOH;
2NaHCO3(过量)+Ca(OH)2
===2H2O+CaCO3↓+Na2CO3
不可用澄清石灰水鉴别二者
与CaCl2 溶液 CaCl2+Na2CO3===CaCO3↓+2NaCl 不反应
名称 碳酸钠(Na2CO3) 碳酸氢钠(NaHCO3)
主要用途 制玻璃、造纸、制皂、洗涤 发酵粉、医药、灭火器
相互转化 Na2CO3 NaHCO3
(1)溶解性不同:常温下Na2CO3的溶解度大于NaHCO3的溶解度。
(2)热稳定性不同,NaHCO3受热易分解,Na2CO3稳定。
(3)与同等浓度的酸反应放出气体的快慢不同:NaHCO3的反应更快。
(4)与Ca(OH)2或Ba(OH)2溶液反应都会生成沉淀。
2.碳酸钠与碳酸氢钠的鉴别
(1)加热法:利用NaHCO3固体受热易分解,Na2CO3固体受热不易分解,将固体置于试管中加热,能产生使澄清石灰水变浑浊的气体的是NaHCO3。
(2)沉淀法:各取少量固体溶于水,再分别滴加BaCl2、CaCl2或Ba(NO3)2溶液,有白色沉淀生成的是Na2CO3。
(3)测气体体积法:取相同质量的固体于试管中,加入足量盐酸,产生气体较多的是NaHCO3。
(4)测pH法:配成相同物质的量浓度的两溶液,用pH试纸测pH,pH较大的是Na2CO3溶液。
(5)观察生成气体快慢:各取少量固体于试管中,加适量水溶解,分别滴加同浓度的稀盐酸,立即有气体产生的是NaHCO3,开始无现象,后来有气体产生的是Na2CO3。
3.除杂
混合物(括号内为杂质) 除杂方法及试剂
Na2CO3固体(NaHCO3) 加热
NaHCO3溶液(Na2CO3) 通入足量CO2气体
Na2CO3溶液(NaHCO3) 加入适量NaOH溶液
4.不用其他试剂鉴别碳酸钠溶液和稀盐酸
Na2CO3溶液与稀盐酸互滴,根据出现的不同现象可鉴别Na2CO3溶液和稀盐酸。向Na2CO3溶液中滴加盐酸,反应分两步进行:Na2CO3+HCl===NaHCO3+NaCl,NaHCO3+HCl===NaCl+H2O+CO2↑,开始无现象(理论上反应生成NaHCO3),后来有气泡产生(NaHCO3转化为CO2);将Na2CO3溶液逐滴滴入稀盐酸中,会立即产生气泡。
应用体验
1.[2023河北石家庄外国语学校高一期中]纯碱和小苏打是厨房中两种常见的用品,都是白色固体。下列关于这两种物质的说法正确的是( )
A.热稳定性:纯碱<小苏打
B.相同条件下的溶解度:纯碱<小苏打
C.与等浓度的食醋反应,产生气泡快慢:纯碱<小苏打
D.二者饱和溶液的碱性强弱:纯碱<小苏打
C
解析 小苏打受热分解为碳酸钠,热稳定性:纯碱>小苏打,A错误;相同条件下的溶解度:纯碱>小苏打,B错误;碳酸氢钠与醋酸的反应快于碳酸钠与醋酸的反应,C正确;物质的量浓度相同时,碳酸钠的碱性强,且相同条件下碳酸钠的溶解度大,所以二者饱和溶液的碱性强弱:纯碱>小苏打,D错误。
2.有两支试管分别装有2 mL、等浓度的Na2CO3和NaHCO3溶液,下列说法正确的是( )
选项 操作 判断
A 分别加入足量澄清石灰水 产生沉淀者为Na2CO3溶液
B 分别加入等浓度的稀盐酸 反应较剧烈者为Na2CO3溶液
C 分别滴入几滴酚酞溶液 红色深的为Na2CO3溶液
D 分别滴入等浓度的稀盐酸 立即产生气泡者为Na2CO3溶液
C
解析 加入澄清石灰水,发生反应:Na2CO3+Ca(OH)2===CaCO3↓+2NaOH、2NaHCO3+Ca(OH)2===CaCO3↓+Na2CO3+2H2O,均产生白色沉淀,A错误;分别加入等浓度的稀盐酸,NaHCO3溶液立即产生大量气泡,Na2CO3溶液过一段时间才产生气泡,反应较剧烈者为NaHCO3溶液,B、D错误;等浓度时,Na2CO3溶液的碱性强于NaHCO3溶液,滴加酚酞溶液后,Na2CO3溶液红色更深,C正确。
学以致用·随堂检测全达标
1
2
3
4
1.我国著名化学家侯德榜所创立的“侯氏制碱法”誉满全球,其中的“碱”指的是( )
A.氢氧化钠
B.碳酸氢钠
C.碳酸钠
D.碳酸钾
C
解析 “侯氏制碱法”是向氨化的饱和氯化钠溶液中通入二氧化碳析出晶体,将晶体加热分解得到碳酸钠;“侯氏制碱法”中的“碱”是碳酸钠(Na2CO3)。
1
2
3
4
2.为除去括号内的杂质,所选用的试剂或方法不正确的是( )
A.Na2CO3溶液(NaHCO3),选用适量的NaOH溶液
B.NaHCO3溶液(Na2CO3),应通入过量的CO2气体
C.CaO固体(CaCO3),将混合物充分加热
D.Na2CO3溶液(Na2SO4),加入适量的Ba(OH)2溶液,过滤
D
1
2
3
4
3.[2023河北石家庄第二中学高一期中]下列有关实验的说法正确的是
( )
A.Na2CO3和NaHCO3各1 g,分别溶于10 mL水中形成溶液,再分别滴加几滴酚酞溶液,前者溶液红色比后者深
B.如图装置可用于比较Na2CO3和NaHCO3的
热稳定性
C.向某溶液中加入稀盐酸,产生使澄清石灰水
变浑浊的无色无味气体,该溶液中一定含有
D.向饱和Na2CO3溶液中通入CO2不可能有浑浊现象产生
A
1
2
3
4
解析 溶质质量分数相同的情况下,Na2CO3溶液碱性比NaHCO3溶液强,Na2CO3和NaHCO3各1 g,分别溶于10 mL水中形成溶液,再分别滴加几滴酚酞溶液,Na2CO3溶液红色比较深,故A正确;如图装置可知,NaHCO3在大试管中,Na2CO3在小试管中,加热大试管后,大试管的温度比小试管的高,NaHCO3先反应,不能说明Na2CO3比NaHCO3的热稳定性强,故B错误;向某溶液中加入稀盐酸,产生使澄清石灰水变浑浊的无色无味气体,该溶液中可能含有 或者二者都有,故C错误;向饱和Na2CO3溶液中通入CO2会发生反应,生成碳酸氢钠,因为相同条件下,碳酸氢钠的溶解度比Na2CO3的小,所以有浑浊现象产生,故D错误。
1
2
3
4
4.(1)鉴别KCl溶液和K2CO3溶液的试剂是 ,化学方程式为 。
(2)除去Na2CO3粉末中混入的NaHCO3杂质用 方法,化学方程式为 。
2NaHCO3 Na2CO3+H2O+CO2↑
稀盐酸
2HCl+K2CO3===H2O+CO2↑+2KCl
加热
解析 (1)碳酸钾与盐酸反应有气体生成,而KCl与盐酸不反应,可选择的试剂为稀盐酸;也可以选择BaCl2或CaCl2溶液,通过有无沉淀生成进行区分。
(2)碳酸氢钠受热易分解,利用加热法可除去Na2CO3粉末中的NaHCO3,发生反应的化学方程式为2NaHCO3 Na2CO3+H2O+CO2↑。
本 课 结 束
专题3
第二单元 第2课时 碳酸钠 碳酸氢钠
素养 目标
1.了解碳酸钠和碳酸氢钠的性质及应用。
2.掌握碳酸钠、碳酸氢钠的鉴别方法,培养科学探究与创新意识的核心素养。
3.了解Na2CO3与NaHCO3的相互转化。
4.了解侯氏制碱法的原理。
基础落实·必备知识全过关
重难探究·能力素养全提升
学以致用·随堂检测全达标
目录索引
基础落实·必备知识全过关
自主梳理
1.碳酸钠的性质及应用
碳酸钠的化学式为 ,俗称 或 。
(1)物理性质:白色固体, 溶于水。
(2)化学性质:
①与盐(CaCl2)溶液反应的化学方程式为 。
②与碱[Ca(OH)2]溶液反应的化学方程式为
。
③与酸(足量盐酸)反应的化学方程式为 。
Na2CO3
纯碱
苏打
易
Na2CO3+CaCl2===CaCO3↓+2NaCl
Na2CO3+Ca(OH)2===CaCO3↓+2NaOH
Na2CO3+2HCl===2NaCl+H2O+CO2↑
④用pH试纸测Na2CO3溶液的pH,可知Na2CO3溶液呈 性,因而Na2CO3被称为 。
⑤Na2CO3溶液中充入CO2,反应的化学方程式为 ;饱和碳酸钠溶液中通入足量CO2时反应的化学方程式为Na2CO3+CO2+H2O===2NaHCO3↓。
(3)应用:①Na2CO3作为重要的化工原料,在制取玻璃、肥皂、合成洗涤剂及造纸、纺织、石油加工等方面有广泛应用。②Na2CO3溶液可以除去炊具表面的 。
碱
纯碱
Na2CO3+CO2+H2O===2NaHCO3
油污
2.碳酸氢钠的性质及应用
碳酸氢钠的化学式为 ,俗称 ,是一种酸式盐。
(1)物理性质:白色固体,易溶于水。
(2)化学性质:
①与NaOH溶液反应的化学方程式为NaHCO3+NaOH===Na2CO3+H2O。
②与盐酸(HCl)反应的化学方程式为 。
③受热分解的化学方程式为 。
④NaHCO3溶液呈 性。
可以利用加热的方法来鉴别碳酸钠和碳酸氢钠固体
NaHCO3
小苏打
NaHCO3+HCl===NaCl+CO2↑+H2O
2NaHCO3 Na2CO3+CO2↑+H2O
===
碱
3.检验溶液中含碳酸根离子的方法:溶液中加氯化钙溶液,若有沉淀,过滤,在沉淀中滴加稀盐酸,若生成无色无味气体且该气体能使澄清石灰水变浑浊,说明溶液中含碳酸根离子。
4.侯氏制碱原理:在氯化钠饱和溶液中先通入氨气,再通入CO2,过滤出生成的沉淀,加热分解可制得纯碱。反应的化学方程式为
, 。
NaCl+NH3+CO2+H2O===NaHCO3↓+NH4Cl
2NaHCO3 Na2CO3+H2O+CO2↑
===
自我检测
判断下列说法是否正确,正确的画“√”,错误的画“×”。
(1)碳酸钠、碳酸氢钠都属于钠盐、碳酸盐。( )
(2)碳酸氢钠可以作为治疗胃酸过多的药物。( )
(3)等浓度的盐酸滴加到浓度相等的碳酸钠、碳酸氢钠溶液中反应现象相同。( )
(4)鉴别碳酸钠、碳酸氢钠固体,可用焰色反应或加稀盐酸。( )
(5)除去碳酸钠溶液中的碳酸氢钠可加稍过量的氢氧化钠溶液。( )
(6)侯氏制碱过程中需先在饱和氯化钠溶液中通入氨气氨化,然后通入CO2。
( )
(7)纯碱、烧碱都是氢氧化钠的俗名。( )
√
√
×
×
×
√
×
重难探究·能力素养全提升
探究 碳酸钠、碳酸氢钠的性质与应用
情境探究
(1)碳酸钠、碳酸氢钠与盐酸反应快慢的比较。
按要求完成实验:在两支试管中分别加入3 mL稀盐酸,将两个各装有少量等质量的Na2CO3、NaHCO3粉末的小气球分别套在两支试管的管口。将气球内的Na2CO3和NaHCO3同时倒入试管中。观察到什么实验现象 为什么
提示 加入碳酸氢钠的试管上方的气球很快变大,另一支试管中仅生成少量气体。碳酸钠粉末倒入稀盐酸中,反应分步进行,反应的化学方程式依次是Na2CO3+HCl===NaHCO3+NaCl,NaHCO3+HCl===NaCl+CO2↑+H2O,反应分两步进行,反应速率较慢;碳酸氢钠可直接与盐酸反应生成气体:NaHCO3+HCl===NaCl+CO2↑+H2O,反应速率较快;计算可知M(Na2CO3)>M(NaHCO3),所以等质量的Na2CO3和NaHCO3粉末,n(NaHCO3)>n(Na2CO3),由Na2CO3~CO2,NaHCO3~CO2可知,等质量的Na2CO3和NaHCO3粉末,NaHCO3放出的气体更多,气球体积更大。
(2)利用如下图所示的“套管实验”,可以比较碳酸钠、碳酸氢钠的热稳定性。
小试管内塞有沾有白色无水硫酸铜粉末的棉花球。点燃酒精灯加热,能观察到的实验现象是小试管中棉花球变蓝色,B烧杯中澄清石灰水变浑浊,A中有少量气泡冒出。该实验可得出什么结论
提示 Na2CO3受热不易分解;NaHCO3受热易分解,生成物中含有CO2和H2O。A中有少量气泡冒出是由于大试管内空气受热膨胀,压强增大,气体逸出,与Na2CO3无关。由此可知,Na2CO3的热稳定性比NaHCO3强。
(3)向饱和Na2CO3溶液中通入CO2气体,有何现象发生 为什么
(4)如何鉴别0.1 mol·L-1的Na2CO3溶液与0.1 mol·L-1的NaHCO3溶液
提示 向饱和碳酸钠溶液中通入CO2气体会发生如下反应:Na2CO3+CO2+H2O===2NaHCO3↓,一定温度时,碳酸钠的溶解度大于碳酸氢钠的溶解度,反应中用掉一部分水,所以溶解度较小的NaHCO3就会从溶液中析出,有晶体析出。另外,反应后生成的碳酸氢钠的质量也大于原碳酸钠溶液中溶质的质量,也是形成碳酸氢钠沉淀的原因之一。
提示 用pH试纸分别测pH,pH大的为Na2CO3溶液;逐滴加入同浓度的盐酸,一开始就有气泡产生的为NaHCO3溶液;分别加入CaCl2溶液,有沉淀产生的为Na2CO3溶液。
(5)如何鉴别Na2CO3和NaHCO3固体 如何除去NaHCO3溶液中的Na2CO3
(6)发酵粉中往往含有什么成分
提示 鉴别方法,分别加热,有使澄清石灰水变浑浊的气体生成的为NaHCO3;向溶液中通入过量CO2气体可除去NaHCO3溶液中的Na2CO3。
提示 碳酸氢钠。
知识归纳
1.碳酸钠、碳酸氢钠的比较
名称 碳酸钠(Na2CO3) 碳酸氢钠(NaHCO3)
俗名 纯碱、苏打 小苏打
物理 性质 颜色状态 白色固体 白色固体
溶液 碱性 水溶液碱性较强 (相同浓度下) 水溶液碱性较弱
(相同浓度下)
水溶性 常温下碳酸钠溶解度大于碳酸氢钠
名称 碳酸钠(Na2CO3) 碳酸氢钠(NaHCO3)
化学 性质 稳定性 稳定 不稳定
滴加 盐酸 开始无气泡,后来有气泡 立即有气泡
碳酸氢钠与HCl反应比碳酸钠与HCl反应快
与澄清 石灰水 反应 Na2CO3+Ca(OH)2===CaCO3↓+ 2NaOH NaHCO3+Ca(OH)2(过量) ===CaCO3↓+H2O+NaOH;
2NaHCO3(过量)+Ca(OH)2
===2H2O+CaCO3↓+Na2CO3
不可用澄清石灰水鉴别二者
与CaCl2 溶液 CaCl2+Na2CO3===CaCO3↓+2NaCl 不反应
名称 碳酸钠(Na2CO3) 碳酸氢钠(NaHCO3)
主要用途 制玻璃、造纸、制皂、洗涤 发酵粉、医药、灭火器
相互转化 Na2CO3 NaHCO3
(1)溶解性不同:常温下Na2CO3的溶解度大于NaHCO3的溶解度。
(2)热稳定性不同,NaHCO3受热易分解,Na2CO3稳定。
(3)与同等浓度的酸反应放出气体的快慢不同:NaHCO3的反应更快。
(4)与Ca(OH)2或Ba(OH)2溶液反应都会生成沉淀。
2.碳酸钠与碳酸氢钠的鉴别
(1)加热法:利用NaHCO3固体受热易分解,Na2CO3固体受热不易分解,将固体置于试管中加热,能产生使澄清石灰水变浑浊的气体的是NaHCO3。
(2)沉淀法:各取少量固体溶于水,再分别滴加BaCl2、CaCl2或Ba(NO3)2溶液,有白色沉淀生成的是Na2CO3。
(3)测气体体积法:取相同质量的固体于试管中,加入足量盐酸,产生气体较多的是NaHCO3。
(4)测pH法:配成相同物质的量浓度的两溶液,用pH试纸测pH,pH较大的是Na2CO3溶液。
(5)观察生成气体快慢:各取少量固体于试管中,加适量水溶解,分别滴加同浓度的稀盐酸,立即有气体产生的是NaHCO3,开始无现象,后来有气体产生的是Na2CO3。
3.除杂
混合物(括号内为杂质) 除杂方法及试剂
Na2CO3固体(NaHCO3) 加热
NaHCO3溶液(Na2CO3) 通入足量CO2气体
Na2CO3溶液(NaHCO3) 加入适量NaOH溶液
4.不用其他试剂鉴别碳酸钠溶液和稀盐酸
Na2CO3溶液与稀盐酸互滴,根据出现的不同现象可鉴别Na2CO3溶液和稀盐酸。向Na2CO3溶液中滴加盐酸,反应分两步进行:Na2CO3+HCl===NaHCO3+NaCl,NaHCO3+HCl===NaCl+H2O+CO2↑,开始无现象(理论上反应生成NaHCO3),后来有气泡产生(NaHCO3转化为CO2);将Na2CO3溶液逐滴滴入稀盐酸中,会立即产生气泡。
应用体验
1.[2023河北石家庄外国语学校高一期中]纯碱和小苏打是厨房中两种常见的用品,都是白色固体。下列关于这两种物质的说法正确的是( )
A.热稳定性:纯碱<小苏打
B.相同条件下的溶解度:纯碱<小苏打
C.与等浓度的食醋反应,产生气泡快慢:纯碱<小苏打
D.二者饱和溶液的碱性强弱:纯碱<小苏打
C
解析 小苏打受热分解为碳酸钠,热稳定性:纯碱>小苏打,A错误;相同条件下的溶解度:纯碱>小苏打,B错误;碳酸氢钠与醋酸的反应快于碳酸钠与醋酸的反应,C正确;物质的量浓度相同时,碳酸钠的碱性强,且相同条件下碳酸钠的溶解度大,所以二者饱和溶液的碱性强弱:纯碱>小苏打,D错误。
2.有两支试管分别装有2 mL、等浓度的Na2CO3和NaHCO3溶液,下列说法正确的是( )
选项 操作 判断
A 分别加入足量澄清石灰水 产生沉淀者为Na2CO3溶液
B 分别加入等浓度的稀盐酸 反应较剧烈者为Na2CO3溶液
C 分别滴入几滴酚酞溶液 红色深的为Na2CO3溶液
D 分别滴入等浓度的稀盐酸 立即产生气泡者为Na2CO3溶液
C
解析 加入澄清石灰水,发生反应:Na2CO3+Ca(OH)2===CaCO3↓+2NaOH、2NaHCO3+Ca(OH)2===CaCO3↓+Na2CO3+2H2O,均产生白色沉淀,A错误;分别加入等浓度的稀盐酸,NaHCO3溶液立即产生大量气泡,Na2CO3溶液过一段时间才产生气泡,反应较剧烈者为NaHCO3溶液,B、D错误;等浓度时,Na2CO3溶液的碱性强于NaHCO3溶液,滴加酚酞溶液后,Na2CO3溶液红色更深,C正确。
学以致用·随堂检测全达标
1
2
3
4
1.我国著名化学家侯德榜所创立的“侯氏制碱法”誉满全球,其中的“碱”指的是( )
A.氢氧化钠
B.碳酸氢钠
C.碳酸钠
D.碳酸钾
C
解析 “侯氏制碱法”是向氨化的饱和氯化钠溶液中通入二氧化碳析出晶体,将晶体加热分解得到碳酸钠;“侯氏制碱法”中的“碱”是碳酸钠(Na2CO3)。
1
2
3
4
2.为除去括号内的杂质,所选用的试剂或方法不正确的是( )
A.Na2CO3溶液(NaHCO3),选用适量的NaOH溶液
B.NaHCO3溶液(Na2CO3),应通入过量的CO2气体
C.CaO固体(CaCO3),将混合物充分加热
D.Na2CO3溶液(Na2SO4),加入适量的Ba(OH)2溶液,过滤
D
1
2
3
4
3.[2023河北石家庄第二中学高一期中]下列有关实验的说法正确的是
( )
A.Na2CO3和NaHCO3各1 g,分别溶于10 mL水中形成溶液,再分别滴加几滴酚酞溶液,前者溶液红色比后者深
B.如图装置可用于比较Na2CO3和NaHCO3的
热稳定性
C.向某溶液中加入稀盐酸,产生使澄清石灰水
变浑浊的无色无味气体,该溶液中一定含有
D.向饱和Na2CO3溶液中通入CO2不可能有浑浊现象产生
A
1
2
3
4
解析 溶质质量分数相同的情况下,Na2CO3溶液碱性比NaHCO3溶液强,Na2CO3和NaHCO3各1 g,分别溶于10 mL水中形成溶液,再分别滴加几滴酚酞溶液,Na2CO3溶液红色比较深,故A正确;如图装置可知,NaHCO3在大试管中,Na2CO3在小试管中,加热大试管后,大试管的温度比小试管的高,NaHCO3先反应,不能说明Na2CO3比NaHCO3的热稳定性强,故B错误;向某溶液中加入稀盐酸,产生使澄清石灰水变浑浊的无色无味气体,该溶液中可能含有 或者二者都有,故C错误;向饱和Na2CO3溶液中通入CO2会发生反应,生成碳酸氢钠,因为相同条件下,碳酸氢钠的溶解度比Na2CO3的小,所以有浑浊现象产生,故D错误。
1
2
3
4
4.(1)鉴别KCl溶液和K2CO3溶液的试剂是 ,化学方程式为 。
(2)除去Na2CO3粉末中混入的NaHCO3杂质用 方法,化学方程式为 。
2NaHCO3 Na2CO3+H2O+CO2↑
稀盐酸
2HCl+K2CO3===H2O+CO2↑+2KCl
加热
解析 (1)碳酸钾与盐酸反应有气体生成,而KCl与盐酸不反应,可选择的试剂为稀盐酸;也可以选择BaCl2或CaCl2溶液,通过有无沉淀生成进行区分。
(2)碳酸氢钠受热易分解,利用加热法可除去Na2CO3粉末中的NaHCO3,发生反应的化学方程式为2NaHCO3 Na2CO3+H2O+CO2↑。
本 课 结 束
