3.1.3 氧化还原反应 课件(共35张PPT)2023-2024学年高一化学苏教版必修一
文档属性
| 名称 | 3.1.3 氧化还原反应 课件(共35张PPT)2023-2024学年高一化学苏教版必修一 |  | |
| 格式 | pptx | ||
| 文件大小 | 2.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-07 21:24:22 | ||
图片预览











文档简介
(共35张PPT)
专题3
第一单元 第3课时 氧化还原反应
素养 目标
1.认识氧化还原反应,了解氧化还原反应的本质。
2.了解氧化剂、还原剂、氧化性、还原性、氧化反应、还原反应等概念。
3.通过氧化还原反应的本质分析,培养宏观辨识与微观探析的核心素养。
4.学习氧化还原反应中电子转移的表示,了解氧化还原反应计算中的守恒思想。
基础落实·必备知识全过关
重难探究·能力素养全提升
学以致用·随堂检测全达标
目录索引
基础落实·必备知识全过关
自主梳理
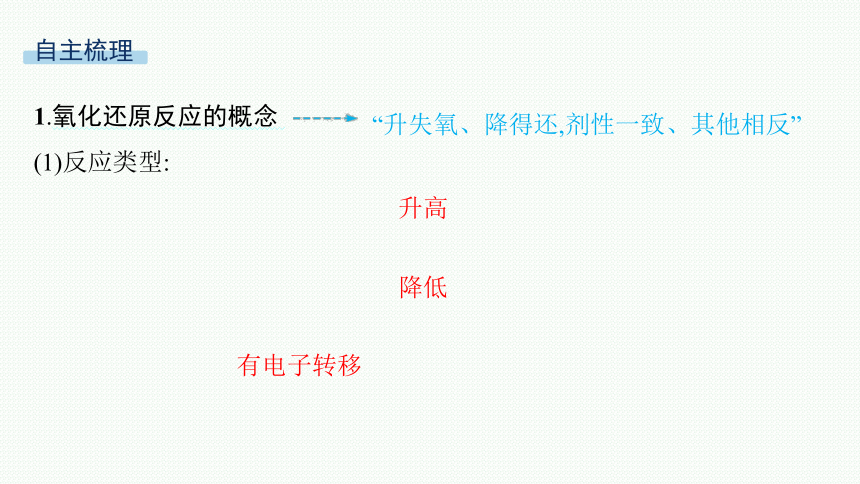
1.氧化还原反应的概念
(1)反应类型:
“升失氧、降得还,剂性一致、其他相反”
升高
降低
有电子转移
(2)反应物:
(3)物质性质:
得到
失去
得到
失去
2.氧化还原反应的实质与表示
(1)氧化还原反应的实质是反应中有 。
(2)用双线桥表示二氧化锰与浓盐酸的反应中电子转移的方向和数目:
。反应中氧化剂是 ,还原剂是 。若1 mol MnO2参与反应,则被氧化的氯化氢的物质的量为 ,反应中电子转移数目为 个。
3.氧化还原反应中,元素化合价升高与降低总数相等,氧化剂 电子的数目与还原剂 电子的数目相等。
电子的转移
MnO2
HCl
2 mol
2NA
得到
失去
自我检测
判断下列说法是否正确,正确的画“√”,错误的画“×”。
(1)氧化还原反应是元素化合价发生变化的反应,所以元素化合价发生变化是氧化还原反应的本质。( )
(2)元素化合价升高,即发生氧化反应。( )
(3)在氧化还原反应中,还原剂被氧化,氧化剂被还原。( )
(4)反应中一种物质被氧化,必定有另一种物质被还原。( )
(5)氧化反应和还原反应一定同时发生。( )
(6)氧化还原反应中物质得到和失去电子的数目一定相等。( )
×
√
√
×
√
√
重难探究·能力素养全提升
探究一 氧化还原反应的相关概念
情境探究
(1)氧化还原反应中,元素化合价发生变化的本质原因是什么
(2)什么是氧化剂,什么是还原剂 各有什么性质
提示 氧化还原反应中,元素化合价发生变化本质原因是电子发生转移。
提示 在氧化还原反应中,失去电子的物质是还原剂,还原剂具有还原性;得到电子的物质是氧化剂,氧化剂具有氧化性。
(3)如何比较物质的氧化性、还原性强弱 氧化性或还原性强弱与电子得失数目是否有关系
提示 可以根据氧化还原反应规律来判断,较强氧化性的氧化剂跟较强还原性的还原剂反应,生成弱还原性的还原产物和弱氧化性的氧化产物,即
氧化性:氧化剂>氧化产物;还原性:还原剂>还原产物。
氧化性、还原性强弱与反应中得失电子数目无关。
知识归纳
1.氧化还原反应中的相关概念
概念 定义
氧化剂 得到电子的反应物
还原剂 失去电子的反应物
氧化反应 失去电子的反应
还原反应 得到电子的反应
被氧化 还原剂失去电子被氧化
被还原 氧化剂得到电子被还原
氧化产物 氧化反应的产物
还原产物 还原反应的产物
氧化剂得电子,所含元素化合价降低,发生还原反应,得到还原产物;还原剂失电子,所含元素化合价升高,发生氧化反应,得到氧化产物。
2.氧化反应和还原反应一定同时进行,有物质被氧化,同时必然有物质被还原,氧化反应和还原反应必然同时存在于一个反应中。氧化剂、还原剂可能是不同种物质,也可能是同种物质,如反应Cl2+2NaOH===NaCl+NaClO+H2O中,Cl2既是氧化剂,又是还原剂。
应用体验
1.[2023河北唐山高一期中]工业上通过反应2Al2O3+3C+6Cl2 4AlCl3+3CO2制取无水氯化铝,关于该反应下列说法正确的是( )
A.该反应中,Al元素被氧化
B.每生成1个CO2分子,转移2个电子
C.该反应中,Cl2得电子被还原
D.该反应中,C发生还原反应
C
解析 Al2O3和AlCl3中Al元素化合价均显+3价,Al元素化合价未变化,A错误;C→CO2,C元素由0价升高到+4价,发生氧化反应,故生成1个CO2分子,转移4个电子,B、D错误;Cl2→AlCl3,Cl元素由0价降低到-1价,故Cl2得电子被还原,C正确。
2.科学家指出,食用虾类等水生甲壳类动物的同时服用维生素C容易中毒,这是因为对人体无害的+5价砷类物质在维生素C的作用下,能够转化为有毒的+3价砷类物质。下列说法错误的是( )
A.维生素C具有还原性
B.+5价砷转化为+3价砷时,得到电子
C.上述过程中+5价砷类物质是还原剂
D.上述过程中砷元素发生还原反应
C
解析 根据题意,+5价砷类物质在维生素C的作用下转化为有毒的+3价砷类物质,砷元素化合价降低,+5价砷类物质是氧化剂,所以维生素C是还原剂,具有还原性,A、C项不符合题意;反应中砷元素化合价降低,得到电子,B项不符合题意;砷元素由+5价变为+3价,化合价降低发生还原反应,D项不符合题意。
规律方法 判断物质在反应中表现氧化性还是还原性,可依据反应中元素化合价的变化。元素化合价升高,失去电子被氧化,物质是还原剂,表现还原性;元素化合价降低,得到电子被还原,物质是氧化剂,表现氧化性。可简记为:升、失、氧,降、得、还;若说剂,正相反。
3.[2023河北石家庄外国语学校高一期中]下列有关氧化还原反应的叙述中,正确的是( )
A.在氧化还原反应中,物质失去的电子数越多,其还原性越强
B.阳离子只具有氧化性,阴离子只具有还原性
C.在氧化还原反应中不一定所有元素的化合价都发生改变
D.氧化剂被还原,化合价升高
C
解析 还原性的强弱与失电子的数目无关,只与失电子的难易程度有关,A错误;阳离子可以既有氧化性又有还原性,如Fe2+,阴离子也可以既有氧化性又有还原性,如 ,B错误;氧化还原反应中有的元素的化合价发生改变,有的元素的化合价不发生改变,如2KClO3 2KCl+3O2↑,此反应中K元素化合价不变,Cl元素、O元素化合价发生了改变,即在氧化还原反应中不一定所有元素的化合价都发生改变,C正确;氧化剂得到电子,被还原,化合价降低,D错误。
探究二 氧化性、还原性
情境探究
(1)反应中氧化剂得到电子,表现氧化性,还原剂失去电子,表现还原性。在氧化还原反应中一种物质被氧化的同时,一定是另一种物质被还原吗 请举例说明。
提示 在氧化还原反应中,不一定是一种物质被氧化的同时,另一种物质被还原。例如氯气与水的反应中,氯气既是氧化剂又是还原剂。
(2)物质的氧化性、还原性与其中元素化合价的高低有什么关系
(3)如何根据已知反应比较物质的氧化性、还原性强弱
提示 当物质所含元素处于最高价时,该元素的化合价只能降低,反应中只能被还原,只表现氧化性;当元素处于最低价态时,该元素的化合价只能升高,反应中只能被氧化,只表现还原性;当元素处于中间价态时,反应中该元素的化合价可能升高,也可能降低,该元素可能会表现还原性,也可能表现氧化性。
提示 对于自发进行的氧化还原反应,氧化剂的氧化性强于氧化产物的氧化性,还原剂的还原性强于还原产物的还原性。
知识归纳
判断物质的氧化性、还原性强弱的方法归纳
(1)根据金属活动性顺序判断氧化性、还原性强弱。
(2)根据非金属活动性顺序来判断。
(3)根据已知氧化还原反应判断。
反应物中氧化剂的氧化性强于生成物中氧化产物的氧化性;反应物中还原剂的还原性强于生成物中还原产物的还原性。
(4)根据氧化还原反应发生的条件来判断。如:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O,2KMnO4+16HCl(浓) ===2MnCl2+2KCl+5Cl2↑+8H2O,由于高锰酸钾与浓盐酸的反应不需要加热,所以氧化性:KMnO4>MnO2。
应用体验
1.实验室制备少量氯气可利用如下反应:KMnO4+HCl(浓)→KCl+MnCl2+Cl2↑+H2O(未配平),该反应常温下就可迅速进行。
请回答下列问题:
(1)上述反应中被氧化的元素为 (填元素符号),还原产物是 (填化学式)。
(2)Fe2+也能与 反应生成Mn2+,反应后Fe2+转化为 。反应中Fe2+表现 (填“氧化”或“还原”,下同)性,发生
反应。
(3)如果上述化学方程式中KMnO4和MnCl2的化学计量数都是2,则HCl的化学计量数是 。
(4)实验室通常利用MnO2与浓盐酸共热反应制得氯气,据此可知KMnO4、Cl2、MnO2三种物质的氧化性由强到弱的顺序为 (用化学式表示)。
答案 (1)Cl MnCl2
(2)Fe3+ 还原 氧化 (3)16
(4)KMnO4>MnO2>Cl2
解析 (1)反应中,氯元素的化合价升高,被氧化,Mn元素的化合价降低,被还原,MnCl2是还原产物。
(2) 将Fe2+氧化为Fe3+,Fe元素的化合价升高,作还原剂,发生氧化反应。
(3)根据得失电子守恒和元素质量守恒,可知反应的化学方程式为2KMnO4+16HCl(浓) ===2KCl+2MnCl2+5Cl2↑+8H2O。
(4)根据反应2KMnO4+16HCl(浓) ===2KCl+2MnCl2+5Cl2↑+8H2O可知,氧化性:KMnO4>Cl2;MnO2与浓盐酸共热反应制得Cl2,故氧化性:MnO2>Cl2;KMnO4常温下将HCl氧化成Cl2,MnO2加热时将HCl氧化成Cl2,故氧化性:KMnO4>MnO2。
2.根据下列反应,判断有关物质的氧化性由强到弱的顺序是( )
①Cl2+2KBr===2KCl+Br2
②Br2+H2SO3+H2O===2HBr+H2SO4
③2KMnO4+16HCl(浓) ===2KCl+2MnCl2+5Cl2↑+8H2O
A.Cl2>KMnO4>Br2>H2SO4
B.KMnO4>Cl2>H2SO4>Br2
C.KMnO4>Cl2>Br2>H2SO4
D.H2SO4>Br2>Cl2>KMnO4
C
解析 根据反应①Cl2+2KBr===2KCl+Br2可知氧化剂是Cl2,氧化产物是Br2,所以氧化性:Cl2>Br2;根据反应②Br2+H2SO3+H2O===2HBr+H2SO4可知氧化剂是Br2,氧化产物是H2SO4,所以氧化性:Br2>H2SO4;根据反应③2KMnO4+16HCl(浓) ===2KCl+2MnCl2+5Cl2↑+8H2O可知氧化剂是KMnO4,氧化产物是Cl2,所以氧化性:KMnO4>Cl2。综合上述分析,物质氧化性由强到弱的顺序是KMnO4>Cl2>Br2>H2SO4。
学以致用·随堂检测全达标
1
2
3
4
1.航母等舰艇的船底都涂有含Cu2O的防污涂料,制备Cu2O的一种方法为Zn+2CuSO4+2NaOH===Cu2O+ZnSO4+Na2SO4+H2O,下列有关该反应的说法正确的是( )
A.Zn失去电子,作氧化剂
B.CuSO4被氧化
C.NaOH是还原剂,失去电子
D.CuSO4是氧化剂
D
解析 反应中Zn元素化合价升高,失去电子,Zn作还原剂;Cu元素化合价降低,得到电子,硫酸铜作氧化剂,被还原;NaOH中的元素化合价未发生变化,既不是氧化剂,也不是还原剂。D项正确。
1
2
3
4
2.下列化学变化需要加入氧化剂才能实现的是( )
A.KMnO4→O2 B.C→CO2
C.CuO→Cu D.H2SO4→BaSO4
B
解析 A项中高锰酸钾自身分解可以生成O2,其本身既是氧化剂又是还原剂,不需另加氧化剂;B项中碳元素的化合价升高,发生氧化反应,需要添加氧化剂才能发生;C项变化中铜元素化合价降低,发生还原反应,需要加入还原剂才能发生;D项变化中各元素的化合价未发生变化,通过复分解反应可以实现。
1
2
3
4
3.下列各组微粒中,在一定条件下均可以作氧化剂的是( )
A.Fe、H2O、CO2
B.Fe3+、
C.Cl2、HClO、Mg
D.ClO-、Cl-、Ag+
B
解析 A项中铁元素化合价为0价,是铁元素的最低化合价,铁单质只有还原性,不能作氧化剂;B项中铁、锰、氮元素化合价都处于高价态,Fe3+、
在一定条件下都可以作氧化剂;C项中镁元素化合价为0价,是镁元素的最低化合价,镁单质不能作氧化剂;D项Cl-中氯元素化合价为-1价,是氯元素的最低化合价,Cl-只有还原性,不能作氧化剂。
1
2
3
4
4.下列电子转移方向和数目的表示不正确的是( )
D
1
2
3
4
解析 D项反应中氧元素化合价由-2价升高到0价,升高2价,高锰酸钾中的锰元素化合价分别降低1价和3价,2 mol KMnO4在反应中得失电子数目为4NA,电子转移方向和数目的正确表示为 ,D项符合题目要求。
本 课 结 束
专题3
第一单元 第3课时 氧化还原反应
素养 目标
1.认识氧化还原反应,了解氧化还原反应的本质。
2.了解氧化剂、还原剂、氧化性、还原性、氧化反应、还原反应等概念。
3.通过氧化还原反应的本质分析,培养宏观辨识与微观探析的核心素养。
4.学习氧化还原反应中电子转移的表示,了解氧化还原反应计算中的守恒思想。
基础落实·必备知识全过关
重难探究·能力素养全提升
学以致用·随堂检测全达标
目录索引
基础落实·必备知识全过关
自主梳理
1.氧化还原反应的概念
(1)反应类型:
“升失氧、降得还,剂性一致、其他相反”
升高
降低
有电子转移
(2)反应物:
(3)物质性质:
得到
失去
得到
失去
2.氧化还原反应的实质与表示
(1)氧化还原反应的实质是反应中有 。
(2)用双线桥表示二氧化锰与浓盐酸的反应中电子转移的方向和数目:
。反应中氧化剂是 ,还原剂是 。若1 mol MnO2参与反应,则被氧化的氯化氢的物质的量为 ,反应中电子转移数目为 个。
3.氧化还原反应中,元素化合价升高与降低总数相等,氧化剂 电子的数目与还原剂 电子的数目相等。
电子的转移
MnO2
HCl
2 mol
2NA
得到
失去
自我检测
判断下列说法是否正确,正确的画“√”,错误的画“×”。
(1)氧化还原反应是元素化合价发生变化的反应,所以元素化合价发生变化是氧化还原反应的本质。( )
(2)元素化合价升高,即发生氧化反应。( )
(3)在氧化还原反应中,还原剂被氧化,氧化剂被还原。( )
(4)反应中一种物质被氧化,必定有另一种物质被还原。( )
(5)氧化反应和还原反应一定同时发生。( )
(6)氧化还原反应中物质得到和失去电子的数目一定相等。( )
×
√
√
×
√
√
重难探究·能力素养全提升
探究一 氧化还原反应的相关概念
情境探究
(1)氧化还原反应中,元素化合价发生变化的本质原因是什么
(2)什么是氧化剂,什么是还原剂 各有什么性质
提示 氧化还原反应中,元素化合价发生变化本质原因是电子发生转移。
提示 在氧化还原反应中,失去电子的物质是还原剂,还原剂具有还原性;得到电子的物质是氧化剂,氧化剂具有氧化性。
(3)如何比较物质的氧化性、还原性强弱 氧化性或还原性强弱与电子得失数目是否有关系
提示 可以根据氧化还原反应规律来判断,较强氧化性的氧化剂跟较强还原性的还原剂反应,生成弱还原性的还原产物和弱氧化性的氧化产物,即
氧化性:氧化剂>氧化产物;还原性:还原剂>还原产物。
氧化性、还原性强弱与反应中得失电子数目无关。
知识归纳
1.氧化还原反应中的相关概念
概念 定义
氧化剂 得到电子的反应物
还原剂 失去电子的反应物
氧化反应 失去电子的反应
还原反应 得到电子的反应
被氧化 还原剂失去电子被氧化
被还原 氧化剂得到电子被还原
氧化产物 氧化反应的产物
还原产物 还原反应的产物
氧化剂得电子,所含元素化合价降低,发生还原反应,得到还原产物;还原剂失电子,所含元素化合价升高,发生氧化反应,得到氧化产物。
2.氧化反应和还原反应一定同时进行,有物质被氧化,同时必然有物质被还原,氧化反应和还原反应必然同时存在于一个反应中。氧化剂、还原剂可能是不同种物质,也可能是同种物质,如反应Cl2+2NaOH===NaCl+NaClO+H2O中,Cl2既是氧化剂,又是还原剂。
应用体验
1.[2023河北唐山高一期中]工业上通过反应2Al2O3+3C+6Cl2 4AlCl3+3CO2制取无水氯化铝,关于该反应下列说法正确的是( )
A.该反应中,Al元素被氧化
B.每生成1个CO2分子,转移2个电子
C.该反应中,Cl2得电子被还原
D.该反应中,C发生还原反应
C
解析 Al2O3和AlCl3中Al元素化合价均显+3价,Al元素化合价未变化,A错误;C→CO2,C元素由0价升高到+4价,发生氧化反应,故生成1个CO2分子,转移4个电子,B、D错误;Cl2→AlCl3,Cl元素由0价降低到-1价,故Cl2得电子被还原,C正确。
2.科学家指出,食用虾类等水生甲壳类动物的同时服用维生素C容易中毒,这是因为对人体无害的+5价砷类物质在维生素C的作用下,能够转化为有毒的+3价砷类物质。下列说法错误的是( )
A.维生素C具有还原性
B.+5价砷转化为+3价砷时,得到电子
C.上述过程中+5价砷类物质是还原剂
D.上述过程中砷元素发生还原反应
C
解析 根据题意,+5价砷类物质在维生素C的作用下转化为有毒的+3价砷类物质,砷元素化合价降低,+5价砷类物质是氧化剂,所以维生素C是还原剂,具有还原性,A、C项不符合题意;反应中砷元素化合价降低,得到电子,B项不符合题意;砷元素由+5价变为+3价,化合价降低发生还原反应,D项不符合题意。
规律方法 判断物质在反应中表现氧化性还是还原性,可依据反应中元素化合价的变化。元素化合价升高,失去电子被氧化,物质是还原剂,表现还原性;元素化合价降低,得到电子被还原,物质是氧化剂,表现氧化性。可简记为:升、失、氧,降、得、还;若说剂,正相反。
3.[2023河北石家庄外国语学校高一期中]下列有关氧化还原反应的叙述中,正确的是( )
A.在氧化还原反应中,物质失去的电子数越多,其还原性越强
B.阳离子只具有氧化性,阴离子只具有还原性
C.在氧化还原反应中不一定所有元素的化合价都发生改变
D.氧化剂被还原,化合价升高
C
解析 还原性的强弱与失电子的数目无关,只与失电子的难易程度有关,A错误;阳离子可以既有氧化性又有还原性,如Fe2+,阴离子也可以既有氧化性又有还原性,如 ,B错误;氧化还原反应中有的元素的化合价发生改变,有的元素的化合价不发生改变,如2KClO3 2KCl+3O2↑,此反应中K元素化合价不变,Cl元素、O元素化合价发生了改变,即在氧化还原反应中不一定所有元素的化合价都发生改变,C正确;氧化剂得到电子,被还原,化合价降低,D错误。
探究二 氧化性、还原性
情境探究
(1)反应中氧化剂得到电子,表现氧化性,还原剂失去电子,表现还原性。在氧化还原反应中一种物质被氧化的同时,一定是另一种物质被还原吗 请举例说明。
提示 在氧化还原反应中,不一定是一种物质被氧化的同时,另一种物质被还原。例如氯气与水的反应中,氯气既是氧化剂又是还原剂。
(2)物质的氧化性、还原性与其中元素化合价的高低有什么关系
(3)如何根据已知反应比较物质的氧化性、还原性强弱
提示 当物质所含元素处于最高价时,该元素的化合价只能降低,反应中只能被还原,只表现氧化性;当元素处于最低价态时,该元素的化合价只能升高,反应中只能被氧化,只表现还原性;当元素处于中间价态时,反应中该元素的化合价可能升高,也可能降低,该元素可能会表现还原性,也可能表现氧化性。
提示 对于自发进行的氧化还原反应,氧化剂的氧化性强于氧化产物的氧化性,还原剂的还原性强于还原产物的还原性。
知识归纳
判断物质的氧化性、还原性强弱的方法归纳
(1)根据金属活动性顺序判断氧化性、还原性强弱。
(2)根据非金属活动性顺序来判断。
(3)根据已知氧化还原反应判断。
反应物中氧化剂的氧化性强于生成物中氧化产物的氧化性;反应物中还原剂的还原性强于生成物中还原产物的还原性。
(4)根据氧化还原反应发生的条件来判断。如:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O,2KMnO4+16HCl(浓) ===2MnCl2+2KCl+5Cl2↑+8H2O,由于高锰酸钾与浓盐酸的反应不需要加热,所以氧化性:KMnO4>MnO2。
应用体验
1.实验室制备少量氯气可利用如下反应:KMnO4+HCl(浓)→KCl+MnCl2+Cl2↑+H2O(未配平),该反应常温下就可迅速进行。
请回答下列问题:
(1)上述反应中被氧化的元素为 (填元素符号),还原产物是 (填化学式)。
(2)Fe2+也能与 反应生成Mn2+,反应后Fe2+转化为 。反应中Fe2+表现 (填“氧化”或“还原”,下同)性,发生
反应。
(3)如果上述化学方程式中KMnO4和MnCl2的化学计量数都是2,则HCl的化学计量数是 。
(4)实验室通常利用MnO2与浓盐酸共热反应制得氯气,据此可知KMnO4、Cl2、MnO2三种物质的氧化性由强到弱的顺序为 (用化学式表示)。
答案 (1)Cl MnCl2
(2)Fe3+ 还原 氧化 (3)16
(4)KMnO4>MnO2>Cl2
解析 (1)反应中,氯元素的化合价升高,被氧化,Mn元素的化合价降低,被还原,MnCl2是还原产物。
(2) 将Fe2+氧化为Fe3+,Fe元素的化合价升高,作还原剂,发生氧化反应。
(3)根据得失电子守恒和元素质量守恒,可知反应的化学方程式为2KMnO4+16HCl(浓) ===2KCl+2MnCl2+5Cl2↑+8H2O。
(4)根据反应2KMnO4+16HCl(浓) ===2KCl+2MnCl2+5Cl2↑+8H2O可知,氧化性:KMnO4>Cl2;MnO2与浓盐酸共热反应制得Cl2,故氧化性:MnO2>Cl2;KMnO4常温下将HCl氧化成Cl2,MnO2加热时将HCl氧化成Cl2,故氧化性:KMnO4>MnO2。
2.根据下列反应,判断有关物质的氧化性由强到弱的顺序是( )
①Cl2+2KBr===2KCl+Br2
②Br2+H2SO3+H2O===2HBr+H2SO4
③2KMnO4+16HCl(浓) ===2KCl+2MnCl2+5Cl2↑+8H2O
A.Cl2>KMnO4>Br2>H2SO4
B.KMnO4>Cl2>H2SO4>Br2
C.KMnO4>Cl2>Br2>H2SO4
D.H2SO4>Br2>Cl2>KMnO4
C
解析 根据反应①Cl2+2KBr===2KCl+Br2可知氧化剂是Cl2,氧化产物是Br2,所以氧化性:Cl2>Br2;根据反应②Br2+H2SO3+H2O===2HBr+H2SO4可知氧化剂是Br2,氧化产物是H2SO4,所以氧化性:Br2>H2SO4;根据反应③2KMnO4+16HCl(浓) ===2KCl+2MnCl2+5Cl2↑+8H2O可知氧化剂是KMnO4,氧化产物是Cl2,所以氧化性:KMnO4>Cl2。综合上述分析,物质氧化性由强到弱的顺序是KMnO4>Cl2>Br2>H2SO4。
学以致用·随堂检测全达标
1
2
3
4
1.航母等舰艇的船底都涂有含Cu2O的防污涂料,制备Cu2O的一种方法为Zn+2CuSO4+2NaOH===Cu2O+ZnSO4+Na2SO4+H2O,下列有关该反应的说法正确的是( )
A.Zn失去电子,作氧化剂
B.CuSO4被氧化
C.NaOH是还原剂,失去电子
D.CuSO4是氧化剂
D
解析 反应中Zn元素化合价升高,失去电子,Zn作还原剂;Cu元素化合价降低,得到电子,硫酸铜作氧化剂,被还原;NaOH中的元素化合价未发生变化,既不是氧化剂,也不是还原剂。D项正确。
1
2
3
4
2.下列化学变化需要加入氧化剂才能实现的是( )
A.KMnO4→O2 B.C→CO2
C.CuO→Cu D.H2SO4→BaSO4
B
解析 A项中高锰酸钾自身分解可以生成O2,其本身既是氧化剂又是还原剂,不需另加氧化剂;B项中碳元素的化合价升高,发生氧化反应,需要添加氧化剂才能发生;C项变化中铜元素化合价降低,发生还原反应,需要加入还原剂才能发生;D项变化中各元素的化合价未发生变化,通过复分解反应可以实现。
1
2
3
4
3.下列各组微粒中,在一定条件下均可以作氧化剂的是( )
A.Fe、H2O、CO2
B.Fe3+、
C.Cl2、HClO、Mg
D.ClO-、Cl-、Ag+
B
解析 A项中铁元素化合价为0价,是铁元素的最低化合价,铁单质只有还原性,不能作氧化剂;B项中铁、锰、氮元素化合价都处于高价态,Fe3+、
在一定条件下都可以作氧化剂;C项中镁元素化合价为0价,是镁元素的最低化合价,镁单质不能作氧化剂;D项Cl-中氯元素化合价为-1价,是氯元素的最低化合价,Cl-只有还原性,不能作氧化剂。
1
2
3
4
4.下列电子转移方向和数目的表示不正确的是( )
D
1
2
3
4
解析 D项反应中氧元素化合价由-2价升高到0价,升高2价,高锰酸钾中的锰元素化合价分别降低1价和3价,2 mol KMnO4在反应中得失电子数目为4NA,电子转移方向和数目的正确表示为 ,D项符合题目要求。
本 课 结 束
