3.2.1 钠的性质与制备 课件(共38张PPT)2023-2024学年高一化学苏教版必修一
文档属性
| 名称 | 3.2.1 钠的性质与制备 课件(共38张PPT)2023-2024学年高一化学苏教版必修一 |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-07 00:00:00 | ||
图片预览










文档简介
(共38张PPT)
专题3
第二单元 第1课时 钠的性质与制备
素养 目标
1.了解钠的物理性质,认识钠是一种很活泼的金属;了解钠的存在、用途及制备方法。
2.能够用实验的方法探究钠及其氧化物的性质。
3.通过实验操作及观察,培养证据推理与模型认知的核心素养。
基础落实·必备知识全过关
重难探究·能力素养全提升
学以致用·随堂检测全达标
目录索引
基础落实·必备知识全过关
自主梳理
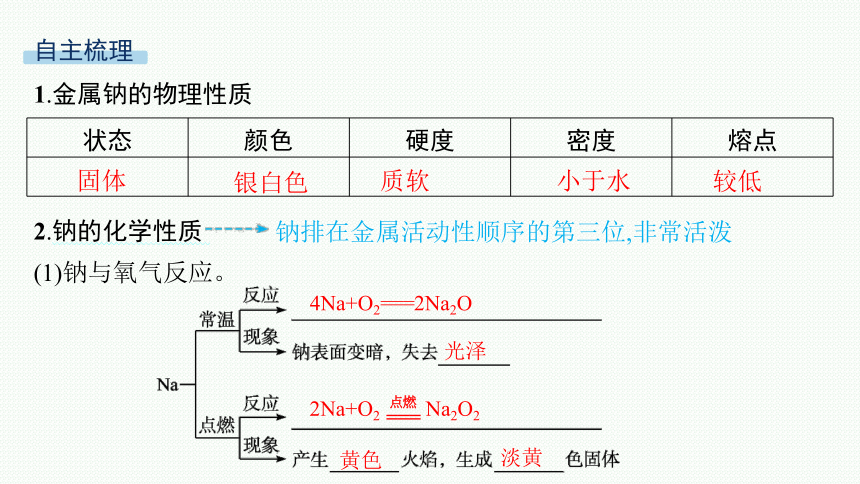
1.金属钠的物理性质
状态 颜色 硬度 密度 熔点
2.钠的化学性质
钠排在金属活动性顺序的第三位,非常活泼
(1)钠与氧气反应。
固体
银白色
质软
小于水
较低
4Na+O2===2Na2O
光泽
2Na+O2 Na2O2
===
点燃
黄色
淡黄
(2)钠与水反应。
钠与水反应, 是氧化剂, 是还原剂,用双线桥表示电子转移的方向和数目:
水
钠
3.钠的保存、制取与用途
(1)保存:实验室中将钠保存在 中,使之隔绝 。
(2)制取:工业制取钠发生反应的化学方程式为
。
(3)用途:金属钠作还原剂可用于冶炼某些金属,如冶炼Ti,反应的化学方程式为 ;可用于制作电光源;可用于制造合金,如钠、钾合金可用作 。
煤油
空气和水
2NaCl(熔融) 2Na+Cl2↑
===
通电
4Na+TiCl4 4NaCl+Ti
=======
700~800℃
快中子反应堆的热交换剂
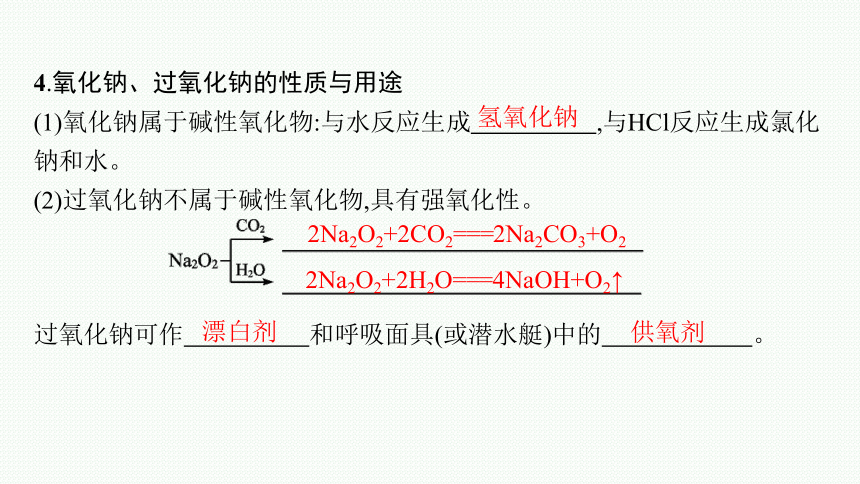
4.氧化钠、过氧化钠的性质与用途
(1)氧化钠属于碱性氧化物:与水反应生成 ,与HCl反应生成氯化钠和水。
(2)过氧化钠不属于碱性氧化物,具有强氧化性。
过氧化钠可作 和呼吸面具(或潜水艇)中的 。
氢氧化钠
2Na2O2+2CO2===2Na2CO3+O2
2Na2O2+2H2O===4NaOH+O2↑
漂白剂
供氧剂
自我检测
判断下列说法是否正确,正确的画“√”,错误的画“×”。
(1)钠原子最外层只有1个电子,反应中易失去电子形成具有稳定结构的钠离子,所以钠的化学性质稳定。( )
(2)从煤油中取出钠,用滤纸小心擦干表面的煤油,可看到钠块表面有银白色的金属光泽。( )
(3)用小刀切割钠块,可看到断面很快变暗,这是因为钠与空气中的氧气反应生成白色的氧化钠。( )
(4)用镊子夹取约绿豆粒大小的钠块,直接在酒精灯上加热,可看到钠块剧烈燃烧,生成淡黄色的过氧化钠。( )
×
×
√
×
(5)钠与氯气、氧气、水发生的反应中,钠均表现还原性。( )
(6)氧化钠、过氧化钠均为碱性氧化物。( )
(7)过氧化钠常用作呼吸面具中的供氧剂。( )
(8)利用金属钠的还原性,生产中可用金属钠置换出TiCl4水溶液中的金属钛。
( )
√
×
√
×
重难探究·能力素养全提升
探究一 金属钠的性质
情境探究
(1)金属钠与氧气在不同条件下的反应产物有什么不同
提示 常温下钠与氧气反应生成氧化钠,加热条件下钠与氧气反应生成过氧化钠。
(2)钠与水反应有哪些现象 试解释原因。
提示
实验操作 实验现象 结论或解释
钠块投入到含酚酞的水中 浮在水面上 钠密度比水小
熔化成闪亮的小球 钠的熔点低,与水反应放热
与水反应发出“嘶嘶”的响声 反应剧烈,有气体生成
小球在水面上迅速游动,逐渐变小,最终消失 产生的气体推动小球游动,反应速率大
溶液由无色逐渐变红色 有碱性物质生成
(3)氧化钠、过氧化钠都是氧化物吗 都是碱性氧化物吗
提示 氧化钠、过氧化钠都是氧化物;氧化钠是碱性氧化物,过氧化钠不是碱性氧化物。
知识归纳
1.钠与氧气的反应探究
实验操作 实验现象 实验结论
新切开的钠断面有银白色金属光泽,在空气中表面很快变暗 常温下钠与O2反应的化学方程式为4Na+O2===2Na2O
钠先熔化为闪亮小球,然后燃烧,火焰呈黄色,最后生成淡黄色固体 加热时与O2反应的化学方程式为2Na+O2 Na2O2
2.钠与酸溶液反应是否比与水反应剧烈 钠与硫酸铜溶液反应是否会析出铜
钠与水剧烈反应,酸溶液中氢离子浓度大,所以钠与酸反应比与水反应剧烈。钠与盐溶液反应,实际是先与水反应生成NaOH,氢氧化钠再与盐溶液反应,所以钠与硫酸铜溶液的反应为2Na+2H2O===2NaOH+H2↑,2NaOH+CuSO4===Cu(OH)2↓+Na2SO4,可用总化学方程式表示:2Na+CuSO4+2H2O===Cu(OH)2↓+H2↑+Na2SO4,不会析出金属铜。
3.在熔融状态下,金属钠能将熔融盐中的不活泼金属置换出来,如钠与熔融的TiCl4反应生成金属Ti,4Na+TiCl4 4NaCl+Ti,类似反应不能在水溶液中进行。
应用体验
1.[2023河北邯郸高一期末]下列关于钠的叙述中,错误的是( )
A.银白色金属
B.熔点比较低
C.具有氧化性
D.可保存在煤油中
C
解析 钠是银白色金属,A正确;钠质软,熔点比较低,B正确;钠化学性质活泼,具有较强的还原性,C错误;钠密度比煤油大,且不与煤油反应,可保存在煤油中,D正确。
2.将约绿豆粒大小的钠块投入如图所示的烧杯中,可能出现的现象是( )
A.钠块只在煤油层中游动,并放出气体
B.钠块只在水层中游动,钠块熔化,水层变红
C.钠块在煤油、水两液体界面处反应,熔化成小球并上下跳动,水层变红
D.钠块在四氯化碳、水两液体界面处反应,熔化成小球并上下跳动,水层变红
C
解析 由题图可知,三种液体的密度:四氯化碳>水>煤油,而钠的密度为0.971 g·cm-3,介于水和煤油的密度之间,故将约绿豆粒大小的钠块投入烧杯中,钠块在煤油、水两液体界面处反应,钠的下半部分与水接触并反应,产生H2推动钠向上游动,进入煤油层后,反应停止,由于钠受到的重力大于浮力,随后钠块下沉,又回落到煤油和水的界面上,重复上述过程,故钠块在水层与煤油层界面处游动并上下跳动,因反应生成NaOH,滴有少量酚酞的水变红。
3.钠与水、氧气、氯气等均能反应,下列选项正确的是( )
A.将Na投入盐酸中,Na先与水反应,生成的NaOH再与HCl反应
B.Na与氧气在常温下反应生成Na2O2,加热时反应生成Na2O
C.Na虽然能与氯气反应生成NaCl,但不能在氯气中燃烧
D.常温下,Na可以与水剧烈反应,证明Na比Fe更活泼
D
解析 将Na投入盐酸中,Na与HCl直接反应生成氢气及氯化钠,若Na过量,过量的Na再与水反应,A错误;Na与氧气在常温下反应生成Na2O,加热时反应生成Na2O2,B错误;Na在氯气中可以燃烧,C错误;常温下,Na可以与水剧烈反应,Fe与水在常温下不易反应,证明Na比Fe更活泼,D正确。
探究二 氧化钠、过氧化钠的性质和用途
情境探究
(1)氧化钠是碱性氧化物,具有哪些化学性质
(2)Na2O2投入滴有酚酞的水中,溶液先变红而后变化至无色,说明什么
提示 氧化钠是可溶性碱性氧化物,能与水、酸、酸性氧化物发生反应。氧化钠与水反应:Na2O+H2O===2NaOH;氧化钠溶于盐酸:Na2O+2HCl===2NaCl+H2O;氧化钠与CO2反应:Na2O+CO2===Na2CO3。
提示 Na2O2与水反应生成NaOH,NaOH使酚酞溶液变红,再变化至无色说明过氧化钠具有漂白性。
(3)为什么说Na2O2不是碱性氧化物
提示 Na2O2与水和CO2反应都生成O2,发生的反应是氧化还原反应。
知识归纳
1.氧化钠、过氧化钠的比较
名称 氧化钠(Na2O) 过氧化钠(Na2O2)
氧元素化合价 -2 -1
物质类别 碱性氧化物 过氧化物
物理性质 颜色、状态 白色固体 淡黄色固体
化学性质 与H2O反应 Na2O+H2O===2NaOH 2Na2O2+2H2O===4NaOH+O2↑
与CO2反应 Na2O+CO2===Na2CO3 2Na2O2+2CO2===2Na2CO3+O2
与酸反应 Na2O+2HCl===2NaCl+H2O 2Na2O2+4HCl===4NaCl+2H2O+O2↑
用途 — 漂白剂、供氧剂
2.Na2O2与CO2或H2O反应中物质的量的关系
(1)物质的量的关系:无论是CO2还是H2O,与足量的Na2O2反应时,放出O2的物质的量与CO2或H2O的物质的量之比均为1∶2。
(2)Na2O2与CO2反应中的质量关系:
2Na2O2 +2CO2===2Na2CO3+O2 Δm(固体) 电子转移
2×78 g 2 mol 2×106 g 增加56 g
(2 mol CO的质量)
固体增加的质量等于与CO2等物质的量的CO的质量,每生成1 mol O2转移2 mol电子。
2 mol
(3)Na2O2与H2O的反应中的质量关系:
2Na2O2+2H2O===4NaOH+O2↑ Δm(固体) 电子转移
2×78 g 2 mol 4×40 g 增加4 g
(2 mol H2的质量) 2 mol
固体增加的质量等于与H2O等物质的量的H2的质量,每生成1 mol O2转移2 mol电子。
3.Na2O2与CO2、H2O混合气反应的先后顺序
一定量的Na2O2与一定量CO2和H2O(g)的混合物反应,可视作Na2O2先与CO2反应,待CO2反应完成后,Na2O2再与H2O发生反应(实际反应次序不一定是这样的)。
应用体验
1.以CO2和Na2O2为原料,制取纯净干燥的O2,实验装置如下:
下列选项不正确的是( )
A.装置②中试剂可以是NaOH溶液
B.装置③的作用是干燥O2
C.收集氧气应选择装置a
D.装置②、③之间应增加盛澄清石灰水的洗气瓶
C
解析 装置②中试剂可以是NaOH溶液,用来吸收二氧化碳气体,不选A;装置③中盛有浓硫酸,作用是干燥O2,不选B;由于氧气密度大于空气,收集O2选择装置b,选C;装置②、③之间应增加盛澄清石灰水的洗气瓶,验证二氧化碳是否除尽,不选D。
2.下列判断正确的是( )
A.可用水来检验某Na2O粉末中是否含有Na2O2
B.可用CO2来检验某Na2O粉末中是否含有Na2O2
C.可利用在纯氧气中加热的方法除去Na2O中的Na2O2
D.将足量的Na2O2、Na2O分别加到酚酞溶液中,最终溶液均为红色
A
解析 氧化钠与水反应生成氢氧化钠,过氧化钠与水反应生成氢氧化钠和氧气,因此可用水来确定某Na2O粉末中是否含有Na2O2,A项正确;虽然二氧化碳与氧化钠反应生成碳酸钠,过氧化钠与二氧化碳反应生成碳酸钠和氧气,反应产物不同,但过氧化钠与二氧化碳反应过程中无明显现象,不可用CO2来确定某Na2O粉末中是否含有Na2O2,B项错误;氧化钠在纯O2中加热生成过氧化钠,不能用在纯氧气中加热的方法除去Na2O中的Na2O2,C项错误;氧化钠加入酚酞溶液中与水反应生成氢氧化钠,碱使酚酞溶液变红色,过氧化钠加入酚酞溶液中生成氢氧化钠和氧气,氢氧化钠使酚酞溶液变红色,但由于过氧化钠具有漂白作用,能使溶液红色褪去,所以溶液先变红色后褪色,两者现象不同,D项错误。
学以致用·随堂检测全达标
1
2
3
4
5
1.钠在自然界中最主要的存在形式是( )
A.游离态 B.氯化钠
C.硫酸钠 D.硝酸钠
B
解析 海水中含有大量的氯化钠,氯化钠是钠元素在自然界中的主要存在形式。
1
2
3
4
5
2.在实验室中,通常将金属钠保存在( )
A.水中 B.煤油中
C.四氯化碳中 D.汽油中
B
解析 金属钠与水剧烈反应,所以不能保存在水中,A错误;金属钠与煤油不反应,且密度比煤油大,沉于煤油底部与空气隔绝,所以钠能保存在煤油中,B正确;金属钠与四氯化碳不反应,但密度比四氯化碳小,浮于上面能接触到空气,所以钠不能保存在四氯化碳中,C错误;金属钠与汽油不反应,密度比汽油大,但汽油的沸点低于煤油,易挥发,所以钠不能保存在汽油中,D错误。
1
2
3
4
5
3.下列关于Na和Na+的叙述错误的是( )
A.它们相差一个电子层
B.它们的化学性质相似
C.钠原子、钠离子均为钠元素
D.灼烧时,它们的焰色反应都呈黄色
B
解析 钠原子有3个电子层,钠离子有2个电子层,它们相差一个电子层,A项正确;Na和Na+的化学性质相差很大,B项错误;钠原子、钠离子的核电荷数均为11,同属于钠元素,C项正确;焰色反应属于元素的性质,灼烧时,它们的焰色反应都是黄色,D项正确。
1
2
3
4
5
4.下列关于钠的叙述正确的是( )
A.钠的氧化物都是碱性氧化物
B.金属钠久置空气中最终转变为Na2O2
C.钠可以将钛、铌等金属从其熔融的氯化物中置换出来
D.过氧化钠只具有氧化性不具有还原性
C
解析 过氧化钠属于过氧化物,不是碱性氧化物,A错误;金属钠久置空气中最终转变为Na2CO3,B错误;钠的还原性强,钠可以将钛、铌等金属从其熔融的氯化物中置换出来,C正确;过氧化钠中的氧元素化合价为-1价,氧元素化合价既可以升高又可以降低,所以过氧化钠既有氧化性又有还原性,在Na2O2与水或CO2的反应中,Na2O2既是氧化剂又是还原剂,D错误。
1
2
3
4
5
5.下列对Na2O和Na2O2的叙述正确的是( )
A.Na2O、Na2O2均能与盐酸反应生成NaCl,二者都是碱性氧化物
B.Na2O2在空气中易变质,需要密封保存,Na2O性质稳定,不必密封保存
C.Na2O2与H2O反应时,H2O既不是氧化剂也不是还原剂
D.将Na2O2放入氢氧化钠溶液中,不发生反应,无明显现象
C
1
2
3
4
5
解析 Na2O、Na2O2均能与盐酸反应生成NaCl,氧化钠是碱性氧化物,由于过氧化钠和盐酸反应还生成氧气,故不属于碱性氧化物,A错误;Na2O2在空气中易变质,需要密封保存,Na2O能与空气中的水和CO2反应,也需要密封保存,B错误;Na2O2与H2O的反应中,过氧化钠中的氧元素的化合价一部分升高、另一部分降低,过氧化钠既是氧化剂又是还原剂,H2O既不是氧化剂也不是还原剂,C正确;将Na2O2放入氢氧化钠溶液中,与水发生反应生成氢氧化钠和氧气,有明显现象,D错误。
本 课 结 束
专题3
第二单元 第1课时 钠的性质与制备
素养 目标
1.了解钠的物理性质,认识钠是一种很活泼的金属;了解钠的存在、用途及制备方法。
2.能够用实验的方法探究钠及其氧化物的性质。
3.通过实验操作及观察,培养证据推理与模型认知的核心素养。
基础落实·必备知识全过关
重难探究·能力素养全提升
学以致用·随堂检测全达标
目录索引
基础落实·必备知识全过关
自主梳理
1.金属钠的物理性质
状态 颜色 硬度 密度 熔点
2.钠的化学性质
钠排在金属活动性顺序的第三位,非常活泼
(1)钠与氧气反应。
固体
银白色
质软
小于水
较低
4Na+O2===2Na2O
光泽
2Na+O2 Na2O2
===
点燃
黄色
淡黄
(2)钠与水反应。
钠与水反应, 是氧化剂, 是还原剂,用双线桥表示电子转移的方向和数目:
水
钠
3.钠的保存、制取与用途
(1)保存:实验室中将钠保存在 中,使之隔绝 。
(2)制取:工业制取钠发生反应的化学方程式为
。
(3)用途:金属钠作还原剂可用于冶炼某些金属,如冶炼Ti,反应的化学方程式为 ;可用于制作电光源;可用于制造合金,如钠、钾合金可用作 。
煤油
空气和水
2NaCl(熔融) 2Na+Cl2↑
===
通电
4Na+TiCl4 4NaCl+Ti
=======
700~800℃
快中子反应堆的热交换剂
4.氧化钠、过氧化钠的性质与用途
(1)氧化钠属于碱性氧化物:与水反应生成 ,与HCl反应生成氯化钠和水。
(2)过氧化钠不属于碱性氧化物,具有强氧化性。
过氧化钠可作 和呼吸面具(或潜水艇)中的 。
氢氧化钠
2Na2O2+2CO2===2Na2CO3+O2
2Na2O2+2H2O===4NaOH+O2↑
漂白剂
供氧剂
自我检测
判断下列说法是否正确,正确的画“√”,错误的画“×”。
(1)钠原子最外层只有1个电子,反应中易失去电子形成具有稳定结构的钠离子,所以钠的化学性质稳定。( )
(2)从煤油中取出钠,用滤纸小心擦干表面的煤油,可看到钠块表面有银白色的金属光泽。( )
(3)用小刀切割钠块,可看到断面很快变暗,这是因为钠与空气中的氧气反应生成白色的氧化钠。( )
(4)用镊子夹取约绿豆粒大小的钠块,直接在酒精灯上加热,可看到钠块剧烈燃烧,生成淡黄色的过氧化钠。( )
×
×
√
×
(5)钠与氯气、氧气、水发生的反应中,钠均表现还原性。( )
(6)氧化钠、过氧化钠均为碱性氧化物。( )
(7)过氧化钠常用作呼吸面具中的供氧剂。( )
(8)利用金属钠的还原性,生产中可用金属钠置换出TiCl4水溶液中的金属钛。
( )
√
×
√
×
重难探究·能力素养全提升
探究一 金属钠的性质
情境探究
(1)金属钠与氧气在不同条件下的反应产物有什么不同
提示 常温下钠与氧气反应生成氧化钠,加热条件下钠与氧气反应生成过氧化钠。
(2)钠与水反应有哪些现象 试解释原因。
提示
实验操作 实验现象 结论或解释
钠块投入到含酚酞的水中 浮在水面上 钠密度比水小
熔化成闪亮的小球 钠的熔点低,与水反应放热
与水反应发出“嘶嘶”的响声 反应剧烈,有气体生成
小球在水面上迅速游动,逐渐变小,最终消失 产生的气体推动小球游动,反应速率大
溶液由无色逐渐变红色 有碱性物质生成
(3)氧化钠、过氧化钠都是氧化物吗 都是碱性氧化物吗
提示 氧化钠、过氧化钠都是氧化物;氧化钠是碱性氧化物,过氧化钠不是碱性氧化物。
知识归纳
1.钠与氧气的反应探究
实验操作 实验现象 实验结论
新切开的钠断面有银白色金属光泽,在空气中表面很快变暗 常温下钠与O2反应的化学方程式为4Na+O2===2Na2O
钠先熔化为闪亮小球,然后燃烧,火焰呈黄色,最后生成淡黄色固体 加热时与O2反应的化学方程式为2Na+O2 Na2O2
2.钠与酸溶液反应是否比与水反应剧烈 钠与硫酸铜溶液反应是否会析出铜
钠与水剧烈反应,酸溶液中氢离子浓度大,所以钠与酸反应比与水反应剧烈。钠与盐溶液反应,实际是先与水反应生成NaOH,氢氧化钠再与盐溶液反应,所以钠与硫酸铜溶液的反应为2Na+2H2O===2NaOH+H2↑,2NaOH+CuSO4===Cu(OH)2↓+Na2SO4,可用总化学方程式表示:2Na+CuSO4+2H2O===Cu(OH)2↓+H2↑+Na2SO4,不会析出金属铜。
3.在熔融状态下,金属钠能将熔融盐中的不活泼金属置换出来,如钠与熔融的TiCl4反应生成金属Ti,4Na+TiCl4 4NaCl+Ti,类似反应不能在水溶液中进行。
应用体验
1.[2023河北邯郸高一期末]下列关于钠的叙述中,错误的是( )
A.银白色金属
B.熔点比较低
C.具有氧化性
D.可保存在煤油中
C
解析 钠是银白色金属,A正确;钠质软,熔点比较低,B正确;钠化学性质活泼,具有较强的还原性,C错误;钠密度比煤油大,且不与煤油反应,可保存在煤油中,D正确。
2.将约绿豆粒大小的钠块投入如图所示的烧杯中,可能出现的现象是( )
A.钠块只在煤油层中游动,并放出气体
B.钠块只在水层中游动,钠块熔化,水层变红
C.钠块在煤油、水两液体界面处反应,熔化成小球并上下跳动,水层变红
D.钠块在四氯化碳、水两液体界面处反应,熔化成小球并上下跳动,水层变红
C
解析 由题图可知,三种液体的密度:四氯化碳>水>煤油,而钠的密度为0.971 g·cm-3,介于水和煤油的密度之间,故将约绿豆粒大小的钠块投入烧杯中,钠块在煤油、水两液体界面处反应,钠的下半部分与水接触并反应,产生H2推动钠向上游动,进入煤油层后,反应停止,由于钠受到的重力大于浮力,随后钠块下沉,又回落到煤油和水的界面上,重复上述过程,故钠块在水层与煤油层界面处游动并上下跳动,因反应生成NaOH,滴有少量酚酞的水变红。
3.钠与水、氧气、氯气等均能反应,下列选项正确的是( )
A.将Na投入盐酸中,Na先与水反应,生成的NaOH再与HCl反应
B.Na与氧气在常温下反应生成Na2O2,加热时反应生成Na2O
C.Na虽然能与氯气反应生成NaCl,但不能在氯气中燃烧
D.常温下,Na可以与水剧烈反应,证明Na比Fe更活泼
D
解析 将Na投入盐酸中,Na与HCl直接反应生成氢气及氯化钠,若Na过量,过量的Na再与水反应,A错误;Na与氧气在常温下反应生成Na2O,加热时反应生成Na2O2,B错误;Na在氯气中可以燃烧,C错误;常温下,Na可以与水剧烈反应,Fe与水在常温下不易反应,证明Na比Fe更活泼,D正确。
探究二 氧化钠、过氧化钠的性质和用途
情境探究
(1)氧化钠是碱性氧化物,具有哪些化学性质
(2)Na2O2投入滴有酚酞的水中,溶液先变红而后变化至无色,说明什么
提示 氧化钠是可溶性碱性氧化物,能与水、酸、酸性氧化物发生反应。氧化钠与水反应:Na2O+H2O===2NaOH;氧化钠溶于盐酸:Na2O+2HCl===2NaCl+H2O;氧化钠与CO2反应:Na2O+CO2===Na2CO3。
提示 Na2O2与水反应生成NaOH,NaOH使酚酞溶液变红,再变化至无色说明过氧化钠具有漂白性。
(3)为什么说Na2O2不是碱性氧化物
提示 Na2O2与水和CO2反应都生成O2,发生的反应是氧化还原反应。
知识归纳
1.氧化钠、过氧化钠的比较
名称 氧化钠(Na2O) 过氧化钠(Na2O2)
氧元素化合价 -2 -1
物质类别 碱性氧化物 过氧化物
物理性质 颜色、状态 白色固体 淡黄色固体
化学性质 与H2O反应 Na2O+H2O===2NaOH 2Na2O2+2H2O===4NaOH+O2↑
与CO2反应 Na2O+CO2===Na2CO3 2Na2O2+2CO2===2Na2CO3+O2
与酸反应 Na2O+2HCl===2NaCl+H2O 2Na2O2+4HCl===4NaCl+2H2O+O2↑
用途 — 漂白剂、供氧剂
2.Na2O2与CO2或H2O反应中物质的量的关系
(1)物质的量的关系:无论是CO2还是H2O,与足量的Na2O2反应时,放出O2的物质的量与CO2或H2O的物质的量之比均为1∶2。
(2)Na2O2与CO2反应中的质量关系:
2Na2O2 +2CO2===2Na2CO3+O2 Δm(固体) 电子转移
2×78 g 2 mol 2×106 g 增加56 g
(2 mol CO的质量)
固体增加的质量等于与CO2等物质的量的CO的质量,每生成1 mol O2转移2 mol电子。
2 mol
(3)Na2O2与H2O的反应中的质量关系:
2Na2O2+2H2O===4NaOH+O2↑ Δm(固体) 电子转移
2×78 g 2 mol 4×40 g 增加4 g
(2 mol H2的质量) 2 mol
固体增加的质量等于与H2O等物质的量的H2的质量,每生成1 mol O2转移2 mol电子。
3.Na2O2与CO2、H2O混合气反应的先后顺序
一定量的Na2O2与一定量CO2和H2O(g)的混合物反应,可视作Na2O2先与CO2反应,待CO2反应完成后,Na2O2再与H2O发生反应(实际反应次序不一定是这样的)。
应用体验
1.以CO2和Na2O2为原料,制取纯净干燥的O2,实验装置如下:
下列选项不正确的是( )
A.装置②中试剂可以是NaOH溶液
B.装置③的作用是干燥O2
C.收集氧气应选择装置a
D.装置②、③之间应增加盛澄清石灰水的洗气瓶
C
解析 装置②中试剂可以是NaOH溶液,用来吸收二氧化碳气体,不选A;装置③中盛有浓硫酸,作用是干燥O2,不选B;由于氧气密度大于空气,收集O2选择装置b,选C;装置②、③之间应增加盛澄清石灰水的洗气瓶,验证二氧化碳是否除尽,不选D。
2.下列判断正确的是( )
A.可用水来检验某Na2O粉末中是否含有Na2O2
B.可用CO2来检验某Na2O粉末中是否含有Na2O2
C.可利用在纯氧气中加热的方法除去Na2O中的Na2O2
D.将足量的Na2O2、Na2O分别加到酚酞溶液中,最终溶液均为红色
A
解析 氧化钠与水反应生成氢氧化钠,过氧化钠与水反应生成氢氧化钠和氧气,因此可用水来确定某Na2O粉末中是否含有Na2O2,A项正确;虽然二氧化碳与氧化钠反应生成碳酸钠,过氧化钠与二氧化碳反应生成碳酸钠和氧气,反应产物不同,但过氧化钠与二氧化碳反应过程中无明显现象,不可用CO2来确定某Na2O粉末中是否含有Na2O2,B项错误;氧化钠在纯O2中加热生成过氧化钠,不能用在纯氧气中加热的方法除去Na2O中的Na2O2,C项错误;氧化钠加入酚酞溶液中与水反应生成氢氧化钠,碱使酚酞溶液变红色,过氧化钠加入酚酞溶液中生成氢氧化钠和氧气,氢氧化钠使酚酞溶液变红色,但由于过氧化钠具有漂白作用,能使溶液红色褪去,所以溶液先变红色后褪色,两者现象不同,D项错误。
学以致用·随堂检测全达标
1
2
3
4
5
1.钠在自然界中最主要的存在形式是( )
A.游离态 B.氯化钠
C.硫酸钠 D.硝酸钠
B
解析 海水中含有大量的氯化钠,氯化钠是钠元素在自然界中的主要存在形式。
1
2
3
4
5
2.在实验室中,通常将金属钠保存在( )
A.水中 B.煤油中
C.四氯化碳中 D.汽油中
B
解析 金属钠与水剧烈反应,所以不能保存在水中,A错误;金属钠与煤油不反应,且密度比煤油大,沉于煤油底部与空气隔绝,所以钠能保存在煤油中,B正确;金属钠与四氯化碳不反应,但密度比四氯化碳小,浮于上面能接触到空气,所以钠不能保存在四氯化碳中,C错误;金属钠与汽油不反应,密度比汽油大,但汽油的沸点低于煤油,易挥发,所以钠不能保存在汽油中,D错误。
1
2
3
4
5
3.下列关于Na和Na+的叙述错误的是( )
A.它们相差一个电子层
B.它们的化学性质相似
C.钠原子、钠离子均为钠元素
D.灼烧时,它们的焰色反应都呈黄色
B
解析 钠原子有3个电子层,钠离子有2个电子层,它们相差一个电子层,A项正确;Na和Na+的化学性质相差很大,B项错误;钠原子、钠离子的核电荷数均为11,同属于钠元素,C项正确;焰色反应属于元素的性质,灼烧时,它们的焰色反应都是黄色,D项正确。
1
2
3
4
5
4.下列关于钠的叙述正确的是( )
A.钠的氧化物都是碱性氧化物
B.金属钠久置空气中最终转变为Na2O2
C.钠可以将钛、铌等金属从其熔融的氯化物中置换出来
D.过氧化钠只具有氧化性不具有还原性
C
解析 过氧化钠属于过氧化物,不是碱性氧化物,A错误;金属钠久置空气中最终转变为Na2CO3,B错误;钠的还原性强,钠可以将钛、铌等金属从其熔融的氯化物中置换出来,C正确;过氧化钠中的氧元素化合价为-1价,氧元素化合价既可以升高又可以降低,所以过氧化钠既有氧化性又有还原性,在Na2O2与水或CO2的反应中,Na2O2既是氧化剂又是还原剂,D错误。
1
2
3
4
5
5.下列对Na2O和Na2O2的叙述正确的是( )
A.Na2O、Na2O2均能与盐酸反应生成NaCl,二者都是碱性氧化物
B.Na2O2在空气中易变质,需要密封保存,Na2O性质稳定,不必密封保存
C.Na2O2与H2O反应时,H2O既不是氧化剂也不是还原剂
D.将Na2O2放入氢氧化钠溶液中,不发生反应,无明显现象
C
1
2
3
4
5
解析 Na2O、Na2O2均能与盐酸反应生成NaCl,氧化钠是碱性氧化物,由于过氧化钠和盐酸反应还生成氧气,故不属于碱性氧化物,A错误;Na2O2在空气中易变质,需要密封保存,Na2O能与空气中的水和CO2反应,也需要密封保存,B错误;Na2O2与H2O的反应中,过氧化钠中的氧元素的化合价一部分升高、另一部分降低,过氧化钠既是氧化剂又是还原剂,H2O既不是氧化剂也不是还原剂,C正确;将Na2O2放入氢氧化钠溶液中,与水发生反应生成氢氧化钠和氧气,有明显现象,D错误。
本 课 结 束
