2.1 钠及其化合物 同步练习 (含解析)2023-2024学年高一上学期人教版(2019)化学必修第一册
文档属性
| 名称 | 2.1 钠及其化合物 同步练习 (含解析)2023-2024学年高一上学期人教版(2019)化学必修第一册 |

|
|
| 格式 | docx | ||
| 文件大小 | 96.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-08 09:36:05 | ||
图片预览



文档简介
2.1 钠及其化合物 同步练习题
一、选择题
1.将绿豆大小的金属钠投入干燥的热坩埚中,继续加热,片刻钠熔化,然后立即撤掉酒精灯,观察到:钠剧烈燃烧,发出黄色火焰,得到一种淡黄色固体。下列说法不正确的是
A.用干燥的坩埚是为了避免钠与水反应 B.金属钠熔化说明其熔点低于坩埚
C.黄色火焰说明燃烧升温已使钠气化 D.得到淡黄色固体说明发生了物理变化
2.下列离子方程式中,正确的是
A.将氧化铜与稀硫酸混合:
B.氢氧化钡与硫酸反应:
C.盐酸滴在石灰石上:
D.金属钠投到水中:
3.下列关于“焰色反应”的理解正确的是
A.只有金属单质才有焰色反应
B.只有金属化合物才有焰色反应
C.只有某些金属或其化合物才有焰色反应
D.所有金属元素都有焰色反应
4.下列行为不符合实验室安全要求的是
A.金属钠着火可以用干燥的沙土灭火
B.将实验剩余的钠直接丢弃在废液缸中
C.闻气体时用手轻轻扇动,使少量气体飘进鼻孔
D.稀释浓硫酸时,将浓硫酸沿器壁缓慢倒入水中并用玻璃棒不断搅拌
5.化学与生活息息相关,下列有关说法正确的是
A.二氧化硫有毒,严禁将其添加到任何食品和饮料中
B.含钠、铜、钙金属元素的化合物均可使火焰呈现出不同的颜色
C.泡沫灭火器可用于扑救一般的起火,也适用于扑救电器起火
D.维生素C具有氧化性,可在人体内起抗氧化作用
6.把一小块钠放入下列溶液中,不会出现沉淀的是
A.稀硫酸 B.溶液 C.硫酸铜溶液 D.饱和氢氧化钠溶液
7.下列有关钠及其化合物的说法错误的是
A.钠和钾形成的合金熔点低,导热性好,可作为快中子反应堆的热交换剂
B.金属钠在空气中加热发出黄色火焰,生成淡黄色固体
C.Na2O2和Na2O均属于氧化物,它们的化学性质相同
D.日常生活中,常用热纯碱溶液去除物品表面的油污
8.为除去括号内少量的杂质,所用的试剂或方法正确的是
A.CO2(HCl):饱和碳酸钠溶液,洗气
B.CO2(CO):氧气,点燃
C.NaHCO3粉末(Na2CO3):加热
D.Cu粉(Fe):盐酸,过滤
二、非选择题
9.现有以下物质:①Cu ②澄清石灰水 ③液氨 ④NaHCO3晶体 ⑤液态HCl ⑥Fe(OH)3胶体 ⑦医用酒精 ⑧Na2O2 ⑨碳酸钡 ⑩CO2。回答下列问题(用相应物质的序号填写):
(1)属于电解质的有_______,属于非电解质的有_______。
(2)写出向⑨中加入⑤的水溶液发生反应的离子方程式_______。
(3)写出向②中滴加少量④的水溶液的离子方程式_______。
(4)向⑥中逐滴加入⑤的水溶液的现象是_______,产生这种现象的原因是_______。(请以文字结合离子方程式回答)
(5)⑧可用作呼吸面具和潜艇的供氧剂,写出⑧与水反应的离子方程式,并用单线桥法表示电子转移情况_______,当生成气体在标准状况下的体积为5.6L时,转移的电子数目为_______。
10.氧化钠(Na2O)和过氧化钠(Na2O2)
(1)状态:Na2O为___________,是一种___________氧化物,具有___________氧化物的通性。Na2O2是___________,是一种___________,其中氧的化合价为___________价。
(2)化学性质:
①Na2O与H2O反应:___________;Na2O与CO2反应:___________。
②Na2O2与H2O反应
现象与结论:
a.产生大量气泡,带火星的木条放置管口能复燃,说明生成O2。
b.试管外壁发热,说明反应放热。
c.用pH试纸检验溶液,试纸变为蓝色,说明生成碱。
化学方程式:___________________。
③Na2O2与CO2反应:___________。
11.将碳酸钠和碳酸氢钠的混合物21.0 g加热到质量不再变化时,剩余物质的质量为14.8g。计算:
(1)产生二氧化碳的质量为______________;
(2)原混合物中碳酸钠的质量分数___________。
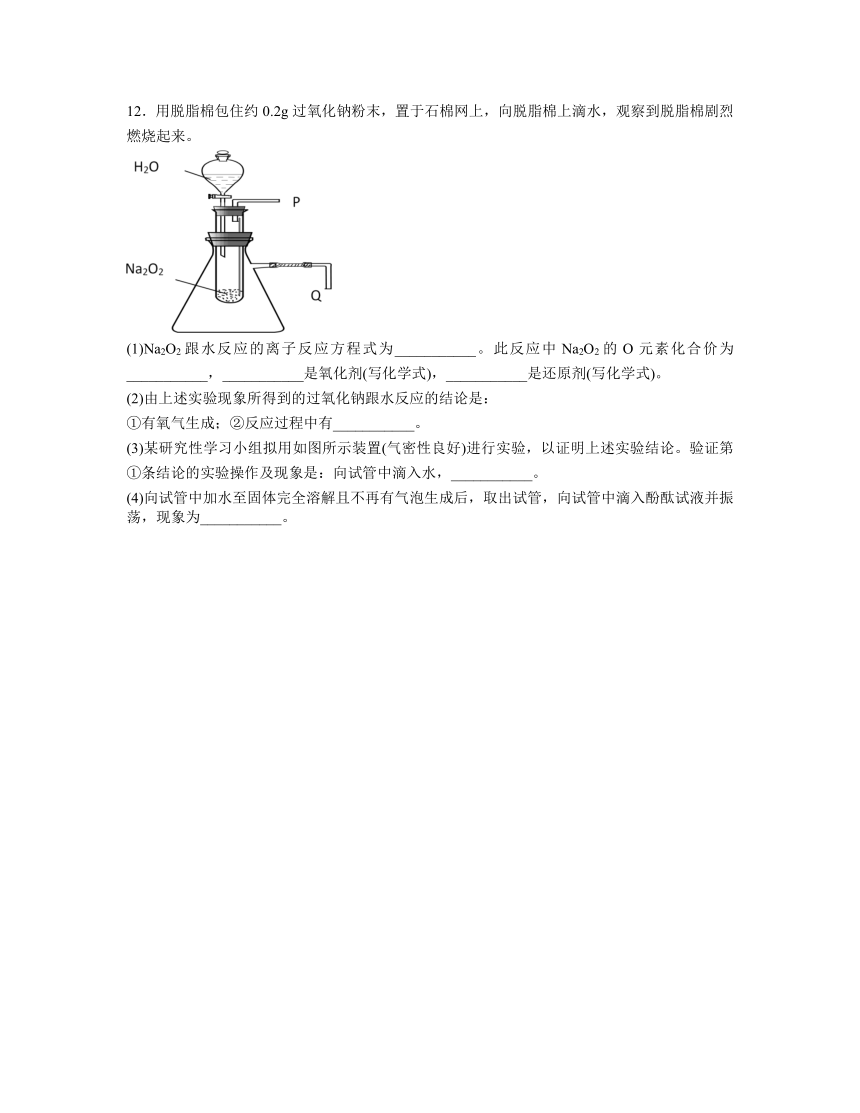
12.用脱脂棉包住约0.2g过氧化钠粉末,置于石棉网上,向脱脂棉上滴水,观察到脱脂棉剧烈燃烧起来。
(1)Na2O2跟水反应的离子反应方程式为___________。此反应中Na2O2的O元素化合价为___________,___________是氧化剂(写化学式),___________是还原剂(写化学式)。
(2)由上述实验现象所得到的过氧化钠跟水反应的结论是:
①有氧气生成;②反应过程中有___________。
(3)某研究性学习小组拟用如图所示装置(气密性良好)进行实验,以证明上述实验结论。验证第①条结论的实验操作及现象是:向试管中滴入水,___________。
(4)向试管中加水至固体完全溶解且不再有气泡生成后,取出试管,向试管中滴入酚酞试液并振荡,现象为___________。
【参考答案】
一、选择题
1.D
解析:A.钠和水生成氢氧化钠和氢气,用干燥的坩埚是为了避免钠与水反应,A正确;
B.金属钠熔化说明其熔点低于坩埚,B正确;
C.黄色火焰说明燃烧升温已使钠气化,气化后的钠燃烧形成火焰,C正确;
D.钠剧烈燃烧,得到淡黄色固体说明生成了新物质,发生了化学变化,D错误;
故选D。
2.C
解析:A.水溶液的反应中,书写离子方程式时氧化物不拆分,A错误;
B.酸碱中和反应生成盐和水,氢氧化钡和硫酸反应生成的是难溶性的硫酸钡和水,B错误;
C.盐酸与碳酸钙反应生成氯化钙,水和二氧化碳,C正确;
D.上述方程式中氢原子不守恒,D错误;
故选C。
3.C
解析:焰色反应是某些金属或它们的化合物在无色火焰中灼烧时使火焰呈现特殊颜色的反应。部分金属单质或金属化合物有焰色反应,不是所有金属元素都有,焰色反应检验的是部分金属元素。故选C。
4.B
解析:A.金属钠着火时,可以用干燥沙土该灭,通过隔绝空气达到灭火的效果,选项A正确;
B.钠和水剧烈反应产生H2,反应放出大量热,当达到H2着火点时可能会发生爆炸,所以钠不能直接丢弃在废液缸中,多余的钠应该放回原瓶,选项B错误;
C.闻气体时,用手轻轻扇动使少量气体飘进鼻孔,达到闻气味目的,同时也可以防止中毒,选项C正确;
D.配制稀硫酸时将浓硫酸慢慢倒入水中并不断搅拌,使热量迅速扩散,以防止液体飞溅,选项D正确;
答案选B。
5.B
解析:A.二氧化硫能杀灭细菌,可按国家规定将其添加到食品和饮料中,A错误;
B.焰色反应,也称作焰色测试及焰色试验,是某些金属或它们的化合物在无色火焰中灼烧时使火焰呈现特殊颜色的反应;含钠、铜、钙金属元素的化合物均可使火焰呈现出不同的颜色,B正确;
C.泡沫灭火器可用于扑救一般的起火,不适用于扑救电器起火容易导致触电事故,C错误;
D.维生素C具有还原性,可在人体内起抗氧化作用,D错误;
故选B。
6.A
解析:A.与稀硫酸反应生成和,没有沉淀产生,A符合题意;
B.先和水反应生成和H2,再与反应生成沉淀,B不符合题意;
C.先和水反应生成和,再与反应生成沉淀,C不符合题意;
D.与水反应生成消耗水,则的量增多,析出部分晶体,D不符合题意;
故选A。
7.C
解析:A.钠钾合金熔点低,具有良好的导热性,可作为快中子反应堆的热交换剂,故A正确;
B.钠在空气中燃烧生成过氧化钠,过氧化钠为淡黄色固体,钠的焰色为黄色,所以金属钠在空气中加热发出黄色火焰,生成淡黄色固体,故B正确;
C.Na2O2和Na2O均属于氧化物,它们的化学性质不相同,如过氧化钠与水、二氧化碳反应都生成氧气,氧化钠不具有此性质,故C错误;
D.碳酸钠水溶液中碳酸根离子水解导致溶液显示碱性,加热会使得碱性更强,油污属于酯类物质,在碱性条件下会水解,碱性越强,水解程度越大,去污效果越好,故D正确;
故答案选C。
8.D
解析:A.二氧化碳和氯化氢都能与碳酸钠溶液反应,所以不能用饱和碳酸钠溶液除去二氧化碳中混有的氯化氢,应选用饱和碳酸氢钠溶液,故A错误;
B.会引入新杂质氧气,则用点燃的方法不能除去二氧化碳中混有的一氧化碳,故B错误;
C.碳酸氢钠受热分解生成碳酸钠、二氧化碳和水,属于不能用加热的方法除去碳酸氢钠中混有的碳酸钠,故C错误;
D.铁能与盐酸反应生成氯化亚铁和氢气,铜不能与稀盐酸反应,所以用盐酸和过滤得方法可以除去铜粉中混有的铁,故D正确;
故选D。
二、非选择题
9.(1)④⑤⑧⑨ ③⑩
(2)
(3)
(4)先生成红褐色沉淀,后沉淀逐渐溶解,溶液变为黄色 因向胶体中加入电解质会发生聚沉,所以向氢氧化铁胶体中滴加盐酸,会生成红褐色沉淀,氢氧化铁沉淀可溶于酸,则继续滴加稀盐酸,沉淀会逐渐溶解,溶液变为黄色,发生反应的离子方程式为:Fe(OH)3+3H+=Fe3++3H2O
(5) 0.5NA
解析:(1)电解质是在水溶液或熔融状态下能导电的化合物,非电解质是在水溶液中和熔融状态下均不导电的化合物,且单质和混合物既不属于电解质也不属于非电解质。根据定义可知,上述物质中,④NaHCO3晶体、⑤液态HCl、⑧Na2O2和⑨碳酸钡属于电解质,③液氨和⑩CO2在水溶液中不是本身导电,属于 非电解质,故答案为:④⑤⑧⑨;③⑩;
(2)碳酸钡不溶于水,在离子方程式中不能拆分,所以向⑨碳酸钡中加入⑤液态HCl的水溶液发生反应的离子方程式为:;
(3)向②澄清石灰水中滴加少量④NaHCO3的水溶液生成碳酸钙沉淀、氢氧化钠和水,其离子方程式为;
(4)因向胶体中加入电解质会发生聚沉,所以向氢氧化铁胶体中滴加盐酸,会生成红褐色沉淀,氢氧化铁沉淀可溶于酸,则继续滴加稀盐酸,沉淀会逐渐溶解,溶液变为黄色,发生反应的离子方程式为:Fe(OH)3+3H+=Fe3++3H2O,故答案为:先生成红褐色沉淀,后沉淀逐渐溶解,溶液变为黄色;因向胶体中加入电解质会发生聚沉,所以向氢氧化铁胶体中滴加盐酸,会生成红褐色沉淀,氢氧化铁沉淀可溶于酸,则继续滴加稀盐酸,沉淀会逐渐溶解,溶液变为黄色,发生反应的离子方程式为:Fe(OH)3+3H+=Fe3++3H2O;
(5)⑧可用作呼吸面具和潜艇的供氧剂,⑧与水反应生成氢氧化钠和氧气,其离子方程式为:2Na2O2+2H2O=4Na++4OH-+O2↑,过氧化钠即做氧化剂,又做还原剂,电子转移数为2e-,利用单线桥表示其电子转移数为:;根据方程式生成1mol氧气转移2mol电子,因此当生成气体在标准状况下的体积为5.6 L即物质的量为,转移的电子数目为0.5NA;故答案为:;0.5NA。
10.(1) 白色固体 碱性 碱性 淡黄色粉末状固体 过氧化物 -1
(2) Na2O+H2O=2NaOH Na2O+CO2=Na2CO3 2Na2O2+2H2O=4NaOH+O2↑ 2Na2O2+2CO2=2Na2CO3+O2
解析:(1)Na2O为白色固体,是一种碱性氧化物,具有碱性氧化物的通性。Na2O2是淡黄色粉末状固体,是一种过氧化物,其中氧的化合价为-1价。
(2)①Na2O与H2O反应的化学方程式为Na2O+H2O=2NaOH;Na2O与CO2反应的化学方程式为Na2O+CO2=Na2CO3。
②根据实验现象,可知Na2O2和H2O反应生成了NaOH和O2,故对应的化学方程式为2Na2O2+2H2O=4NaOH+O2↑。
③Na2O2与CO2反应的化学方程式为2Na2O2+2CO2=2Na2CO3+O2。
11.4g 20.0%
【分析】根据2NaHCO3Na2CO3+H2O+CO2↑反应前后固体质量的减轻是因为生成水、CO2,据此分析计算。
解析:(1)设混合物中碳酸氢钠的质量为mg,生成CO2的质量为ng则:
,解得:n=4.4,m=16.8;即生成CO2的质量为4.4g;
(2)由(1)知固体混合物中NaHCO3质量为16.8g,则原混合物中碳酸钠的质量为21.0g-16.8g=4.2g,质量分数为=20.0%。
12.(1) 2Na2O2 + 2H2O =4Na++4OH-+ O2↑ -1 Na2O2 Na2O2
(2)放出大量的热
(3)将带火星的木条放在P口处,木条复燃
(4)溶液先变红后褪色
解析:从题干内容可知Na2O2跟水反应生成氧气和氢氧化钠、该反应放热,可以用带火星的木条来检验反应产生的氧气,反应所得溶液有碱性、且有强氧化性漂白性物质,故能使酚酞溶液先变红后褪色。
(1)Na2O2跟水反应生成氧气和氢氧化钠,离子反应方程式为2Na2O2 + 2H2O =4Na++4OH+ O2↑。此反应中Na2O2的O元素化合价为-1,部分氧元素从-1价升高到0价、部分氧元素从-1价降低到-2价,则Na2O2是氧化剂,Na2O2是还原剂。
(2)用脱脂棉包住约0.2g过氧化钠粉末,置于石棉网上,向脱脂棉上滴水,观察到脱脂棉剧烈燃烧起来,燃烧需要达到可燃物的着火点、需要氧气,则由上述实验现象所得到的过氧化钠跟水反应的结论是:①有氧气生成;②反应过程中有放出大量的热。
(3)可以用带火星的木条来检验反应产生的氧气,则:验证第①条结论(产生氧气)的实验操作及现象是:向试管中滴入水,将带火星的木条放在P口处,木条复燃。
(4)向试管中加水至固体完全溶解,所得溶液含有氢氧化钠溶液有碱性、且有强氧化性漂白性物质,向试管中滴入酚酞试液并振荡,现象为溶液先变红后褪色
一、选择题
1.将绿豆大小的金属钠投入干燥的热坩埚中,继续加热,片刻钠熔化,然后立即撤掉酒精灯,观察到:钠剧烈燃烧,发出黄色火焰,得到一种淡黄色固体。下列说法不正确的是
A.用干燥的坩埚是为了避免钠与水反应 B.金属钠熔化说明其熔点低于坩埚
C.黄色火焰说明燃烧升温已使钠气化 D.得到淡黄色固体说明发生了物理变化
2.下列离子方程式中,正确的是
A.将氧化铜与稀硫酸混合:
B.氢氧化钡与硫酸反应:
C.盐酸滴在石灰石上:
D.金属钠投到水中:
3.下列关于“焰色反应”的理解正确的是
A.只有金属单质才有焰色反应
B.只有金属化合物才有焰色反应
C.只有某些金属或其化合物才有焰色反应
D.所有金属元素都有焰色反应
4.下列行为不符合实验室安全要求的是
A.金属钠着火可以用干燥的沙土灭火
B.将实验剩余的钠直接丢弃在废液缸中
C.闻气体时用手轻轻扇动,使少量气体飘进鼻孔
D.稀释浓硫酸时,将浓硫酸沿器壁缓慢倒入水中并用玻璃棒不断搅拌
5.化学与生活息息相关,下列有关说法正确的是
A.二氧化硫有毒,严禁将其添加到任何食品和饮料中
B.含钠、铜、钙金属元素的化合物均可使火焰呈现出不同的颜色
C.泡沫灭火器可用于扑救一般的起火,也适用于扑救电器起火
D.维生素C具有氧化性,可在人体内起抗氧化作用
6.把一小块钠放入下列溶液中,不会出现沉淀的是
A.稀硫酸 B.溶液 C.硫酸铜溶液 D.饱和氢氧化钠溶液
7.下列有关钠及其化合物的说法错误的是
A.钠和钾形成的合金熔点低,导热性好,可作为快中子反应堆的热交换剂
B.金属钠在空气中加热发出黄色火焰,生成淡黄色固体
C.Na2O2和Na2O均属于氧化物,它们的化学性质相同
D.日常生活中,常用热纯碱溶液去除物品表面的油污
8.为除去括号内少量的杂质,所用的试剂或方法正确的是
A.CO2(HCl):饱和碳酸钠溶液,洗气
B.CO2(CO):氧气,点燃
C.NaHCO3粉末(Na2CO3):加热
D.Cu粉(Fe):盐酸,过滤
二、非选择题
9.现有以下物质:①Cu ②澄清石灰水 ③液氨 ④NaHCO3晶体 ⑤液态HCl ⑥Fe(OH)3胶体 ⑦医用酒精 ⑧Na2O2 ⑨碳酸钡 ⑩CO2。回答下列问题(用相应物质的序号填写):
(1)属于电解质的有_______,属于非电解质的有_______。
(2)写出向⑨中加入⑤的水溶液发生反应的离子方程式_______。
(3)写出向②中滴加少量④的水溶液的离子方程式_______。
(4)向⑥中逐滴加入⑤的水溶液的现象是_______,产生这种现象的原因是_______。(请以文字结合离子方程式回答)
(5)⑧可用作呼吸面具和潜艇的供氧剂,写出⑧与水反应的离子方程式,并用单线桥法表示电子转移情况_______,当生成气体在标准状况下的体积为5.6L时,转移的电子数目为_______。
10.氧化钠(Na2O)和过氧化钠(Na2O2)
(1)状态:Na2O为___________,是一种___________氧化物,具有___________氧化物的通性。Na2O2是___________,是一种___________,其中氧的化合价为___________价。
(2)化学性质:
①Na2O与H2O反应:___________;Na2O与CO2反应:___________。
②Na2O2与H2O反应
现象与结论:
a.产生大量气泡,带火星的木条放置管口能复燃,说明生成O2。
b.试管外壁发热,说明反应放热。
c.用pH试纸检验溶液,试纸变为蓝色,说明生成碱。
化学方程式:___________________。
③Na2O2与CO2反应:___________。
11.将碳酸钠和碳酸氢钠的混合物21.0 g加热到质量不再变化时,剩余物质的质量为14.8g。计算:
(1)产生二氧化碳的质量为______________;
(2)原混合物中碳酸钠的质量分数___________。
12.用脱脂棉包住约0.2g过氧化钠粉末,置于石棉网上,向脱脂棉上滴水,观察到脱脂棉剧烈燃烧起来。
(1)Na2O2跟水反应的离子反应方程式为___________。此反应中Na2O2的O元素化合价为___________,___________是氧化剂(写化学式),___________是还原剂(写化学式)。
(2)由上述实验现象所得到的过氧化钠跟水反应的结论是:
①有氧气生成;②反应过程中有___________。
(3)某研究性学习小组拟用如图所示装置(气密性良好)进行实验,以证明上述实验结论。验证第①条结论的实验操作及现象是:向试管中滴入水,___________。
(4)向试管中加水至固体完全溶解且不再有气泡生成后,取出试管,向试管中滴入酚酞试液并振荡,现象为___________。
【参考答案】
一、选择题
1.D
解析:A.钠和水生成氢氧化钠和氢气,用干燥的坩埚是为了避免钠与水反应,A正确;
B.金属钠熔化说明其熔点低于坩埚,B正确;
C.黄色火焰说明燃烧升温已使钠气化,气化后的钠燃烧形成火焰,C正确;
D.钠剧烈燃烧,得到淡黄色固体说明生成了新物质,发生了化学变化,D错误;
故选D。
2.C
解析:A.水溶液的反应中,书写离子方程式时氧化物不拆分,A错误;
B.酸碱中和反应生成盐和水,氢氧化钡和硫酸反应生成的是难溶性的硫酸钡和水,B错误;
C.盐酸与碳酸钙反应生成氯化钙,水和二氧化碳,C正确;
D.上述方程式中氢原子不守恒,D错误;
故选C。
3.C
解析:焰色反应是某些金属或它们的化合物在无色火焰中灼烧时使火焰呈现特殊颜色的反应。部分金属单质或金属化合物有焰色反应,不是所有金属元素都有,焰色反应检验的是部分金属元素。故选C。
4.B
解析:A.金属钠着火时,可以用干燥沙土该灭,通过隔绝空气达到灭火的效果,选项A正确;
B.钠和水剧烈反应产生H2,反应放出大量热,当达到H2着火点时可能会发生爆炸,所以钠不能直接丢弃在废液缸中,多余的钠应该放回原瓶,选项B错误;
C.闻气体时,用手轻轻扇动使少量气体飘进鼻孔,达到闻气味目的,同时也可以防止中毒,选项C正确;
D.配制稀硫酸时将浓硫酸慢慢倒入水中并不断搅拌,使热量迅速扩散,以防止液体飞溅,选项D正确;
答案选B。
5.B
解析:A.二氧化硫能杀灭细菌,可按国家规定将其添加到食品和饮料中,A错误;
B.焰色反应,也称作焰色测试及焰色试验,是某些金属或它们的化合物在无色火焰中灼烧时使火焰呈现特殊颜色的反应;含钠、铜、钙金属元素的化合物均可使火焰呈现出不同的颜色,B正确;
C.泡沫灭火器可用于扑救一般的起火,不适用于扑救电器起火容易导致触电事故,C错误;
D.维生素C具有还原性,可在人体内起抗氧化作用,D错误;
故选B。
6.A
解析:A.与稀硫酸反应生成和,没有沉淀产生,A符合题意;
B.先和水反应生成和H2,再与反应生成沉淀,B不符合题意;
C.先和水反应生成和,再与反应生成沉淀,C不符合题意;
D.与水反应生成消耗水,则的量增多,析出部分晶体,D不符合题意;
故选A。
7.C
解析:A.钠钾合金熔点低,具有良好的导热性,可作为快中子反应堆的热交换剂,故A正确;
B.钠在空气中燃烧生成过氧化钠,过氧化钠为淡黄色固体,钠的焰色为黄色,所以金属钠在空气中加热发出黄色火焰,生成淡黄色固体,故B正确;
C.Na2O2和Na2O均属于氧化物,它们的化学性质不相同,如过氧化钠与水、二氧化碳反应都生成氧气,氧化钠不具有此性质,故C错误;
D.碳酸钠水溶液中碳酸根离子水解导致溶液显示碱性,加热会使得碱性更强,油污属于酯类物质,在碱性条件下会水解,碱性越强,水解程度越大,去污效果越好,故D正确;
故答案选C。
8.D
解析:A.二氧化碳和氯化氢都能与碳酸钠溶液反应,所以不能用饱和碳酸钠溶液除去二氧化碳中混有的氯化氢,应选用饱和碳酸氢钠溶液,故A错误;
B.会引入新杂质氧气,则用点燃的方法不能除去二氧化碳中混有的一氧化碳,故B错误;
C.碳酸氢钠受热分解生成碳酸钠、二氧化碳和水,属于不能用加热的方法除去碳酸氢钠中混有的碳酸钠,故C错误;
D.铁能与盐酸反应生成氯化亚铁和氢气,铜不能与稀盐酸反应,所以用盐酸和过滤得方法可以除去铜粉中混有的铁,故D正确;
故选D。
二、非选择题
9.(1)④⑤⑧⑨ ③⑩
(2)
(3)
(4)先生成红褐色沉淀,后沉淀逐渐溶解,溶液变为黄色 因向胶体中加入电解质会发生聚沉,所以向氢氧化铁胶体中滴加盐酸,会生成红褐色沉淀,氢氧化铁沉淀可溶于酸,则继续滴加稀盐酸,沉淀会逐渐溶解,溶液变为黄色,发生反应的离子方程式为:Fe(OH)3+3H+=Fe3++3H2O
(5) 0.5NA
解析:(1)电解质是在水溶液或熔融状态下能导电的化合物,非电解质是在水溶液中和熔融状态下均不导电的化合物,且单质和混合物既不属于电解质也不属于非电解质。根据定义可知,上述物质中,④NaHCO3晶体、⑤液态HCl、⑧Na2O2和⑨碳酸钡属于电解质,③液氨和⑩CO2在水溶液中不是本身导电,属于 非电解质,故答案为:④⑤⑧⑨;③⑩;
(2)碳酸钡不溶于水,在离子方程式中不能拆分,所以向⑨碳酸钡中加入⑤液态HCl的水溶液发生反应的离子方程式为:;
(3)向②澄清石灰水中滴加少量④NaHCO3的水溶液生成碳酸钙沉淀、氢氧化钠和水,其离子方程式为;
(4)因向胶体中加入电解质会发生聚沉,所以向氢氧化铁胶体中滴加盐酸,会生成红褐色沉淀,氢氧化铁沉淀可溶于酸,则继续滴加稀盐酸,沉淀会逐渐溶解,溶液变为黄色,发生反应的离子方程式为:Fe(OH)3+3H+=Fe3++3H2O,故答案为:先生成红褐色沉淀,后沉淀逐渐溶解,溶液变为黄色;因向胶体中加入电解质会发生聚沉,所以向氢氧化铁胶体中滴加盐酸,会生成红褐色沉淀,氢氧化铁沉淀可溶于酸,则继续滴加稀盐酸,沉淀会逐渐溶解,溶液变为黄色,发生反应的离子方程式为:Fe(OH)3+3H+=Fe3++3H2O;
(5)⑧可用作呼吸面具和潜艇的供氧剂,⑧与水反应生成氢氧化钠和氧气,其离子方程式为:2Na2O2+2H2O=4Na++4OH-+O2↑,过氧化钠即做氧化剂,又做还原剂,电子转移数为2e-,利用单线桥表示其电子转移数为:;根据方程式生成1mol氧气转移2mol电子,因此当生成气体在标准状况下的体积为5.6 L即物质的量为,转移的电子数目为0.5NA;故答案为:;0.5NA。
10.(1) 白色固体 碱性 碱性 淡黄色粉末状固体 过氧化物 -1
(2) Na2O+H2O=2NaOH Na2O+CO2=Na2CO3 2Na2O2+2H2O=4NaOH+O2↑ 2Na2O2+2CO2=2Na2CO3+O2
解析:(1)Na2O为白色固体,是一种碱性氧化物,具有碱性氧化物的通性。Na2O2是淡黄色粉末状固体,是一种过氧化物,其中氧的化合价为-1价。
(2)①Na2O与H2O反应的化学方程式为Na2O+H2O=2NaOH;Na2O与CO2反应的化学方程式为Na2O+CO2=Na2CO3。
②根据实验现象,可知Na2O2和H2O反应生成了NaOH和O2,故对应的化学方程式为2Na2O2+2H2O=4NaOH+O2↑。
③Na2O2与CO2反应的化学方程式为2Na2O2+2CO2=2Na2CO3+O2。
11.4g 20.0%
【分析】根据2NaHCO3Na2CO3+H2O+CO2↑反应前后固体质量的减轻是因为生成水、CO2,据此分析计算。
解析:(1)设混合物中碳酸氢钠的质量为mg,生成CO2的质量为ng则:
,解得:n=4.4,m=16.8;即生成CO2的质量为4.4g;
(2)由(1)知固体混合物中NaHCO3质量为16.8g,则原混合物中碳酸钠的质量为21.0g-16.8g=4.2g,质量分数为=20.0%。
12.(1) 2Na2O2 + 2H2O =4Na++4OH-+ O2↑ -1 Na2O2 Na2O2
(2)放出大量的热
(3)将带火星的木条放在P口处,木条复燃
(4)溶液先变红后褪色
解析:从题干内容可知Na2O2跟水反应生成氧气和氢氧化钠、该反应放热,可以用带火星的木条来检验反应产生的氧气,反应所得溶液有碱性、且有强氧化性漂白性物质,故能使酚酞溶液先变红后褪色。
(1)Na2O2跟水反应生成氧气和氢氧化钠,离子反应方程式为2Na2O2 + 2H2O =4Na++4OH+ O2↑。此反应中Na2O2的O元素化合价为-1,部分氧元素从-1价升高到0价、部分氧元素从-1价降低到-2价,则Na2O2是氧化剂,Na2O2是还原剂。
(2)用脱脂棉包住约0.2g过氧化钠粉末,置于石棉网上,向脱脂棉上滴水,观察到脱脂棉剧烈燃烧起来,燃烧需要达到可燃物的着火点、需要氧气,则由上述实验现象所得到的过氧化钠跟水反应的结论是:①有氧气生成;②反应过程中有放出大量的热。
(3)可以用带火星的木条来检验反应产生的氧气,则:验证第①条结论(产生氧气)的实验操作及现象是:向试管中滴入水,将带火星的木条放在P口处,木条复燃。
(4)向试管中加水至固体完全溶解,所得溶液含有氢氧化钠溶液有碱性、且有强氧化性漂白性物质,向试管中滴入酚酞试液并振荡,现象为溶液先变红后褪色
