2.4化学反应的调控 同步练习(含解析) 2023-2024学年高二上学期人教版(2019)化学选择性必修1
文档属性
| 名称 | 2.4化学反应的调控 同步练习(含解析) 2023-2024学年高二上学期人教版(2019)化学选择性必修1 |

|
|
| 格式 | docx | ||
| 文件大小 | 464.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-08 00:00:00 | ||
图片预览



文档简介
2.4化学反应的调控同步练习题
一、选择题
1.工业制硫酸的第二步反应:2SO2(g)+O2(g)2SO3(g)ΔH<0,反应达平衡后,改变某一个条件,下列八条曲线(①~⑧)正确的是
A.①⑥⑧ B.①⑤⑦ C.②③⑧ D.②④⑦
2.将和充入某密闭容器中,控制适当条件使其充分反应生成。下列关于合成氨反应的说法正确的是
A.该反应是吸热反应 B.温度越高,压强越大,氨的平衡产率越高
C.达到限度时正逆反应速率相等 D.该容器中最终得到
3.我国科技工作者研究利用(氢型分子筛)为载体,以和氢气为原料合成绿色燃料甲醚。一定条件下发生反应: 。下列叙述正确的是
A.恒容时,升高温度,的平衡转化率增大
B.恒容恒温时,及时分离出甲醚,平衡右移,反应速率增大
C.恒容恒温时,增大,反应物转化率均增大
D.是该反应的催化剂,可加快反应速率
4.下列说法正确的是
A.根据化学反应速率可以判断反应物转变为生成物的难易
B.根据 H可以判断反应的活化能
C.根据熵变可以判断所有化学反应能否自发进行
D.根据化学平衡常数可以判断化学反应进行的程度
5.可逆反应2X(g)+Y(s)2Z(g)在t1min时达到平衡状态。当增大平衡体系的压强(减小容器体积)时,下列有关正,逆反应速率(v)随时间(t)变化的图象正确的是()
A. B.
C. D.
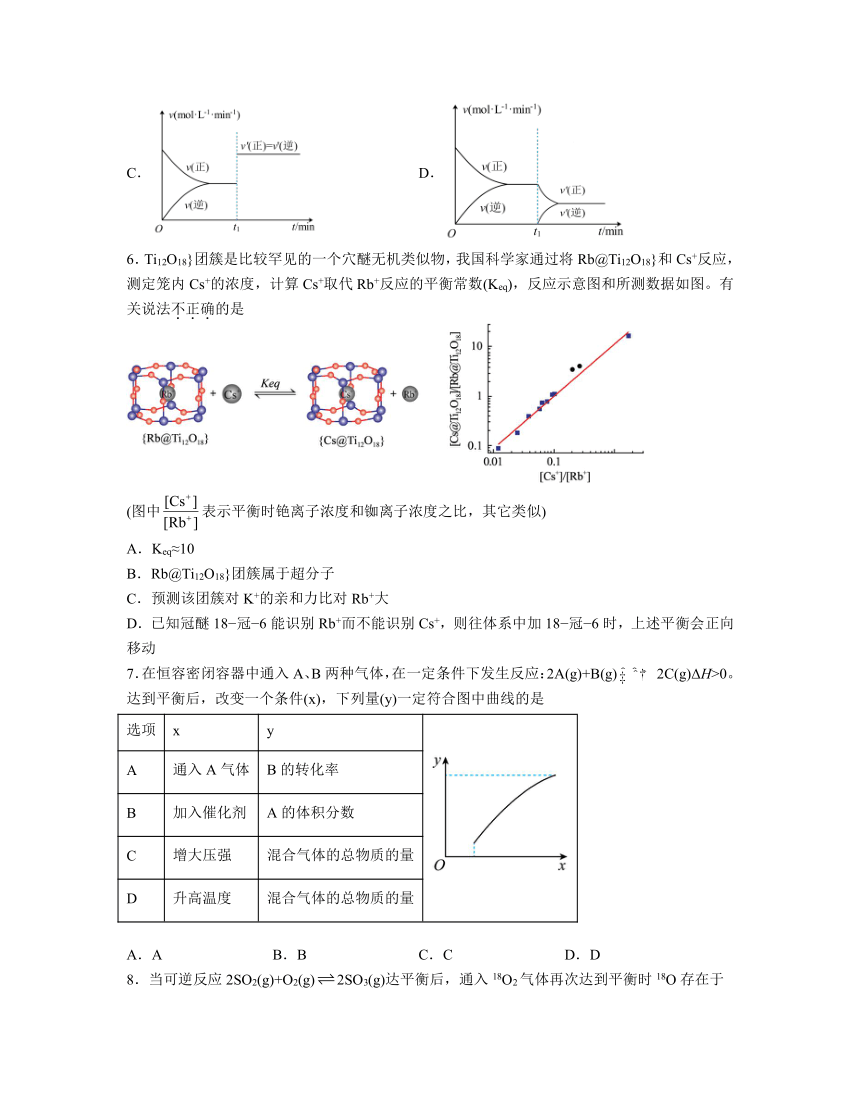
6.Ti12O18}团簇是比较罕见的一个穴醚无机类似物,我国科学家通过将Rb@Ti12O18}和Cs+反应,测定笼内Cs+的浓度,计算Cs+取代Rb+反应的平衡常数(Keq),反应示意图和所测数据如图。有关说法不正确的是
(图中表示平衡时铯离子浓度和铷离子浓度之比,其它类似)
A.Keq≈10
B.Rb@Ti12O18}团簇属于超分子
C.预测该团簇对K+的亲和力比对Rb+大
D.已知冠醚18 冠 6能识别Rb+而不能识别Cs+,则往体系中加18 冠 6时,上述平衡会正向移动
7.在恒容密闭容器中通入A、B两种气体,在一定条件下发生反应:2A(g)+B(g)2C(g)ΔH>0。达到平衡后,改变一个条件(x),下列量(y)一定符合图中曲线的是
选项 x y
A 通入A气体 B的转化率
B 加入催化剂 A的体积分数
C 增大压强 混合气体的总物质的量
D 升高温度 混合气体的总物质的量
A.A B.B C.C D.D
8.当可逆反应2SO2(g)+O2(g)2SO3(g)达平衡后,通入18O2气体再次达到平衡时18O存在于
A.SO3中 B.O2中 C.SO2、O2、SO3中 D.O2、SO3中
二、非选择题
9.工业上,裂解丁烷可以获得乙烯、丙烯等化工原料。
反应1:C4H10(g,正丁烷)CH4(g)+C3H6(g) △H1
反应2:C4H10(g,正丁烷)C2H6(g)+C2H4(g) △H2
已知几种烃的燃烧热如下:
烃 正丁烷 异丁烷 甲烷 乙烷 乙烯 丙烯
燃烧热(△H)/( kJ mol 1) 2878 2869 890.3 1559.8 1411 2058.3
回答下列问题:
(1)根据上述数据计算,△H1=___ kJ mol 1。
(2)稳定性:正丁烷___异丁烷(填“大于”“小于”或“等于”)。
(3)在密闭容器中投入一定量的正丁烷,发生上述反应1和2,测定丁烷的平衡转化率(α)与压强(p)、温度(T)关系如图所示。
①在相同压强下,升高温度,丁烷的平衡转化率增大的原因是___。
②比较压强大小:p1___p2___p3(填“>”“<”或“=”)。
(4)某温度下,向2L恒容密闭容器中投入2mol正丁烷.假设控制反应条件,只发生反应1,达到平衡时测得CH4的体积分数为。
①下列情况表明上述反应达到平衡的是___(填字母,双选)。
A.混合气体的密度保持不变 B.甲烷、丙烯的生成速率相等
C.混合气体压强保持不变 D.丙烯体积分数保持不变
②该温度下,反应1的平衡常数K=___。
10.在工业上常用CO与H2合成甲醇,热化学方程式为CO(g)+2H2(g) CH3OH(g) ΔH=-574.4 kJ·mol-1。
(1)在T1时,向体积为2 L的恒容容器中充入物质的量之和为3 mol的CO和H2,发生反应CO(g)+2H2(g) CH3OH(g),反应达到平衡时CH3OH(g)的体积分数[φ(CH3OH)]与的关系如图所示。
①当起始=2时,经过5 min反应达到平衡,CO的转化率为0.6,则0~5 min内平均反应速率v(H2)=_______。若此刻再向容器中加入CO(g)和CH3OH(g)各0.4 mol,达到新平衡时H2的转化率将_______(填“增大”“减小”或“不变”)。
②当=3.5时,反应达到平衡后,CH3OH的体积分数可能是图中的_______(填“D”“E”或“F”)点。
(2)在一容积可变的密闭容器中充有10 mol CO和20 mol H2。CO的平衡转化率[α(CO)]与温度(T)、压强(p)的关系如图所示。
①A、B、C三点对应的平衡常数KA、KB、KC的大小关系为_______。
②若达到平衡状态A时,容器的体积为10 L,则在平衡状态B时容器的体积为_______L。
【参考答案】
一、选择题
1.B
解析:由于该反应是气体体积减小且放热的反应,所以当温度升高时,平衡逆向移动,平衡常数减小,①正确、②错误;
使用催化剂对平衡移动没有影响,所以反应物转化率不变,③、④均错误;
平衡常数只受温度的影响,所以增加氧气的物质的量,平衡常数不变,⑤正确、⑥错误;
压强增大,平衡向正反应方向移动,所以三氧化硫的物质的量浓度增大,⑦正确、⑧错误;
所以图中①⑤⑦三条曲线是正确的,故选B。
2.C
解析:A.合成氨反应为氮气和氢气在催化剂作用下生成氨气,反应为放热反应,A错误;
B.合成氨反应为放热、气体分子数减小的反应,低温、高压利于平衡正向移动提高氨的平衡产率,B错误;
C.达到限度时,平衡不再移动,正逆反应速率相等,C正确;
D.该反应为可逆反应,反应不能进行完全,反应后容器中最终得到NH3的物质的量小于2mol,D错误;
故选C。
3.D
解析:A.该反应放热,升温时平衡逆向移动,的平衡转化率降低,A项错误;
B.分离出生成物,其浓度降低,反应速率减小,B项错误;
C.增大一种反应物的浓度,另外一种反应物的转化率增大,但增加的这种反应物的转化率减小,故增大,氢气转化率增大,通常二氧化碳的转化率减小,C项错误;
D.由题目信息提示可知,是该合成甲醚反应的催化剂,催化剂能加快反应速率,D项正确;
答案选D。
4.D
解析:A.化学反应速率是表示化学反应快慢程度的物理量,不能表示反应的难易程度,故A错误;
B.根据正反应和逆反应的活化能之差可计算焓变 H,不能根据 H判断反应的活化能,故B错误;
C.反应能否自发进行,不能单独通过熵变判断,要用综合判据 G= H-T S来判断,故C错误;
D.化学平衡常数是表明化学反应限度的一个特征值,化学平衡常数越大,反应进行的程度越大,故D正确;
答案选D。
5.C
解析:对于反应前后气体分子数不变的可逆反应,达到平衡状态后,增大平衡体系的压强(减小容器体积),平衡不移动,正、逆反应速率仍相等,但由于压强增大,所以正、逆反应速率同等程度地增大,故选C。
6.C
解析:A.,根据右边图像的意义看,Keq=直线的斜率,故A正确;
B.Ti12O18}团簇是比较罕见的一个穴醚无机类似物,说明Rb@Ti12O18}团簇属于超分子,故B正确;
C.根据Cs+取代Rb+反应的平衡常数Keq≈10,Ti12O18}团簇对Cs+的亲和力比对Rb+大,则Ti12O18}团簇对K+的亲和力比对Rb+小,故C错误;
D.已知冠醚18-冠-6能识别Rb+而不能识别Cs+,则往体系中加18-冠-6时,则识别出Rb+,平衡正向移动,故D正确。
综上所述,答案为C。
7.A
解析:A.恒容下再加气体A,A的浓度增大,平衡正移,B的转化率增大,A正确;
B.催化剂只改变反应速率,不影响平衡移动,与图象不符,B错误;
C.该反应是一个反应后气体分子数减小的反应,增大压强,平衡正移,混合气体的总物质的量减小,与图象不符,C错误;
D.该正反应为吸热反应,升高温度,平衡正移,混合气体的总物质的量减小,与图象不符,D错误;
故选:A。
8.C
解析:可逆反应是在一定条件下既能向正反应方向进行又可以向负反应方向进行。反应达到平衡再通入通入18O2气体时,化学平衡向正向移动,生成的SO3中存在18O,但是同时SO3通过分解反应,故18O会存在于SO2、O2中,综上所述,答案选C。
二、非选择题
9. (1)+70.6
(2)小于
(3) 反应1和反应2的正反应都是吸热反应,其他条件不变,升温,平衡向正反应方向移动 < <
(4) CD 0.5mol L 1
解析:(1)①(g,正丁烷), ②, ③, 根据盖斯定律,① ② ③得:;故答案为:+70.6。
(2)(g,异丁烷),
(g,异丁烷)(g,正丁烷),故正丁烷的相对能量高于异丁烷,正丁烷比异丁烷活泼,即异丁烷比正丁烷稳定;故答案为:小于。
(3)①反应1和反应2的正反应都是吸热反应,其他条件相同时,升温,平衡向正反应方向移动,丁烷的平衡转化率增大;故答案为:反应1和反应2的正反应都是吸热反应,其他条件不变,升温,平衡向正反应方向移动。
②反应1和反应2的正反应都是气体物质的量增大的反应,根据图象,在相同温度下,增大压强,平衡向逆反应方向移动,丁烷转化率减小,故;故答案为:<;<。
(4)①A.气体密度等于气体质量除以容器体积,反应1的反应物和产物都是气体,气体质量不变,容器体积不变,因此在恒温恒容条件下气体密度始终不变,不能作为判断平衡标志,故A不符合题意;B.甲烷、丙烯均属于产物,两者的化学计量数相同,无论是否达到平衡,它们的生成速率始终相等,故B不符合题意;C.在恒容恒温下,气体分子数逐渐增多,气体压强由小到大,当压强不变时达到平衡,故C符合题意;D.丙烯体积分数由0逐渐增大,丙烯体积分数不变时表明达到平衡,故D符合题意;综上所述,答案为CD。
②利用“三段式”:
反应1:,依题意,解得:,平衡体系中各组分的浓度分别是,;故答案为:0.5mol L 1。
10.12 mol·L-1·min-1 增大 F KA=KB>KC 2
解析:(1) ①=2,又n(CO)+n(H2)=3mol,则n(H2)=2mol,n(CO)=1mol,0-5 min内转化的n(CO)= 0.6mol,则有
,>,所以平衡正向移动,v正>v逆,H2的转化率增大,故答案为:0.12 mol·L-1·min-1,增大;
②反应物按方程式中各物质的化学计量数之比投料时,产物的体积分数最大,否则都会使产物的体积分数减小,故应选F点,故答案为:F;
(2) ①平衡常数只与温度有关,CO与H2反应生成CH3OH的反应为放热反应,则升高温度,平衡常数减小,KCKC
故答案为:KA=KB>KC;
②达到平衡状态A时,容器的体积为10L,状态A与B的平衡常数相同,状态A时CO的转化率是0.5,则平衡时n(CO) = 10 mol× (1-0. 5)= 5 mol,c(CO) =0.5,c(H2)=1 mol·L-1,生成甲醇的浓度是0.5 mol·L-1,所以平衡常数KA=,设状态B时容器的体积是V L,状态B时CO的转化率是0.8,则平衡时c(CO)=,c(H2)= ,生成甲醇的物质的量浓度是,,解得V=2,故答案为:2
一、选择题
1.工业制硫酸的第二步反应:2SO2(g)+O2(g)2SO3(g)ΔH<0,反应达平衡后,改变某一个条件,下列八条曲线(①~⑧)正确的是
A.①⑥⑧ B.①⑤⑦ C.②③⑧ D.②④⑦
2.将和充入某密闭容器中,控制适当条件使其充分反应生成。下列关于合成氨反应的说法正确的是
A.该反应是吸热反应 B.温度越高,压强越大,氨的平衡产率越高
C.达到限度时正逆反应速率相等 D.该容器中最终得到
3.我国科技工作者研究利用(氢型分子筛)为载体,以和氢气为原料合成绿色燃料甲醚。一定条件下发生反应: 。下列叙述正确的是
A.恒容时,升高温度,的平衡转化率增大
B.恒容恒温时,及时分离出甲醚,平衡右移,反应速率增大
C.恒容恒温时,增大,反应物转化率均增大
D.是该反应的催化剂,可加快反应速率
4.下列说法正确的是
A.根据化学反应速率可以判断反应物转变为生成物的难易
B.根据 H可以判断反应的活化能
C.根据熵变可以判断所有化学反应能否自发进行
D.根据化学平衡常数可以判断化学反应进行的程度
5.可逆反应2X(g)+Y(s)2Z(g)在t1min时达到平衡状态。当增大平衡体系的压强(减小容器体积)时,下列有关正,逆反应速率(v)随时间(t)变化的图象正确的是()
A. B.
C. D.
6.Ti12O18}团簇是比较罕见的一个穴醚无机类似物,我国科学家通过将Rb@Ti12O18}和Cs+反应,测定笼内Cs+的浓度,计算Cs+取代Rb+反应的平衡常数(Keq),反应示意图和所测数据如图。有关说法不正确的是
(图中表示平衡时铯离子浓度和铷离子浓度之比,其它类似)
A.Keq≈10
B.Rb@Ti12O18}团簇属于超分子
C.预测该团簇对K+的亲和力比对Rb+大
D.已知冠醚18 冠 6能识别Rb+而不能识别Cs+,则往体系中加18 冠 6时,上述平衡会正向移动
7.在恒容密闭容器中通入A、B两种气体,在一定条件下发生反应:2A(g)+B(g)2C(g)ΔH>0。达到平衡后,改变一个条件(x),下列量(y)一定符合图中曲线的是
选项 x y
A 通入A气体 B的转化率
B 加入催化剂 A的体积分数
C 增大压强 混合气体的总物质的量
D 升高温度 混合气体的总物质的量
A.A B.B C.C D.D
8.当可逆反应2SO2(g)+O2(g)2SO3(g)达平衡后,通入18O2气体再次达到平衡时18O存在于
A.SO3中 B.O2中 C.SO2、O2、SO3中 D.O2、SO3中
二、非选择题
9.工业上,裂解丁烷可以获得乙烯、丙烯等化工原料。
反应1:C4H10(g,正丁烷)CH4(g)+C3H6(g) △H1
反应2:C4H10(g,正丁烷)C2H6(g)+C2H4(g) △H2
已知几种烃的燃烧热如下:
烃 正丁烷 异丁烷 甲烷 乙烷 乙烯 丙烯
燃烧热(△H)/( kJ mol 1) 2878 2869 890.3 1559.8 1411 2058.3
回答下列问题:
(1)根据上述数据计算,△H1=___ kJ mol 1。
(2)稳定性:正丁烷___异丁烷(填“大于”“小于”或“等于”)。
(3)在密闭容器中投入一定量的正丁烷,发生上述反应1和2,测定丁烷的平衡转化率(α)与压强(p)、温度(T)关系如图所示。
①在相同压强下,升高温度,丁烷的平衡转化率增大的原因是___。
②比较压强大小:p1___p2___p3(填“>”“<”或“=”)。
(4)某温度下,向2L恒容密闭容器中投入2mol正丁烷.假设控制反应条件,只发生反应1,达到平衡时测得CH4的体积分数为。
①下列情况表明上述反应达到平衡的是___(填字母,双选)。
A.混合气体的密度保持不变 B.甲烷、丙烯的生成速率相等
C.混合气体压强保持不变 D.丙烯体积分数保持不变
②该温度下,反应1的平衡常数K=___。
10.在工业上常用CO与H2合成甲醇,热化学方程式为CO(g)+2H2(g) CH3OH(g) ΔH=-574.4 kJ·mol-1。
(1)在T1时,向体积为2 L的恒容容器中充入物质的量之和为3 mol的CO和H2,发生反应CO(g)+2H2(g) CH3OH(g),反应达到平衡时CH3OH(g)的体积分数[φ(CH3OH)]与的关系如图所示。
①当起始=2时,经过5 min反应达到平衡,CO的转化率为0.6,则0~5 min内平均反应速率v(H2)=_______。若此刻再向容器中加入CO(g)和CH3OH(g)各0.4 mol,达到新平衡时H2的转化率将_______(填“增大”“减小”或“不变”)。
②当=3.5时,反应达到平衡后,CH3OH的体积分数可能是图中的_______(填“D”“E”或“F”)点。
(2)在一容积可变的密闭容器中充有10 mol CO和20 mol H2。CO的平衡转化率[α(CO)]与温度(T)、压强(p)的关系如图所示。
①A、B、C三点对应的平衡常数KA、KB、KC的大小关系为_______。
②若达到平衡状态A时,容器的体积为10 L,则在平衡状态B时容器的体积为_______L。
【参考答案】
一、选择题
1.B
解析:由于该反应是气体体积减小且放热的反应,所以当温度升高时,平衡逆向移动,平衡常数减小,①正确、②错误;
使用催化剂对平衡移动没有影响,所以反应物转化率不变,③、④均错误;
平衡常数只受温度的影响,所以增加氧气的物质的量,平衡常数不变,⑤正确、⑥错误;
压强增大,平衡向正反应方向移动,所以三氧化硫的物质的量浓度增大,⑦正确、⑧错误;
所以图中①⑤⑦三条曲线是正确的,故选B。
2.C
解析:A.合成氨反应为氮气和氢气在催化剂作用下生成氨气,反应为放热反应,A错误;
B.合成氨反应为放热、气体分子数减小的反应,低温、高压利于平衡正向移动提高氨的平衡产率,B错误;
C.达到限度时,平衡不再移动,正逆反应速率相等,C正确;
D.该反应为可逆反应,反应不能进行完全,反应后容器中最终得到NH3的物质的量小于2mol,D错误;
故选C。
3.D
解析:A.该反应放热,升温时平衡逆向移动,的平衡转化率降低,A项错误;
B.分离出生成物,其浓度降低,反应速率减小,B项错误;
C.增大一种反应物的浓度,另外一种反应物的转化率增大,但增加的这种反应物的转化率减小,故增大,氢气转化率增大,通常二氧化碳的转化率减小,C项错误;
D.由题目信息提示可知,是该合成甲醚反应的催化剂,催化剂能加快反应速率,D项正确;
答案选D。
4.D
解析:A.化学反应速率是表示化学反应快慢程度的物理量,不能表示反应的难易程度,故A错误;
B.根据正反应和逆反应的活化能之差可计算焓变 H,不能根据 H判断反应的活化能,故B错误;
C.反应能否自发进行,不能单独通过熵变判断,要用综合判据 G= H-T S来判断,故C错误;
D.化学平衡常数是表明化学反应限度的一个特征值,化学平衡常数越大,反应进行的程度越大,故D正确;
答案选D。
5.C
解析:对于反应前后气体分子数不变的可逆反应,达到平衡状态后,增大平衡体系的压强(减小容器体积),平衡不移动,正、逆反应速率仍相等,但由于压强增大,所以正、逆反应速率同等程度地增大,故选C。
6.C
解析:A.,根据右边图像的意义看,Keq=直线的斜率,故A正确;
B.Ti12O18}团簇是比较罕见的一个穴醚无机类似物,说明Rb@Ti12O18}团簇属于超分子,故B正确;
C.根据Cs+取代Rb+反应的平衡常数Keq≈10,Ti12O18}团簇对Cs+的亲和力比对Rb+大,则Ti12O18}团簇对K+的亲和力比对Rb+小,故C错误;
D.已知冠醚18-冠-6能识别Rb+而不能识别Cs+,则往体系中加18-冠-6时,则识别出Rb+,平衡正向移动,故D正确。
综上所述,答案为C。
7.A
解析:A.恒容下再加气体A,A的浓度增大,平衡正移,B的转化率增大,A正确;
B.催化剂只改变反应速率,不影响平衡移动,与图象不符,B错误;
C.该反应是一个反应后气体分子数减小的反应,增大压强,平衡正移,混合气体的总物质的量减小,与图象不符,C错误;
D.该正反应为吸热反应,升高温度,平衡正移,混合气体的总物质的量减小,与图象不符,D错误;
故选:A。
8.C
解析:可逆反应是在一定条件下既能向正反应方向进行又可以向负反应方向进行。反应达到平衡再通入通入18O2气体时,化学平衡向正向移动,生成的SO3中存在18O,但是同时SO3通过分解反应,故18O会存在于SO2、O2中,综上所述,答案选C。
二、非选择题
9. (1)+70.6
(2)小于
(3) 反应1和反应2的正反应都是吸热反应,其他条件不变,升温,平衡向正反应方向移动 < <
(4) CD 0.5mol L 1
解析:(1)①(g,正丁烷), ②, ③, 根据盖斯定律,① ② ③得:;故答案为:+70.6。
(2)(g,异丁烷),
(g,异丁烷)(g,正丁烷),故正丁烷的相对能量高于异丁烷,正丁烷比异丁烷活泼,即异丁烷比正丁烷稳定;故答案为:小于。
(3)①反应1和反应2的正反应都是吸热反应,其他条件相同时,升温,平衡向正反应方向移动,丁烷的平衡转化率增大;故答案为:反应1和反应2的正反应都是吸热反应,其他条件不变,升温,平衡向正反应方向移动。
②反应1和反应2的正反应都是气体物质的量增大的反应,根据图象,在相同温度下,增大压强,平衡向逆反应方向移动,丁烷转化率减小,故;故答案为:<;<。
(4)①A.气体密度等于气体质量除以容器体积,反应1的反应物和产物都是气体,气体质量不变,容器体积不变,因此在恒温恒容条件下气体密度始终不变,不能作为判断平衡标志,故A不符合题意;B.甲烷、丙烯均属于产物,两者的化学计量数相同,无论是否达到平衡,它们的生成速率始终相等,故B不符合题意;C.在恒容恒温下,气体分子数逐渐增多,气体压强由小到大,当压强不变时达到平衡,故C符合题意;D.丙烯体积分数由0逐渐增大,丙烯体积分数不变时表明达到平衡,故D符合题意;综上所述,答案为CD。
②利用“三段式”:
反应1:,依题意,解得:,平衡体系中各组分的浓度分别是,;故答案为:0.5mol L 1。
10.12 mol·L-1·min-1 增大 F KA=KB>KC 2
解析:(1) ①=2,又n(CO)+n(H2)=3mol,则n(H2)=2mol,n(CO)=1mol,0-5 min内转化的n(CO)= 0.6mol,则有
,>,所以平衡正向移动,v正>v逆,H2的转化率增大,故答案为:0.12 mol·L-1·min-1,增大;
②反应物按方程式中各物质的化学计量数之比投料时,产物的体积分数最大,否则都会使产物的体积分数减小,故应选F点,故答案为:F;
(2) ①平衡常数只与温度有关,CO与H2反应生成CH3OH的反应为放热反应,则升高温度,平衡常数减小,KC
故答案为:KA=KB>KC;
②达到平衡状态A时,容器的体积为10L,状态A与B的平衡常数相同,状态A时CO的转化率是0.5,则平衡时n(CO) = 10 mol× (1-0. 5)= 5 mol,c(CO) =0.5,c(H2)=1 mol·L-1,生成甲醇的浓度是0.5 mol·L-1,所以平衡常数KA=,设状态B时容器的体积是V L,状态B时CO的转化率是0.8,则平衡时c(CO)=,c(H2)= ,生成甲醇的物质的量浓度是,,解得V=2,故答案为:2
