2.4化学反应的调控 同步练习题(含解析) 2023-2024学年高二上学期化学人教版(2019)选择性必修1
文档属性
| 名称 | 2.4化学反应的调控 同步练习题(含解析) 2023-2024学年高二上学期化学人教版(2019)选择性必修1 |  | |
| 格式 | docx | ||
| 文件大小 | 123.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-08 09:41:11 | ||
图片预览


文档简介
2.4化学反应的调控同步练习题
一、选择题
1.工业合成氨和制硫酸中SO2催化氧化的生产过程的说法中,错误的是
A.都使用了催化剂 B.都选择了较高温度
C.都按方程式的系数比投料 D.合成氨采用高压;合成SO3采用常压
2.已知反应 。在一定温度和压强下于密闭容器中,反应达到平衡。下列叙述正确的是
A.升高温度,K减小
B.减小压强,的物质的量增大
C.增大压强,CO转化率增大
D.充入一定量的氦气,的物质的量增大
3.在一个密闭容器中发生反应:2SO2(g)+O2(g)2SO3(g),反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2 mol/L、0.2 mol/L、0.2 mol/L,当反应达到反应限度时可能的数据是
A.c(SO3)=0.4mol/L
B.c(SO2)=c(SO3)=0.15mol/L
C.c(O2)=0.35mol/L
D.c(SO2)+c(SO3)=0.4mol/L
4.温度为T0时,X(g)和Y(g)在2L的密闭容器中发生反应生成Z(g),各物质的物质的量随时间变化的关系如图a所示。其他条件相同,温度分别为T1、T2时发生反应,X的物质的量随时间变化关系如图b所示。下列叙述中错误的是
A.反应的方程式为X(g)+Y(g) 2Z(g)
B.X(g)和Y(g)生成Z(g)的反应时放热反应
C.图a中反应达到平衡时,Y的转化率为62.5%
D.T1时,若该反应的平衡常数K1的值为50,则T1>T0
5.某温度下,将含有和各0.10mol的气态混合物充入容积为10L的密闭容器中,发生反应,达到平衡后测得,则此温度下该反应的平衡常数为
A.0.25 B.0.5 C.2 D.4
6.下列哪种因素改变,会导致一个可逆反应的平衡常数会改变
A.压强 B.温度 C.催化剂 D.反应物浓度
7.反应2A(g)2B(g)+C(g) ΔH>0,达平衡时,要使c(A)增大、v(正)增大,应采取的措施是
A.降温 B.加压 C.升温 D.加催化剂
8.已知相同条件下,下列反应的焓变和平衡常数分别表示为
①2H2O(g)=O2(g)+2H2(g)ΔH1 K1=x
②Cl2(g)+H2(g)=2HCl(g)ΔH2 K2=y
③2Cl2(g)+2H2O(g)=4HCl(g)+O2(g)ΔH3 K3=z
则下列关系正确的是( )
A.ΔH3=ΔH1+2ΔH2z=xy2 B.ΔH3=ΔH1+ΔH2z=x+y
C.ΔH3=ΔH1+2ΔH2z=x﹣y2 D.ΔH3=ΔH1+ΔH2z=
二、非选择题
9.Ⅰ.甲醇可以与水蒸气反应生成氢气,反应方程式如下:CH3OH(g)+H2O(g)CO2(g)+3H2(g);△H>0
(1)一定条件下,向体积为2L的恒容密闭容器中充入1molCH3OH(g)和3molH2O(g),20s后,测得混合气体的压强是反应前的1.2倍,则用甲醇表示该反应的速率为___。
(2)如图中P是可自由平行滑动的活塞,关闭K,在相同温度时,向A容器中充入1molCH3OH(g)和2molH2O(g),向B容器中充入1.2molCH3OH(g)和2.4molH2O(g),两容器分别发生上述反应。已知起始时容器A和B的体积均为aL,反应达到平衡时容器B的体积为1.5aL,维持其他条件不变,若打开K,一段时间后重新达到平衡,容器B的体积为___L(连通管中气体体积忽略不计,且不考虑温度的影响)。
Ⅱ.甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇(于固定容器中进行):2H2(g)+CO(g)CH3OH(g)
下表所列数据是该反应在不同温度下的化学平衡常数(K)
温度 250℃ 300℃ 350℃
K 2.041 0.27 0.012
(1)300℃下,将2molCO、6molH2和4molCH3OH充入2L的密闭容器中,判断反应___(填“正向”或“逆向”)进行。
(2)要提高CO的转化率,可以采取的措施是___(填序号)。
a.升温 b.加入催化剂 c.增加CO的浓度 d.加入H2加压 e.加入惰性气体加压 f.分离出甲醇
10.醛类物质的用途广泛。如,甲醛蒸气可对空气消毒、甲醛溶液可用于生物标本的防腐等;脂肪醛类一般具有麻醉、催眠作用等。回答下列问题:
利用乙二醛(OHC—CHO)催化氧化法合成乙醛酸的反应原理为:2OHC—CHO(aq)+O2(g)2OHC—COOH(aq)
可能发生副反应有:2OHC—COOH(aq)+O2(g)2H2C2O4(草酸)
在反应瓶内加入含1molOHC—CHO(乙二醛)的反应液2L,加热至45~60℃,通入氧气并保持氧气压强为0.12MPa,反应3h达平衡状态,得到的混合液中含0.84molOHC—COOH(乙醛酸),0.12molH2C2O4(草酸),0.04molOHC—CHO(乙二醛)(溶液体积变化可忽略不计)。
(1)草酸的平均生成速率为___mol·L-1·h-1。
(2)通过化学反应原理分析,增大压强有利于加快反应速率,对于乙二醛的转化率的影响是__(填“增大”或“减小”)。
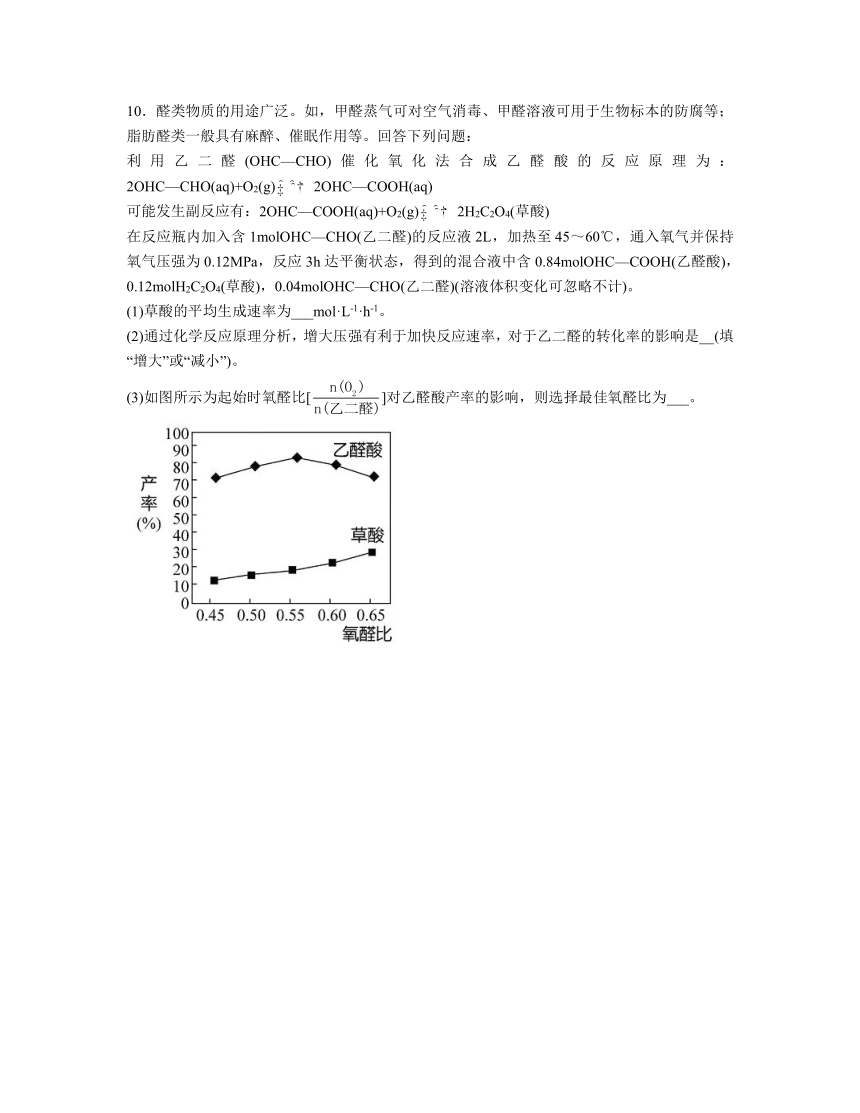
(3)如图所示为起始时氧醛比[]对乙醛酸产率的影响,则选择最佳氧醛比为___。
【参考答案】
一、选择题
1.C
解析:A.工业合成氨是氢气和氮气高温高压催化剂作用反应生成氨气,SO2与氧气催化氧化生成三氧化硫,因此都使用了催化剂,故A正确;
B.工业合成氨是高温高压,SO2催化氧化在500℃左右反应,因此都选择了较高温度,故B正确;
C.由于两个反应都是可逆反应,因此都是将廉价物质投入量过量,使得另外一种物质的转化率较大,因此不是按方程式的系数比投料,故C错误;
D.合成氨采用高压;合成SO3采用常压,都是采用较高温度,故D正确。
综上所述,答案为C。
2.A
解析:A.因为正反应放热,因此升高温度,平衡逆向移动,K减小,A正确;
B.CO(g)+H2O(g)CO2(g)+H2(g),反应前后气体化学计量数相等,减小压强,平衡不移动,n(CO2)不变,B错误;
C.CO(g)+H2O(g) CO2(g)+H2(g),反应前后气体化学计量数相等,增大压强,平衡不移动,CO转化率不变,C错误;
D.温度、压强一定,充入一定量的氦气,体积增大,对平衡的影响相当于减压,因为反应前后气体化学计量数相等,压强对平衡无影响,n(H2)不变,D错误;
故选A。
3.D
解析:
A.由于反应为可逆反应,SO3的浓度一定小于0.4mol/L,故A错误;
B.SO3、SO2浓度不会均为0.15mol/L,只能一种物质的浓度增大,另一种物质的浓度减小,故B错误;
C.由于反应为可逆反应,O2的浓度一定小于0.3mol/L,则不可能为0.35mol/L,故C错误;
D.根据元素守恒定律,c(SO2)+c(SO3)=0.4mol/L,故D正确;
故选D。
【点晴】本题考查可逆反应,注意可逆反应的特点为不完全转化性,学生应学会利用极限转化的思想来分析物质的最大浓度,但实际浓度一定小于最大浓度。化学平衡的建立,既可以从正反应开始,也可以从逆反应开始,或者从正逆反应开始,不论从哪个方向开始,物质都不能完全反应,利用极限法假设完全反应,计算出相应物质的浓度变化量,实际变化量小于极限值。
4.D
解析:A.反应达到平衡时,X改变量为0.25mol,Y改变量为0.25mol,Z改变量为0.5mol,X、Y减少,Z增加,因此反应的方程式为X(g)+Y(g)2Z(g),A正确;
B.根据图b,先拐先平衡,数值大,T1>T2,从T2到T1,升温,X量增加,平衡逆向移动,即逆向是吸热反应,正向为放热反应,X(g)与Y(g)生成Z(g)的反应是放热反应,B正确;
C.图a中反应达到平衡时,Y改变量为0.25mol,则Y的转化率,C正确;
D.T0时,根据图中信息得出反应平衡常数,升高温度平衡逆向移动,平衡常数减小,则T0>T1,D错误;
故选D。
5.A
解析:,此时,A项正确。
故选A。
6.B
解析:化学平衡常数只与温度有关,与压强、催化剂、反应物浓度等其他因素均无关,故选B。
7.B
解析:A.降温,正逆反应速率都减小,平衡向逆反应方向移动,c(A)增大,A项不选;
B.加压,平衡向逆反应方向移动,c(A)增大,正逆反应速率都增大,B项选;
C.升温,化学反应速率加快,平衡向正反应方向移动,c(A)减小,C项不选;
D.加入催化剂,正逆反应速率均加快,化学平衡不会发生移动,D项不选;
答案选B。
8.A
解析:①2H2O(g)=O2(g)+2H2(g)ΔH1
②Cl2(g)+H2(g)=2HCl(g)ΔH2
③2Cl2(g)+2H2O(g)=4HCl(g)+O2(g)ΔH3
则反应③=①+2×② ,由盖斯定律可知,ΔH3=ΔH1+2ΔH2,且z=xy2,故选A;
二、非选择题
9.01mol·L-1·s-1 1.75a 正向 df
【分析】Ⅰ. ⑴根据压强之比等于物质的量之比,得出20s时混合物的物质的量,再根据三段式建立关系,计算甲醇消耗得物质的量,再计算速率。
⑵先计算单独B容器达到平衡时的体积,再计算AB中容器所有物质反应后的物质的量的,再根据体积之比等于物质的量之比,得到反应后总的容器体积,再计算B容器的体积。
Ⅱ.⑴根据浓度商与平衡常数比较。
⑵根据温度升高,平衡常数减小,说明反应是放热反应,a.升温,平衡逆向移动,转化率降低;b.加入催化剂,平衡不移动,转化率不变;c.增加CO的浓度,平衡正向移动,但CO转化率降低;d.加入H2加压,平衡正向移动,CO转化率增大;e.加入惰性气体加压,平衡不移动,转化率不变;f.分离出甲醇,平衡正向移动,转化率增大。
解析:Ⅰ.⑴一定条件下,向体积为2L的恒容密闭容器中充入1molCH3OH(g)和3molH2O(g),20s后,测得混合气体的压强是反应前的1.2倍,则有,则n(20s)=4.8mol,
1 x + 3 x + x+3x = 4.8,则x = 0.4,甲醇表示该反应的速率为;故答案为:0.01mol·L-1·s-1。
⑵如图中P是可自由平行滑动的活塞,关闭K,在相同温度时,向A容器中充入1molCH3OH(g)和2molH2O(g),向B容器中充入1.2molCH3OH(g)和2.4molH2O(g),两容器分别发生上述反应。已知起始时容器A和B的体积均为aL,反应达到平衡时容器B的体积为1.5aL,根据,则,得到B中反应后物质的量n(B) =5.4mol,为维持其他条件不变,若打开K,一段时间后重新达到平衡,A、B的比例相同,可以理解为全部混合,n(总) = 1mol+2mol+1.2mol+2.4mol = 6.6mol,根据B中容器反应前后物质的量的比例关系得出3.6mol:5.4mol = 6.6mol :n(反应后总),n(反应后总)= 9.9mol,再根据,得到,V = 2.75a L,原来A容器为aL,因此容器B的体积为2.75a L a L = 1.75aL ;故答案为:1.75a。
Ⅱ.⑴300℃下,将2molCO、6molH2和4molCH3OH充入2L的密闭容器中,,因此反应正向进行;故答案为:正向。
⑵根据温度升高,平衡常数减小,说明反应是放热反应,
a.升温,平衡逆向移动,转化率降低,故a不符合题意;
b.加入催化剂,平衡不移动,转化率不变,故b不符合题意;
c.增加CO的浓度,平衡正向移动,但CO转化率降低,故c不符合题意;
d.加入H2加压,平衡正向移动,CO转化率增大,故d符合题意;
e.加入惰性气体加压,平衡不移动,转化率不变,故e不符合题意;
f.分离出甲醇,平衡正向移动,转化率增大,故f符合题意;
综上所述,答案为df。
10.02 增大 0.55
解析:(1)3h达到平衡后H2C2O4的物质的量为0.12mol,溶液体积为2L,则草酸的平均生成速率为;故答案为:0.02。
(2)正反应为气体体积减小的反应,故增大压强,平衡向正反应方向移动,转化率增大;故答案为:增大。
(3)根据图象,乙醛酸产率最高的氧醛比为:0.55;故答案为:0.55
一、选择题
1.工业合成氨和制硫酸中SO2催化氧化的生产过程的说法中,错误的是
A.都使用了催化剂 B.都选择了较高温度
C.都按方程式的系数比投料 D.合成氨采用高压;合成SO3采用常压
2.已知反应 。在一定温度和压强下于密闭容器中,反应达到平衡。下列叙述正确的是
A.升高温度,K减小
B.减小压强,的物质的量增大
C.增大压强,CO转化率增大
D.充入一定量的氦气,的物质的量增大
3.在一个密闭容器中发生反应:2SO2(g)+O2(g)2SO3(g),反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2 mol/L、0.2 mol/L、0.2 mol/L,当反应达到反应限度时可能的数据是
A.c(SO3)=0.4mol/L
B.c(SO2)=c(SO3)=0.15mol/L
C.c(O2)=0.35mol/L
D.c(SO2)+c(SO3)=0.4mol/L
4.温度为T0时,X(g)和Y(g)在2L的密闭容器中发生反应生成Z(g),各物质的物质的量随时间变化的关系如图a所示。其他条件相同,温度分别为T1、T2时发生反应,X的物质的量随时间变化关系如图b所示。下列叙述中错误的是
A.反应的方程式为X(g)+Y(g) 2Z(g)
B.X(g)和Y(g)生成Z(g)的反应时放热反应
C.图a中反应达到平衡时,Y的转化率为62.5%
D.T1时,若该反应的平衡常数K1的值为50,则T1>T0
5.某温度下,将含有和各0.10mol的气态混合物充入容积为10L的密闭容器中,发生反应,达到平衡后测得,则此温度下该反应的平衡常数为
A.0.25 B.0.5 C.2 D.4
6.下列哪种因素改变,会导致一个可逆反应的平衡常数会改变
A.压强 B.温度 C.催化剂 D.反应物浓度
7.反应2A(g)2B(g)+C(g) ΔH>0,达平衡时,要使c(A)增大、v(正)增大,应采取的措施是
A.降温 B.加压 C.升温 D.加催化剂
8.已知相同条件下,下列反应的焓变和平衡常数分别表示为
①2H2O(g)=O2(g)+2H2(g)ΔH1 K1=x
②Cl2(g)+H2(g)=2HCl(g)ΔH2 K2=y
③2Cl2(g)+2H2O(g)=4HCl(g)+O2(g)ΔH3 K3=z
则下列关系正确的是( )
A.ΔH3=ΔH1+2ΔH2z=xy2 B.ΔH3=ΔH1+ΔH2z=x+y
C.ΔH3=ΔH1+2ΔH2z=x﹣y2 D.ΔH3=ΔH1+ΔH2z=
二、非选择题
9.Ⅰ.甲醇可以与水蒸气反应生成氢气,反应方程式如下:CH3OH(g)+H2O(g)CO2(g)+3H2(g);△H>0
(1)一定条件下,向体积为2L的恒容密闭容器中充入1molCH3OH(g)和3molH2O(g),20s后,测得混合气体的压强是反应前的1.2倍,则用甲醇表示该反应的速率为___。
(2)如图中P是可自由平行滑动的活塞,关闭K,在相同温度时,向A容器中充入1molCH3OH(g)和2molH2O(g),向B容器中充入1.2molCH3OH(g)和2.4molH2O(g),两容器分别发生上述反应。已知起始时容器A和B的体积均为aL,反应达到平衡时容器B的体积为1.5aL,维持其他条件不变,若打开K,一段时间后重新达到平衡,容器B的体积为___L(连通管中气体体积忽略不计,且不考虑温度的影响)。
Ⅱ.甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇(于固定容器中进行):2H2(g)+CO(g)CH3OH(g)
下表所列数据是该反应在不同温度下的化学平衡常数(K)
温度 250℃ 300℃ 350℃
K 2.041 0.27 0.012
(1)300℃下,将2molCO、6molH2和4molCH3OH充入2L的密闭容器中,判断反应___(填“正向”或“逆向”)进行。
(2)要提高CO的转化率,可以采取的措施是___(填序号)。
a.升温 b.加入催化剂 c.增加CO的浓度 d.加入H2加压 e.加入惰性气体加压 f.分离出甲醇
10.醛类物质的用途广泛。如,甲醛蒸气可对空气消毒、甲醛溶液可用于生物标本的防腐等;脂肪醛类一般具有麻醉、催眠作用等。回答下列问题:
利用乙二醛(OHC—CHO)催化氧化法合成乙醛酸的反应原理为:2OHC—CHO(aq)+O2(g)2OHC—COOH(aq)
可能发生副反应有:2OHC—COOH(aq)+O2(g)2H2C2O4(草酸)
在反应瓶内加入含1molOHC—CHO(乙二醛)的反应液2L,加热至45~60℃,通入氧气并保持氧气压强为0.12MPa,反应3h达平衡状态,得到的混合液中含0.84molOHC—COOH(乙醛酸),0.12molH2C2O4(草酸),0.04molOHC—CHO(乙二醛)(溶液体积变化可忽略不计)。
(1)草酸的平均生成速率为___mol·L-1·h-1。
(2)通过化学反应原理分析,增大压强有利于加快反应速率,对于乙二醛的转化率的影响是__(填“增大”或“减小”)。
(3)如图所示为起始时氧醛比[]对乙醛酸产率的影响,则选择最佳氧醛比为___。
【参考答案】
一、选择题
1.C
解析:A.工业合成氨是氢气和氮气高温高压催化剂作用反应生成氨气,SO2与氧气催化氧化生成三氧化硫,因此都使用了催化剂,故A正确;
B.工业合成氨是高温高压,SO2催化氧化在500℃左右反应,因此都选择了较高温度,故B正确;
C.由于两个反应都是可逆反应,因此都是将廉价物质投入量过量,使得另外一种物质的转化率较大,因此不是按方程式的系数比投料,故C错误;
D.合成氨采用高压;合成SO3采用常压,都是采用较高温度,故D正确。
综上所述,答案为C。
2.A
解析:A.因为正反应放热,因此升高温度,平衡逆向移动,K减小,A正确;
B.CO(g)+H2O(g)CO2(g)+H2(g),反应前后气体化学计量数相等,减小压强,平衡不移动,n(CO2)不变,B错误;
C.CO(g)+H2O(g) CO2(g)+H2(g),反应前后气体化学计量数相等,增大压强,平衡不移动,CO转化率不变,C错误;
D.温度、压强一定,充入一定量的氦气,体积增大,对平衡的影响相当于减压,因为反应前后气体化学计量数相等,压强对平衡无影响,n(H2)不变,D错误;
故选A。
3.D
解析:
A.由于反应为可逆反应,SO3的浓度一定小于0.4mol/L,故A错误;
B.SO3、SO2浓度不会均为0.15mol/L,只能一种物质的浓度增大,另一种物质的浓度减小,故B错误;
C.由于反应为可逆反应,O2的浓度一定小于0.3mol/L,则不可能为0.35mol/L,故C错误;
D.根据元素守恒定律,c(SO2)+c(SO3)=0.4mol/L,故D正确;
故选D。
【点晴】本题考查可逆反应,注意可逆反应的特点为不完全转化性,学生应学会利用极限转化的思想来分析物质的最大浓度,但实际浓度一定小于最大浓度。化学平衡的建立,既可以从正反应开始,也可以从逆反应开始,或者从正逆反应开始,不论从哪个方向开始,物质都不能完全反应,利用极限法假设完全反应,计算出相应物质的浓度变化量,实际变化量小于极限值。
4.D
解析:A.反应达到平衡时,X改变量为0.25mol,Y改变量为0.25mol,Z改变量为0.5mol,X、Y减少,Z增加,因此反应的方程式为X(g)+Y(g)2Z(g),A正确;
B.根据图b,先拐先平衡,数值大,T1>T2,从T2到T1,升温,X量增加,平衡逆向移动,即逆向是吸热反应,正向为放热反应,X(g)与Y(g)生成Z(g)的反应是放热反应,B正确;
C.图a中反应达到平衡时,Y改变量为0.25mol,则Y的转化率,C正确;
D.T0时,根据图中信息得出反应平衡常数,升高温度平衡逆向移动,平衡常数减小,则T0>T1,D错误;
故选D。
5.A
解析:,此时,A项正确。
故选A。
6.B
解析:化学平衡常数只与温度有关,与压强、催化剂、反应物浓度等其他因素均无关,故选B。
7.B
解析:A.降温,正逆反应速率都减小,平衡向逆反应方向移动,c(A)增大,A项不选;
B.加压,平衡向逆反应方向移动,c(A)增大,正逆反应速率都增大,B项选;
C.升温,化学反应速率加快,平衡向正反应方向移动,c(A)减小,C项不选;
D.加入催化剂,正逆反应速率均加快,化学平衡不会发生移动,D项不选;
答案选B。
8.A
解析:①2H2O(g)=O2(g)+2H2(g)ΔH1
②Cl2(g)+H2(g)=2HCl(g)ΔH2
③2Cl2(g)+2H2O(g)=4HCl(g)+O2(g)ΔH3
则反应③=①+2×② ,由盖斯定律可知,ΔH3=ΔH1+2ΔH2,且z=xy2,故选A;
二、非选择题
9.01mol·L-1·s-1 1.75a 正向 df
【分析】Ⅰ. ⑴根据压强之比等于物质的量之比,得出20s时混合物的物质的量,再根据三段式建立关系,计算甲醇消耗得物质的量,再计算速率。
⑵先计算单独B容器达到平衡时的体积,再计算AB中容器所有物质反应后的物质的量的,再根据体积之比等于物质的量之比,得到反应后总的容器体积,再计算B容器的体积。
Ⅱ.⑴根据浓度商与平衡常数比较。
⑵根据温度升高,平衡常数减小,说明反应是放热反应,a.升温,平衡逆向移动,转化率降低;b.加入催化剂,平衡不移动,转化率不变;c.增加CO的浓度,平衡正向移动,但CO转化率降低;d.加入H2加压,平衡正向移动,CO转化率增大;e.加入惰性气体加压,平衡不移动,转化率不变;f.分离出甲醇,平衡正向移动,转化率增大。
解析:Ⅰ.⑴一定条件下,向体积为2L的恒容密闭容器中充入1molCH3OH(g)和3molH2O(g),20s后,测得混合气体的压强是反应前的1.2倍,则有,则n(20s)=4.8mol,
1 x + 3 x + x+3x = 4.8,则x = 0.4,甲醇表示该反应的速率为;故答案为:0.01mol·L-1·s-1。
⑵如图中P是可自由平行滑动的活塞,关闭K,在相同温度时,向A容器中充入1molCH3OH(g)和2molH2O(g),向B容器中充入1.2molCH3OH(g)和2.4molH2O(g),两容器分别发生上述反应。已知起始时容器A和B的体积均为aL,反应达到平衡时容器B的体积为1.5aL,根据,则,得到B中反应后物质的量n(B) =5.4mol,为维持其他条件不变,若打开K,一段时间后重新达到平衡,A、B的比例相同,可以理解为全部混合,n(总) = 1mol+2mol+1.2mol+2.4mol = 6.6mol,根据B中容器反应前后物质的量的比例关系得出3.6mol:5.4mol = 6.6mol :n(反应后总),n(反应后总)= 9.9mol,再根据,得到,V = 2.75a L,原来A容器为aL,因此容器B的体积为2.75a L a L = 1.75aL ;故答案为:1.75a。
Ⅱ.⑴300℃下,将2molCO、6molH2和4molCH3OH充入2L的密闭容器中,,因此反应正向进行;故答案为:正向。
⑵根据温度升高,平衡常数减小,说明反应是放热反应,
a.升温,平衡逆向移动,转化率降低,故a不符合题意;
b.加入催化剂,平衡不移动,转化率不变,故b不符合题意;
c.增加CO的浓度,平衡正向移动,但CO转化率降低,故c不符合题意;
d.加入H2加压,平衡正向移动,CO转化率增大,故d符合题意;
e.加入惰性气体加压,平衡不移动,转化率不变,故e不符合题意;
f.分离出甲醇,平衡正向移动,转化率增大,故f符合题意;
综上所述,答案为df。
10.02 增大 0.55
解析:(1)3h达到平衡后H2C2O4的物质的量为0.12mol,溶液体积为2L,则草酸的平均生成速率为;故答案为:0.02。
(2)正反应为气体体积减小的反应,故增大压强,平衡向正反应方向移动,转化率增大;故答案为:增大。
(3)根据图象,乙醛酸产率最高的氧醛比为:0.55;故答案为:0.55
