1.2研究有机化合物的一般方法课堂同步练(含解析)2023-2024学年下学期高二化学人教版(2019)选择性必修3
文档属性
| 名称 | 1.2研究有机化合物的一般方法课堂同步练(含解析)2023-2024学年下学期高二化学人教版(2019)选择性必修3 |

|
|
| 格式 | docx | ||
| 文件大小 | 191.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-08 09:51:46 | ||
图片预览


文档简介
1.2研究有机化合物的一般方法课堂同步练
一、单选题
1.从碘的四氯化碳溶液中分离出碘、并回收四氯化碳,所采用的方法是( )
A.蒸发 B.蒸馏 C.过滤 D.分液
2.欲分离某CCl4和H2O的混合液,除铁架台、铁圈外,还需要用到的仪器是( )
A.漏斗 B.长颈漏斗 C.分液漏斗 D.直形冷凝管
3.“辛勤的劳动才能创造美好的生活”。下列生产活动中,没有运用相应化学原理的是( )
选项 生产活动 化学原理
A 古代科技:我国古代湿法炼铜 发生置换反应
B 现代建筑:港珠溴大桥的钢铁护栏涂刷防锈漆 钢铁与潮湿空气隔绝可防止腐蚀
C 科学研究:屠呦呦从青蒿中提取青蒿素 主要利用蒸馏原理
D 民间艺术:五颜六色的烟花 金属和金属离子的焰色反应
A.A B.B C.C D.D
4.下列有关物质的分离提纯操作的说法正确的是( )
A.蒸馏时,温度计应插入液面以下
B.分液时,下层液体从分液漏斗的下口流出,上层液体从上口倒出
C.可用酒精萃取溴水中的溴
D.东晋葛洪《肘后备急方》中称“青蒿一握,以水二升渍,绞取汁”,以此法提取青蒿素属于过滤
5.某烯烃与H2加成后的产物的结构简式如下,则该烯烃可能有( )
A.1种 B.2种 C.3种 D.4种
6.下列叙述正确的是( )
A.p区元素均有p轨道
B.2p、3p、4p能级的轨道数依次增多
C.共价化合物中,电负性大的成键元素表现为负价
D.1s22s22p→1s22s22p过程中形成的是发射光谱
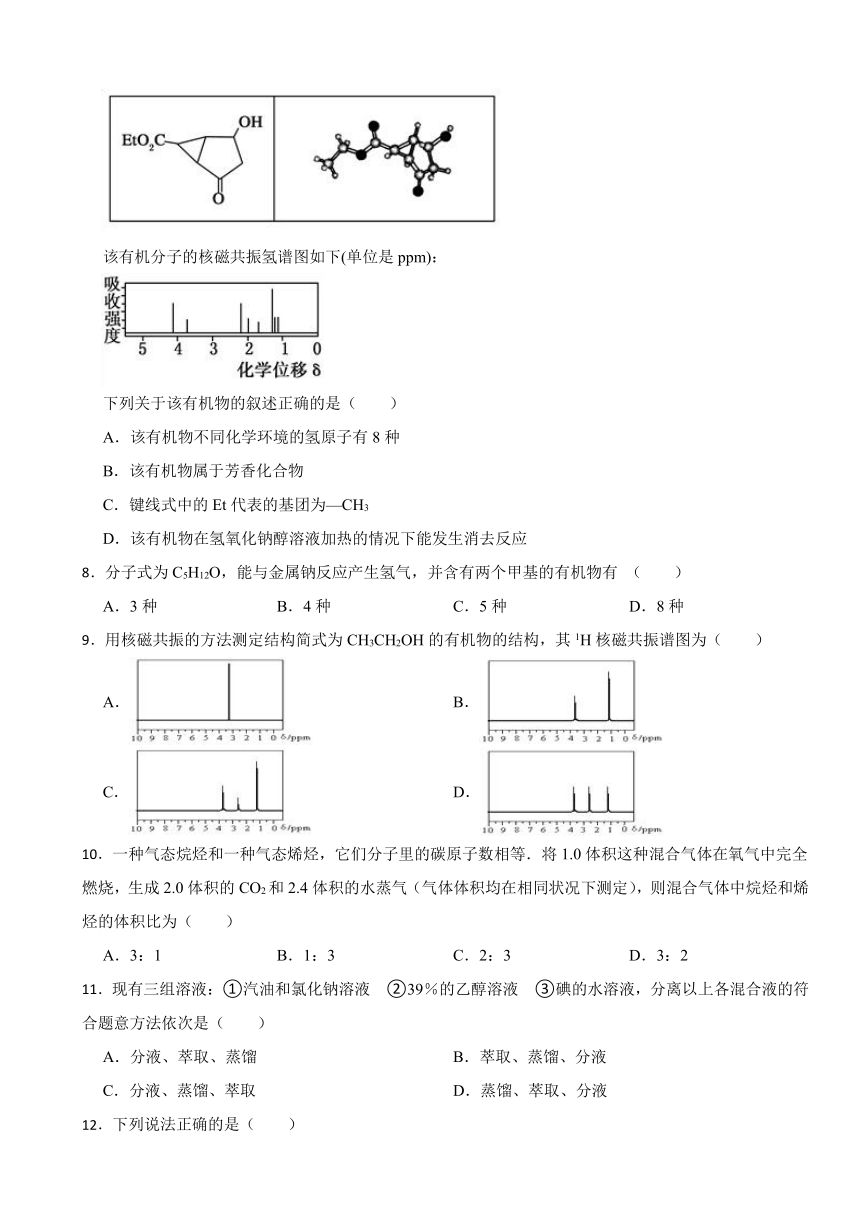
7.某化合物的结构(键线式)及球棍模型如下:
该有机分子的核磁共振氢谱图如下(单位是ppm):
下列关于该有机物的叙述正确的是( )
A.该有机物不同化学环境的氢原子有8种
B.该有机物属于芳香化合物
C.键线式中的Et代表的基团为—CH3
D.该有机物在氢氧化钠醇溶液加热的情况下能发生消去反应
8.分子式为C5H12O,能与金属钠反应产生氢气,并含有两个甲基的有机物有 ( )
A.3种 B.4种 C.5种 D.8种
9.用核磁共振的方法测定结构简式为CH3CH2OH的有机物的结构,其1H核磁共振谱图为( )
A. B.
C. D.
10.一种气态烷烃和一种气态烯烃,它们分子里的碳原子数相等.将1.0体积这种混合气体在氧气中完全燃烧,生成2.0体积的CO2和2.4体积的水蒸气(气体体积均在相同状况下测定),则混合气体中烷烃和烯烃的体积比为( )
A.3:1 B.1:3 C.2:3 D.3:2
11.现有三组溶液:①汽油和氯化钠溶液 ②39%的乙醇溶液 ③碘的水溶液,分离以上各混合液的符合题意方法依次是( )
A.分液、萃取、蒸馏 B.萃取、蒸馏、分液
C.分液、蒸馏、萃取 D.蒸馏、萃取、分液
12.下列说法正确的是( )
A.石油裂化的目的是为了得到气态短链烃
B.苯与溴的四氯化碳溶液充分混合仅发生萃取
C.相同温度下,酯在酸性环境下的水解程度小于碱性环境
D.煤的干馏是指煤在空气中加强热发生复杂的物理、化学变化的过程
13.化学与生活、社会发展息息相关,下列说法错误的是( )
A.“霾尘积聚难见路人”,雾霾所形成的气溶胶有丁达尔效应
B.“熬胆矾铁釜,久之亦化为铜”,该过程发生了置换反应
C.“青蒿一握,以水二升渍,绞取汁”是东晋葛洪提取青蒿素的过程,属化学变化
D.“春蚕到死丝方尽,蜡炬成灰泪始干” 诗句中涉及氧化还原反应
14.过氧化氢分子中含有过氧键(﹣O﹣O﹣).有机化合物A的相对分子质量为120.经分析,其中氧的质量分数为0.5334,其余为碳和氢,则A分子中过氧键数最多为( )
A.1 B.2 C.3 D.4
15.蒸馏操作不需要的仪器是( )
①漏斗②冷凝管③蒸馏烧瓶④玻璃棒⑤分液漏斗⑥锥形瓶.
A.①③④ B.①②⑥ C.①④⑤ D.②③⑥
16.某烷烃和烯烃的混合气体密度是1.07g/L(标况下),该烷烃和烯烃的体积比是4:1,则这两种烃是( )
A.CH4 和 C2H4 B.C2H6和C2H4
C.CH4和C4H8 D.C2H4和 C3H6
二、综合题
17.室温时,将20mL某气态烃与过量的氧气混合,充分燃烧后冷却至室温,发现混合气体的体积减少60mL,将所得混合气体通过氢氧化钠溶液后,体积又减少80mL.
(1)通过计算确定气态烃分子式
(2)若该烃能使溴水和高锰酸钾褪色,且该烃与H2加成后的产物有三个甲基,请写出该烃的结构简式.又知该烃在一定的温度、压强和催化剂的作用下,生成一种高聚物,写出其方程式.
18.根据问题填空:
(1)某烃A的蒸气密度是同条件下氢气密度的64倍,则 A的分子式可能为 ,若A中含有6个甲基,但不可能是烯烃与氢气的加成产物,则A的结构简式 ;
(2)已知1mol烃B中所含电子总数为42NA,且C、H两种元素的质量比为5:1,则其分子式为 ,在它的同分异构体中,一氯代物只有一种的是
(写结构简式).
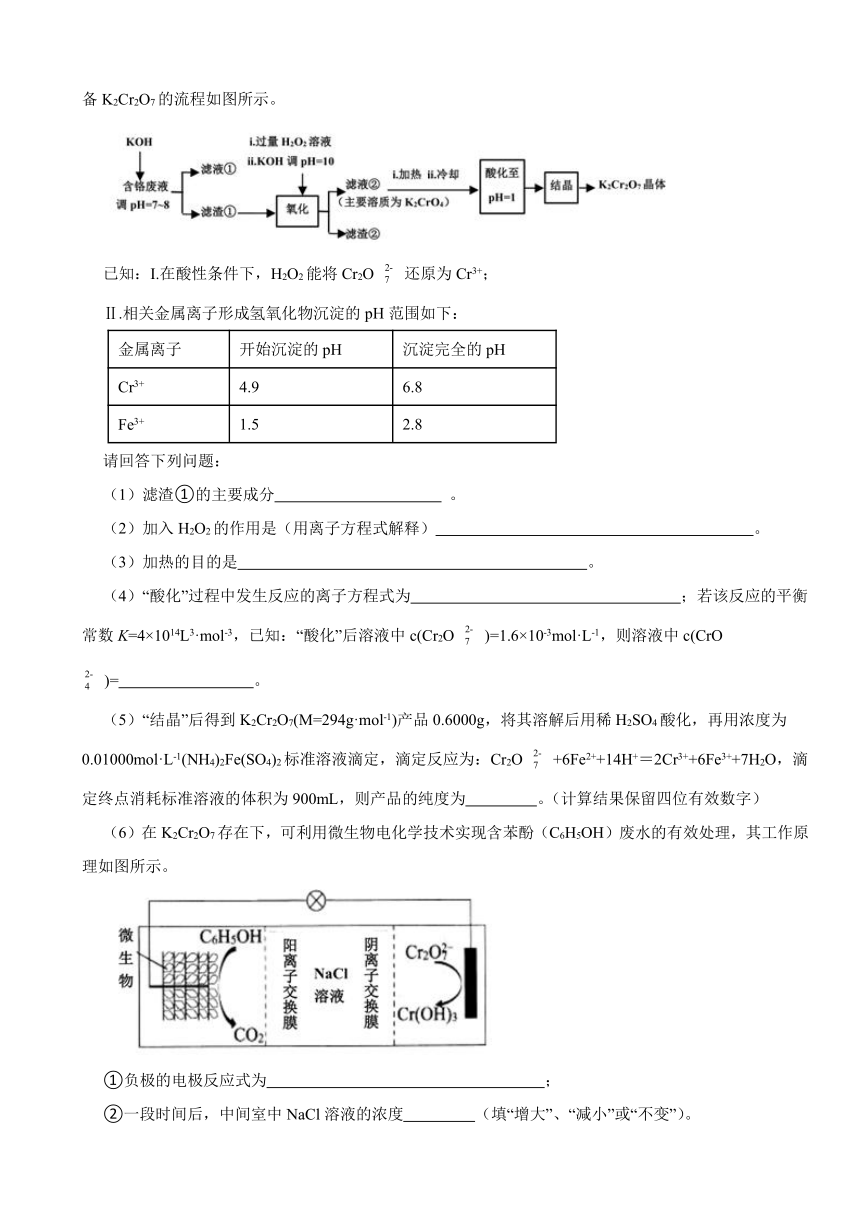
19.重铬酸钾常用作有机合成的氧化剂和催化剂等。由含铬废液(主要含Cr3+、Fe3+、K+、SO 等)制备K2Cr2O7的流程如图所示。
已知:I.在酸性条件下,H2O2能将Cr2O 还原为Cr3+;
Ⅱ.相关金属离子形成氢氧化物沉淀的pH范围如下:
金属离子 开始沉淀的pH 沉淀完全的pH
Cr3+ 4.9 6.8
Fe3+ 1.5 2.8
请回答下列问题:
(1)滤渣①的主要成分 。
(2)加入H2O2的作用是(用离子方程式解释) 。
(3)加热的目的是 。
(4)“酸化”过程中发生反应的离子方程式为 ;若该反应的平衡常数K=4×1014L3·mol-3,已知:“酸化”后溶液中c(Cr2O )=1.6×10-3mol·L-1,则溶液中c(CrO )= 。
(5)“结晶”后得到K2Cr2O7(M=294g·mol-1)产品0.6000g,将其溶解后用稀H2SO4酸化,再用浓度为0.01000mol·L-1(NH4)2Fe(SO4)2标准溶液滴定,滴定反应为:Cr2O +6Fe2++14H+=2Cr3++6Fe3++7H2O,滴定终点消耗标准溶液的体积为900mL,则产品的纯度为 。(计算结果保留四位有效数字)
(6)在K2Cr2O7存在下,可利用微生物电化学技术实现含苯酚(C6H5OH)废水的有效处理,其工作原理如图所示。
①负极的电极反应式为 ;
②一段时间后,中间室中NaCl溶液的浓度 (填“增大”、“减小”或“不变”)。
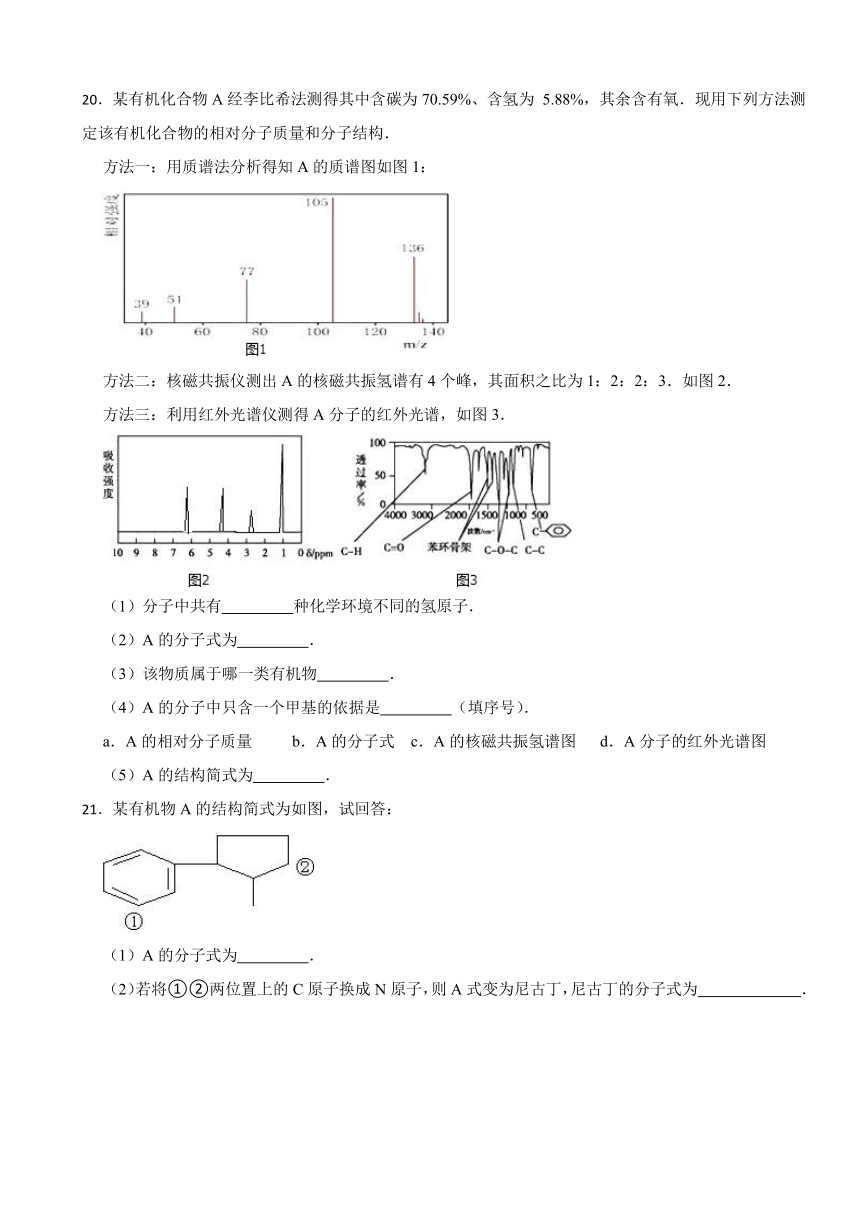
20.某有机化合物A经李比希法测得其中含碳为70.59%、含氢为 5.88%,其余含有氧.现用下列方法测定该有机化合物的相对分子质量和分子结构.
方法一:用质谱法分析得知A的质谱图如图1:
方法二:核磁共振仪测出A的核磁共振氢谱有4个峰,其面积之比为1:2:2:3.如图2.
方法三:利用红外光谱仪测得A分子的红外光谱,如图3.
(1)分子中共有 种化学环境不同的氢原子.
(2)A的分子式为 .
(3)该物质属于哪一类有机物 .
(4)A的分子中只含一个甲基的依据是 (填序号).
a.A的相对分子质量 b.A的分子式 c.A的核磁共振氢谱图 d.A分子的红外光谱图
(5)A的结构简式为 .
21.某有机物A的结构简式为如图,试回答:
(1)A的分子式为 .
(2)若将①②两位置上的C原子换成N原子,则A式变为尼古丁,尼古丁的分子式为 .
答案解析部分
1.【答案】B
【解析】【解答】解:因四氯化碳与碘的沸点不同,可用蒸馏的方法分离碘的和四氯化碳,
故选:B.
【分析】根据四氯化碳的沸点低,易挥发,可用蒸馏的方法分离碘的和四氯化碳.
2.【答案】C
【解析】【解答】解:根据各仪器的作用选取仪器,CCl4和H2O不溶,可用分液分离,分液需要铁架台、铁圈、分液漏斗、烧杯,还需要用到分液漏斗,
故选C.
【分析】CCl4和H2O不溶,可用分液分离,分液需要铁架台、铁圈、分液漏斗、烧杯.
3.【答案】C
【解析】【解答】A.湿法炼铜就是把铁放在胆矾(硫酸铜)溶液里,化学原理为置换反应,A项不选;
B.刷防锈漆防腐蚀原理为将钢铁与潮湿空气隔绝,B项不选;
C.从青蒿中提取青蒿素主要利用萃取,C项选;
D.烟花的颜色利用了焰色反应,D项不选;
故答案为:C。
【分析】注意区分是运用物理方法还是化学原理,蒸馏、蒸发、过滤等都是物理方法。
4.【答案】B
5.【答案】C
【解析】【解答】该烯烃的结构可能为 、 、 三种,C项符合题意。
故答案为:C
【分析】烯烃中含有碳碳双键,C原子的最外层电子数为4,只能形成四个化学键,据此确定碳碳双键的位置。
6.【答案】C
【解析】【解答】A.p区中的零族元素He元素电子排布式为1s2,无p轨道,A不符合题意;
B.p能级含有的轨道数是相同的,B不符合题意;
C.电负性大的成键元素得电子的能力更强,易表现为负价,在共价化合物中,共用电子对偏向电负性大的元素,C符合题意;
D. 1s22s22p→1s22s22p 过程,电子一直在2p能级,不能形成发射光谱,D不符合题意;
故答案为:C
【分析】A.p区中的零族元素He无p轨道;
B.p能级含有的轨道数是相同的;
C.电负性大的成键元素得电子的能力更强,易表现为负价;
D.电子一直在2p能级,不能形成发射光谱。
7.【答案】A
【解析】【解答】A.该有机物结构不对称,含8种位置的H原子,所以核磁共振波谱图中有8种峰,故A符合题意;
B.该有机物中不含苯环,则不属于芳香族化合物,故B不符合题意;
C.由结构及球棍模型可知,Et代表-CH2CH3,故C不符合题意;
D.含-OH,且与-OH相连的C的邻位C上含H,所以在一定条件下能够发生消去反应,但反应条件是浓硫酸加热,不是氢氧化钠醇溶液加热,故D不符合题意;
故答案为:A。
【分析】根据核磁公振氢谱的原理,有几个吸收峰就有几种性质的氢,且峰面积比等于氢原子个数比。
8.【答案】B
【解析】【解答】该有机物能与金属钠反应放出氢气,说明存在羟基,烃基分子式为C4H9-。同分异构体有(碳骨架表示): ,有4种同分异构体,
故答案为:B
【分析】该题试题基础性强,侧重对学生基础知识的巩固和训练,有利于培养学生的逻辑推理能力和逆向思维能力,提高学生灵活运用基础知识解决实际问题的能力,记住简单的烃基的同分异构体种数对解题很有帮助。
9.【答案】C
【解析】【解答】乙醇中有3种不同化学环境的氢原子,应有3个峰,峰的面积比为3:2:1,C符合题意。
故答案为:C
【分析】核磁共振氢谱图中有机物有几种化学环境相同的氢就有几组峰,峰面积与氢原子个数成正比。
10.【答案】C
【解析】【解答】解:相同条件下,气体的体积之比等于物质的量之比,1体积的这两种气体的混合物在氧气中完全燃烧,生成2体积的二氧化碳和2.4体积的水蒸气,混合气体的物质的量与生成二氧化碳的物质的量之比为:1:2,则混合气体中平均碳原子数为: =2,
混合物体积与水的物质的量之比为:1:2.4,则混合物中平均氢原子数为: =4.8,
由于烯烃和烷烃分子中的碳原子数相等,则混合物为乙烷和乙烯,
设乙烷的体积为x,乙烯的体积为y,
混合物中平均氢原子数为: =4.8,
解得x:y=2:3,
故选C.
【分析】1体积的这两种气体的混合物在氧气中完全燃烧,生成2体积的二氧化碳和2.4体积的水蒸气,则平均碳原子数为: =2,平均氢原子数为: =4.8;二者分子中碳原子数相等,则都含有2个碳原子,应该为乙烷和乙烯的混合物;设乙烷的体积为x,乙烯的体积为y,根据混合物中平均氢原子数列式计算出x:y即可.
11.【答案】C
【解析】【解答】①汽油不溶于水,汽油和氯化钠溶液是分层的,可采用分液的方法分离;
②酒精和水任意比互溶,可采用蒸馏的方法来分离;
③碘的水溶液中加入萃取剂四氯化碳后,碘单质会溶解在四氯化碳中,四氯化碳和水互不相溶而分层,然后再采用分液的方法来分离。
故答案为C。
【分析】汽油与氯化钠溶溶液互不相溶,用分液,乙醇与水互溶沸点差距比较大,用蒸馏,碘单质在有机溶剂与水中的溶解度不相同,用萃取。
12.【答案】C
【解析】【解答】A.石油裂解的目的是为了获得乙烯,裂化的目的是为了获得轻质油,故A不符合题意;
B.苯与溴的四氯化碳溶液是互溶,不能萃取,故B不符合题意;
C.相同温度下,酯在酸性和碱性环境下水解均产生酸和醇,但碱可继续消耗酸,使平衡正向移动,则酯在酸性环境下的水解程度小于其在碱性环境下的水解程度,故C符合题意;
D.煤的干馏是指将煤隔绝空气加强热,发生复杂的物理和化学变化的过程,故D不符合题意。
故答案为:C。
【分析】A.石油裂化是在一定的条件下,将相对分子质量较大、沸点较高的烃断裂为相对分子质量较小、沸点较低的烃的过程。单靠热的作用发生的裂化反应称为热裂化,在催化作用下进行的裂化,叫做催化裂化;
B.苯是有机物,四氯化碳也是有机物,根据相似相溶原理可知,二者之间是互溶的;
C.脂在酸性和减小条件下都会发生水解,但是水解的产物是不相同的;
D.煤的干馏指煤在隔绝空气条件下加热、分解,生成焦炭(或半焦)、煤焦油、粗苯、煤气等产物的过程,煤的干馏是属于化学变化。
13.【答案】C
【解析】【解答】A.雾霾所形成的气溶胶属于胶体,具有丁达尔效应,A不符合题意;
B.铁置换铜属于湿法炼铜,该过程发生了置换反应,B不符合题意;
C.对青蒿素的提取利用的是萃取原理,萃取过程中没有新物质生成,属于物理变化,C符合题意;
D.石蜡的燃烧是氧化还原反应,D不符合题意。
故答案为:C。
【分析】萃取是物理变化
14.【答案】B
【解析】【解答】A的相对分子质量为120,氧的质量分数为0.5334,120×0.5334=64,含有4个氧原子,最多有2个过氧键.故选B.
【分析】根据氧原子的质量分数确定氧原子的个数,然后确定过氧键的数目.
15.【答案】C
【解析】【解答】解:在实验室里进行蒸馏操作时,需用到:带铁圈的铁架台,酒精灯,石棉网,蒸馏烧瓶,温度计,冷凝管,牛角管,锥形瓶等仪器,用不到的有:①漏斗、④玻璃棒、⑤分液漏斗;
故选:C.
【分析】在实验室里进行蒸馏操作时,需用到:带铁圈的铁架台,酒精灯,石棉网,蒸馏烧瓶,温度计,冷凝管,牛角管,锥形瓶等仪器,据此解答.
16.【答案】C
【解析】【解答】解:某烷烃和烯烃的混合气体的密度是1.07g/L(标准状况),则平均相对分子质量为1.07×22.4=24,由于烯烃中乙烯的相对分子质量最小为28,故含有的烷烃为甲烷,
假设烯烃相对分子质量为a,则 =24,解得a=56,
令烯烃组成为CnH2n,则14n=56,故n=4,则相同分子式为C4H8,
故选C.
【分析】某烷烃和烯烃的混合气体的密度是1.07g/L(标准状况),则平均相对分子质量为1.07×22.4=24,由于烯烃中乙烯的相对分子质量最小为28,故含有的烷烃为甲烷,结合体积比计算烯烃的相对分子质量,进而确定烯烃的分子式.
17.【答案】(1)解:NaOH溶液吸收80mL为燃烧生成CO2的体积,产物通过浓硫酸,再恢复至室温,气体体积减少了60mL,则:
CxHy+ (x+ )O2 xCO2+ H2O △V
1 (x+ ) x 1+
20mL 80mL 60mL
故x= =4,
1+ = ,则y=8,
所以该烃的分子式为C4H8,
答:气态烃的分子式为C4H8;
(2)解:该烃能使溴水和高锰酸钾褪色,则该烃分子中含有不饱和键,该烃为丁烯,与H2加成后的产物有三个甲基的丁烯为:2﹣甲基﹣1﹣丙烯,其结构简式为: ;2﹣甲基﹣1﹣丙烯发生加聚反应的化学方程式为:n ,
答:该烃的结构简式为 ;该烃发生加聚反应的方程式为:n
【解析】【分析】(1)该气态烃的组成为CxHy,燃烧方程式为CxHy+(x+ )O2 xCO2+ H2O,NaOH溶液吸收80mL为燃烧生成CO2的体积,产物通过浓硫酸,再恢复至室温,气体体积减少了60mL,根据方程式利用差量法计算相互x、y,从而确定其分子式;(2)根据该烃的化学性质及与氢气反应生成产物中含有3个甲基取代其结构简式,然后写出该烃发生加聚反应的化学方程式.
18.【答案】(1)C9H20或C10H8;(CH3)3CCH2C(CH3)3
(2)C5H12;
【解析】【解答】解:(1)因气体的密度之比等于摩尔质量之比,烃A蒸气的摩尔质量为2g/mol×64=128g/mol,若为烷烃,则12n+2n+2=128,解得n=9,所以烷烃A的分子式为C9H20,若为芳香烃,12个氢用1个碳代替,分子式变为C10H8;若A不可能是氢气与烯烃加成的产物,说明A中两个C间不可能存在C=C键,C只能构成4个键因此得到A的结构简式:(CH3)3CCH2C(CH3)3,
故答案为:C9H20或C10H8;(CH3)3CCH2C(CH3)3;(2)C、H两种元素的质量比为5:1,则C、H两种元素的物质的量比为 {#mathmL#}{#/mathmL#} : {#mathmL#}{#/mathmL#} =5:12,可知该烃的实验式为:C5H12,电子总数为42(由于C已达饱和结构)所以实验式即为该烃的分子式;B的分子式为C5H12,有3种同分异构体,分别为正戊烷、异戊烷、新戊烷.一氯代物只有一种的是新戊烷,即为 ,
故答案为:C5H12; .
【分析】(1)根据气体的密度之比等于摩尔质量之比确定烷烃A的摩尔质量;根据烷烃的通式求出分子式,然后根据要求书写A的结构简式;(2)C、H两种元素的质量比为5:1,则C、H两种元素的物质的量比为 {#mathmL#}{#/mathmL#} : {#mathmL#}{#/mathmL#} =5:12,可知该烃的实验式为:C5H12,1mol烃B中所含电子总数为42NA,可知该烃的分子式;一氯代物只有一种的是新戊烷.
19.【答案】(1)Fe(OH)3和Cr(OH)3
(2)2Cr(OH)3+3H2O2+4OH-=2CrO +8H2O
(3)除去过量H2O2,防止将Cr2O 还原成Cr3+
(4)2CrO +2H+ Cr2O +H2O;2×10-8mol/L
(5)73.50%
(6)C6H5OH+11H2O-28e-=6CO2↑+28H+;减小
【解析】【解答】(1)由以上分析可知滤渣①的主要成分是Fe(OH)3和Cr(OH)3;(2)“氧化”步骤中,碱性条件下,过氧化氢氧化Cr(OH)3生成K2CrO4溶液,反应的离子方程式为2Cr(OH)3+3H2O2+4OH-=2CrO +8H2O;(3)因为在酸性条件下,H2O2能将Cr2O 还原为Cr3+,为防止后续“酸化”步骤中H2O2将Cr2O 还原为Cr3+而混入杂质,所以酸化之前必须除去H2O2,并且H2O2对热不稳定、易分解,通过加热可除去;(4)“酸化”过程中发生反应的离子方程式为2CrO +2H+ Cr2O +H2O;酸化”过程中pH=1,即c(H+)=0.1mol/L,反应2CrO +2H+ Cr2O +H2O的平衡常数K= = =4×1014,解得 =2×10-8mol L-1;(5)由反应Cr2O +6Fe2++14H+=2Cr3++6Fe3++7H2O有n(K2Cr2O7)= n[(NH4)2Fe(SO4)2]= ×0.0100mol/L×0.9L=0.0015mol,产品的纯度=0.0015mol×294g/mol/0.6000g×100%=73.50%;(6)①C6H5OH→CO2,则苯酚发生氧化反应、作负极,结合电子守恒和电荷守恒有电极反应式C6H5OH+11H2O-28e-=6CO2↑+28H+;
②由于电解质NaCl溶液被阳离子交换膜和阴离子交换膜隔离,使Na+和Cl-不能定向移动,所以电池工作时,负极生成的H+透过阳离子交换膜加入NaCl溶液中,正极生成的OH-透过阴离子交换膜进入NaCl溶液中与H+反应生成水,是NaCl溶液浓度减小。
【分析】含铬废液(主要含Cr3+、Fe3+、K+、SO 等)制备K2Cr2O7的流程:废液与足量KOH反应生成沉淀Cr(OH)3、Fe(OH)3,过滤得到滤渣①Cr(OH)3、Fe(OH)3混合物,除去K+、SO 等离子,碱性条件下在滤渣中加入过氧化氢氧化Cr(OH)3生成K2CrO4,过滤除去Fe(OH)3,得到K2CrO4滤液②,加热除去过量过氧化氢,防止后续加酸时H2O2能将Cr2O 还原为Cr3+,加酸调pH=1,使K2CrO4溶液转化为K2Cr2O7溶液,蒸发结晶得到K2Cr2O7晶体,以此解答该题。
20.【答案】(1)4
(2)C8H8O2
(3)酯类
(4)bc
(5)
【解析】【解答】解:(1)由A的核磁共振氢谱图知,A有4个峰,则A中有4种氢原子,
故答案为:4;(2)由A的质谱图,可知A 的相对分子质量为136,则分子中N(C)= {#mathmL#}{#/mathmL#} =8,N(H)= {#mathmL#}{#/mathmL#} =8,则N(O)= {#mathmL#}{#/mathmL#} =2,则分子式为C8H8O2,
故答案为:C8H8O2;(3)由红外光谱图知,A含有苯环,占6个C原子,还含有C=O、C﹣O﹣C、C﹣C、C﹣H,其中C=O、C﹣O﹣C可组合为 ,知有4种氢原子,且其比例为1:2:2:3,又由于﹣CH3上氢原子数为3,所以只能有一个﹣CH3,故A的结构简式为: ,属于酯类,
故答案为:酯类;(4)结合上述(3)的解析,再结合图A知有4种氢原子,且其比例为1:2:2:3,又由于﹣CH3上氢原子数为3,所以只能有一个﹣CH3,
故答案为:bc;(5)综上所述,A的结构简式为 ,
故答案为: .
【分析】(1)A的核磁共振氢谱有4个峰,说明分子中有4种H原子;(2)由A的质谱图,可知A的相对分子质量为136,结合元素质量分数计算A中C、H、O原子个数,进而确定有机物A的分子式;(3)由红外光谱图知,A含有苯环,占6个C原子,还含有C=O、C﹣O﹣C、C﹣C、C﹣H,其中C=O、C﹣O﹣C可组合为 ,结合分子式、核磁共振氢谱判断;(4)A的核磁共振氢谱有4个峰,说明分子中有4种H原子,其面积之比为对应的各种H原子个数之比,根据分子式可知分子中H原子总数,进而确定甲基数目;(5)根据A分子的红外光谱,核磁共振氢谱确定确定A的结构简式.
21.【答案】(1)C12H16
(2)C10H14N2
【解析】【解答】解:(1)有机物A的碳原子数和不饱和度分别为12、5,则H原子数为12×2+2﹣5×2=16,因此A的分子式为C12H16,
故答案为:C12H16;(2)将A中的两个CH原子团换成两个N,得尼古丁的分子式为C10H14N2,
故答案为:C10H14N2.
【分析】(1)用公式法计算,根据A的碳原子数和不饱和度计算H的个数,从而确定分子式;(2)用等价代换法,将A中的两个CH原子团换成两个N,得尼古丁的分子式.
一、单选题
1.从碘的四氯化碳溶液中分离出碘、并回收四氯化碳,所采用的方法是( )
A.蒸发 B.蒸馏 C.过滤 D.分液
2.欲分离某CCl4和H2O的混合液,除铁架台、铁圈外,还需要用到的仪器是( )
A.漏斗 B.长颈漏斗 C.分液漏斗 D.直形冷凝管
3.“辛勤的劳动才能创造美好的生活”。下列生产活动中,没有运用相应化学原理的是( )
选项 生产活动 化学原理
A 古代科技:我国古代湿法炼铜 发生置换反应
B 现代建筑:港珠溴大桥的钢铁护栏涂刷防锈漆 钢铁与潮湿空气隔绝可防止腐蚀
C 科学研究:屠呦呦从青蒿中提取青蒿素 主要利用蒸馏原理
D 民间艺术:五颜六色的烟花 金属和金属离子的焰色反应
A.A B.B C.C D.D
4.下列有关物质的分离提纯操作的说法正确的是( )
A.蒸馏时,温度计应插入液面以下
B.分液时,下层液体从分液漏斗的下口流出,上层液体从上口倒出
C.可用酒精萃取溴水中的溴
D.东晋葛洪《肘后备急方》中称“青蒿一握,以水二升渍,绞取汁”,以此法提取青蒿素属于过滤
5.某烯烃与H2加成后的产物的结构简式如下,则该烯烃可能有( )
A.1种 B.2种 C.3种 D.4种
6.下列叙述正确的是( )
A.p区元素均有p轨道
B.2p、3p、4p能级的轨道数依次增多
C.共价化合物中,电负性大的成键元素表现为负价
D.1s22s22p→1s22s22p过程中形成的是发射光谱
7.某化合物的结构(键线式)及球棍模型如下:
该有机分子的核磁共振氢谱图如下(单位是ppm):
下列关于该有机物的叙述正确的是( )
A.该有机物不同化学环境的氢原子有8种
B.该有机物属于芳香化合物
C.键线式中的Et代表的基团为—CH3
D.该有机物在氢氧化钠醇溶液加热的情况下能发生消去反应
8.分子式为C5H12O,能与金属钠反应产生氢气,并含有两个甲基的有机物有 ( )
A.3种 B.4种 C.5种 D.8种
9.用核磁共振的方法测定结构简式为CH3CH2OH的有机物的结构,其1H核磁共振谱图为( )
A. B.
C. D.
10.一种气态烷烃和一种气态烯烃,它们分子里的碳原子数相等.将1.0体积这种混合气体在氧气中完全燃烧,生成2.0体积的CO2和2.4体积的水蒸气(气体体积均在相同状况下测定),则混合气体中烷烃和烯烃的体积比为( )
A.3:1 B.1:3 C.2:3 D.3:2
11.现有三组溶液:①汽油和氯化钠溶液 ②39%的乙醇溶液 ③碘的水溶液,分离以上各混合液的符合题意方法依次是( )
A.分液、萃取、蒸馏 B.萃取、蒸馏、分液
C.分液、蒸馏、萃取 D.蒸馏、萃取、分液
12.下列说法正确的是( )
A.石油裂化的目的是为了得到气态短链烃
B.苯与溴的四氯化碳溶液充分混合仅发生萃取
C.相同温度下,酯在酸性环境下的水解程度小于碱性环境
D.煤的干馏是指煤在空气中加强热发生复杂的物理、化学变化的过程
13.化学与生活、社会发展息息相关,下列说法错误的是( )
A.“霾尘积聚难见路人”,雾霾所形成的气溶胶有丁达尔效应
B.“熬胆矾铁釜,久之亦化为铜”,该过程发生了置换反应
C.“青蒿一握,以水二升渍,绞取汁”是东晋葛洪提取青蒿素的过程,属化学变化
D.“春蚕到死丝方尽,蜡炬成灰泪始干” 诗句中涉及氧化还原反应
14.过氧化氢分子中含有过氧键(﹣O﹣O﹣).有机化合物A的相对分子质量为120.经分析,其中氧的质量分数为0.5334,其余为碳和氢,则A分子中过氧键数最多为( )
A.1 B.2 C.3 D.4
15.蒸馏操作不需要的仪器是( )
①漏斗②冷凝管③蒸馏烧瓶④玻璃棒⑤分液漏斗⑥锥形瓶.
A.①③④ B.①②⑥ C.①④⑤ D.②③⑥
16.某烷烃和烯烃的混合气体密度是1.07g/L(标况下),该烷烃和烯烃的体积比是4:1,则这两种烃是( )
A.CH4 和 C2H4 B.C2H6和C2H4
C.CH4和C4H8 D.C2H4和 C3H6
二、综合题
17.室温时,将20mL某气态烃与过量的氧气混合,充分燃烧后冷却至室温,发现混合气体的体积减少60mL,将所得混合气体通过氢氧化钠溶液后,体积又减少80mL.
(1)通过计算确定气态烃分子式
(2)若该烃能使溴水和高锰酸钾褪色,且该烃与H2加成后的产物有三个甲基,请写出该烃的结构简式.又知该烃在一定的温度、压强和催化剂的作用下,生成一种高聚物,写出其方程式.
18.根据问题填空:
(1)某烃A的蒸气密度是同条件下氢气密度的64倍,则 A的分子式可能为 ,若A中含有6个甲基,但不可能是烯烃与氢气的加成产物,则A的结构简式 ;
(2)已知1mol烃B中所含电子总数为42NA,且C、H两种元素的质量比为5:1,则其分子式为 ,在它的同分异构体中,一氯代物只有一种的是
(写结构简式).
19.重铬酸钾常用作有机合成的氧化剂和催化剂等。由含铬废液(主要含Cr3+、Fe3+、K+、SO 等)制备K2Cr2O7的流程如图所示。
已知:I.在酸性条件下,H2O2能将Cr2O 还原为Cr3+;
Ⅱ.相关金属离子形成氢氧化物沉淀的pH范围如下:
金属离子 开始沉淀的pH 沉淀完全的pH
Cr3+ 4.9 6.8
Fe3+ 1.5 2.8
请回答下列问题:
(1)滤渣①的主要成分 。
(2)加入H2O2的作用是(用离子方程式解释) 。
(3)加热的目的是 。
(4)“酸化”过程中发生反应的离子方程式为 ;若该反应的平衡常数K=4×1014L3·mol-3,已知:“酸化”后溶液中c(Cr2O )=1.6×10-3mol·L-1,则溶液中c(CrO )= 。
(5)“结晶”后得到K2Cr2O7(M=294g·mol-1)产品0.6000g,将其溶解后用稀H2SO4酸化,再用浓度为0.01000mol·L-1(NH4)2Fe(SO4)2标准溶液滴定,滴定反应为:Cr2O +6Fe2++14H+=2Cr3++6Fe3++7H2O,滴定终点消耗标准溶液的体积为900mL,则产品的纯度为 。(计算结果保留四位有效数字)
(6)在K2Cr2O7存在下,可利用微生物电化学技术实现含苯酚(C6H5OH)废水的有效处理,其工作原理如图所示。
①负极的电极反应式为 ;
②一段时间后,中间室中NaCl溶液的浓度 (填“增大”、“减小”或“不变”)。
20.某有机化合物A经李比希法测得其中含碳为70.59%、含氢为 5.88%,其余含有氧.现用下列方法测定该有机化合物的相对分子质量和分子结构.
方法一:用质谱法分析得知A的质谱图如图1:
方法二:核磁共振仪测出A的核磁共振氢谱有4个峰,其面积之比为1:2:2:3.如图2.
方法三:利用红外光谱仪测得A分子的红外光谱,如图3.
(1)分子中共有 种化学环境不同的氢原子.
(2)A的分子式为 .
(3)该物质属于哪一类有机物 .
(4)A的分子中只含一个甲基的依据是 (填序号).
a.A的相对分子质量 b.A的分子式 c.A的核磁共振氢谱图 d.A分子的红外光谱图
(5)A的结构简式为 .
21.某有机物A的结构简式为如图,试回答:
(1)A的分子式为 .
(2)若将①②两位置上的C原子换成N原子,则A式变为尼古丁,尼古丁的分子式为 .
答案解析部分
1.【答案】B
【解析】【解答】解:因四氯化碳与碘的沸点不同,可用蒸馏的方法分离碘的和四氯化碳,
故选:B.
【分析】根据四氯化碳的沸点低,易挥发,可用蒸馏的方法分离碘的和四氯化碳.
2.【答案】C
【解析】【解答】解:根据各仪器的作用选取仪器,CCl4和H2O不溶,可用分液分离,分液需要铁架台、铁圈、分液漏斗、烧杯,还需要用到分液漏斗,
故选C.
【分析】CCl4和H2O不溶,可用分液分离,分液需要铁架台、铁圈、分液漏斗、烧杯.
3.【答案】C
【解析】【解答】A.湿法炼铜就是把铁放在胆矾(硫酸铜)溶液里,化学原理为置换反应,A项不选;
B.刷防锈漆防腐蚀原理为将钢铁与潮湿空气隔绝,B项不选;
C.从青蒿中提取青蒿素主要利用萃取,C项选;
D.烟花的颜色利用了焰色反应,D项不选;
故答案为:C。
【分析】注意区分是运用物理方法还是化学原理,蒸馏、蒸发、过滤等都是物理方法。
4.【答案】B
5.【答案】C
【解析】【解答】该烯烃的结构可能为 、 、 三种,C项符合题意。
故答案为:C
【分析】烯烃中含有碳碳双键,C原子的最外层电子数为4,只能形成四个化学键,据此确定碳碳双键的位置。
6.【答案】C
【解析】【解答】A.p区中的零族元素He元素电子排布式为1s2,无p轨道,A不符合题意;
B.p能级含有的轨道数是相同的,B不符合题意;
C.电负性大的成键元素得电子的能力更强,易表现为负价,在共价化合物中,共用电子对偏向电负性大的元素,C符合题意;
D. 1s22s22p→1s22s22p 过程,电子一直在2p能级,不能形成发射光谱,D不符合题意;
故答案为:C
【分析】A.p区中的零族元素He无p轨道;
B.p能级含有的轨道数是相同的;
C.电负性大的成键元素得电子的能力更强,易表现为负价;
D.电子一直在2p能级,不能形成发射光谱。
7.【答案】A
【解析】【解答】A.该有机物结构不对称,含8种位置的H原子,所以核磁共振波谱图中有8种峰,故A符合题意;
B.该有机物中不含苯环,则不属于芳香族化合物,故B不符合题意;
C.由结构及球棍模型可知,Et代表-CH2CH3,故C不符合题意;
D.含-OH,且与-OH相连的C的邻位C上含H,所以在一定条件下能够发生消去反应,但反应条件是浓硫酸加热,不是氢氧化钠醇溶液加热,故D不符合题意;
故答案为:A。
【分析】根据核磁公振氢谱的原理,有几个吸收峰就有几种性质的氢,且峰面积比等于氢原子个数比。
8.【答案】B
【解析】【解答】该有机物能与金属钠反应放出氢气,说明存在羟基,烃基分子式为C4H9-。同分异构体有(碳骨架表示): ,有4种同分异构体,
故答案为:B
【分析】该题试题基础性强,侧重对学生基础知识的巩固和训练,有利于培养学生的逻辑推理能力和逆向思维能力,提高学生灵活运用基础知识解决实际问题的能力,记住简单的烃基的同分异构体种数对解题很有帮助。
9.【答案】C
【解析】【解答】乙醇中有3种不同化学环境的氢原子,应有3个峰,峰的面积比为3:2:1,C符合题意。
故答案为:C
【分析】核磁共振氢谱图中有机物有几种化学环境相同的氢就有几组峰,峰面积与氢原子个数成正比。
10.【答案】C
【解析】【解答】解:相同条件下,气体的体积之比等于物质的量之比,1体积的这两种气体的混合物在氧气中完全燃烧,生成2体积的二氧化碳和2.4体积的水蒸气,混合气体的物质的量与生成二氧化碳的物质的量之比为:1:2,则混合气体中平均碳原子数为: =2,
混合物体积与水的物质的量之比为:1:2.4,则混合物中平均氢原子数为: =4.8,
由于烯烃和烷烃分子中的碳原子数相等,则混合物为乙烷和乙烯,
设乙烷的体积为x,乙烯的体积为y,
混合物中平均氢原子数为: =4.8,
解得x:y=2:3,
故选C.
【分析】1体积的这两种气体的混合物在氧气中完全燃烧,生成2体积的二氧化碳和2.4体积的水蒸气,则平均碳原子数为: =2,平均氢原子数为: =4.8;二者分子中碳原子数相等,则都含有2个碳原子,应该为乙烷和乙烯的混合物;设乙烷的体积为x,乙烯的体积为y,根据混合物中平均氢原子数列式计算出x:y即可.
11.【答案】C
【解析】【解答】①汽油不溶于水,汽油和氯化钠溶液是分层的,可采用分液的方法分离;
②酒精和水任意比互溶,可采用蒸馏的方法来分离;
③碘的水溶液中加入萃取剂四氯化碳后,碘单质会溶解在四氯化碳中,四氯化碳和水互不相溶而分层,然后再采用分液的方法来分离。
故答案为C。
【分析】汽油与氯化钠溶溶液互不相溶,用分液,乙醇与水互溶沸点差距比较大,用蒸馏,碘单质在有机溶剂与水中的溶解度不相同,用萃取。
12.【答案】C
【解析】【解答】A.石油裂解的目的是为了获得乙烯,裂化的目的是为了获得轻质油,故A不符合题意;
B.苯与溴的四氯化碳溶液是互溶,不能萃取,故B不符合题意;
C.相同温度下,酯在酸性和碱性环境下水解均产生酸和醇,但碱可继续消耗酸,使平衡正向移动,则酯在酸性环境下的水解程度小于其在碱性环境下的水解程度,故C符合题意;
D.煤的干馏是指将煤隔绝空气加强热,发生复杂的物理和化学变化的过程,故D不符合题意。
故答案为:C。
【分析】A.石油裂化是在一定的条件下,将相对分子质量较大、沸点较高的烃断裂为相对分子质量较小、沸点较低的烃的过程。单靠热的作用发生的裂化反应称为热裂化,在催化作用下进行的裂化,叫做催化裂化;
B.苯是有机物,四氯化碳也是有机物,根据相似相溶原理可知,二者之间是互溶的;
C.脂在酸性和减小条件下都会发生水解,但是水解的产物是不相同的;
D.煤的干馏指煤在隔绝空气条件下加热、分解,生成焦炭(或半焦)、煤焦油、粗苯、煤气等产物的过程,煤的干馏是属于化学变化。
13.【答案】C
【解析】【解答】A.雾霾所形成的气溶胶属于胶体,具有丁达尔效应,A不符合题意;
B.铁置换铜属于湿法炼铜,该过程发生了置换反应,B不符合题意;
C.对青蒿素的提取利用的是萃取原理,萃取过程中没有新物质生成,属于物理变化,C符合题意;
D.石蜡的燃烧是氧化还原反应,D不符合题意。
故答案为:C。
【分析】萃取是物理变化
14.【答案】B
【解析】【解答】A的相对分子质量为120,氧的质量分数为0.5334,120×0.5334=64,含有4个氧原子,最多有2个过氧键.故选B.
【分析】根据氧原子的质量分数确定氧原子的个数,然后确定过氧键的数目.
15.【答案】C
【解析】【解答】解:在实验室里进行蒸馏操作时,需用到:带铁圈的铁架台,酒精灯,石棉网,蒸馏烧瓶,温度计,冷凝管,牛角管,锥形瓶等仪器,用不到的有:①漏斗、④玻璃棒、⑤分液漏斗;
故选:C.
【分析】在实验室里进行蒸馏操作时,需用到:带铁圈的铁架台,酒精灯,石棉网,蒸馏烧瓶,温度计,冷凝管,牛角管,锥形瓶等仪器,据此解答.
16.【答案】C
【解析】【解答】解:某烷烃和烯烃的混合气体的密度是1.07g/L(标准状况),则平均相对分子质量为1.07×22.4=24,由于烯烃中乙烯的相对分子质量最小为28,故含有的烷烃为甲烷,
假设烯烃相对分子质量为a,则 =24,解得a=56,
令烯烃组成为CnH2n,则14n=56,故n=4,则相同分子式为C4H8,
故选C.
【分析】某烷烃和烯烃的混合气体的密度是1.07g/L(标准状况),则平均相对分子质量为1.07×22.4=24,由于烯烃中乙烯的相对分子质量最小为28,故含有的烷烃为甲烷,结合体积比计算烯烃的相对分子质量,进而确定烯烃的分子式.
17.【答案】(1)解:NaOH溶液吸收80mL为燃烧生成CO2的体积,产物通过浓硫酸,再恢复至室温,气体体积减少了60mL,则:
CxHy+ (x+ )O2 xCO2+ H2O △V
1 (x+ ) x 1+
20mL 80mL 60mL
故x= =4,
1+ = ,则y=8,
所以该烃的分子式为C4H8,
答:气态烃的分子式为C4H8;
(2)解:该烃能使溴水和高锰酸钾褪色,则该烃分子中含有不饱和键,该烃为丁烯,与H2加成后的产物有三个甲基的丁烯为:2﹣甲基﹣1﹣丙烯,其结构简式为: ;2﹣甲基﹣1﹣丙烯发生加聚反应的化学方程式为:n ,
答:该烃的结构简式为 ;该烃发生加聚反应的方程式为:n
【解析】【分析】(1)该气态烃的组成为CxHy,燃烧方程式为CxHy+(x+ )O2 xCO2+ H2O,NaOH溶液吸收80mL为燃烧生成CO2的体积,产物通过浓硫酸,再恢复至室温,气体体积减少了60mL,根据方程式利用差量法计算相互x、y,从而确定其分子式;(2)根据该烃的化学性质及与氢气反应生成产物中含有3个甲基取代其结构简式,然后写出该烃发生加聚反应的化学方程式.
18.【答案】(1)C9H20或C10H8;(CH3)3CCH2C(CH3)3
(2)C5H12;
【解析】【解答】解:(1)因气体的密度之比等于摩尔质量之比,烃A蒸气的摩尔质量为2g/mol×64=128g/mol,若为烷烃,则12n+2n+2=128,解得n=9,所以烷烃A的分子式为C9H20,若为芳香烃,12个氢用1个碳代替,分子式变为C10H8;若A不可能是氢气与烯烃加成的产物,说明A中两个C间不可能存在C=C键,C只能构成4个键因此得到A的结构简式:(CH3)3CCH2C(CH3)3,
故答案为:C9H20或C10H8;(CH3)3CCH2C(CH3)3;(2)C、H两种元素的质量比为5:1,则C、H两种元素的物质的量比为 {#mathmL#}{#/mathmL#} : {#mathmL#}{#/mathmL#} =5:12,可知该烃的实验式为:C5H12,电子总数为42(由于C已达饱和结构)所以实验式即为该烃的分子式;B的分子式为C5H12,有3种同分异构体,分别为正戊烷、异戊烷、新戊烷.一氯代物只有一种的是新戊烷,即为 ,
故答案为:C5H12; .
【分析】(1)根据气体的密度之比等于摩尔质量之比确定烷烃A的摩尔质量;根据烷烃的通式求出分子式,然后根据要求书写A的结构简式;(2)C、H两种元素的质量比为5:1,则C、H两种元素的物质的量比为 {#mathmL#}{#/mathmL#} : {#mathmL#}{#/mathmL#} =5:12,可知该烃的实验式为:C5H12,1mol烃B中所含电子总数为42NA,可知该烃的分子式;一氯代物只有一种的是新戊烷.
19.【答案】(1)Fe(OH)3和Cr(OH)3
(2)2Cr(OH)3+3H2O2+4OH-=2CrO +8H2O
(3)除去过量H2O2,防止将Cr2O 还原成Cr3+
(4)2CrO +2H+ Cr2O +H2O;2×10-8mol/L
(5)73.50%
(6)C6H5OH+11H2O-28e-=6CO2↑+28H+;减小
【解析】【解答】(1)由以上分析可知滤渣①的主要成分是Fe(OH)3和Cr(OH)3;(2)“氧化”步骤中,碱性条件下,过氧化氢氧化Cr(OH)3生成K2CrO4溶液,反应的离子方程式为2Cr(OH)3+3H2O2+4OH-=2CrO +8H2O;(3)因为在酸性条件下,H2O2能将Cr2O 还原为Cr3+,为防止后续“酸化”步骤中H2O2将Cr2O 还原为Cr3+而混入杂质,所以酸化之前必须除去H2O2,并且H2O2对热不稳定、易分解,通过加热可除去;(4)“酸化”过程中发生反应的离子方程式为2CrO +2H+ Cr2O +H2O;酸化”过程中pH=1,即c(H+)=0.1mol/L,反应2CrO +2H+ Cr2O +H2O的平衡常数K= = =4×1014,解得 =2×10-8mol L-1;(5)由反应Cr2O +6Fe2++14H+=2Cr3++6Fe3++7H2O有n(K2Cr2O7)= n[(NH4)2Fe(SO4)2]= ×0.0100mol/L×0.9L=0.0015mol,产品的纯度=0.0015mol×294g/mol/0.6000g×100%=73.50%;(6)①C6H5OH→CO2,则苯酚发生氧化反应、作负极,结合电子守恒和电荷守恒有电极反应式C6H5OH+11H2O-28e-=6CO2↑+28H+;
②由于电解质NaCl溶液被阳离子交换膜和阴离子交换膜隔离,使Na+和Cl-不能定向移动,所以电池工作时,负极生成的H+透过阳离子交换膜加入NaCl溶液中,正极生成的OH-透过阴离子交换膜进入NaCl溶液中与H+反应生成水,是NaCl溶液浓度减小。
【分析】含铬废液(主要含Cr3+、Fe3+、K+、SO 等)制备K2Cr2O7的流程:废液与足量KOH反应生成沉淀Cr(OH)3、Fe(OH)3,过滤得到滤渣①Cr(OH)3、Fe(OH)3混合物,除去K+、SO 等离子,碱性条件下在滤渣中加入过氧化氢氧化Cr(OH)3生成K2CrO4,过滤除去Fe(OH)3,得到K2CrO4滤液②,加热除去过量过氧化氢,防止后续加酸时H2O2能将Cr2O 还原为Cr3+,加酸调pH=1,使K2CrO4溶液转化为K2Cr2O7溶液,蒸发结晶得到K2Cr2O7晶体,以此解答该题。
20.【答案】(1)4
(2)C8H8O2
(3)酯类
(4)bc
(5)
【解析】【解答】解:(1)由A的核磁共振氢谱图知,A有4个峰,则A中有4种氢原子,
故答案为:4;(2)由A的质谱图,可知A 的相对分子质量为136,则分子中N(C)= {#mathmL#}{#/mathmL#} =8,N(H)= {#mathmL#}{#/mathmL#} =8,则N(O)= {#mathmL#}{#/mathmL#} =2,则分子式为C8H8O2,
故答案为:C8H8O2;(3)由红外光谱图知,A含有苯环,占6个C原子,还含有C=O、C﹣O﹣C、C﹣C、C﹣H,其中C=O、C﹣O﹣C可组合为 ,知有4种氢原子,且其比例为1:2:2:3,又由于﹣CH3上氢原子数为3,所以只能有一个﹣CH3,故A的结构简式为: ,属于酯类,
故答案为:酯类;(4)结合上述(3)的解析,再结合图A知有4种氢原子,且其比例为1:2:2:3,又由于﹣CH3上氢原子数为3,所以只能有一个﹣CH3,
故答案为:bc;(5)综上所述,A的结构简式为 ,
故答案为: .
【分析】(1)A的核磁共振氢谱有4个峰,说明分子中有4种H原子;(2)由A的质谱图,可知A的相对分子质量为136,结合元素质量分数计算A中C、H、O原子个数,进而确定有机物A的分子式;(3)由红外光谱图知,A含有苯环,占6个C原子,还含有C=O、C﹣O﹣C、C﹣C、C﹣H,其中C=O、C﹣O﹣C可组合为 ,结合分子式、核磁共振氢谱判断;(4)A的核磁共振氢谱有4个峰,说明分子中有4种H原子,其面积之比为对应的各种H原子个数之比,根据分子式可知分子中H原子总数,进而确定甲基数目;(5)根据A分子的红外光谱,核磁共振氢谱确定确定A的结构简式.
21.【答案】(1)C12H16
(2)C10H14N2
【解析】【解答】解:(1)有机物A的碳原子数和不饱和度分别为12、5,则H原子数为12×2+2﹣5×2=16,因此A的分子式为C12H16,
故答案为:C12H16;(2)将A中的两个CH原子团换成两个N,得尼古丁的分子式为C10H14N2,
故答案为:C10H14N2.
【分析】(1)用公式法计算,根据A的碳原子数和不饱和度计算H的个数,从而确定分子式;(2)用等价代换法,将A中的两个CH原子团换成两个N,得尼古丁的分子式.
