4.2 电解池 (含解析)课堂练习 2023-2024学年高二上学期化学人教版(2019)选择性必修1
文档属性
| 名称 | 4.2 电解池 (含解析)课堂练习 2023-2024学年高二上学期化学人教版(2019)选择性必修1 |  | |
| 格式 | docx | ||
| 文件大小 | 511.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-08 11:42:41 | ||
图片预览


文档简介
4.2 电解池 课堂练习
一、单选题
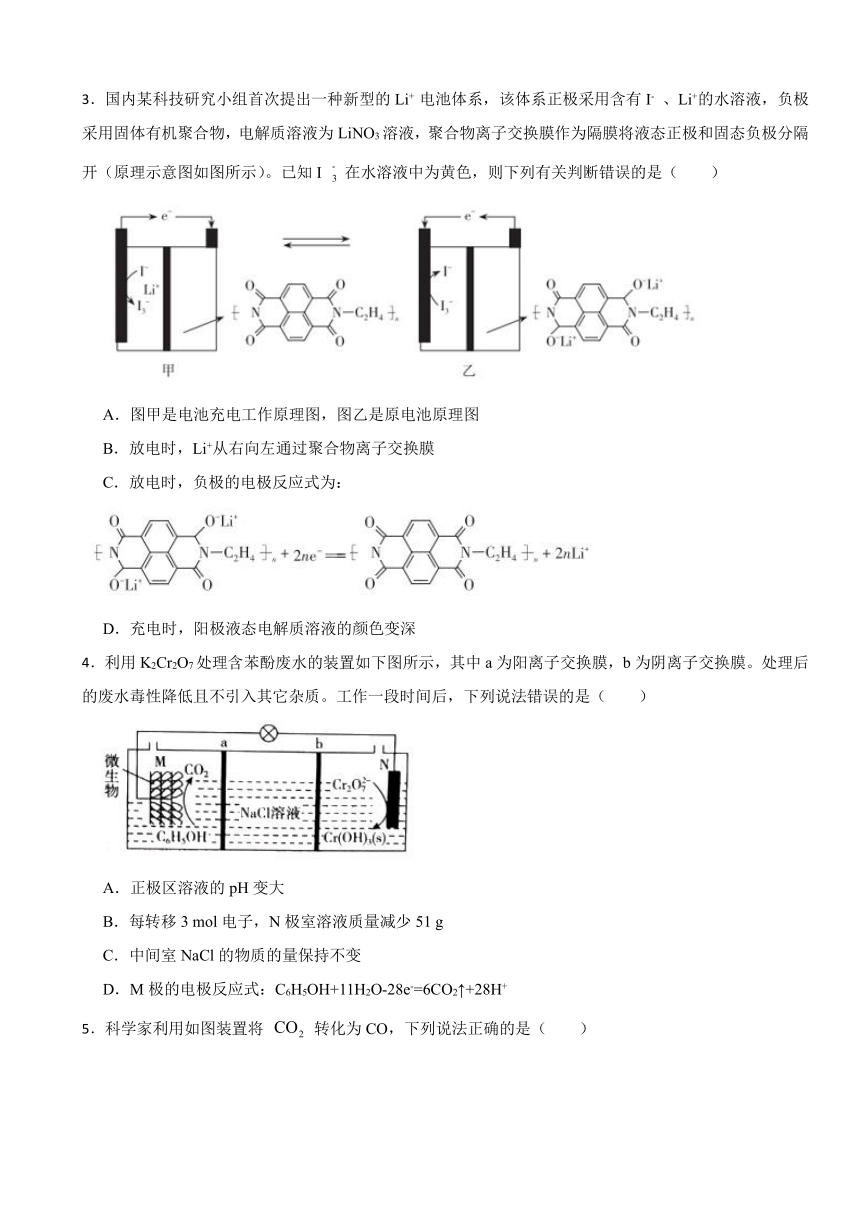
1.工业上利用双极膜电渗析法制取盐酸和氢氧化钠的装置如下图所示。图中的双极膜中间层中的电离为和,并在直流电场作用下分别向两极迁移。
下列有关说法错误的是( )
A.N表示阴离子交换膜
B.甲室流出的为氢氧化钠溶液
C.电解总反应:
D.相比现有氯碱工业制取氢氧化钠,该方法更环保
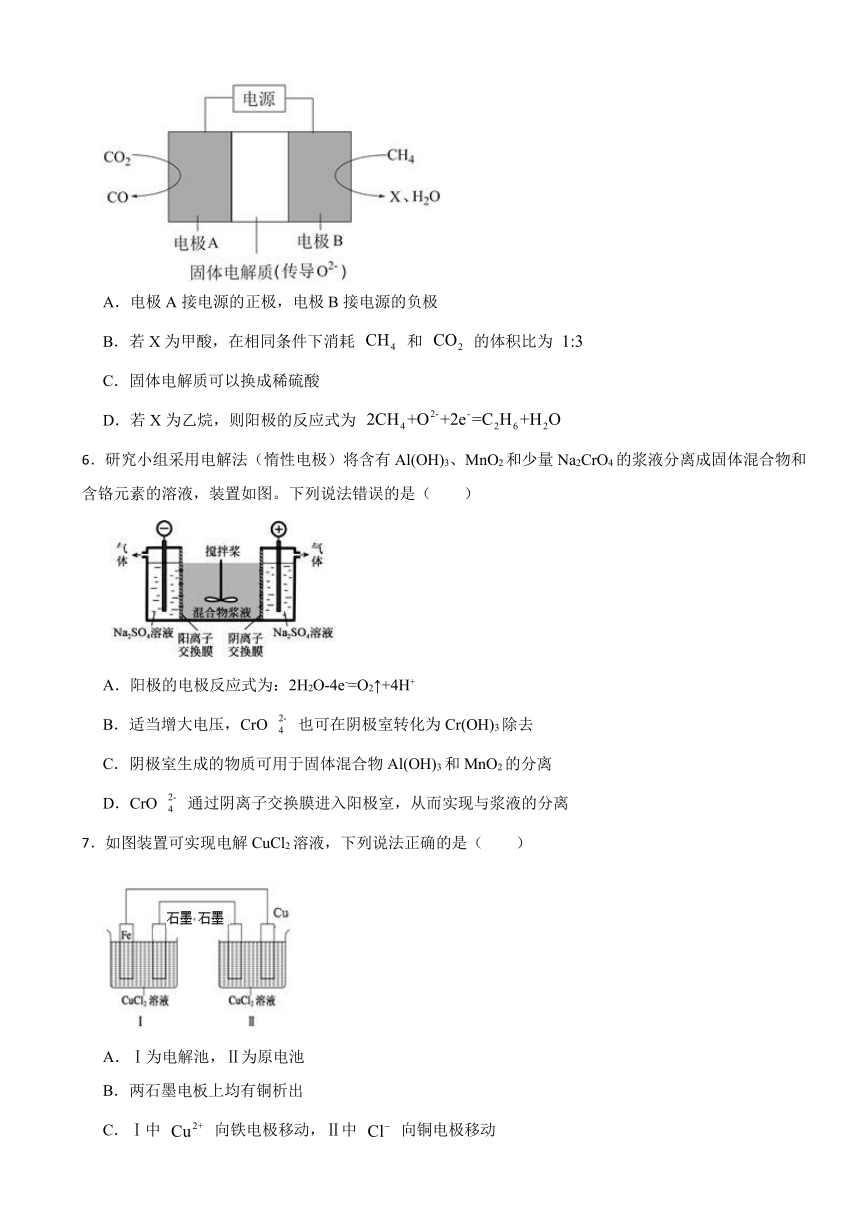
2.截至到2013年12月末,中国光伏发电新增装机容量达到10.66GW,光伏发电累计装机容量达到17.16GW,图1为光伏并网发电装置.图2为电解尿素[CO(NH2)2]的碱性溶液制氢的装置示意图(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极).下列叙述中正确的是( )
A.图1中N型半导体为正极,P型半导体为负极
B.图2溶液中电子流向:从B极流向A极
C.X2为氧气
D.工作时,A极的电极反应式为CO(NH2)2+8OH﹣﹣6e﹣═CO32﹣+N2↑+6H2O
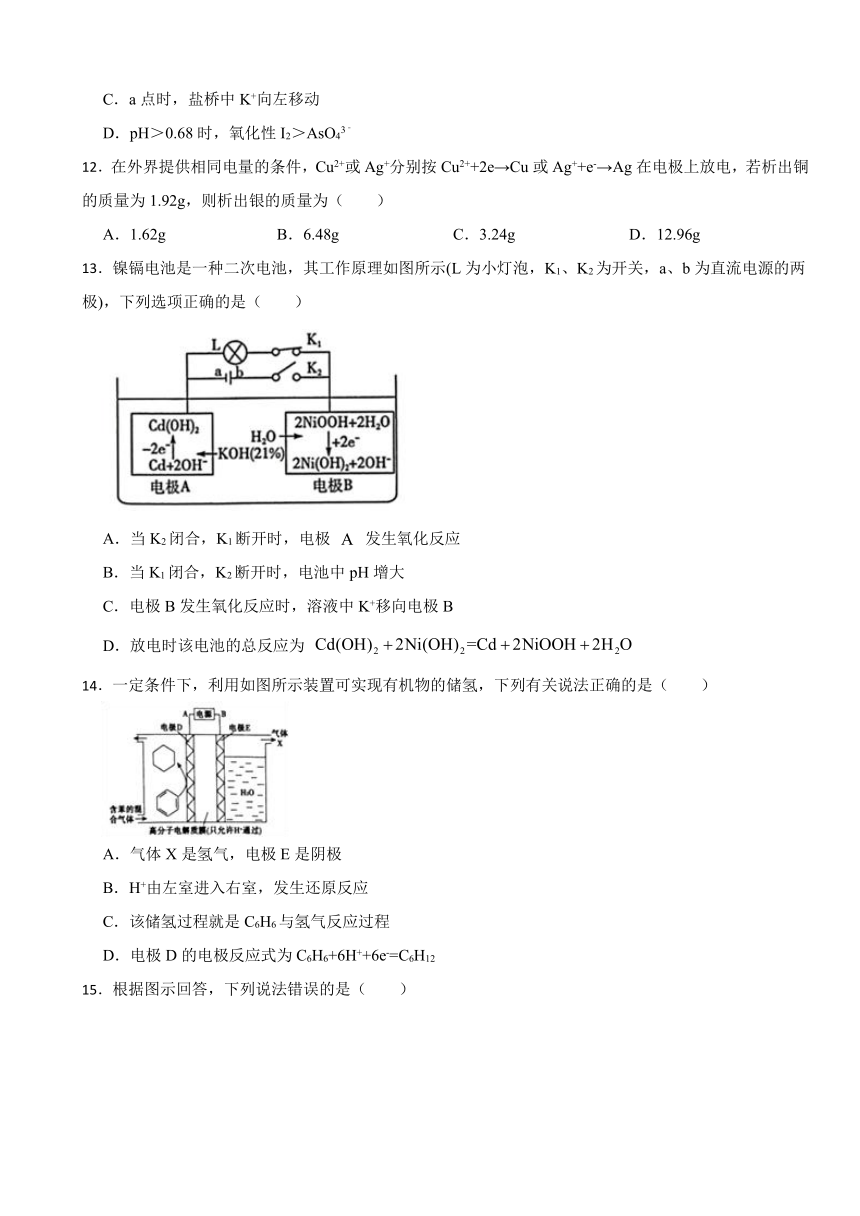
3.国内某科技研究小组首次提出一种新型的Li+ 电池体系,该体系正极采用含有I- 、Li+的水溶液,负极采用固体有机聚合物,电解质溶液为LiNO3溶液,聚合物离子交换膜作为隔膜将液态正极和固态负极分隔开(原理示意图如图所示)。已知I 在水溶液中为黄色,则下列有关判断错误的是( )
A.图甲是电池充电工作原理图,图乙是原电池原理图
B.放电时,Li+从右向左通过聚合物离子交换膜
C.放电时,负极的电极反应式为:
D.充电时,阳极液态电解质溶液的颜色变深
4.利用K2Cr2O7处理含苯酚废水的装置如下图所示,其中a为阳离子交换膜,b为阴离子交换膜。处理后的废水毒性降低且不引入其它杂质。工作一段时间后,下列说法错误的是( )
A.正极区溶液的pH变大
B.每转移3 mol电子,N极室溶液质量减少51 g
C.中间室NaCl的物质的量保持不变
D.M极的电极反应式:C6H5OH+11H2O-28e-=6CO2↑+28H+
5.科学家利用如图装置将 转化为CO,下列说法正确的是( )
A.电极A接电源的正极,电极B接电源的负极
B.若X为甲酸,在相同条件下消耗 和 的体积比为
C.固体电解质可以换成稀硫酸
D.若X为乙烷,则阳极的反应式为
6.研究小组采用电解法(惰性电极)将含有Al(OH)3、MnO2和少量Na2CrO4的浆液分离成固体混合物和含铬元素的溶液,装置如图。下列说法错误的是( )
A.阳极的电极反应式为:2H2O-4e-=O2↑+4H+
B.适当增大电压,CrO 也可在阴极室转化为Cr(OH)3除去
C.阴极室生成的物质可用于固体混合物Al(OH)3和MnO2的分离
D.CrO 通过阴离子交换膜进入阳极室,从而实现与浆液的分离
7.如图装置可实现电解CuCl2溶液,下列说法正确的是( )
A.Ⅰ为电解池,Ⅱ为原电池
B.两石墨电板上均有铜析出
C.Ⅰ中 向铁电极移动,Ⅱ中 向铜电极移动
D.工作一段时间后,理论上Ⅰ中 不变,Ⅱ中 减小
8.500mL KNO3和Cu(NO3)2的混合溶液中c(NO3﹣)=6.0mol L﹣1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到22.4L气体(标准状况),假定电解后溶液体积仍为500mL,下列说法正确的是( )
A.原混合溶液中c(K+)为1 mol L﹣1
B.上述电解过程中共转移4 mol电子
C.电解得到的Cu的物质的量为0.5 mol
D.电解后溶液中c(H+)为2 mol L﹣1
9.依据下列甲、乙、丙三图,判断下列叙述不正确的是( )
A.甲是原电池,乙是电镀装置
B.甲、乙装置中,锌极上均发生氧化反应
C.乙、丙装置中,阳极均发生氧化反应而溶解
D.丙装置中,铜电极的质量有增有减
10.下列关于铜电极的叙述中错误的是( )
A.锌铜原电池中铜是正极
B.在镀件上镀铜时可用金属铜作阳极
C.用电解法精炼粗铜时粗铜作阳极
D.用电解法精炼粗铜时纯铜作阳极
11.某实验小组依据反应AsO43﹣+2H++2I﹣ AsO33﹣+I2+H2O设计如图1,电池,探究pH对AsO43﹣氧化性的影响,测得输出电压与pH的关系如图2.下列有关叙述错误的是( )
A.c点时,正极的电极反应为ASO43﹣+2H++2e﹣═AsO33﹣+H2O
B.b点时,反应处于化学平衡状态
C.a点时,盐桥中K+向左移动
D.pH>0.68时,氧化性I2>AsO43﹣
12.在外界提供相同电量的条件,Cu2+或Ag+分别按Cu2++2e→Cu或Ag++e-→Ag在电极上放电,若析出铜的质量为1.92g,则析出银的质量为( )
A.1.62g B.6.48g C.3.24g D.12.96g
13.镍镉电池是一种二次电池,其工作原理如图所示(L为小灯泡,K1、K2为开关,a、b为直流电源的两极),下列选项正确的是( )
A.当K2闭合,K1断开时,电极 发生氧化反应
B.当K1闭合,K2断开时,电池中pH增大
C.电极B发生氧化反应时,溶液中K+移向电极B
D.放电时该电池的总反应为
14.一定条件下,利用如图所示装置可实现有机物的储氢,下列有关说法正确的是( )
A.气体X是氢气,电极E是阴极
B.H+由左室进入右室,发生还原反应
C.该储氢过程就是C6H6与氢气反应过程
D.电极D的电极反应式为C6H6+6H++6e-=C6H12
15.根据图示回答,下列说法错误的是( )
A.该燃料电池中正极反应为:
B.a电极为精铜时,硫酸铜溶液的浓度不变
C.若用该装置进行粗铜的精炼,当有水生成时,阴极可得到精铜
D.此装置用于铁表面镀铜时,a电极为铁
16.某小组设计电解饱和食盐水的装置如图,通电后两极均有气泡产生,下列叙述正确的是( )
A.铜是电解池的阳极 B.石墨电极附近溶液呈红色
C.铜电极上产生的是无色气体 D.石墨电极上发生还原反应
二、综合题
17.氮氧化物是造成酸雨、臭氧空洞、光化学烟雾等环境问题的主要原因之一。如何消除大气污染物中氮氧化物已成为人们关注的主要问题之一。
I.NH3-SCR法是工业上消除氮氧化物的常用方法。该法是利用氨的还原性,在一定条件下,将烟气中的NOx直接还原为N2。
主要反应原理为:4NH3+4NO+O2 4N2+6H2O
(1)已知有下列热化学方程式:
①4NH3(g)+4NO(g)+O2(g) 4N2(g)+6H2O(1) △H =-1891.5kJ mol-1
②N2(g)+O2(g) 2NO(g) △H =+180.5kJ mol-1
③H2O(1)=H2O(g) △H =+44.0kJ mol-1
则氨气与氧气反应生成NO和气态水的热化学方程式为 。
(2)其他条件相同,某2 L密闭容器中分别投入2 mol NH3、2 mol NO、1 mol O2,在甲、乙两种催化剂作用下,NO转化率与温度的关系如图所示。
①工业上选择催化剂乙的原因是 。
②在催化剂甲作用下,高于210℃时,NO转化率降低的原因可能是 。
(3)Ⅱ.CH4可以消除氮氧化物的污染。主要反应原理为:CH4(g)+2NO2(g)= CO2(g)+2H2O(g)+ N2(g) △H=-868.7kJ mol-1
在3.00L密闭容器中,通入0.100mol CH4和0.200mol NO2,在一定温度下进行上述反应,反应时间(t)与容器内气体总压强(P) 的数据见下表:
反应时间t/min 0 2 4 6 8 10
总压强p/100kPa 4.80 5.44 5.76 5.92 6.00 6.00
由表中数据,计算0-4min内v(NO2)= ,该温度下的平衡常数K= 。
(4)在一恒容装置中,通入一定量CH4和NO2,测得在相同时间内和不同温度下,NO2的转化率α(NO2)如下图,则下列叙述正确的是_____________
A.若温度维持在200℃更长时间,NO2的转化率将大于19%
B.反应速率:b点的v(逆)>e点的v(逆)
C.平衡常数: c点=d点
D.在时间t内,提高c点时NO2的转化率和反应速率,可适当升温或增大c(CH4)
(5)Ⅲ.工业上也常采用电解的方法消除氮氧化物的污染。
清华大学曹天宇等人研究的基于固体氧化物电解池(SOEC)的NOx电化学还原技术,为大气污染物治理开拓了新颖的思路。SOEC反应器的工作原理如图所示。电源的a 是 极。写出阴极的电极反应式: 。
18.ClO2为一种黄绿色气体,是目前国际上公认的高效、广谱、快速安全的杀菌剂。制备ClO2的新工艺是电解法。
(1)如图所示用石墨做电极,在一定条件下电解饱和食盐水制取ClO2,写出阳极产生ClO2的电极方程式: ;图中b电极为 (填“阳极”或“阴极”)。
(2)电解一段时间,当阴极产生标准状况下气体112 mL时,停止电解,则通过阳离子交换膜的阳离子物质的量为 mol,阴极区pH (填“变大”“变小”或“不变”)。
(3)ClO2对污水中Fe2+、Mn2+、S2-、CN-等有明显去除效果,某工厂中污水含CN-(a mol·L-1),现将ClO2把CN-氧化成两种无毒气体,写出该反应的离子方程式: 。
19.工业上电解制碱的技术是用离子交换膜法,主要原料是饱和食盐水.下图为离子交换膜法电解原理示意图:请回答下列问题:
(1)溶液A的溶质是 ,电解饱和食盐水的离子方程式是 .
(2)电解槽中部的阳离子交换膜把电解槽隔成了阴极室和阳极室,它只允许 (填离子符号,下同)通过,而不允许 和气体通过.
(3)电解法制碱的主要原料饱和食盐水是由粗盐制得,其中含有泥沙及Ca2+、Mg2+、Fe3+、SO42﹣等杂质,因此必须精制.精制时所用试剂为①NaOH ②Na2CO3③BaCl2④盐酸,这四种试剂的添加顺序为 (填序号).
(4)若将标准状况下6.72L阳极气体通入热的氢氧化钠溶液中,反应中只有一种元素的化合价发生改变,电子转移数是0.5×6.02×1023,产物中得到了两种含氯化合物,写出该反应的离子方程式: .
20.电解原理在化学工业中有广泛的应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
(1)若X、Y都是惰性电极,a是NaOH溶液,
①电解池中X极上的电极反应式为 ;
②Y电极上的电极反应式为 ;
③总的电解化学方程式为 ;
④电解后溶液PH的变化为 .(变大、不变或变小)
(2)如果用电解方法精炼粗铜,电解液a选用CuSO4溶液,则:
①X电极的材料是 ,电极反应是 .
②Y电极的材料是 ,电极反应是 .(说明:杂质发生的电极反应不必写出)
21.铅蓄电池、镍镉碱性充电电池都是重要的二次电池。已知:
①铅蓄电池总的化学方程式为: ,使用(放电)段时间后,其内阻明显增大,电压却几乎不变,此时只有充电才能继续使用;
②镍镉碱性充电电池放电时,正极反应为: ,负极反应式: ,使用(放电)到后期,当电压明显下降时,其内阻却几乎不变,此时充电后也能继续使用;
回答下列问题:
(1)铅蓄电池负极板上覆盖的物质是 (填名称),充电时,PbSO4在 (填“阳极”、“阴极”或“两个电极”)上 (填“生成或除去”)。
(2)镍镉碱性充电电池在充电时的总反应的化学方程式为 。
(3)铅蓄电池和镍镉碱性充电电池使用一段时间后,一个内阻明显增大,而另一个内阻却几乎不变的主要原因可能是 。
(4)现用铅蓄电池作为电源,连成如图所示装置,其中a为电解质溶液,X、Y是两块电极板,
①若X、Y都是惰性电极,a是CuSO4溶液,电解一段时间后,阴极只析出6.4g固体,则需要加入 (填化学式)即可恢复电解质溶液的浓度。
②可用该装置在实验室模拟铝制品表面“钝化”处理,可使铝制品表面形成较致密的氧化膜以更好地保护铝制品,a是稀硫酸溶液,写出Y电极上发生的电极反应式 。
答案解析部分
1.【答案】C
【解析】【解答】A.由图可知,左边石墨为阴极,右边石墨为阳极,电流方向由右向左,阳离子方向由右向左,阴离子方由左向右。氯离子由乙室向丙室迁移,N为阴离子交换膜,A不符合题意;
B.钠离子由乙室向甲室迁移,OH-由双极膜向甲室迁移,甲室流出的为氢氧化钠溶液,B不符合题意;
C.电解总反应为: ,C符合题意;
D.相比现有氯碱工业制取氢氧化钠,该方法无氯气产生,更环保,D不符合题意;
故答案为:C。
【分析】由图可知,左边电极与电源负极相连,为阴极,右边电极与电源正极相连,为阳极。
2.【答案】D
【解析】【解答】解:A.该电池反应时中,氮元素化合价由﹣3价变为0价,H元素化合价由+1价变为0价,则氮元素被氧化,氢元素被还原,所以生成氮气的电极A是阳极,生成氢气的电极B是阴极,则图1中N型半导体为负极,P型半导体为正极,故A错误;
B.电解时,电子的流向为:阳极→电源,电源→阴极,故B错误;
C.阴极B上水得电子生成氢气和氢氧根离子,电极反应式为2H2O+2e﹣═H2↑+2OH﹣,故C错误;
D.A极为阳极,电极反应式为:CO(NH2)2+80H﹣﹣6e﹣═CO32﹣+N2↑+6H2O,故D正确;
故选:D.
【分析】该电池反应时中,氮元素化合价由﹣3价变为0价,H元素化合价由+1价变为0价,所以生成氮气的电极A是阳极,生成氢气的电极B是阴极,结合电解池的工作原理分析解答.
3.【答案】C
【解析】【解答】A.图甲中,3I--2e-= ,作阳极,应是电池充电工作原理图;图乙中, +2e-=3I-,作正极,应是原电池原理图,A不符合题意;
B.放电时,乙池中左侧电极为正极,阳离子向正极移动,则Li+从右向左通过聚合物离子交换膜,B不符合题意;
C.放电时,负极应为有机物失电子,电极反应式为:
,C符合题意;
D.充电时,阳极3I--2e-= , 在水溶液中为黄色,所以液态电解质溶液的颜色变深,D不符合题意;
故答案为:C。
【分析】A.根据电子的流向,知甲中失去电子,作阳极,是原电池,乙中得到电子,做电源正极。是电解池
B.放电时,乙中左侧是正极区,聚集大量电子,吸引阳离子,
C.放电时,正极 I3- +2e-=3I-.负极应该失去电子。
D.充电时,阳极区域发生3I--2e-= I3- ,而 I3- 是黄色
4.【答案】B
【解析】【解答】A.N为正极,电极反应式为: +6e-+7H2O=2Cr(OH)3↓+8OH-,溶液的pH变大,故A不符合题意;
B.b是阴离子交换膜,N极室的OH-通过b进入中间室。当转移3mol电子时,根据N极的电极反应式可知,生成1molCr(OH)3,同时有3moOH-离开N极室,则N极室溶液质量减少1mol×103g/mol+3mol×17g/mol=154g,故B符合题意;
C.N极室中的OH-进入中间室,M极室的H+进入中间室,OH-和H+中和生成水,不影响NaCl的物质的量,所以中间室NaCl的物质的量保持不变,故C不符合题意;
D.M极为负极,C6H5OH失去电子生成CO2,电极反应式为:C6H5OH+11H2O-28e-=6CO2↑+28H+,故D不符合题意;
故答案为:B。
【分析】在M极,C6H5OH转化为CO2,碳元素化合价升高,失去电子,M极是负极,则N极为正极。
5.【答案】B
【解析】【解答】A. 转化成CO,得电子,发生还原反应,故电极A为阴极,接电源的负极,电极B接电源的正极,A项不符合题意;
B. 阴极电极反应式为 ,若X为甲酸,阳极电极反应式为 ,根据阴阳极得失电子守恒可知,消耗 和 的体积比为 ,B项符合题意;
C. 不能在水溶液中存在,C项不符合题意;
D. 根据氧化还原反应得失电子守恒规律,若X为乙烷,则阳极的反应式为 ,D项不符合题意;
故答案为:B。
【分析】根据元素的化合价的变化,二氧化碳到一氧化碳的元素化合价降低,被还原,即电极A为阴极,连接的电池的负极。电极B是阳极,连接的是电池的正极,根据X是甲酸即可写出方程式即可判断甲烷和二氧化碳的物质的量比值,根据传导的离子不能用硫酸作为电解质,当X为乙烷时根据阳极的电子转移即可写出电极式
6.【答案】B
【解析】【解答】A.阳极发生氧化反应,该电极的电极反应式为:2H2O - 4e- = O2↑+4H+,故A不符合题意;
B.适当增大电压,电解时,右池为阳极,阴离子向阳极移动,CrO42 通过阴离子交换膜向阳极移动,从而CrO42-能从浆液中分离出,故B符合题意;
C.阴极发生还原反应生成氢气,同时还会得到硫酸钠、氢氧化钠, Al(OH)3和MnO2中的氢氧化铝可以溶于氢氧化钠,氢氧化钠可用于固体混合物Al(OH)3和MnO2的分离,故C不符合题意;
D.电解时,CrO42-通过阴离子交换膜向阳极移动,通电后CrO42-将通过阴离子膜进入阳极室,从而实现与浆液的分离,故D不符合题意;
故答案为:B。
【分析】电解时,CrO42 通过阴离子交换膜向阳极移动,在阳极氢氧根离子失电子发生氧化反应,OH 放电后,阳极池酸度增强,发生反应2CrO42 +2H+=Cr2O72 +H2O,阴极发生还原反应生成氢气和NaOH,以此解答该题。
7.【答案】D
【解析】【解答】A.根据分析可知,图Ⅰ为铁碳原电池,图Ⅱ为电解池,故A不符合题意;
B.图Ⅰ为铁碳原电池,Cu2+向正极石墨电极移动,图Ⅱ为电解池,石墨作阳极,氯离子移向阳极,失电子发生氧化反应,电极反应为2Cl--2e-Cl2↑,故B符合题意;
C.原电池中,阳离子移向正极,Ⅰ中Cu2+向石墨电极移动,电解池中,阴离子移向阳极,Ⅱ中 向石墨电极移动,故C不符合题意;
D.工作一段时间后,Ⅰ中氯离子没有参与电极反应,Ⅱ中氯离子移向阳极,失电子发生氧化反应,电极反应为2Cl--2e-Cl2↑,故理论上Ⅰ中 不变,Ⅱ中 减小,故D符合题意;
故答案为:D。
【分析】图Ⅰ为铁碳原电池,铁比石墨活泼是负极,负极上失电子发生氧化反应,电极反应为:Fe-2e-=Fe2+,铜为正极,铜离子在石墨电极上得电子发生还原反应,电极反应为Cu2++2e-=Cu;图Ⅱ为电解池,与铁相连的铜为阴极,得电子发生还原反应,铜离子在阴极上得电子形成铜单质,电极反应为Cu2++2e-=Cu,与石墨相连的石墨为阳极,氯离子移向阳极,失电子发生氧化反应,电极反应为2Cl--2e=Cl2↑,据此分析。
8.【答案】B
【解析】【解答】解:石墨作电极电解此溶液,当通电一段时间后,两极均收集到22.4L气体(标准状况),n(O2)= =1mol,
阳极发生电极反应为:
4OH﹣ ﹣ 4e﹣ ═ O2↑ + 2H2O
4mol 4mol 1mol
阴极发生的电极反应为:
Cu2+ + 2e﹣ ═ Cu
1mol 2mol 1mol
2H+ + 2e﹣ ═ H2↑
1mol 2mol 1mol
A.c(Cu2+)= =2mol/L,由电荷守恒可知,原混合溶液中c(K+)=6mol/L﹣2mol/L×2=2mol/L,故A错误;
B.根据氧气计算转移电子的物质的量,转移电子的物质的量=1mol×4=4mol,故B正确;
C.电解得到的Cu的物质的量为1mol,故C错误;
D.电解后溶液中c(H+)为: =4mol/L,故D错误;
故选B.
【分析】石墨作电极电解此溶液,当通电一段时间后,两极均收集到22.4L气体(标准状况),阴极发生反应为:Cu2++2e﹣═Cu、2H++2e﹣═H2↑,阳极发生反应为:4OH﹣﹣4e﹣═O2↑+2H2O,n(O2)= =1mol,结合电子守恒及物质的量浓度的计算来解答.
9.【答案】B
【解析】【解答】解:A、甲装置没有外加电源,属于原电池,乙装置存在外加电源,属于电解池,可以在锌上镀铜,故A正确;
B、甲装置中,锌是负极,该电极上锌失电子发生氧化反应,乙装置中,锌极是阴极,该电极上发生还原反应,故B错误;
C、乙、丙装置中,阳极均是活泼的金属电极,该电极发生氧化反应而溶解,故C正确;
D、丙装置中,粗铜电极发生氧化反应,质量减少;精铜上电解质溶液中的铜离子放电生成单质铜,质量增加,所以铜电极的质量有增有减,故D正确.
故选B.
【分析】A、甲装置没有外加电源,属于原电池,乙装置存在外加电源,属于电解池;
B、在原电池的负极上发生氧化反应,在电解池的阴极上,发生还原反应;
C、在电解池的阳极上发生的是失电子的氧化反应,根据电极材料确定发生的反应;
D、丙装置中,粗铜电极发生氧化反应,质量减少;精铜上电解质溶液中的铜离子放电生成单质铜,质量增加.
10.【答案】D
【解析】【解答】A.锌铜原电池中锌做负极,铜做正极,A不符合题意;
B.在电镀池中,镀件做阴极,铜做阳极,B不符合题意;
C.电解法精炼铜,粗铜做阳极,纯铜做阴极,C不符合题意;
D.电解法精炼铜,纯铜做阴极,D符合题意;
故答案为:D。
【分析】A.活泼性强的做负极
B.镀铜时,需要铜离子得到电子,故可将铜做阳极失去电子变成铜离子
C.电解精炼铜时,粗铜做阳极,失去电子,铜离子在阴极得到电子发生还原反应
D.在纯铜表面析出铜单质,故做阴极
11.【答案】A
【解析】【解答】解:A、pH=5时,电压小于0,反应逆向进行,AsO33﹣在负极失电子,则负极电极反应式为AsO33﹣﹣2e﹣+H2O=AsO43﹣+2H+,故A错误;
B、pH=0.68时,电压为零,反应处于平衡状态,故B正确;
C、乙中碘离子失电子,则乙中石墨电极为负极,甲中石墨为正极,原电池中阳离子向正极移动,所以盐桥中K+向左移动,故C正确;
D、pH>0.68时,电压小于0,反应逆向进行,碘作氧化剂,所以氧化性I2>AsO43﹣,故D正确.
故选A.
【分析】A、pH=5时,电压小于0,反应逆向进行,AsO33﹣在负极失电子;
B、pH=0.68时,电压为零;
C、原电池中阳离子向正极移动;
D、pH>0.68时,电压小于0,反应逆向进行.
12.【答案】B
【解析】【解答】由Cu2++2e→Cu,Ag++e-→Ag可知,当得电子数相等时,析出铜和银的关系式为:Cu--2Ag,设析出银的质量为x
Cu--2Ag
64g (108×2)g
1.92g x
所以x= =6.48g
故答案为:B。
【分析】根据电量守恒得出关系式后进行计算即可。
13.【答案】B
【解析】【解答】A. 当K2闭合,K1断开时,该装置为电解池,电极 与电源负极相连,为阴极发生还原反应,A不符合题意;
B. 当K1闭合,K1断开时,该装置为原电池,放电时该电池的总反应为 ,因反应不断消耗水,使得电解液pH不断增大,B符合题意;
C.电极B发生氧化反应时,该装置为电解池,电极 为阳极,反应产生阳离子,根据同种电荷相互排斥,异种电荷相互吸引,可知阴离子移向B,C不符合题意;
D.电池放电时装置为原电池,根据图示可知总反应方程式为: ,D不符合题意;
故答案为:B。
【分析】
A.K2闭合,K1断开时,为电解池,A为负极发生还原反应;
B.K1闭合,K2断开,为原电池,根据总反应不断生成碱性物质,此时pH增大;
C.B电极氧化反应,失电子,而钾离子需要得电子,故钾离子应远离B电离方向移动;
D.根据图像的电极反应进行合并即可得出。
14.【答案】D
【解析】【解答】A,E为阳极,水中-2价O发生氧化反应生成氧气(气体X)和H+,故A不符合题意;
B,H+由右室进入左室,参与阴极反应,没有发生还原反应,故B不符合题意;
C,该储氢过程总反应为:2C6H6+6H2O 2C6H12+3O2,故C不符合题意;
D,电极D为阴极,苯发生还原反应生成C6H12,同时有H+参与,电极反应式为C6H6+6H++6e-=C6H12,故D符合题意。
故答案为:D
【分析】如图所示,左侧苯(C6H6)转化为环己烷(C6H12),所以苯发生还原反应,则D为阴极、A为电源负极,因此B为电源正极、E为阳极,据此解答即可。
15.【答案】D
【解析】【解答】A.图中左边装置为原电池,通入O2的电极为正极,O2得电子生成H2O,正极反应为O2+4e-+4H+=2H2O,A符合题意;
B.a电极为C铜时,精铜作阳极,阳极溶解的金属铜等于阴极析出的金属Cu,所以电解质溶液中铜离子相当于不参加反应,则其浓度不变,B符合题意;
C.电解精炼时,粗铜作阳极、纯铜作阴极,当有1 mol水生成时,转移电子是2mol,则根据Cu2++2e-=Cu,可得到64g铜,C符合题意;
D.此装置用于铁表面镀铜时,金属铜做阳极,a为阳极是金属铜电极,D不符合题意;
故答案为:D。
【分析】A.燃料电池中,燃料在负极失电子发生氧化反应;氧气在正极得电子,发生还原反应;
B.依据精炼铜的原理分析;
C.依据得失电子守恒;
D.依据电镀时,镀层作阳极,镀件作阴极,含镀层阳离子的溶液作电镀液判断。
16.【答案】C
【解析】【解答】解:根据电解饱和食盐水的装置,如果通电后两极均有气泡产生,则金属铜电极一定是阴极,该极上的反应:2H++2e﹣=H2↑,阳极上是氯离子失电子,发生的电极反应为:2Cl﹣﹣2e﹣=Cl2↑;
A.金属铜电极一定是阴极,故A错误;
B.石墨电极是阳极,该电极附近发生的电极反应为:2Cl﹣﹣2e﹣=Cl2↑,可以观察到黄绿色气体产生,故B错误;
C.金属铜电极上的反应为2H++2e﹣=H2↑,铜电极附近观察到无色气体,故C正确;
D.石墨电极是阳极,该极上的反应为氧化反应,故D错误;
故选C.
【分析】电解饱和食盐水的装置如图,通电后两极均有气泡产生,则Cu为阴极,石墨为阳极,Cu与电源负极相连,结合阳极发生氧化反应、阴极发生还原反应来解答.
17.【答案】(1)4NH3(g)+5O2(g)=4NO(g)+6H2O(g) ΔH=- 905.5kJ·mol-1
(2)低温下有很强的催化活性(或在较大的温度范围内有较高催化活性);温度超出了催化剂的活性温度范围;温度升高发生了副反应,该反应是放热反应,达到平衡后升高温度,平衡逆向移动等
(3)0.0100mol·L-l·min-1;0.675mol·L-1
(4)A;D
(5)正;2NO+4e-=N2+2O2-;O2+4e-=2O2-
【解析】【解答】(1)①+4×②+6×③得到:4NH3(g) + 5O2(g) = 4NO(g) + 6H2O(g) ΔH=- 905.5kJ·mol-1。
(2)①从图中看出,乙催化剂在较低温度下就可以达到较好的催化效果,所以工业上会使用乙催化剂。②当温度高于210℃的时候,在催化剂甲的作用下,NO的转化率降低,其原因可能是:在较高温度下,催化剂的催化活性降低,反应的NO减少,转化率降低;也可能是反应已经达平衡,升高温度平衡逆向移动,转化率降低;另外一种可能性是,温度升高,发生副反应,所以转化率降低。
(3)恒温恒容下,容器的压强比等于气体的物质的量的比。
CH4(g) + 2NO2(g) = CO2(g) + 2H2O(g) + N2(g)
起始 0.100 0.200 0 0 0
转化 x 2x x 2x x
4min 0.100-x 0.200-2x x 2x x
所以起始有0.3mol气体,4min时有(0.3+X) mol气体,有0.3∶(0.3+X)=4.80∶5.76,解得X=0.0600。所以反应的NO2为0.120mol,速率为:0.120mol÷3L÷4min=0.0100mol·L-1·min-1。
达到平衡时的压强为6.00,所以有:
CH4(g) + 2NO2(g) = CO2(g) + 2H2O(g) + N2(g)
起始 0.100 0.200 0 0 0
转化 x 2x x 2x x
平衡 0.100-x 0.200-2x x 2x x
所以起始有0.3mol气体,平衡时有(0.3+X) mol气体,有0.3∶(0.3+X)=4.80∶6,解得X=0.075。所以达平衡时CH4、NO2、CO2、H2O、N2的物质的量分别为0.025mol、0.05mol、0.075mol、0.15mol、0.075mol;平衡常数K= 0.675mol·L-1。
(4)实验的测定过程为:在一恒容装置中,通入一定量CH4和NO2,测在相同时间内和不同温度下,NO2的转化率α(NO2)。所以实验中测得的是不同温度下,反应相同时间后,NO2的转化率,不一定是平衡转化率。所以温度较低的时候,反应较慢,此时间没有达平衡,那么反应速率较快的,反应的NO2多,转化率就高(a、b、c三点符合此要求);温度较高时,反应快,此时间达到平衡态,则温度升高平衡逆向移动,转化率降低(d、e两点符合此要求)。由上,a点(200℃,转化率为19%)未达平衡,则如果反应时间再长一些,反应的NO2就会增加,转化率会高于19%,选项A符合题意。e点的温度高于b点所以速率应该高于b点,选项B不符合题意。点c和点d的温度不等,则平衡常数一定不等,选项C不符合题意。点c未达平衡,所以在不改变反应时间的前提下,升高温度加快反应速率,在相同时间内反应更多的NO2,提高NO2的转化率;增大甲烷的浓度一定加快速率,平衡正向移动,提高NO2的转化率,选项D符合题意。所以答案为AD。
(5)电解时阴离子应该向正极移动,根据图示的O2-的移动方向,确定上面是电解的阳极,所以a是电源的正极。阴极的反应物是NO、O2,从图中得到,阴极应该生成O2-,所以反应为(该装置是去污染装置,所以NO应该转化为氮气):2NO+4e-=N2+2O2-;O2+4e-=2O2-。
【分析】(5)根据氧负离子的移动方向判断电解池的电极,节和电解原理分析电极反应、书写电极方程式即可。
18.【答案】(1)Cl--5e-+2H2O=ClO2↑+4H+;阴极
(2)0.01 mol;变大
(3)2ClO2+2CN-=N2+2CO2+2Cl-
【解析】【解答】(1)电解液中阳离子由左至右,故左边是阳极,右边是阴极(b是阴极)。
(2)阴极产生的是H2,n(H2)=0.005 mol,需要转移的电子为0.01 mol,通过阳离子交换膜的为H+,故n(H+)=0.01 mol;阴极区H+放电,pH变大。
(3)根据电子得失守恒和原子守恒得2ClO2+2CN-=N2+2CO2+2Cl-。
【分析】(1)Cl-在阳极发生失电子的氧化反应,生成ClO2,据此写出电极反应;结合离子的移动方向确定b电极;
(2)结合电极反应式进行计算;
(3)ClO2具有氧化性,能将CN-氧化成N2和CO2,结合得失电子守恒、电荷守恒和原子守恒书写反应的离子方程式;
19.【答案】(1)NaOH;2Cl﹣+2H2O {#mathmL#}{#/mathmL#} H2↑+Cl2↑+2OH﹣
(2)Na+;Cl﹣、OH﹣
(3)③②①④
(4)3Cl2+6OH﹣ {#mathmL#}{#/mathmL#} 5Cl﹣+ClO3﹣+3H2O
【解析】【解答】解:(1)电解饱和食盐水时,阳极上氯离子失电子生成氯气,阴极上氢离子得电子生成氢气同时溶液中生成NaOH,其电解离子方程式为:2Cl﹣+2H2O {#mathmL#}{#/mathmL#} H2↑+Cl2↑+2OH﹣;在阴极上溶液中生成NaOH,所以A的溶质为NaOH;
故答案为:NaOH;2Cl﹣+2H2O {#mathmL#}{#/mathmL#} H2↑+Cl2↑+2OH﹣;(2)阳离子交换膜只允许阳离子钠离子通过,而阴离子氢氧根和氯离子均不能通过,
故答案为:Na+;Cl﹣、OH﹣;(3)粗盐提纯时加试剂的原则是:氢氧化钠除去镁离子和三价铁离子,碳酸钠一定加在氯化钡之后,这样碳酸钠既可以除去钙离子又可以除去多余的钡离子,盐酸加在最后来除去多余的碳酸根离子和氢氧根离子,
故答案为:③②①④;(4)氯气和热的氢氧化钠溶液反应生成氯化钠、氯酸钠和水,方程式为:3Cl2+6OH﹣ {#mathmL#}{#/mathmL#} 5Cl﹣+ClO3﹣+3H2O;
故答案为:3Cl2+6OH﹣ {#mathmL#}{#/mathmL#} 5Cl﹣+ClO3﹣+3H2O.
【分析】(1)电解饱和食盐水时,阳极上氯离子失电子生成氯气,阴极上氢离子得电子生成氢气同时溶液中生成NaOH;(2)阳离子交换膜只允许阳离子通过,而阴离子不能通过;(3)粗盐提纯时加试剂的原则是:碳酸钠一定加在氯化钡之后,盐酸加在最后;(4)氯气和热的氢氧化钠溶液反应生成氯化钠、氯酸钠和水.
20.【答案】(1)2H++2e﹣=H2↑;4OH﹣﹣4e﹣=2H2O+O2↑;2H2O {#mathmL#}{#/mathmL#} 2H2↑+O2↑;变大
(2)纯铜;Cu2++2e﹣=Cu;粗铜;Cu﹣2e﹣=Cu2+
【解析】【解答】解:(1)①和电源的负极相连的电极X极是阴极,该电极上氢离子发生得电子的还原反应,即2H++2e﹣=H2↑,故答案为:2H++2e﹣=H2↑;②和电源的正极相连的电极Y极是阳极,该电极上氢氧根离子发生失电子的氧化反应,即4OH﹣﹣4e﹣=2H2O+O2↑,故答案为:4OH﹣﹣4e﹣=2H2O+O2↑;③根据两极反应得到:电解的实质相当于电解水,总的电解化学方程式为2H2O {#mathmL#}{#/mathmL#} 2H2↑+O2↑,故答案为:2H2O {#mathmL#}{#/mathmL#} 2H2↑+O2↑;④相当于电解水,电解后溶液中溶剂减少,氢氧化钠的浓度增加,pH增大,即电解后溶液pH变大,故答案为:变大;(2)①电极反应为:Cu2++2e﹣=Cu,故答案为:精铜; Cu2++2e﹣=Cu;②电解方法精炼粗铜,电解池的阳极材料是粗铜,电极反应为:Cu﹣2e﹣=Cu2+,故答案为:粗铜;Cu﹣2e﹣=Cu2+.
【分析】(1)电解氢氧化钠时,阳极上是氢氧根离子失电子,阴极上是氢离子得电子,相当于电解水,所以电解后溶液中氢氧化钠的浓度增加;(2)根据电解精炼铜的工作原理知识:电解池的阴极材料是纯铜、阳极材料是粗铜来回答.
21.【答案】(1)铅;两个电极;除去
(2)Cd(OH)2 + 2Ni(OH)2=Cd + 2NiOOH + 2H2O
(3)放电时,铅蓄电池中硫酸溶液浓度减小,故内阻明显增大,而镍镉碱性电池的电解质溶液浓度几乎不变,故内阻几乎不变
(4)8.0CuO或12.4/CuCO3;2Al-6e-+3H2O=Al2O3 + 6H+
【解析】【解答】(1)反应中Pb失去电子,作负极,因此铅蓄电池负极板上覆盖的物质是铅,由于放电时两个电极上均生成硫酸铅,所以充电时,PbSO4在两个电极除去。
(2)镍镉碱性充电电池放电时,正极反应为: ,负极反应式: ,因此镍镉碱性充电电池放电时的总反应式为Cd + 2NiOOH + 2H2O=Cd(OH)2 + 2Ni(OH)2,则在充电时的总反应的化学方程式为Cd(OH)2 + 2Ni(OH)2=Cd + 2NiOOH + 2H2O。
(3)由于放电时,铅蓄电池中硫酸溶液浓度减小,故内阻明显增大,而镍镉碱性电池的电解质溶液浓度几乎不变,故内阻几乎不变。
(4)①惰性电极电解硫酸铜溶液,阴极铜离子放电析出铜,阳极氢氧根离子放电生成氧气,铜的物质的量是6.4g÷64g/mol=0.1mol,所以需要加入0.1mol氧化铜或0.1mol碳酸铜即可恢复电解质溶液的浓度,其质量分别是8.0g、12.4g。
②Y电极是阳极,铝失去电子转化为氧化铝可使铝制品表面形成较致密的氧化膜,从而更好地保护铝制品,Y电极上发生的电极反应式为2Al-6e-+3H2O=Al2O3 +6H+。
【分析】
(1)根据总的反应,Pb化合价升高,故做负极材料,充电时,阳极是硫酸铅失去电子变为二氧化铅,阴极是硫酸铅得到电子变为铅单质,故阴极和阳极均消耗硫酸铅
(2)根据放电的电极式即可写出充电的电极式,即可写出总的电池反应
(3)内阻变化主要是电解质溶液的浓度造成,浓度减小,内阻变大
(4)①根据阳极和阴极电解产物即可判断加入的物质②铝表面形成氧化铝薄膜,主要是铝失去电子,故在阳极反应,即铝在阳极失去电子结合水形成氧化铝和氢离子,即可写出电极式
一、单选题
1.工业上利用双极膜电渗析法制取盐酸和氢氧化钠的装置如下图所示。图中的双极膜中间层中的电离为和,并在直流电场作用下分别向两极迁移。
下列有关说法错误的是( )
A.N表示阴离子交换膜
B.甲室流出的为氢氧化钠溶液
C.电解总反应:
D.相比现有氯碱工业制取氢氧化钠,该方法更环保
2.截至到2013年12月末,中国光伏发电新增装机容量达到10.66GW,光伏发电累计装机容量达到17.16GW,图1为光伏并网发电装置.图2为电解尿素[CO(NH2)2]的碱性溶液制氢的装置示意图(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极).下列叙述中正确的是( )
A.图1中N型半导体为正极,P型半导体为负极
B.图2溶液中电子流向:从B极流向A极
C.X2为氧气
D.工作时,A极的电极反应式为CO(NH2)2+8OH﹣﹣6e﹣═CO32﹣+N2↑+6H2O
3.国内某科技研究小组首次提出一种新型的Li+ 电池体系,该体系正极采用含有I- 、Li+的水溶液,负极采用固体有机聚合物,电解质溶液为LiNO3溶液,聚合物离子交换膜作为隔膜将液态正极和固态负极分隔开(原理示意图如图所示)。已知I 在水溶液中为黄色,则下列有关判断错误的是( )
A.图甲是电池充电工作原理图,图乙是原电池原理图
B.放电时,Li+从右向左通过聚合物离子交换膜
C.放电时,负极的电极反应式为:
D.充电时,阳极液态电解质溶液的颜色变深
4.利用K2Cr2O7处理含苯酚废水的装置如下图所示,其中a为阳离子交换膜,b为阴离子交换膜。处理后的废水毒性降低且不引入其它杂质。工作一段时间后,下列说法错误的是( )
A.正极区溶液的pH变大
B.每转移3 mol电子,N极室溶液质量减少51 g
C.中间室NaCl的物质的量保持不变
D.M极的电极反应式:C6H5OH+11H2O-28e-=6CO2↑+28H+
5.科学家利用如图装置将 转化为CO,下列说法正确的是( )
A.电极A接电源的正极,电极B接电源的负极
B.若X为甲酸,在相同条件下消耗 和 的体积比为
C.固体电解质可以换成稀硫酸
D.若X为乙烷,则阳极的反应式为
6.研究小组采用电解法(惰性电极)将含有Al(OH)3、MnO2和少量Na2CrO4的浆液分离成固体混合物和含铬元素的溶液,装置如图。下列说法错误的是( )
A.阳极的电极反应式为:2H2O-4e-=O2↑+4H+
B.适当增大电压,CrO 也可在阴极室转化为Cr(OH)3除去
C.阴极室生成的物质可用于固体混合物Al(OH)3和MnO2的分离
D.CrO 通过阴离子交换膜进入阳极室,从而实现与浆液的分离
7.如图装置可实现电解CuCl2溶液,下列说法正确的是( )
A.Ⅰ为电解池,Ⅱ为原电池
B.两石墨电板上均有铜析出
C.Ⅰ中 向铁电极移动,Ⅱ中 向铜电极移动
D.工作一段时间后,理论上Ⅰ中 不变,Ⅱ中 减小
8.500mL KNO3和Cu(NO3)2的混合溶液中c(NO3﹣)=6.0mol L﹣1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到22.4L气体(标准状况),假定电解后溶液体积仍为500mL,下列说法正确的是( )
A.原混合溶液中c(K+)为1 mol L﹣1
B.上述电解过程中共转移4 mol电子
C.电解得到的Cu的物质的量为0.5 mol
D.电解后溶液中c(H+)为2 mol L﹣1
9.依据下列甲、乙、丙三图,判断下列叙述不正确的是( )
A.甲是原电池,乙是电镀装置
B.甲、乙装置中,锌极上均发生氧化反应
C.乙、丙装置中,阳极均发生氧化反应而溶解
D.丙装置中,铜电极的质量有增有减
10.下列关于铜电极的叙述中错误的是( )
A.锌铜原电池中铜是正极
B.在镀件上镀铜时可用金属铜作阳极
C.用电解法精炼粗铜时粗铜作阳极
D.用电解法精炼粗铜时纯铜作阳极
11.某实验小组依据反应AsO43﹣+2H++2I﹣ AsO33﹣+I2+H2O设计如图1,电池,探究pH对AsO43﹣氧化性的影响,测得输出电压与pH的关系如图2.下列有关叙述错误的是( )
A.c点时,正极的电极反应为ASO43﹣+2H++2e﹣═AsO33﹣+H2O
B.b点时,反应处于化学平衡状态
C.a点时,盐桥中K+向左移动
D.pH>0.68时,氧化性I2>AsO43﹣
12.在外界提供相同电量的条件,Cu2+或Ag+分别按Cu2++2e→Cu或Ag++e-→Ag在电极上放电,若析出铜的质量为1.92g,则析出银的质量为( )
A.1.62g B.6.48g C.3.24g D.12.96g
13.镍镉电池是一种二次电池,其工作原理如图所示(L为小灯泡,K1、K2为开关,a、b为直流电源的两极),下列选项正确的是( )
A.当K2闭合,K1断开时,电极 发生氧化反应
B.当K1闭合,K2断开时,电池中pH增大
C.电极B发生氧化反应时,溶液中K+移向电极B
D.放电时该电池的总反应为
14.一定条件下,利用如图所示装置可实现有机物的储氢,下列有关说法正确的是( )
A.气体X是氢气,电极E是阴极
B.H+由左室进入右室,发生还原反应
C.该储氢过程就是C6H6与氢气反应过程
D.电极D的电极反应式为C6H6+6H++6e-=C6H12
15.根据图示回答,下列说法错误的是( )
A.该燃料电池中正极反应为:
B.a电极为精铜时,硫酸铜溶液的浓度不变
C.若用该装置进行粗铜的精炼,当有水生成时,阴极可得到精铜
D.此装置用于铁表面镀铜时,a电极为铁
16.某小组设计电解饱和食盐水的装置如图,通电后两极均有气泡产生,下列叙述正确的是( )
A.铜是电解池的阳极 B.石墨电极附近溶液呈红色
C.铜电极上产生的是无色气体 D.石墨电极上发生还原反应
二、综合题
17.氮氧化物是造成酸雨、臭氧空洞、光化学烟雾等环境问题的主要原因之一。如何消除大气污染物中氮氧化物已成为人们关注的主要问题之一。
I.NH3-SCR法是工业上消除氮氧化物的常用方法。该法是利用氨的还原性,在一定条件下,将烟气中的NOx直接还原为N2。
主要反应原理为:4NH3+4NO+O2 4N2+6H2O
(1)已知有下列热化学方程式:
①4NH3(g)+4NO(g)+O2(g) 4N2(g)+6H2O(1) △H =-1891.5kJ mol-1
②N2(g)+O2(g) 2NO(g) △H =+180.5kJ mol-1
③H2O(1)=H2O(g) △H =+44.0kJ mol-1
则氨气与氧气反应生成NO和气态水的热化学方程式为 。
(2)其他条件相同,某2 L密闭容器中分别投入2 mol NH3、2 mol NO、1 mol O2,在甲、乙两种催化剂作用下,NO转化率与温度的关系如图所示。
①工业上选择催化剂乙的原因是 。
②在催化剂甲作用下,高于210℃时,NO转化率降低的原因可能是 。
(3)Ⅱ.CH4可以消除氮氧化物的污染。主要反应原理为:CH4(g)+2NO2(g)= CO2(g)+2H2O(g)+ N2(g) △H=-868.7kJ mol-1
在3.00L密闭容器中,通入0.100mol CH4和0.200mol NO2,在一定温度下进行上述反应,反应时间(t)与容器内气体总压强(P) 的数据见下表:
反应时间t/min 0 2 4 6 8 10
总压强p/100kPa 4.80 5.44 5.76 5.92 6.00 6.00
由表中数据,计算0-4min内v(NO2)= ,该温度下的平衡常数K= 。
(4)在一恒容装置中,通入一定量CH4和NO2,测得在相同时间内和不同温度下,NO2的转化率α(NO2)如下图,则下列叙述正确的是_____________
A.若温度维持在200℃更长时间,NO2的转化率将大于19%
B.反应速率:b点的v(逆)>e点的v(逆)
C.平衡常数: c点=d点
D.在时间t内,提高c点时NO2的转化率和反应速率,可适当升温或增大c(CH4)
(5)Ⅲ.工业上也常采用电解的方法消除氮氧化物的污染。
清华大学曹天宇等人研究的基于固体氧化物电解池(SOEC)的NOx电化学还原技术,为大气污染物治理开拓了新颖的思路。SOEC反应器的工作原理如图所示。电源的a 是 极。写出阴极的电极反应式: 。
18.ClO2为一种黄绿色气体,是目前国际上公认的高效、广谱、快速安全的杀菌剂。制备ClO2的新工艺是电解法。
(1)如图所示用石墨做电极,在一定条件下电解饱和食盐水制取ClO2,写出阳极产生ClO2的电极方程式: ;图中b电极为 (填“阳极”或“阴极”)。
(2)电解一段时间,当阴极产生标准状况下气体112 mL时,停止电解,则通过阳离子交换膜的阳离子物质的量为 mol,阴极区pH (填“变大”“变小”或“不变”)。
(3)ClO2对污水中Fe2+、Mn2+、S2-、CN-等有明显去除效果,某工厂中污水含CN-(a mol·L-1),现将ClO2把CN-氧化成两种无毒气体,写出该反应的离子方程式: 。
19.工业上电解制碱的技术是用离子交换膜法,主要原料是饱和食盐水.下图为离子交换膜法电解原理示意图:请回答下列问题:
(1)溶液A的溶质是 ,电解饱和食盐水的离子方程式是 .
(2)电解槽中部的阳离子交换膜把电解槽隔成了阴极室和阳极室,它只允许 (填离子符号,下同)通过,而不允许 和气体通过.
(3)电解法制碱的主要原料饱和食盐水是由粗盐制得,其中含有泥沙及Ca2+、Mg2+、Fe3+、SO42﹣等杂质,因此必须精制.精制时所用试剂为①NaOH ②Na2CO3③BaCl2④盐酸,这四种试剂的添加顺序为 (填序号).
(4)若将标准状况下6.72L阳极气体通入热的氢氧化钠溶液中,反应中只有一种元素的化合价发生改变,电子转移数是0.5×6.02×1023,产物中得到了两种含氯化合物,写出该反应的离子方程式: .
20.电解原理在化学工业中有广泛的应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
(1)若X、Y都是惰性电极,a是NaOH溶液,
①电解池中X极上的电极反应式为 ;
②Y电极上的电极反应式为 ;
③总的电解化学方程式为 ;
④电解后溶液PH的变化为 .(变大、不变或变小)
(2)如果用电解方法精炼粗铜,电解液a选用CuSO4溶液,则:
①X电极的材料是 ,电极反应是 .
②Y电极的材料是 ,电极反应是 .(说明:杂质发生的电极反应不必写出)
21.铅蓄电池、镍镉碱性充电电池都是重要的二次电池。已知:
①铅蓄电池总的化学方程式为: ,使用(放电)段时间后,其内阻明显增大,电压却几乎不变,此时只有充电才能继续使用;
②镍镉碱性充电电池放电时,正极反应为: ,负极反应式: ,使用(放电)到后期,当电压明显下降时,其内阻却几乎不变,此时充电后也能继续使用;
回答下列问题:
(1)铅蓄电池负极板上覆盖的物质是 (填名称),充电时,PbSO4在 (填“阳极”、“阴极”或“两个电极”)上 (填“生成或除去”)。
(2)镍镉碱性充电电池在充电时的总反应的化学方程式为 。
(3)铅蓄电池和镍镉碱性充电电池使用一段时间后,一个内阻明显增大,而另一个内阻却几乎不变的主要原因可能是 。
(4)现用铅蓄电池作为电源,连成如图所示装置,其中a为电解质溶液,X、Y是两块电极板,
①若X、Y都是惰性电极,a是CuSO4溶液,电解一段时间后,阴极只析出6.4g固体,则需要加入 (填化学式)即可恢复电解质溶液的浓度。
②可用该装置在实验室模拟铝制品表面“钝化”处理,可使铝制品表面形成较致密的氧化膜以更好地保护铝制品,a是稀硫酸溶液,写出Y电极上发生的电极反应式 。
答案解析部分
1.【答案】C
【解析】【解答】A.由图可知,左边石墨为阴极,右边石墨为阳极,电流方向由右向左,阳离子方向由右向左,阴离子方由左向右。氯离子由乙室向丙室迁移,N为阴离子交换膜,A不符合题意;
B.钠离子由乙室向甲室迁移,OH-由双极膜向甲室迁移,甲室流出的为氢氧化钠溶液,B不符合题意;
C.电解总反应为: ,C符合题意;
D.相比现有氯碱工业制取氢氧化钠,该方法无氯气产生,更环保,D不符合题意;
故答案为:C。
【分析】由图可知,左边电极与电源负极相连,为阴极,右边电极与电源正极相连,为阳极。
2.【答案】D
【解析】【解答】解:A.该电池反应时中,氮元素化合价由﹣3价变为0价,H元素化合价由+1价变为0价,则氮元素被氧化,氢元素被还原,所以生成氮气的电极A是阳极,生成氢气的电极B是阴极,则图1中N型半导体为负极,P型半导体为正极,故A错误;
B.电解时,电子的流向为:阳极→电源,电源→阴极,故B错误;
C.阴极B上水得电子生成氢气和氢氧根离子,电极反应式为2H2O+2e﹣═H2↑+2OH﹣,故C错误;
D.A极为阳极,电极反应式为:CO(NH2)2+80H﹣﹣6e﹣═CO32﹣+N2↑+6H2O,故D正确;
故选:D.
【分析】该电池反应时中,氮元素化合价由﹣3价变为0价,H元素化合价由+1价变为0价,所以生成氮气的电极A是阳极,生成氢气的电极B是阴极,结合电解池的工作原理分析解答.
3.【答案】C
【解析】【解答】A.图甲中,3I--2e-= ,作阳极,应是电池充电工作原理图;图乙中, +2e-=3I-,作正极,应是原电池原理图,A不符合题意;
B.放电时,乙池中左侧电极为正极,阳离子向正极移动,则Li+从右向左通过聚合物离子交换膜,B不符合题意;
C.放电时,负极应为有机物失电子,电极反应式为:
,C符合题意;
D.充电时,阳极3I--2e-= , 在水溶液中为黄色,所以液态电解质溶液的颜色变深,D不符合题意;
故答案为:C。
【分析】A.根据电子的流向,知甲中失去电子,作阳极,是原电池,乙中得到电子,做电源正极。是电解池
B.放电时,乙中左侧是正极区,聚集大量电子,吸引阳离子,
C.放电时,正极 I3- +2e-=3I-.负极应该失去电子。
D.充电时,阳极区域发生3I--2e-= I3- ,而 I3- 是黄色
4.【答案】B
【解析】【解答】A.N为正极,电极反应式为: +6e-+7H2O=2Cr(OH)3↓+8OH-,溶液的pH变大,故A不符合题意;
B.b是阴离子交换膜,N极室的OH-通过b进入中间室。当转移3mol电子时,根据N极的电极反应式可知,生成1molCr(OH)3,同时有3moOH-离开N极室,则N极室溶液质量减少1mol×103g/mol+3mol×17g/mol=154g,故B符合题意;
C.N极室中的OH-进入中间室,M极室的H+进入中间室,OH-和H+中和生成水,不影响NaCl的物质的量,所以中间室NaCl的物质的量保持不变,故C不符合题意;
D.M极为负极,C6H5OH失去电子生成CO2,电极反应式为:C6H5OH+11H2O-28e-=6CO2↑+28H+,故D不符合题意;
故答案为:B。
【分析】在M极,C6H5OH转化为CO2,碳元素化合价升高,失去电子,M极是负极,则N极为正极。
5.【答案】B
【解析】【解答】A. 转化成CO,得电子,发生还原反应,故电极A为阴极,接电源的负极,电极B接电源的正极,A项不符合题意;
B. 阴极电极反应式为 ,若X为甲酸,阳极电极反应式为 ,根据阴阳极得失电子守恒可知,消耗 和 的体积比为 ,B项符合题意;
C. 不能在水溶液中存在,C项不符合题意;
D. 根据氧化还原反应得失电子守恒规律,若X为乙烷,则阳极的反应式为 ,D项不符合题意;
故答案为:B。
【分析】根据元素的化合价的变化,二氧化碳到一氧化碳的元素化合价降低,被还原,即电极A为阴极,连接的电池的负极。电极B是阳极,连接的是电池的正极,根据X是甲酸即可写出方程式即可判断甲烷和二氧化碳的物质的量比值,根据传导的离子不能用硫酸作为电解质,当X为乙烷时根据阳极的电子转移即可写出电极式
6.【答案】B
【解析】【解答】A.阳极发生氧化反应,该电极的电极反应式为:2H2O - 4e- = O2↑+4H+,故A不符合题意;
B.适当增大电压,电解时,右池为阳极,阴离子向阳极移动,CrO42 通过阴离子交换膜向阳极移动,从而CrO42-能从浆液中分离出,故B符合题意;
C.阴极发生还原反应生成氢气,同时还会得到硫酸钠、氢氧化钠, Al(OH)3和MnO2中的氢氧化铝可以溶于氢氧化钠,氢氧化钠可用于固体混合物Al(OH)3和MnO2的分离,故C不符合题意;
D.电解时,CrO42-通过阴离子交换膜向阳极移动,通电后CrO42-将通过阴离子膜进入阳极室,从而实现与浆液的分离,故D不符合题意;
故答案为:B。
【分析】电解时,CrO42 通过阴离子交换膜向阳极移动,在阳极氢氧根离子失电子发生氧化反应,OH 放电后,阳极池酸度增强,发生反应2CrO42 +2H+=Cr2O72 +H2O,阴极发生还原反应生成氢气和NaOH,以此解答该题。
7.【答案】D
【解析】【解答】A.根据分析可知,图Ⅰ为铁碳原电池,图Ⅱ为电解池,故A不符合题意;
B.图Ⅰ为铁碳原电池,Cu2+向正极石墨电极移动,图Ⅱ为电解池,石墨作阳极,氯离子移向阳极,失电子发生氧化反应,电极反应为2Cl--2e-Cl2↑,故B符合题意;
C.原电池中,阳离子移向正极,Ⅰ中Cu2+向石墨电极移动,电解池中,阴离子移向阳极,Ⅱ中 向石墨电极移动,故C不符合题意;
D.工作一段时间后,Ⅰ中氯离子没有参与电极反应,Ⅱ中氯离子移向阳极,失电子发生氧化反应,电极反应为2Cl--2e-Cl2↑,故理论上Ⅰ中 不变,Ⅱ中 减小,故D符合题意;
故答案为:D。
【分析】图Ⅰ为铁碳原电池,铁比石墨活泼是负极,负极上失电子发生氧化反应,电极反应为:Fe-2e-=Fe2+,铜为正极,铜离子在石墨电极上得电子发生还原反应,电极反应为Cu2++2e-=Cu;图Ⅱ为电解池,与铁相连的铜为阴极,得电子发生还原反应,铜离子在阴极上得电子形成铜单质,电极反应为Cu2++2e-=Cu,与石墨相连的石墨为阳极,氯离子移向阳极,失电子发生氧化反应,电极反应为2Cl--2e=Cl2↑,据此分析。
8.【答案】B
【解析】【解答】解:石墨作电极电解此溶液,当通电一段时间后,两极均收集到22.4L气体(标准状况),n(O2)= =1mol,
阳极发生电极反应为:
4OH﹣ ﹣ 4e﹣ ═ O2↑ + 2H2O
4mol 4mol 1mol
阴极发生的电极反应为:
Cu2+ + 2e﹣ ═ Cu
1mol 2mol 1mol
2H+ + 2e﹣ ═ H2↑
1mol 2mol 1mol
A.c(Cu2+)= =2mol/L,由电荷守恒可知,原混合溶液中c(K+)=6mol/L﹣2mol/L×2=2mol/L,故A错误;
B.根据氧气计算转移电子的物质的量,转移电子的物质的量=1mol×4=4mol,故B正确;
C.电解得到的Cu的物质的量为1mol,故C错误;
D.电解后溶液中c(H+)为: =4mol/L,故D错误;
故选B.
【分析】石墨作电极电解此溶液,当通电一段时间后,两极均收集到22.4L气体(标准状况),阴极发生反应为:Cu2++2e﹣═Cu、2H++2e﹣═H2↑,阳极发生反应为:4OH﹣﹣4e﹣═O2↑+2H2O,n(O2)= =1mol,结合电子守恒及物质的量浓度的计算来解答.
9.【答案】B
【解析】【解答】解:A、甲装置没有外加电源,属于原电池,乙装置存在外加电源,属于电解池,可以在锌上镀铜,故A正确;
B、甲装置中,锌是负极,该电极上锌失电子发生氧化反应,乙装置中,锌极是阴极,该电极上发生还原反应,故B错误;
C、乙、丙装置中,阳极均是活泼的金属电极,该电极发生氧化反应而溶解,故C正确;
D、丙装置中,粗铜电极发生氧化反应,质量减少;精铜上电解质溶液中的铜离子放电生成单质铜,质量增加,所以铜电极的质量有增有减,故D正确.
故选B.
【分析】A、甲装置没有外加电源,属于原电池,乙装置存在外加电源,属于电解池;
B、在原电池的负极上发生氧化反应,在电解池的阴极上,发生还原反应;
C、在电解池的阳极上发生的是失电子的氧化反应,根据电极材料确定发生的反应;
D、丙装置中,粗铜电极发生氧化反应,质量减少;精铜上电解质溶液中的铜离子放电生成单质铜,质量增加.
10.【答案】D
【解析】【解答】A.锌铜原电池中锌做负极,铜做正极,A不符合题意;
B.在电镀池中,镀件做阴极,铜做阳极,B不符合题意;
C.电解法精炼铜,粗铜做阳极,纯铜做阴极,C不符合题意;
D.电解法精炼铜,纯铜做阴极,D符合题意;
故答案为:D。
【分析】A.活泼性强的做负极
B.镀铜时,需要铜离子得到电子,故可将铜做阳极失去电子变成铜离子
C.电解精炼铜时,粗铜做阳极,失去电子,铜离子在阴极得到电子发生还原反应
D.在纯铜表面析出铜单质,故做阴极
11.【答案】A
【解析】【解答】解:A、pH=5时,电压小于0,反应逆向进行,AsO33﹣在负极失电子,则负极电极反应式为AsO33﹣﹣2e﹣+H2O=AsO43﹣+2H+,故A错误;
B、pH=0.68时,电压为零,反应处于平衡状态,故B正确;
C、乙中碘离子失电子,则乙中石墨电极为负极,甲中石墨为正极,原电池中阳离子向正极移动,所以盐桥中K+向左移动,故C正确;
D、pH>0.68时,电压小于0,反应逆向进行,碘作氧化剂,所以氧化性I2>AsO43﹣,故D正确.
故选A.
【分析】A、pH=5时,电压小于0,反应逆向进行,AsO33﹣在负极失电子;
B、pH=0.68时,电压为零;
C、原电池中阳离子向正极移动;
D、pH>0.68时,电压小于0,反应逆向进行.
12.【答案】B
【解析】【解答】由Cu2++2e→Cu,Ag++e-→Ag可知,当得电子数相等时,析出铜和银的关系式为:Cu--2Ag,设析出银的质量为x
Cu--2Ag
64g (108×2)g
1.92g x
所以x= =6.48g
故答案为:B。
【分析】根据电量守恒得出关系式后进行计算即可。
13.【答案】B
【解析】【解答】A. 当K2闭合,K1断开时,该装置为电解池,电极 与电源负极相连,为阴极发生还原反应,A不符合题意;
B. 当K1闭合,K1断开时,该装置为原电池,放电时该电池的总反应为 ,因反应不断消耗水,使得电解液pH不断增大,B符合题意;
C.电极B发生氧化反应时,该装置为电解池,电极 为阳极,反应产生阳离子,根据同种电荷相互排斥,异种电荷相互吸引,可知阴离子移向B,C不符合题意;
D.电池放电时装置为原电池,根据图示可知总反应方程式为: ,D不符合题意;
故答案为:B。
【分析】
A.K2闭合,K1断开时,为电解池,A为负极发生还原反应;
B.K1闭合,K2断开,为原电池,根据总反应不断生成碱性物质,此时pH增大;
C.B电极氧化反应,失电子,而钾离子需要得电子,故钾离子应远离B电离方向移动;
D.根据图像的电极反应进行合并即可得出。
14.【答案】D
【解析】【解答】A,E为阳极,水中-2价O发生氧化反应生成氧气(气体X)和H+,故A不符合题意;
B,H+由右室进入左室,参与阴极反应,没有发生还原反应,故B不符合题意;
C,该储氢过程总反应为:2C6H6+6H2O 2C6H12+3O2,故C不符合题意;
D,电极D为阴极,苯发生还原反应生成C6H12,同时有H+参与,电极反应式为C6H6+6H++6e-=C6H12,故D符合题意。
故答案为:D
【分析】如图所示,左侧苯(C6H6)转化为环己烷(C6H12),所以苯发生还原反应,则D为阴极、A为电源负极,因此B为电源正极、E为阳极,据此解答即可。
15.【答案】D
【解析】【解答】A.图中左边装置为原电池,通入O2的电极为正极,O2得电子生成H2O,正极反应为O2+4e-+4H+=2H2O,A符合题意;
B.a电极为C铜时,精铜作阳极,阳极溶解的金属铜等于阴极析出的金属Cu,所以电解质溶液中铜离子相当于不参加反应,则其浓度不变,B符合题意;
C.电解精炼时,粗铜作阳极、纯铜作阴极,当有1 mol水生成时,转移电子是2mol,则根据Cu2++2e-=Cu,可得到64g铜,C符合题意;
D.此装置用于铁表面镀铜时,金属铜做阳极,a为阳极是金属铜电极,D不符合题意;
故答案为:D。
【分析】A.燃料电池中,燃料在负极失电子发生氧化反应;氧气在正极得电子,发生还原反应;
B.依据精炼铜的原理分析;
C.依据得失电子守恒;
D.依据电镀时,镀层作阳极,镀件作阴极,含镀层阳离子的溶液作电镀液判断。
16.【答案】C
【解析】【解答】解:根据电解饱和食盐水的装置,如果通电后两极均有气泡产生,则金属铜电极一定是阴极,该极上的反应:2H++2e﹣=H2↑,阳极上是氯离子失电子,发生的电极反应为:2Cl﹣﹣2e﹣=Cl2↑;
A.金属铜电极一定是阴极,故A错误;
B.石墨电极是阳极,该电极附近发生的电极反应为:2Cl﹣﹣2e﹣=Cl2↑,可以观察到黄绿色气体产生,故B错误;
C.金属铜电极上的反应为2H++2e﹣=H2↑,铜电极附近观察到无色气体,故C正确;
D.石墨电极是阳极,该极上的反应为氧化反应,故D错误;
故选C.
【分析】电解饱和食盐水的装置如图,通电后两极均有气泡产生,则Cu为阴极,石墨为阳极,Cu与电源负极相连,结合阳极发生氧化反应、阴极发生还原反应来解答.
17.【答案】(1)4NH3(g)+5O2(g)=4NO(g)+6H2O(g) ΔH=- 905.5kJ·mol-1
(2)低温下有很强的催化活性(或在较大的温度范围内有较高催化活性);温度超出了催化剂的活性温度范围;温度升高发生了副反应,该反应是放热反应,达到平衡后升高温度,平衡逆向移动等
(3)0.0100mol·L-l·min-1;0.675mol·L-1
(4)A;D
(5)正;2NO+4e-=N2+2O2-;O2+4e-=2O2-
【解析】【解答】(1)①+4×②+6×③得到:4NH3(g) + 5O2(g) = 4NO(g) + 6H2O(g) ΔH=- 905.5kJ·mol-1。
(2)①从图中看出,乙催化剂在较低温度下就可以达到较好的催化效果,所以工业上会使用乙催化剂。②当温度高于210℃的时候,在催化剂甲的作用下,NO的转化率降低,其原因可能是:在较高温度下,催化剂的催化活性降低,反应的NO减少,转化率降低;也可能是反应已经达平衡,升高温度平衡逆向移动,转化率降低;另外一种可能性是,温度升高,发生副反应,所以转化率降低。
(3)恒温恒容下,容器的压强比等于气体的物质的量的比。
CH4(g) + 2NO2(g) = CO2(g) + 2H2O(g) + N2(g)
起始 0.100 0.200 0 0 0
转化 x 2x x 2x x
4min 0.100-x 0.200-2x x 2x x
所以起始有0.3mol气体,4min时有(0.3+X) mol气体,有0.3∶(0.3+X)=4.80∶5.76,解得X=0.0600。所以反应的NO2为0.120mol,速率为:0.120mol÷3L÷4min=0.0100mol·L-1·min-1。
达到平衡时的压强为6.00,所以有:
CH4(g) + 2NO2(g) = CO2(g) + 2H2O(g) + N2(g)
起始 0.100 0.200 0 0 0
转化 x 2x x 2x x
平衡 0.100-x 0.200-2x x 2x x
所以起始有0.3mol气体,平衡时有(0.3+X) mol气体,有0.3∶(0.3+X)=4.80∶6,解得X=0.075。所以达平衡时CH4、NO2、CO2、H2O、N2的物质的量分别为0.025mol、0.05mol、0.075mol、0.15mol、0.075mol;平衡常数K= 0.675mol·L-1。
(4)实验的测定过程为:在一恒容装置中,通入一定量CH4和NO2,测在相同时间内和不同温度下,NO2的转化率α(NO2)。所以实验中测得的是不同温度下,反应相同时间后,NO2的转化率,不一定是平衡转化率。所以温度较低的时候,反应较慢,此时间没有达平衡,那么反应速率较快的,反应的NO2多,转化率就高(a、b、c三点符合此要求);温度较高时,反应快,此时间达到平衡态,则温度升高平衡逆向移动,转化率降低(d、e两点符合此要求)。由上,a点(200℃,转化率为19%)未达平衡,则如果反应时间再长一些,反应的NO2就会增加,转化率会高于19%,选项A符合题意。e点的温度高于b点所以速率应该高于b点,选项B不符合题意。点c和点d的温度不等,则平衡常数一定不等,选项C不符合题意。点c未达平衡,所以在不改变反应时间的前提下,升高温度加快反应速率,在相同时间内反应更多的NO2,提高NO2的转化率;增大甲烷的浓度一定加快速率,平衡正向移动,提高NO2的转化率,选项D符合题意。所以答案为AD。
(5)电解时阴离子应该向正极移动,根据图示的O2-的移动方向,确定上面是电解的阳极,所以a是电源的正极。阴极的反应物是NO、O2,从图中得到,阴极应该生成O2-,所以反应为(该装置是去污染装置,所以NO应该转化为氮气):2NO+4e-=N2+2O2-;O2+4e-=2O2-。
【分析】(5)根据氧负离子的移动方向判断电解池的电极,节和电解原理分析电极反应、书写电极方程式即可。
18.【答案】(1)Cl--5e-+2H2O=ClO2↑+4H+;阴极
(2)0.01 mol;变大
(3)2ClO2+2CN-=N2+2CO2+2Cl-
【解析】【解答】(1)电解液中阳离子由左至右,故左边是阳极,右边是阴极(b是阴极)。
(2)阴极产生的是H2,n(H2)=0.005 mol,需要转移的电子为0.01 mol,通过阳离子交换膜的为H+,故n(H+)=0.01 mol;阴极区H+放电,pH变大。
(3)根据电子得失守恒和原子守恒得2ClO2+2CN-=N2+2CO2+2Cl-。
【分析】(1)Cl-在阳极发生失电子的氧化反应,生成ClO2,据此写出电极反应;结合离子的移动方向确定b电极;
(2)结合电极反应式进行计算;
(3)ClO2具有氧化性,能将CN-氧化成N2和CO2,结合得失电子守恒、电荷守恒和原子守恒书写反应的离子方程式;
19.【答案】(1)NaOH;2Cl﹣+2H2O {#mathmL#}{#/mathmL#} H2↑+Cl2↑+2OH﹣
(2)Na+;Cl﹣、OH﹣
(3)③②①④
(4)3Cl2+6OH﹣ {#mathmL#}{#/mathmL#} 5Cl﹣+ClO3﹣+3H2O
【解析】【解答】解:(1)电解饱和食盐水时,阳极上氯离子失电子生成氯气,阴极上氢离子得电子生成氢气同时溶液中生成NaOH,其电解离子方程式为:2Cl﹣+2H2O {#mathmL#}{#/mathmL#} H2↑+Cl2↑+2OH﹣;在阴极上溶液中生成NaOH,所以A的溶质为NaOH;
故答案为:NaOH;2Cl﹣+2H2O {#mathmL#}{#/mathmL#} H2↑+Cl2↑+2OH﹣;(2)阳离子交换膜只允许阳离子钠离子通过,而阴离子氢氧根和氯离子均不能通过,
故答案为:Na+;Cl﹣、OH﹣;(3)粗盐提纯时加试剂的原则是:氢氧化钠除去镁离子和三价铁离子,碳酸钠一定加在氯化钡之后,这样碳酸钠既可以除去钙离子又可以除去多余的钡离子,盐酸加在最后来除去多余的碳酸根离子和氢氧根离子,
故答案为:③②①④;(4)氯气和热的氢氧化钠溶液反应生成氯化钠、氯酸钠和水,方程式为:3Cl2+6OH﹣ {#mathmL#}{#/mathmL#} 5Cl﹣+ClO3﹣+3H2O;
故答案为:3Cl2+6OH﹣ {#mathmL#}{#/mathmL#} 5Cl﹣+ClO3﹣+3H2O.
【分析】(1)电解饱和食盐水时,阳极上氯离子失电子生成氯气,阴极上氢离子得电子生成氢气同时溶液中生成NaOH;(2)阳离子交换膜只允许阳离子通过,而阴离子不能通过;(3)粗盐提纯时加试剂的原则是:碳酸钠一定加在氯化钡之后,盐酸加在最后;(4)氯气和热的氢氧化钠溶液反应生成氯化钠、氯酸钠和水.
20.【答案】(1)2H++2e﹣=H2↑;4OH﹣﹣4e﹣=2H2O+O2↑;2H2O {#mathmL#}{#/mathmL#} 2H2↑+O2↑;变大
(2)纯铜;Cu2++2e﹣=Cu;粗铜;Cu﹣2e﹣=Cu2+
【解析】【解答】解:(1)①和电源的负极相连的电极X极是阴极,该电极上氢离子发生得电子的还原反应,即2H++2e﹣=H2↑,故答案为:2H++2e﹣=H2↑;②和电源的正极相连的电极Y极是阳极,该电极上氢氧根离子发生失电子的氧化反应,即4OH﹣﹣4e﹣=2H2O+O2↑,故答案为:4OH﹣﹣4e﹣=2H2O+O2↑;③根据两极反应得到:电解的实质相当于电解水,总的电解化学方程式为2H2O {#mathmL#}{#/mathmL#} 2H2↑+O2↑,故答案为:2H2O {#mathmL#}{#/mathmL#} 2H2↑+O2↑;④相当于电解水,电解后溶液中溶剂减少,氢氧化钠的浓度增加,pH增大,即电解后溶液pH变大,故答案为:变大;(2)①电极反应为:Cu2++2e﹣=Cu,故答案为:精铜; Cu2++2e﹣=Cu;②电解方法精炼粗铜,电解池的阳极材料是粗铜,电极反应为:Cu﹣2e﹣=Cu2+,故答案为:粗铜;Cu﹣2e﹣=Cu2+.
【分析】(1)电解氢氧化钠时,阳极上是氢氧根离子失电子,阴极上是氢离子得电子,相当于电解水,所以电解后溶液中氢氧化钠的浓度增加;(2)根据电解精炼铜的工作原理知识:电解池的阴极材料是纯铜、阳极材料是粗铜来回答.
21.【答案】(1)铅;两个电极;除去
(2)Cd(OH)2 + 2Ni(OH)2=Cd + 2NiOOH + 2H2O
(3)放电时,铅蓄电池中硫酸溶液浓度减小,故内阻明显增大,而镍镉碱性电池的电解质溶液浓度几乎不变,故内阻几乎不变
(4)8.0CuO或12.4/CuCO3;2Al-6e-+3H2O=Al2O3 + 6H+
【解析】【解答】(1)反应中Pb失去电子,作负极,因此铅蓄电池负极板上覆盖的物质是铅,由于放电时两个电极上均生成硫酸铅,所以充电时,PbSO4在两个电极除去。
(2)镍镉碱性充电电池放电时,正极反应为: ,负极反应式: ,因此镍镉碱性充电电池放电时的总反应式为Cd + 2NiOOH + 2H2O=Cd(OH)2 + 2Ni(OH)2,则在充电时的总反应的化学方程式为Cd(OH)2 + 2Ni(OH)2=Cd + 2NiOOH + 2H2O。
(3)由于放电时,铅蓄电池中硫酸溶液浓度减小,故内阻明显增大,而镍镉碱性电池的电解质溶液浓度几乎不变,故内阻几乎不变。
(4)①惰性电极电解硫酸铜溶液,阴极铜离子放电析出铜,阳极氢氧根离子放电生成氧气,铜的物质的量是6.4g÷64g/mol=0.1mol,所以需要加入0.1mol氧化铜或0.1mol碳酸铜即可恢复电解质溶液的浓度,其质量分别是8.0g、12.4g。
②Y电极是阳极,铝失去电子转化为氧化铝可使铝制品表面形成较致密的氧化膜,从而更好地保护铝制品,Y电极上发生的电极反应式为2Al-6e-+3H2O=Al2O3 +6H+。
【分析】
(1)根据总的反应,Pb化合价升高,故做负极材料,充电时,阳极是硫酸铅失去电子变为二氧化铅,阴极是硫酸铅得到电子变为铅单质,故阴极和阳极均消耗硫酸铅
(2)根据放电的电极式即可写出充电的电极式,即可写出总的电池反应
(3)内阻变化主要是电解质溶液的浓度造成,浓度减小,内阻变大
(4)①根据阳极和阴极电解产物即可判断加入的物质②铝表面形成氧化铝薄膜,主要是铝失去电子,故在阳极反应,即铝在阳极失去电子结合水形成氧化铝和氢离子,即可写出电极式
