1.1.1 化学反应的焓变 课件 (共51张PPT)2023-2024学年高二化学苏教版选择性必修1
文档属性
| 名称 | 1.1.1 化学反应的焓变 课件 (共51张PPT)2023-2024学年高二化学苏教版选择性必修1 |

|
|
| 格式 | pptx | ||
| 文件大小 | 3.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-08 14:29:35 | ||
图片预览










文档简介
(共51张PPT)
专题1
第一单元 第1课时 化学反应的焓变
基础落实·必备知识全过关
重难探究·能力素养全提升
目录索引
素养 目标 1.能辨识化学反应中的能量转化形式,能解释化学反应中能量变化的本质,形成宏观辨识与微观探析的核心素养。
2.知道内能是体系内物质的各种能量的总和,受温度、压强、物质的聚集状态和组成的影响。能用热化学方程式表示反应中的能量变化,形成证据推理与模型认知的核心素养。
基础落实·必备知识全过关
一、焓变 反应热
1.焓和焓变
焓是 物理量。
单位: ;符号: 。
焓变是 。
单位: ;符号: 。
2.反应热
在化学反应过程中,当反应物和生成物具有相同温度时,吸收或释放的热称为化学反应的热效应,也称反应热。
与内能有关的
kJ·mol-1
H
在恒压条件下化学反应过程中吸收或释放的热
kJ·mol-1
ΔH
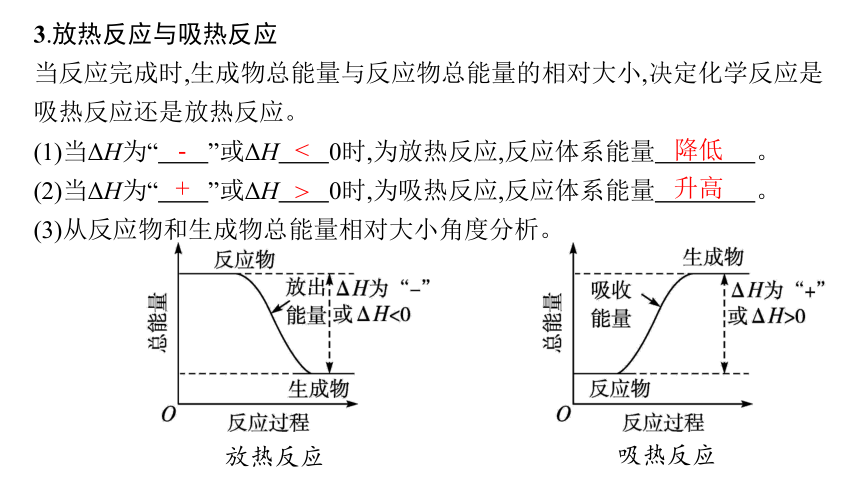
3.放热反应与吸热反应
当反应完成时,生成物总能量与反应物总能量的相对大小,决定化学反应是吸热反应还是放热反应。
(1)当ΔH为“ ”或ΔH 0时,为放热反应,反应体系能量 。
(2)当ΔH为“ ”或ΔH 0时,为吸热反应,反应体系能量 。
(3)从反应物和生成物总能量相对大小角度分析。
放热反应
吸热反应
-
<
降低
+
>
升高
教材阅读想一想阅读教材图1-2
思考:图中总能量高的物质与总能量低的物质相比,哪种物质稳定
提示 从能量的角度比较物质的稳定性:物质本身具有的能量越高,其稳定性越差;物质本身具有的能量越低,其稳定性越强。
易错辨析判一判
(1)反应热是化学反应在一定条件下所释放或吸收的能量。( )
(2)反应热常用符号ΔH来表示,它的单位是 kJ·mol-1。( )
(3)放热反应中,生成物总能量大于反应物总能量,反应体系的能量降低。
( )
(4)放热反应的ΔH>0,吸热反应的ΔH<0。( )
(5)焓变就是化学反应的热效应。( )
√
√
×
×
提示 放热反应的ΔH<0,吸热反应的ΔH>0。
×
提示 焓变是在恒压条件下反应的热效应。
二、热化学方程式
1.定义
能够表示 的化学方程式叫做热化学方程式。
2.表示意义
(1)热化学方程式不仅表明了化学反应中的 变化,也表明了化学反应中的 变化。
不能表示分子数
(2)热化学方程式中物质的化学计量数,表示实际参加反应的反应物的
和实际生成的生成物的 。
(3)热化学方程式中的反应热与反应物、生成物的 相对应。
反应热
物质
热量
物质的量
物质的量
物质的量
3.书写热化学方程式的注意事项
(1)注明物质的聚集状态,一般用“ ”表示气体,“ ”表示液体,“ ”表示固体,“ ”表示水溶液。
(2)标出对应的反应热:放热反应的ΔH<0,吸热反应的ΔH>0。
(3) (常温常压时可不注明)。
g
l
s
aq
标明反应所处的外界条件
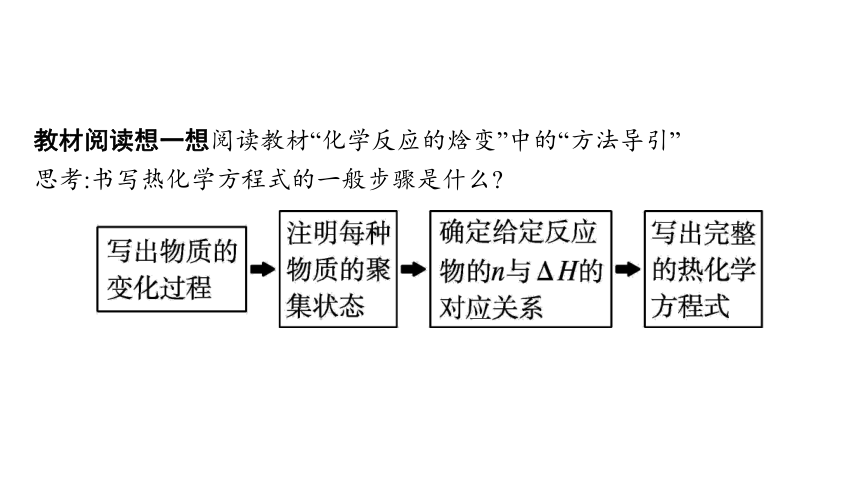
教材阅读想一想阅读教材“化学反应的焓变”中的“方法导引”
思考:书写热化学方程式的一般步骤是什么
易错辨析判一判
(1)热化学方程式中,化学计量数既可表示物质的量,也可表示分子个数。
( )
(2)2H2(g)+O2(g) ══ 2H2O(g) ΔH1,2H2(g)+O2(g) ══ 2H2O(l) ΔH2,则ΔH1=ΔH2。( )
(3)热化学方程式未注明温度和压强时,ΔH表示标准状况下的数据。( )
(4)C(石墨,s) ══ C(金刚石,s) ΔH>0,说明石墨比金刚石稳定。( )
×
提示 不能表示分子个数。
×
提示 ΔH1>ΔH2。
×
√
三、化学反应中能量变化的本质原因——从反应物断键和生成物成键角度分析
1.N2(g)+O2(g) ══ 2NO(g)反应的能量变化如图所示:
由图可知:
1 mol N2分子中的化学键断裂吸收的能量是 ,1 mol O2分子中的化学键断裂吸收的能量是 ,形成2 mol NO分子中的化学键释放的能量是 ,则反应N2(g)+O2(g) ══ 2NO(g)生成2 mol NO(g)时吸收的热量为 。
946 kJ
498 kJ
1 264 kJ
180 kJ
2.化学反应中能量变化的原因
化学反应的本质是______________________________________________
。
任何化学反应都有反应热,这是由于在化学反应过程中,旧化学键断裂时吸收的能量与新化学键形成时释放的能量不同。
ΔH= 物分子的总键能- 物分子的总键能。
反应物中旧化学键断裂和生成物中新化学键形成的
过程
反应
生成
教材阅读想一想阅读教材“化学反应的焓变”中的相关内容
思考:反应热与化学键能量变化的关系是什么
提示 反应热与化学键能量变化的关系可以表示为ΔH=反应物总键能-生成物总键能。
易错辨析判一判
(1)断开化学键吸收能量。( )
(2)反应物的总键能>生成物的总键能,该反应为吸热反应。( )
(3)如果用E表示破坏(或生成)1 mol化学键所消耗(或释放)的能量,则求2H2(g)+O2(g) ══ 2H2O(g)的反应热时,可用下式表示:
ΔH=2E(H—H键)+E(O=O键)-2E(H—O键)。( )
(4)某物质的键能越大,破坏其化学键所吸收的能量就越大,该物质就越稳定。( )
√
√
×
提示 该反应的ΔH=2E(H—H键)+E(O=O键)-4E(H—O键)。
√
重难探究·能力素养全提升
探究一 从宏观和微观的角度分析反应热
情境探究
“一拉热”一共有两层:上层是食品;底层上边是水,下边是石灰,只要一抽中间那根线,内袋就会破裂,水与石灰相遇,就产生了热量。
(1)“一拉热”食品的原理是什么
提示 原理是发生化学反应CaO+H2O ══ Ca(OH)2,该反应可以放出大量的热,放出的热量使食品的温度升高。
(2)化学反应有能量变化的本质原因是什么
(3)判断化学反应是吸热还是放热的方法有哪些
(4)化学反应的反应热如何计算
提示 化学反应中旧化学键断裂时吸收的能量与新化学键形成时释放的能量不同是化学反应有能量变化的本质原因。
提示 可从生成物与反应物的内能差异,反应物的旧键断裂吸收的能量与生成物的新键形成释放的能量差异等角度判断。
提示 ΔH=反应物总键能-生成物总键能。ΔH=生成物总能量-反应物总 能量。
方法突破
化学反应伴随能量变化的原因
(1)从反应物和生成物总能量相对大小角度分析。
同一反应中反应物的总能量与生成物的总能量不相等,反应过程存在焓变(ΔH),ΔH=E(生成物总能量)-E(反应物总能量)。
名师点拨 从能量的角度比较物质的稳定性:物质本身具有的能量越高,其稳定性越差,能量越低的物质越稳定。
(2)从反应物断键和生成物成键角度分析。
ΔH=E1-E2:当E1>E2时,反应吸收能量;当E1名师点拨 从键能的角度比较物质的稳定性:键能越大,物质越稳定。
应用体验
视角1放热反应与吸热反应
1.(2023河北唐山十县一中联盟高二期末)下列过程的能量变化与如图所示相符的是( )
A.NaOH溶液与稀硫酸反应
B.铝热反应
C.NH4Cl固体与Ba(OH)2·8H2O固体混合搅拌
D.生石灰与水的反应
C
解析 由图像可知,反应物总能量低于生成物总能量,对应的反应是吸热反应。酸碱中和反应是放热反应,A不符合题意;铝热反应是放热反应,B不符合题意;NH4Cl固体与Ba(OH)2·8H2O固体的反应是吸热反应,C符合题意;生石灰与水的反应是放热反应,D不符合题意。
2.下列图示或操作吸收热量的是( )
A
解析 生成物的总能量比反应物的总能量高,是吸热反应,A项符合题意;生成物的总能量比反应物的总能量低,是放热反应,B项不符合题意;浓硫酸稀释是放热过程,C项不符合题意;活泼金属和强酸反应是放热反应,D项不符合题意。
3.某反应由两步反应A B C构成,它的反应能量曲线如图,下列叙述正确的是( )
A.两步反应均为吸热反应
B.反应A B,反应条件一定要加热
C.A与C的能量差为E4
D.三种物质中C最稳定
D
解析 AB为吸热反应,BC为放热反应,A项错误;放热反应、吸热反应与是否需要加热无关,B项错误;A与C的能量差为ΔH,C项错误;三种物质中C的能量最低,最稳定,D项正确。
视角2焓变的理解与应用
4.分析图中的能量变化情况,下列选项正确的是( )
A.2A+B ══ 2C ΔH<0
B.2C ══ 2A+B ΔH<0
C.2A(g)+B(g) ══ 2C(g) ΔH>0
D.2A(g)+B(g) ══ 2C(g) ΔH<0
C
解析 若反应物的总能量高于生成物的总能量,则该化学反应为放热反应,若反应物的总能量低于生成物的总能量,则该化学反应为吸热反应,且热化学方程式要标明物质的聚集状态,故C项正确。
5.已知:断开或形成1 mol共价键吸收或放出的能量数据如下表。
共价键 H—H C—H C≡C
能量变化/(kJ·mol-1) a b c
则反应2CH4(g) ══ HC≡CH(g)+3H2(g)的ΔH(单位: kJ·mol-1)为( )
A.b-c-a B.c+3a-4b
C.c+3a-6b D.6b-c-3a
D
解析 由于化学反应的焓变=反应物的键能之和-生成物的键能之和,因此ΔH=(8b-c-2b-3a) kJ·mol-1=(6b-c-3a) kJ·mol-1,D项正确。
探究二 热化学方程式
情境探究
大家好,我是“胖五”,全名是“长征五号遥三”运载火箭。我起飞的时候质量大约为869吨,在这些质量里,绝大多数是我肚子里的“食物”——燃料。我的“饮食”非常健康,以液氧、液氢为主要“食物”,这种健康的饮食,喷出来的是无毒的水蒸气,十分环保,“消化过程”可用热化学方程式H2(l)+ O2(l) ══ H2O(g) ΔH=-234.04 kJ·mol-1表示。某同学在查阅25 ℃、101 kPa条件下氢气燃烧的热化学方程式时,找到如下几种表示形式:
①2H2(g)+O2(g) ══ 2H2O(l) ΔH=-571.6 kJ·mol-1;
②2H2(g)+O2(g) ══ 2H2O(g) ΔH=-483.6 kJ·mol-1;
③H2(g)+ O2(g) ══ H2O(l) ΔH=-285.8 kJ·mol-1;
④H2(g)+ O2(g) ══ H2O(g) ΔH=-241.8 kJ·mol-1。
分析上述热化学方程式,回答下列问题:
(1)根据热化学方程式①和②,能得出什么结论
提示 反应热数值与物质的聚集状态有关,书写热化学方程式时必须注明物质的聚集状态。
(2)根据热化学方程式①和③,能得出什么结论
(3)根据热化学方程式③和④,O2的化学计量数可出现分数,说明什么
(4)根据上述热化学方程式,求H2O(l) ══ H2(g)+ O2(g)的反应热ΔH。
提示 当化学计量数不同时,其ΔH也不同。ΔH的绝对值与化学计量数成
正比。
提示 热化学方程式中的化学计量数不表示分子个数,只表示物质的量,可以用整数表示,也可以用分数表示。
提示 ΔH=285.8 kJ·mol-1。
方法突破
1.普通化学方程式与热化学方程式的区别
类型 普通化学方程式 热化学方程式
化学计量数 是整数,既表示微粒个数又表示该物质的物质的量 可以是整数也可以是分数,只表示该物质的物质的量
状态 不要求注明 必须在化学式后注明
ΔH正、负号及单位 无 必须注明(正号常省略)
意义 表明了化学反应中的物质变化 不仅表明了化学反应中的物质变化,也表明了化学反应中的能量变化
遵循规律 原子守恒 原子守恒和能量守恒
2.正确书写热化学方程式的注意事项
(1)要注明反应时的温度、压强。如果没有标明温度和压强,则表示是在
25 ℃(298 K)、101 kPa条件下。
(2)物质的聚集状态涉及的焓不同,反应热ΔH也不同,所以热化学方程式中要标明物质的聚集状态。气体用“g”,液体用“l”,固体用“s”,溶液用“aq”。热化学方程式中不用“↑”和“↓”。
(3)注意热化学方程式中各物质化学式前面的化学计量数仅表示该物质的物质的量,并不表示物质的分子数或原子数。因此化学计量数可以是整数,也可以是分数。
(4)注意热化学方程式是表示反应已完成的数量。由于ΔH与反应完成物质的量有关,所以热化学方程式中化学式前面的化学计量数加倍时,ΔH的数值也要加倍。当反应物、生成物颠倒时,ΔH绝对值不变,但符号相反。
(5)注意热化学方程式一般不写反应条件(如点燃、加热、高温等)。
应用体验
视角1热化学方程式的书写
1.氢气是人类理想的能源。已知在25 ℃、101 kPa下,1 g氢气完全燃烧生成液态水时放出热量142.9 kJ,则下列热化学方程式书写正确的是( )
A.2H2+O2 ══ 2H2O ΔH=-142.9 kJ·mol-1
B.2H2(g)+O2(g) ══ 2H2O(l) ΔH=-142.9 kJ·mol-1
C.2H2(g)+O2(g) ══ 2H2O(l) ΔH=-571.6 kJ·mol-1
D.2H2(g)+O2(g) ══ 2H2O(l) ΔH=571.6 kJ·mol-1
C
解析 A项,各物质没有标明物质的聚集状态,错误;ΔH与化学方程式中的化学计量数成正比,燃烧反应为放热反应,所以2H2(g)+O2(g) ══ 2H2O(l) ΔH=-571.6 kJ·mol-1,C项正确。
归纳总结 书写热化学方程式的“五步”
2.(2023河北邢台南和区一中高二期中)下列热化学方程式书写正确的是
( )
A.2H2(g)+O2(g) ══ 2H2O(l) ΔH=571.6 kJ·mol-1
B.2NO2 ══ O2+2NO ΔH=116.2 kJ·mol-1
C.已知稀溶液中,H+(aq)+OH-(aq) ══ H2O(l) ΔH=-57.3 kJ·mol-1,则有Ba(OH)2(aq)+H2SO4(aq) ══ BaSO4(s)+2H2O(l) ΔH=-114.6 kJ·mol-1
D.已知1 mol H2(g)与1 mol Cl2(g)反应生成2 mol HCl(g)时放出184.6 kJ的热量,则有 H2(g)+ Cl2(g) ══ HCl(g) ΔH=-92.3 kJ·mol-1
D
解析 氢气燃烧时放热,ΔH<0,A错误;热化学方程式中要标注各物质的聚集状态,B错误;发生酸碱中和反应的同时还伴随沉淀反应,故C错误;根据
1 mol H2(g)与1 mol Cl2(g)反应生成2 mol HCl(g)时放出184.6 kJ的热量,则有 H2(g)+ Cl2(g) ══ HCl(g) ΔH=-92.3 kJ·mol-1,D正确。
3.标准状况下,气态分子断开1 mol化学键的焓变称为键焓。已知H—H键、H—O键和O=O键的键焓ΔH分别为436 kJ·mol-1、463 kJ·mol-1和495 kJ·mol-1。下列热化学方程式正确的是( )
A.H2O(g) ══ H2+ O2(g) ΔH=-485 kJ·mol-1
B.H2O(g) ══ H2(g)+ O2(g) ΔH=485 kJ·mol-1
C.2H2(g)+O2(g) ══ 2H2O(g) ΔH=485 kJ·mol-1
D.2H2(g)+O2(g) ══ 2H2O(g) ΔH=-485 kJ·mol-1
D
4.下列热化学方程式书写或叙述正确的是( )
A.1 mol 液态肼(N2H4)在足量氧气中完全燃烧生成水蒸气,放出642 kJ热量:N2H4(l)+O2(g) ══ N2(g)+2H2O(g) ΔH=642 kJ·mol-1
B.12 g石墨转化为CO(g)时,放出110.5 kJ热量:2C(石墨,s)+O2(g) ══ 2CO(g) ΔH=-110.5 kJ·mol-1
C.已知:H2(g)+ O2(g) ══ H2O(l) ΔH=-286 kJ·mol-1,则2H2O(l) ══ 2H2(g)+O2(g) ΔH=572 kJ·mol-1
D.已知:N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1。在一定条件下向密闭容器中充入0.5 mol N2(g)和1.5 mol H2(g)充分反应放出46.2 kJ的热量
C
解析 A项,放出热量,ΔH<0,正确的热化学方程式为N2H4(l)+O2(g) ══ N2(g)+2H2O(g) ΔH=-642 kJ·mol-1。B项,2C(石墨,s)+O2(g) ══ 2CO(g)的ΔH应是2 mol即24 g石墨转化为CO时的反应热,即ΔH=-221 kJ·mol-1。C项,根据热化学方程式的含义知,若热化学方程式中各物质的化学计量数加倍,则ΔH数值也加倍;若反应的方向发生改变,则ΔH改变符号,但绝对值不变,据此可判断该项正确。D项,N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1表示1 mol N2(g)与3 mol H2(g)完全反应生成2 mol NH3(g)时放出92.4 kJ的热量,但合成氨反应是可逆反应,0.5 mol N2(g)与1.5 mol H2(g)充分反应后生成的NH3(g)的物质的量小于1 mol,故放出的热量小于46.2 kJ。
视角2热化学方程式的意义及理解
5.热化学方程式C(s)+H2O(g) ══ CO(g)+H2(g) ΔH=131.3 kJ·mol-1表示
( )
A.碳和水反应吸收131.3 kJ的热量
B.1 mol碳和1 mol水反应生成1 mol一氧化碳和1 mol氢气时吸收131.3 kJ
热量
C.1 mol固态碳和1 mol水蒸气反应生成1 mol一氧化碳气体和1 mol氢气时吸收热量131.3 kJ
D.1个固态碳原子和1分子水蒸气反应吸收热量131.3 kJ
C
解析 依据反应热的定义,反应热表示按照热化学方程式中化学计量数的物质的量反应时,吸收或放出的热量,单位是kJ·mol-1,该热化学方程式表示1 mol固态碳和1 mol水蒸气反应生成1 mol一氧化碳气体和1 mol氢气时吸收131.3 kJ的热量,特别要指明水的聚集状态。
6.(2023河北张家口高二期末)25 ℃、101 kPa下,关于反应2H2(g)+O2(g) ══ 2H2O(g) ΔH=-483.6 kJ·mol-1的相关叙述正确的是( )
A.1 mol H2(g)燃烧生成H2O(l)放出的热量为241.8 kJ
B.2 mol H2(g)和1 mol O2(g)的总键能之和大于2 mol H2O(g)的键能之和
C.2H2O(g) ══ 2H2(g)+O2(g) ΔH=483.6 kJ·mol-1
D.2H2(g)+O2(g) ══ 2H2O(l) ΔH>-483.6 kJ·mol-1
C
解析 题中给出的是生成气态水时的焓变,无法计算生成液态水时的焓变,A项错误;H2和O2的反应为放热反应,所以2 mol H2(g)和1 mol O2(g)的总键能之和小于2 mol H2O(g)的键能之和,B项错误;根据信息可知2H2O(g) ══ 2H2(g)+O2(g) ΔH=483.6 kJ·mol-1,C项正确;生成液态水比生成气态水放热更多,所以存在2H2(g)+O2(g) ══ 2H2O(l) ΔH<-483.6 kJ·mol-1,D项错误。
7.(2023河北邯郸魏县五中期中)CO(g)与H2O(g)反应过程的能量变化如图所示,有关两者反应的说法正确的是( )
A.该反应为吸热反应
B.1 mol CO(g)和1 mol H2O(g)所具有的总能量大于1 mol CO2(g)和1 mol H2(g)具有的总能量
C.反应的热化学方程式为CO(g)+H2O(g) ══ CO2(g)+H2(g)
ΔH=41 kJ·mol-1
D.1 mol CO2(g)和1 mol H2(g)反应生成1 mol CO(g)和1 mol H2O(g)要放出41 kJ的热量
B
解析 根据图示可知,反应物的总能量大于生成物的总能量,该反应为放热反应,A错误;1 mol CO(g)和1 mol H2O(g)反应生成1 mol CO2(g)和1 mol H2(g)放出热量,则1 mol CO(g)和1 mol H2O(g)的总能量大于1 mol CO2(g)和1 mol H2(g)的总能量,B正确;1 mol CO(g)和1 mol H2O(g)反应生成1 mol CO2(g)和1 mol H2(g)放出41 kJ热量,该反应的热化学方程式为CO(g)+H2O(g) ══ CO2(g)+H2(g) ΔH=-41 kJ·mol-1,C错误;1 mol CO2(g)和1 mol H2(g)反应生成1 mol CO(g)和1 mol H2O(g)要吸收41 kJ的热量,D错误。
8.(1)已知2.0 g燃料肼(N2H4)气体完全燃烧生成N2(g)和水蒸气时,放出33.4 kJ的热量,则表示肼燃烧的热化学方程式为 。
(2)2.3 g某液态有机化合物和一定量的氧气混合点燃,恰好完全燃烧,生成2.7 g液态水和2.24 L CO2(标准状况)并放出68.35 kJ的热量。写出此反应的热化学方程式: 。
答案 (1)N2H4(g)+O2(g) ══ N2(g)+2H2O(g)
ΔH=-534.4 kJ·mol-1
(2)C2H6O(l)+3O2(g) ══ 2CO2(g)+3H2O(l)
ΔH=-1 367 kJ·mol-1
解析 (2)通过燃烧的产物可知该有机化合物中肯定含有碳元素和氢元素,可能含有氧元素。n(H2O)= =0.15 mol,n(H)=0.3 mol,m(H)=0.3 g, n(CO2)= =0.1 mol,n(C)=0.1 mol,m(C)=1.2 g,则碳元素和氢元素的质量之和是0.3 g+1.2 g=1.5 g<2.3 g,故该有机化合物中还含有氧元素,氧元素的质量是2.3 g-1.5 g=0.8 g,n(O)=0.05 mol,从而可确定该有机化合物的分子式为C2H6O,该液态有机化合物燃烧的热化学方程式为C2H6O(l)+3O2(g) ══ 2CO2(g)+3H2O(l) ΔH=-1 367 kJ·mol-1。
本 课 结 束
专题1
第一单元 第1课时 化学反应的焓变
基础落实·必备知识全过关
重难探究·能力素养全提升
目录索引
素养 目标 1.能辨识化学反应中的能量转化形式,能解释化学反应中能量变化的本质,形成宏观辨识与微观探析的核心素养。
2.知道内能是体系内物质的各种能量的总和,受温度、压强、物质的聚集状态和组成的影响。能用热化学方程式表示反应中的能量变化,形成证据推理与模型认知的核心素养。
基础落实·必备知识全过关
一、焓变 反应热
1.焓和焓变
焓是 物理量。
单位: ;符号: 。
焓变是 。
单位: ;符号: 。
2.反应热
在化学反应过程中,当反应物和生成物具有相同温度时,吸收或释放的热称为化学反应的热效应,也称反应热。
与内能有关的
kJ·mol-1
H
在恒压条件下化学反应过程中吸收或释放的热
kJ·mol-1
ΔH
3.放热反应与吸热反应
当反应完成时,生成物总能量与反应物总能量的相对大小,决定化学反应是吸热反应还是放热反应。
(1)当ΔH为“ ”或ΔH 0时,为放热反应,反应体系能量 。
(2)当ΔH为“ ”或ΔH 0时,为吸热反应,反应体系能量 。
(3)从反应物和生成物总能量相对大小角度分析。
放热反应
吸热反应
-
<
降低
+
>
升高
教材阅读想一想阅读教材图1-2
思考:图中总能量高的物质与总能量低的物质相比,哪种物质稳定
提示 从能量的角度比较物质的稳定性:物质本身具有的能量越高,其稳定性越差;物质本身具有的能量越低,其稳定性越强。
易错辨析判一判
(1)反应热是化学反应在一定条件下所释放或吸收的能量。( )
(2)反应热常用符号ΔH来表示,它的单位是 kJ·mol-1。( )
(3)放热反应中,生成物总能量大于反应物总能量,反应体系的能量降低。
( )
(4)放热反应的ΔH>0,吸热反应的ΔH<0。( )
(5)焓变就是化学反应的热效应。( )
√
√
×
×
提示 放热反应的ΔH<0,吸热反应的ΔH>0。
×
提示 焓变是在恒压条件下反应的热效应。
二、热化学方程式
1.定义
能够表示 的化学方程式叫做热化学方程式。
2.表示意义
(1)热化学方程式不仅表明了化学反应中的 变化,也表明了化学反应中的 变化。
不能表示分子数
(2)热化学方程式中物质的化学计量数,表示实际参加反应的反应物的
和实际生成的生成物的 。
(3)热化学方程式中的反应热与反应物、生成物的 相对应。
反应热
物质
热量
物质的量
物质的量
物质的量
3.书写热化学方程式的注意事项
(1)注明物质的聚集状态,一般用“ ”表示气体,“ ”表示液体,“ ”表示固体,“ ”表示水溶液。
(2)标出对应的反应热:放热反应的ΔH<0,吸热反应的ΔH>0。
(3) (常温常压时可不注明)。
g
l
s
aq
标明反应所处的外界条件
教材阅读想一想阅读教材“化学反应的焓变”中的“方法导引”
思考:书写热化学方程式的一般步骤是什么
易错辨析判一判
(1)热化学方程式中,化学计量数既可表示物质的量,也可表示分子个数。
( )
(2)2H2(g)+O2(g) ══ 2H2O(g) ΔH1,2H2(g)+O2(g) ══ 2H2O(l) ΔH2,则ΔH1=ΔH2。( )
(3)热化学方程式未注明温度和压强时,ΔH表示标准状况下的数据。( )
(4)C(石墨,s) ══ C(金刚石,s) ΔH>0,说明石墨比金刚石稳定。( )
×
提示 不能表示分子个数。
×
提示 ΔH1>ΔH2。
×
√
三、化学反应中能量变化的本质原因——从反应物断键和生成物成键角度分析
1.N2(g)+O2(g) ══ 2NO(g)反应的能量变化如图所示:
由图可知:
1 mol N2分子中的化学键断裂吸收的能量是 ,1 mol O2分子中的化学键断裂吸收的能量是 ,形成2 mol NO分子中的化学键释放的能量是 ,则反应N2(g)+O2(g) ══ 2NO(g)生成2 mol NO(g)时吸收的热量为 。
946 kJ
498 kJ
1 264 kJ
180 kJ
2.化学反应中能量变化的原因
化学反应的本质是______________________________________________
。
任何化学反应都有反应热,这是由于在化学反应过程中,旧化学键断裂时吸收的能量与新化学键形成时释放的能量不同。
ΔH= 物分子的总键能- 物分子的总键能。
反应物中旧化学键断裂和生成物中新化学键形成的
过程
反应
生成
教材阅读想一想阅读教材“化学反应的焓变”中的相关内容
思考:反应热与化学键能量变化的关系是什么
提示 反应热与化学键能量变化的关系可以表示为ΔH=反应物总键能-生成物总键能。
易错辨析判一判
(1)断开化学键吸收能量。( )
(2)反应物的总键能>生成物的总键能,该反应为吸热反应。( )
(3)如果用E表示破坏(或生成)1 mol化学键所消耗(或释放)的能量,则求2H2(g)+O2(g) ══ 2H2O(g)的反应热时,可用下式表示:
ΔH=2E(H—H键)+E(O=O键)-2E(H—O键)。( )
(4)某物质的键能越大,破坏其化学键所吸收的能量就越大,该物质就越稳定。( )
√
√
×
提示 该反应的ΔH=2E(H—H键)+E(O=O键)-4E(H—O键)。
√
重难探究·能力素养全提升
探究一 从宏观和微观的角度分析反应热
情境探究
“一拉热”一共有两层:上层是食品;底层上边是水,下边是石灰,只要一抽中间那根线,内袋就会破裂,水与石灰相遇,就产生了热量。
(1)“一拉热”食品的原理是什么
提示 原理是发生化学反应CaO+H2O ══ Ca(OH)2,该反应可以放出大量的热,放出的热量使食品的温度升高。
(2)化学反应有能量变化的本质原因是什么
(3)判断化学反应是吸热还是放热的方法有哪些
(4)化学反应的反应热如何计算
提示 化学反应中旧化学键断裂时吸收的能量与新化学键形成时释放的能量不同是化学反应有能量变化的本质原因。
提示 可从生成物与反应物的内能差异,反应物的旧键断裂吸收的能量与生成物的新键形成释放的能量差异等角度判断。
提示 ΔH=反应物总键能-生成物总键能。ΔH=生成物总能量-反应物总 能量。
方法突破
化学反应伴随能量变化的原因
(1)从反应物和生成物总能量相对大小角度分析。
同一反应中反应物的总能量与生成物的总能量不相等,反应过程存在焓变(ΔH),ΔH=E(生成物总能量)-E(反应物总能量)。
名师点拨 从能量的角度比较物质的稳定性:物质本身具有的能量越高,其稳定性越差,能量越低的物质越稳定。
(2)从反应物断键和生成物成键角度分析。
ΔH=E1-E2:当E1>E2时,反应吸收能量;当E1
应用体验
视角1放热反应与吸热反应
1.(2023河北唐山十县一中联盟高二期末)下列过程的能量变化与如图所示相符的是( )
A.NaOH溶液与稀硫酸反应
B.铝热反应
C.NH4Cl固体与Ba(OH)2·8H2O固体混合搅拌
D.生石灰与水的反应
C
解析 由图像可知,反应物总能量低于生成物总能量,对应的反应是吸热反应。酸碱中和反应是放热反应,A不符合题意;铝热反应是放热反应,B不符合题意;NH4Cl固体与Ba(OH)2·8H2O固体的反应是吸热反应,C符合题意;生石灰与水的反应是放热反应,D不符合题意。
2.下列图示或操作吸收热量的是( )
A
解析 生成物的总能量比反应物的总能量高,是吸热反应,A项符合题意;生成物的总能量比反应物的总能量低,是放热反应,B项不符合题意;浓硫酸稀释是放热过程,C项不符合题意;活泼金属和强酸反应是放热反应,D项不符合题意。
3.某反应由两步反应A B C构成,它的反应能量曲线如图,下列叙述正确的是( )
A.两步反应均为吸热反应
B.反应A B,反应条件一定要加热
C.A与C的能量差为E4
D.三种物质中C最稳定
D
解析 AB为吸热反应,BC为放热反应,A项错误;放热反应、吸热反应与是否需要加热无关,B项错误;A与C的能量差为ΔH,C项错误;三种物质中C的能量最低,最稳定,D项正确。
视角2焓变的理解与应用
4.分析图中的能量变化情况,下列选项正确的是( )
A.2A+B ══ 2C ΔH<0
B.2C ══ 2A+B ΔH<0
C.2A(g)+B(g) ══ 2C(g) ΔH>0
D.2A(g)+B(g) ══ 2C(g) ΔH<0
C
解析 若反应物的总能量高于生成物的总能量,则该化学反应为放热反应,若反应物的总能量低于生成物的总能量,则该化学反应为吸热反应,且热化学方程式要标明物质的聚集状态,故C项正确。
5.已知:断开或形成1 mol共价键吸收或放出的能量数据如下表。
共价键 H—H C—H C≡C
能量变化/(kJ·mol-1) a b c
则反应2CH4(g) ══ HC≡CH(g)+3H2(g)的ΔH(单位: kJ·mol-1)为( )
A.b-c-a B.c+3a-4b
C.c+3a-6b D.6b-c-3a
D
解析 由于化学反应的焓变=反应物的键能之和-生成物的键能之和,因此ΔH=(8b-c-2b-3a) kJ·mol-1=(6b-c-3a) kJ·mol-1,D项正确。
探究二 热化学方程式
情境探究
大家好,我是“胖五”,全名是“长征五号遥三”运载火箭。我起飞的时候质量大约为869吨,在这些质量里,绝大多数是我肚子里的“食物”——燃料。我的“饮食”非常健康,以液氧、液氢为主要“食物”,这种健康的饮食,喷出来的是无毒的水蒸气,十分环保,“消化过程”可用热化学方程式H2(l)+ O2(l) ══ H2O(g) ΔH=-234.04 kJ·mol-1表示。某同学在查阅25 ℃、101 kPa条件下氢气燃烧的热化学方程式时,找到如下几种表示形式:
①2H2(g)+O2(g) ══ 2H2O(l) ΔH=-571.6 kJ·mol-1;
②2H2(g)+O2(g) ══ 2H2O(g) ΔH=-483.6 kJ·mol-1;
③H2(g)+ O2(g) ══ H2O(l) ΔH=-285.8 kJ·mol-1;
④H2(g)+ O2(g) ══ H2O(g) ΔH=-241.8 kJ·mol-1。
分析上述热化学方程式,回答下列问题:
(1)根据热化学方程式①和②,能得出什么结论
提示 反应热数值与物质的聚集状态有关,书写热化学方程式时必须注明物质的聚集状态。
(2)根据热化学方程式①和③,能得出什么结论
(3)根据热化学方程式③和④,O2的化学计量数可出现分数,说明什么
(4)根据上述热化学方程式,求H2O(l) ══ H2(g)+ O2(g)的反应热ΔH。
提示 当化学计量数不同时,其ΔH也不同。ΔH的绝对值与化学计量数成
正比。
提示 热化学方程式中的化学计量数不表示分子个数,只表示物质的量,可以用整数表示,也可以用分数表示。
提示 ΔH=285.8 kJ·mol-1。
方法突破
1.普通化学方程式与热化学方程式的区别
类型 普通化学方程式 热化学方程式
化学计量数 是整数,既表示微粒个数又表示该物质的物质的量 可以是整数也可以是分数,只表示该物质的物质的量
状态 不要求注明 必须在化学式后注明
ΔH正、负号及单位 无 必须注明(正号常省略)
意义 表明了化学反应中的物质变化 不仅表明了化学反应中的物质变化,也表明了化学反应中的能量变化
遵循规律 原子守恒 原子守恒和能量守恒
2.正确书写热化学方程式的注意事项
(1)要注明反应时的温度、压强。如果没有标明温度和压强,则表示是在
25 ℃(298 K)、101 kPa条件下。
(2)物质的聚集状态涉及的焓不同,反应热ΔH也不同,所以热化学方程式中要标明物质的聚集状态。气体用“g”,液体用“l”,固体用“s”,溶液用“aq”。热化学方程式中不用“↑”和“↓”。
(3)注意热化学方程式中各物质化学式前面的化学计量数仅表示该物质的物质的量,并不表示物质的分子数或原子数。因此化学计量数可以是整数,也可以是分数。
(4)注意热化学方程式是表示反应已完成的数量。由于ΔH与反应完成物质的量有关,所以热化学方程式中化学式前面的化学计量数加倍时,ΔH的数值也要加倍。当反应物、生成物颠倒时,ΔH绝对值不变,但符号相反。
(5)注意热化学方程式一般不写反应条件(如点燃、加热、高温等)。
应用体验
视角1热化学方程式的书写
1.氢气是人类理想的能源。已知在25 ℃、101 kPa下,1 g氢气完全燃烧生成液态水时放出热量142.9 kJ,则下列热化学方程式书写正确的是( )
A.2H2+O2 ══ 2H2O ΔH=-142.9 kJ·mol-1
B.2H2(g)+O2(g) ══ 2H2O(l) ΔH=-142.9 kJ·mol-1
C.2H2(g)+O2(g) ══ 2H2O(l) ΔH=-571.6 kJ·mol-1
D.2H2(g)+O2(g) ══ 2H2O(l) ΔH=571.6 kJ·mol-1
C
解析 A项,各物质没有标明物质的聚集状态,错误;ΔH与化学方程式中的化学计量数成正比,燃烧反应为放热反应,所以2H2(g)+O2(g) ══ 2H2O(l) ΔH=-571.6 kJ·mol-1,C项正确。
归纳总结 书写热化学方程式的“五步”
2.(2023河北邢台南和区一中高二期中)下列热化学方程式书写正确的是
( )
A.2H2(g)+O2(g) ══ 2H2O(l) ΔH=571.6 kJ·mol-1
B.2NO2 ══ O2+2NO ΔH=116.2 kJ·mol-1
C.已知稀溶液中,H+(aq)+OH-(aq) ══ H2O(l) ΔH=-57.3 kJ·mol-1,则有Ba(OH)2(aq)+H2SO4(aq) ══ BaSO4(s)+2H2O(l) ΔH=-114.6 kJ·mol-1
D.已知1 mol H2(g)与1 mol Cl2(g)反应生成2 mol HCl(g)时放出184.6 kJ的热量,则有 H2(g)+ Cl2(g) ══ HCl(g) ΔH=-92.3 kJ·mol-1
D
解析 氢气燃烧时放热,ΔH<0,A错误;热化学方程式中要标注各物质的聚集状态,B错误;发生酸碱中和反应的同时还伴随沉淀反应,故C错误;根据
1 mol H2(g)与1 mol Cl2(g)反应生成2 mol HCl(g)时放出184.6 kJ的热量,则有 H2(g)+ Cl2(g) ══ HCl(g) ΔH=-92.3 kJ·mol-1,D正确。
3.标准状况下,气态分子断开1 mol化学键的焓变称为键焓。已知H—H键、H—O键和O=O键的键焓ΔH分别为436 kJ·mol-1、463 kJ·mol-1和495 kJ·mol-1。下列热化学方程式正确的是( )
A.H2O(g) ══ H2+ O2(g) ΔH=-485 kJ·mol-1
B.H2O(g) ══ H2(g)+ O2(g) ΔH=485 kJ·mol-1
C.2H2(g)+O2(g) ══ 2H2O(g) ΔH=485 kJ·mol-1
D.2H2(g)+O2(g) ══ 2H2O(g) ΔH=-485 kJ·mol-1
D
4.下列热化学方程式书写或叙述正确的是( )
A.1 mol 液态肼(N2H4)在足量氧气中完全燃烧生成水蒸气,放出642 kJ热量:N2H4(l)+O2(g) ══ N2(g)+2H2O(g) ΔH=642 kJ·mol-1
B.12 g石墨转化为CO(g)时,放出110.5 kJ热量:2C(石墨,s)+O2(g) ══ 2CO(g) ΔH=-110.5 kJ·mol-1
C.已知:H2(g)+ O2(g) ══ H2O(l) ΔH=-286 kJ·mol-1,则2H2O(l) ══ 2H2(g)+O2(g) ΔH=572 kJ·mol-1
D.已知:N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1。在一定条件下向密闭容器中充入0.5 mol N2(g)和1.5 mol H2(g)充分反应放出46.2 kJ的热量
C
解析 A项,放出热量,ΔH<0,正确的热化学方程式为N2H4(l)+O2(g) ══ N2(g)+2H2O(g) ΔH=-642 kJ·mol-1。B项,2C(石墨,s)+O2(g) ══ 2CO(g)的ΔH应是2 mol即24 g石墨转化为CO时的反应热,即ΔH=-221 kJ·mol-1。C项,根据热化学方程式的含义知,若热化学方程式中各物质的化学计量数加倍,则ΔH数值也加倍;若反应的方向发生改变,则ΔH改变符号,但绝对值不变,据此可判断该项正确。D项,N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1表示1 mol N2(g)与3 mol H2(g)完全反应生成2 mol NH3(g)时放出92.4 kJ的热量,但合成氨反应是可逆反应,0.5 mol N2(g)与1.5 mol H2(g)充分反应后生成的NH3(g)的物质的量小于1 mol,故放出的热量小于46.2 kJ。
视角2热化学方程式的意义及理解
5.热化学方程式C(s)+H2O(g) ══ CO(g)+H2(g) ΔH=131.3 kJ·mol-1表示
( )
A.碳和水反应吸收131.3 kJ的热量
B.1 mol碳和1 mol水反应生成1 mol一氧化碳和1 mol氢气时吸收131.3 kJ
热量
C.1 mol固态碳和1 mol水蒸气反应生成1 mol一氧化碳气体和1 mol氢气时吸收热量131.3 kJ
D.1个固态碳原子和1分子水蒸气反应吸收热量131.3 kJ
C
解析 依据反应热的定义,反应热表示按照热化学方程式中化学计量数的物质的量反应时,吸收或放出的热量,单位是kJ·mol-1,该热化学方程式表示1 mol固态碳和1 mol水蒸气反应生成1 mol一氧化碳气体和1 mol氢气时吸收131.3 kJ的热量,特别要指明水的聚集状态。
6.(2023河北张家口高二期末)25 ℃、101 kPa下,关于反应2H2(g)+O2(g) ══ 2H2O(g) ΔH=-483.6 kJ·mol-1的相关叙述正确的是( )
A.1 mol H2(g)燃烧生成H2O(l)放出的热量为241.8 kJ
B.2 mol H2(g)和1 mol O2(g)的总键能之和大于2 mol H2O(g)的键能之和
C.2H2O(g) ══ 2H2(g)+O2(g) ΔH=483.6 kJ·mol-1
D.2H2(g)+O2(g) ══ 2H2O(l) ΔH>-483.6 kJ·mol-1
C
解析 题中给出的是生成气态水时的焓变,无法计算生成液态水时的焓变,A项错误;H2和O2的反应为放热反应,所以2 mol H2(g)和1 mol O2(g)的总键能之和小于2 mol H2O(g)的键能之和,B项错误;根据信息可知2H2O(g) ══ 2H2(g)+O2(g) ΔH=483.6 kJ·mol-1,C项正确;生成液态水比生成气态水放热更多,所以存在2H2(g)+O2(g) ══ 2H2O(l) ΔH<-483.6 kJ·mol-1,D项错误。
7.(2023河北邯郸魏县五中期中)CO(g)与H2O(g)反应过程的能量变化如图所示,有关两者反应的说法正确的是( )
A.该反应为吸热反应
B.1 mol CO(g)和1 mol H2O(g)所具有的总能量大于1 mol CO2(g)和1 mol H2(g)具有的总能量
C.反应的热化学方程式为CO(g)+H2O(g) ══ CO2(g)+H2(g)
ΔH=41 kJ·mol-1
D.1 mol CO2(g)和1 mol H2(g)反应生成1 mol CO(g)和1 mol H2O(g)要放出41 kJ的热量
B
解析 根据图示可知,反应物的总能量大于生成物的总能量,该反应为放热反应,A错误;1 mol CO(g)和1 mol H2O(g)反应生成1 mol CO2(g)和1 mol H2(g)放出热量,则1 mol CO(g)和1 mol H2O(g)的总能量大于1 mol CO2(g)和1 mol H2(g)的总能量,B正确;1 mol CO(g)和1 mol H2O(g)反应生成1 mol CO2(g)和1 mol H2(g)放出41 kJ热量,该反应的热化学方程式为CO(g)+H2O(g) ══ CO2(g)+H2(g) ΔH=-41 kJ·mol-1,C错误;1 mol CO2(g)和1 mol H2(g)反应生成1 mol CO(g)和1 mol H2O(g)要吸收41 kJ的热量,D错误。
8.(1)已知2.0 g燃料肼(N2H4)气体完全燃烧生成N2(g)和水蒸气时,放出33.4 kJ的热量,则表示肼燃烧的热化学方程式为 。
(2)2.3 g某液态有机化合物和一定量的氧气混合点燃,恰好完全燃烧,生成2.7 g液态水和2.24 L CO2(标准状况)并放出68.35 kJ的热量。写出此反应的热化学方程式: 。
答案 (1)N2H4(g)+O2(g) ══ N2(g)+2H2O(g)
ΔH=-534.4 kJ·mol-1
(2)C2H6O(l)+3O2(g) ══ 2CO2(g)+3H2O(l)
ΔH=-1 367 kJ·mol-1
解析 (2)通过燃烧的产物可知该有机化合物中肯定含有碳元素和氢元素,可能含有氧元素。n(H2O)= =0.15 mol,n(H)=0.3 mol,m(H)=0.3 g, n(CO2)= =0.1 mol,n(C)=0.1 mol,m(C)=1.2 g,则碳元素和氢元素的质量之和是0.3 g+1.2 g=1.5 g<2.3 g,故该有机化合物中还含有氧元素,氧元素的质量是2.3 g-1.5 g=0.8 g,n(O)=0.05 mol,从而可确定该有机化合物的分子式为C2H6O,该液态有机化合物燃烧的热化学方程式为C2H6O(l)+3O2(g) ══ 2CO2(g)+3H2O(l) ΔH=-1 367 kJ·mol-1。
本 课 结 束
