1.1.2 反应热的测量与计算 课件(共51张PPT) 2023-2024学年高二化学苏教版选择性必修1
文档属性
| 名称 | 1.1.2 反应热的测量与计算 课件(共51张PPT) 2023-2024学年高二化学苏教版选择性必修1 |

|
|
| 格式 | pptx | ||
| 文件大小 | 3.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-08 00:00:00 | ||
图片预览











文档简介
(共51张PPT)
专题1
第一单元 第2课时 反应热的测量与计算
基础落实·必备知识全过关
重难探究·能力素养全提升
目录索引
素养 目标 1.通过交流讨论理解盖斯定律的本质,能用盖斯定律进行有关反应热的简单计算,形成运用盖斯定律进行相关判断或计算的思维模型,培养宏观辨识与微观探析的化学核心素养。
2.通过实验了解定量测定中和反应反应热的基本原理和实验方法,能正确分析误差产生的原因并能采取适当措施减小误差,培养科学探究与创新意识的化学核心素养。
基础落实·必备知识全过关
一、中和反应反应热的测定
强酸和强碱反应生成可溶性盐和水的离子方程式为H++OH- ══ H2O。中和反应反应热可以用实验的方法测得:先将反应器置于绝热容器中,然后在反应器内将酸、碱稀溶液混合,发生中和反应,
,测量出 ,根据水的质量、比热等即可求出反应放出的热量。
放出的热传入水(稀溶液)中
水(稀溶液)的温度变化
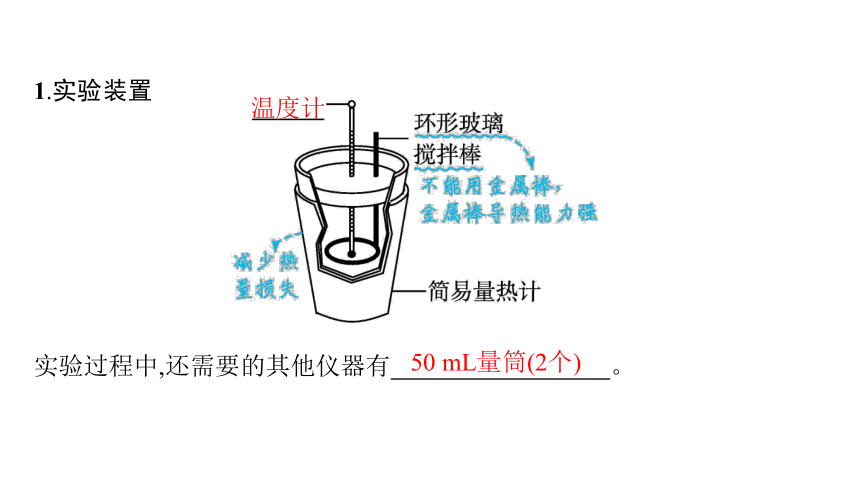
1.实验装置
实验过程中,还需要的其他仪器有 。
温度计
50 mL量筒(2个)
2.实验步骤
(1)用量筒量取50 mL 0.50 mol· L-1盐酸,倒入简易量热计中,测量并记录盐酸的温度(T1)。
(2)用另一量筒量取50 mL 0.50 mol· L-1 NaOH溶液,测量并记录NaOH溶液的温度(T2)。
(3)将量筒中的NaOH溶液迅速倒入盛有盐酸的简易量热计中,立即盖上盖板,用 轻轻搅拌,观察温度计的温度变化,准确读出反应体系的 温度(T3)并记录。
(4)假设溶液的比热与水的比热(c=4.18 J· g-1· ℃-1)相等,溶液的密度与水的密度相等,忽略量热计的比热,根据溶液温度升高的数值,计算该反应的反应热并写出热化学方程式。
环形玻璃搅拌棒
最高
3.实验记录表
盐酸的温度(T1)/℃
氢氧化钠溶液的温度(T2)/℃
反应体系的最高温度(T3)/℃
反应体系的温度变化(ΔT=T3- )/℃
反应体系的热容[C=(ρHCl·VHCl+ρNaOH·VNaOH)×4.18]/(J· ℃-1)
生成1 mol H2O时的反应热
教材阅读想一想阅读教材“反应热的测量与计算”中的“实验探究”
思考:以稀盐酸与稀NaOH溶液反应为例,测定H+(aq)+OH-(aq) ══ H2O(l)的反应热,实验过程中,应该测量哪些数据
提示 测量反应前稀盐酸的温度(T1 ℃)、稀NaOH溶液的温度(T2 ℃);测量反应体系的最高温度(T3 ℃);重复实验两次,记录测量数据。
易错辨析判一判
(1)稀NaOH溶液与浓硫酸反应生成1 mol水时释放的能量就是中和热。
( )
(2)1 mol强酸跟强碱反应放出的热量一定是57.3 kJ。( )
(3)中和反应反应热与强酸、强碱的用量没有关系。( )
×
提示 浓硫酸溶于水放热。
×
提示 还要求生成1 mol水。
√
二、盖斯定律
1.盖斯定律
一个化学反应,不论是 完成,还是 完成,其总的热效应是完全相等的。盖斯定律表明,一个化学反应的焓变(ΔH)仅与反应的
和反应的 有关,而与反应的 无关。
一步
分几步
起始状态
最终状态
途径
2.盖斯定律的应用
因为有些反应的反应速率 ,有些反应伴有 发生,还有些反应在通常条件下 ,这给测定反应热造成了困难。应用盖斯定律可以间接地把它们的反应热计算出来。已知:
C(s)+O2(g) ══ CO2(g)
ΔH1=-393.5 kJ·mol-1 ①
CO(g)+ O2(g) ══ CO2(g)
ΔH2=-283.0 kJ·mol-1 ②
反应C(s)+ O2(g) ══ CO(g)的焓变为ΔH3。
很小
副反应
不易直接进行
(1)根据盖斯定律可以得到 ,则
ΔH3= = 。
(2)根据盖斯定律,直接将热化学方程式①、②左右两边分别相减,也可以求得C(s)与O2(g)反应生成CO(g)的焓变。
则ΔH3= = 。
ΔH1=ΔH2+ΔH3
ΔH1-ΔH2
-110.5 kJ·mol-1
ΔH1-ΔH2
-110.5 kJ·mol-1
教材阅读想一想阅读教材“反应热的测量与计算”中的“方法导引”
思考:为什么化学反应的反应热与化学反应的途径无关
提示 化学反应遵循原子守恒和能量守恒。在指定的状态下各种物质的焓都是确定且唯一的,因此,不论反应是一步完成的还是分步完成的,最初的反应物和最终的生成物都是一样的,因此焓变与反应途径无关,即反应热与反应途径无关。
易错辨析判一判
(1)一个反应一步完成或分几步完成,两者相比,经过的步骤越多,放出或吸收的热量越多。( )
(2)化学反应的反应热与化学反应的始态有关,与终态无关。( )
(3)同一反应的反应热ΔH与化学计量数成正比。( )
(4)同温同压下,氢气和氯气分别在光照条件下和点燃的条件下发生反应时的ΔH不同。( )
×
提示 相等。
×
提示 与始态、终态有关。
√
×
提示 相同。
重难探究·能力素养全提升
探究一 中和反应反应热的测定
情境探究
如图为反应热测定的实验。
简易量热计示意图
(1)提高测定反应热准确度的措施有哪些
(2)若用等浓度的醋酸与NaOH溶液反应,对测得的中和反应反应热有什么影响 改用浓硫酸代替盐酸呢
提示 用保温效果较好的量热计;温度计使用后及时冲洗;用环形玻璃搅拌棒匀速搅拌;操作动作迅速;多次测量取平均值。
提示 醋酸电离要吸收热量,测得的中和反应反应热偏大;浓硫酸溶于水放热,测得的中和反应反应热偏小。
方法突破
1.中和反应反应热测量实验中的“三关”
(1)隔热关——装置保温、隔热效果好,减少热量的损失,使用简易量热计,其优点是保温效果好,也可在保温杯中进行。
(2)测量关——温度在测量过程中是重要的参数,测量时要又快又准。
①选择精密温度计,精确到0.1 ℃。
②测量溶液温度时,将温度计插在液体中央,使水银球处于溶液中央位置,水银球不要碰到容器壁或在液面以上。
③温度计不能当搅拌棒用,用环形玻璃搅拌棒搅拌,使溶液迅速、充分混合。
④测量酸和碱溶液的温度时要稳定一会儿再读数,测量反应混合液的温度时要随时读取温度值,记录最高温度。
(3)酸、碱关——注意酸碱的强弱和浓度。
强酸、强碱浓溶液稀释过程中会放出热量,而弱酸、弱碱电离过程中需吸收热量。故通常中和反应反应热是指强酸、强碱在稀溶液中反应生成1 mol水的反应热。
2.中和热测定实验中产生误差的可能原因
(1)量取溶液的体积有误差(测量结果是按50 mL的酸、碱进行计算的,若实际量取时大于50 mL或小于50 mL都会造成误差)。
(2)温度计的读数有误。
(3)实验过程中有液体洒在外面。
(4)混合酸、碱溶液时,动作缓慢,导致实验误差。
(5)隔热操作不到位,致使实验过程中热量损失而导致误差。
(6)测了酸后的温度计未用水清洗便立即去测碱的温度,会引起误差。
3.实验数据处理方法
(1)取三次测量所得数据的平均值作为计算依据。
实验次数 起始温度T1/℃ 终止温度 T2/℃ 温度差
(T2-T1)/℃
盐酸 NaOH溶液 平均值
1
2
3
(2)计算反应热。
为了计算简便,我们近似地认为实验所用酸、碱溶液的密度和比热与水相同,并忽略实验装置的比热,则:
50 mL 0.50 mol· L-1盐酸的质量m1=50 g,50 mL 0.50 mol· L-1NaOH溶液的质量m2=50 g。
中和后生成的溶液的比热c=4.18 J· g-1· ℃-1,则50 mL 0.50 mol· L-1盐酸与 50 mL 0.50 mol· L-1 NaOH溶液发生中和反应时放出的热量为(m1+m2)·c·(T2-T1)=0.418(T2-T1) kJ。
生成1 mol H2O时的反应热
应用体验
视角1中和反应热的测定原理
1.在中和反应反应热的测定实验中,下列操作正确的是( )
A.量取0.50 mol·L-1的醋酸、0.50 mol·L-1的NaOH溶液各50 mL
B.分多次把NaOH溶液倒入盛有硫酸的量热计中
C.环形玻璃搅拌棒上下移动,使酸碱溶液混合
D.用温度计测定NaOH溶液起始温度后直接测定硫酸的温度
C
解析 弱酸电离过程中吸收热量,会使测得的结果产生误差,A项错误;尽量一次快速将NaOH溶液倒入盛有硫酸的量热计中,分多次把NaOH溶液倒入盛有硫酸的量热计中,会导致热量散失较多,则测定的中和反应反应热的数值不准,B项错误;环形玻璃搅拌棒起搅拌作用,应该上下移动,使反应物混合均匀,加快反应速率,减小实验误差,C项正确;测定NaOH溶液起始温度后的温度计直接插入硫酸测温度,由于氢氧化钠与硫酸反应放热,硫酸的起始温度偏高且消耗H2SO4,会造成测得中和反应反应热的数值不准,D项错误。
归纳总结 中和反应反应热测定实验中应注意的事项
(1)用环形玻璃棒搅拌,而不能用金属棒(丝)搅拌;实验时动作要迅速。
(2)可加过量碱液使酸完全反应,碱过量对测定中和反应反应热没有影响。
(3)数据处理时,相差较大的数据可能是偶然误差引起的,应舍去。
2.分别取50 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1氢氧化钠溶液在下列装置中混合后进行中和热的测定,下列说法不正确的是( )
A.仪器A的名称是环形玻璃搅拌棒
B.用稍过量的氢氧化钠溶液可确保盐酸完全反应
C.为减少热量损失,酸碱混合时需将量筒中NaOH溶液快速倒入小烧杯中
D.用稀硫酸和Ba(OH)2溶液代替盐酸和NaOH溶液进行反应,结果也正确
D
解析 根据装置图可知,仪器A的名称是环形玻璃搅拌棒,A正确;HCl与NaOH发生中和反应,为保证盐酸完全反应,加入的NaOH溶液应稍微过量,B正确;为减少酸碱中和反应过程的热量损失,酸碱混合时需将量筒中NaOH溶液一次性快速倒入小烧杯中,C正确;若用稀硫酸和Ba(OH)2溶液代替盐酸和NaOH溶液进行反应,由于此时除了H+与OH-反应产生H2O放出热量外,还有Ba2+与 结合形成BaSO4沉淀也有一定的热效应,因此会导致实验结果不准确,D错误。
视角2中和反应热测定的分析
3.中和反应反应热测定实验中下列说法错误的是( )
A.一组完整实验数据需要测三次温度
B.使用简易量热计,其优点是保温效果好
C.可用铜做的搅拌棒代替环形玻璃搅拌棒,因铜和盐酸不反应
D.在量取NaOH溶液和盐酸体积时均仰视,测得反应热的绝对值将偏大
C
解析 一组完整实验数据需要测实验前酸的温度、碱的温度和反应过程中的最高温度,故A项正确;简易量热计优点是保温效果好,故B项正确;金属的导热性很好,用铜做的搅拌棒代替环形玻璃搅拌棒,会导致热量的散失,实验结果不准确,故C项错误;在量取溶液体积时仰视,则实际量取体积偏高,计算出热量数值大,则测得反应热的绝对值将偏大,故D正确。
探究二 盖斯定律
情境探究
多角度理解盖斯定律
①从反应途径角度
②从能量守恒角度
对于如图所示的过程:
从反应途径角度:A→D ΔH=ΔH1+ΔH2+ΔH3=-(ΔH4+ΔH5+ΔH6);
从能量守恒角度:ΔH1+ΔH2+ΔH3+ΔH4+ΔH5+ΔH6=0。
(1)山的高度与从不同的途径登山有没有关系
提示 山的高度与登山的途径无关,只与起点和终点的相对高度有关。
(2)根据以下两个反应:
C(s)+O2(g) ══ CO2(g) ΔH1=-393.5 kJ·mol-1
CO(g)+ O2(g) ══ CO2(g) ΔH2=-283.0 kJ·mol-1
根据盖斯定律,设计合理的途径,计算出C(s)+ O2(g) ══ CO(g)的反应热ΔH。
提示 根据所给的两个热化学方程式,反应C(s)+O2(g) ══ CO2(g)可设计为如下途径:
ΔH1=ΔH+ΔH2
ΔH=ΔH1-ΔH2=-393.5 kJ·mol-1-(-283.0 kJ·mol-1)=-110.5 kJ·mol-1。
(3)盖斯定律的应用除了“虚拟路径”法外,还有热化学方程式“加和”法,该方法简单易行,便于掌握。试根据上题中的两个热化学方程式,利用“加和”法求C(s)+ O2(g) ══ CO(g)的ΔH。
提示 C(s)+O2(g) ══ CO2(g) ΔH1=-393.5 kJ·mol-1
CO2(g) ══ CO(g)+ O2(g) ΔH2'=283.0 kJ·mol-1
上述两式相加得:
C(s)+ O2(g) ══ CO(g) ΔH=-110.5 kJ·mol-1。
方法突破
盖斯定律的应用方法
(1)加和法。
(2)虚拟路径法。
①方法。先根据题意虚拟转化路径,然后根据盖斯定律列式求解,即可求得待求的反应热。
②举例。
若反应物A变为生成物D,可以有两个途径:
a.由A直接变成D,反应热为ΔH。
b.由A经过B变成C,再由C变成D,每步的反应热分别为ΔH1、ΔH2、ΔH3。
如图所示:
则有:ΔH=ΔH1+ΔH2+ΔH3。
应用体验
视角1盖斯定律的理解
1.下列关于盖斯定律描述不正确的是( )
A.化学反应的反应热不仅与反应体系的始态和终态有关,也与反应的途径有关
B.盖斯定律遵守能量守恒定律
C.利用盖斯定律可间接计算通过实验难测定的反应的反应热
D.利用盖斯定律可以计算有副反应发生的反应的反应热
A
解析 化学反应的反应热与反应体系的始态和终态有关,与反应途径无关。
2.在缺氧条件下,由于兼性脱氮菌的作用,将 和 还原成N2实现脱硝的过程,称为反硝化。污水处理厂以甲醇作碳源实现硝酸盐的反硝化过程分两步进行:
3 (aq)+CH3OH(l) ══ 3 (aq)+CO2(g)+2H2O(l)
ΔH=-398.9 kJ·mol-1
2 (aq)+CH3OH(l) ══ N2(g)+CO2(g)+H2O(l)+2OH-(aq)
ΔH=-91.5 kJ·mol-1
反应6 (aq)+5CH3OH(l) ══ 3N2(g)+5CO2(g)+7H2O(l)+6OH-(aq)的ΔH= kJ·mol-1。
-1 072.3
解析 将已知的两个反应依次编号为反应①、反应②,根据盖斯定律:反应①×2+反应②×3得:6 (aq)+5CH3OH(l) ══ 3N2(g)+5CO2(g)+7H2O(l)+6OH-(aq)的ΔH=-1 072.3 kJ·mol-1。
3.已知反应:
①2H2(g)+O2(g) ══ 2H2O(g) ΔH1
②N2(g)+2O2(g) ══ 2NO2(g) ΔH2
③N2(g)+3H2(g) 2NH3(g) ΔH3,
则反应4NH3(g)+7O2(g) ══ 4NO2(g)+6H2O(g)的ΔH为( )
A.2ΔH1+2ΔH2-2ΔH3
B.ΔH1+ΔH2-ΔH3
C.3ΔH1+2ΔH2-2ΔH3
D.3ΔH1+2ΔH2+2ΔH3
C
解析 已知反应:①2H2(g)+O2(g) ══ 2H2O(g) ΔH1,
②N2(g)+2O2(g) ══ 2NO2(g) ΔH2,
③N2(g)+3H2(g) 2NH3(g) ΔH3,
根据盖斯定律,将①×3+②×2-③×2,整理可得4NH3(g)+7O2(g) ══ 4NO2(g)+6H2O(g) ΔH=3ΔH1+2ΔH2-2ΔH3,故正确选项是C。
归纳总结 盖斯定律解题模型
视角2反应热的计算
4.COS可作为一种粮食熏蒸剂,其制备的原理为CO(g)+H2S(g) ══ COS(g)+H2(g)。已知:
化学键 C≡O H—S C=S C=O H—H
1 072 339 536 745 436
COS的结构与CO2相似。则该制备反应的ΔH为( )
A.82 kJ·mol-1 B.33 kJ·mol-1
C.-285 kJ·mol-1 D.-110 kJ·mol-1
B
解析 由题目给出的化学键键能可计算得该反应的ΔH=∑反应物总键能-∑生成物总键能=1 072 kJ·mol-1+2×339 kJ·mol-1-(536 kJ·mol-1+745 kJ·mol-1 +436 kJ·mol-1)=33 kJ·mol-1,故选B。
5.已知:(1)CH3COOH(l)+2O2(g) ══ 2CO2(g)+2H2O(l) ΔH1
(2)C(s)+O2(g) ══ CO2(g) ΔH2
(3)2H2(g)+O2(g) ══ 2H2O(l) ΔH3
(4)2CO2(g)+4H2(g) ══ CH3COOH(l)+2H2O(l) ΔH4
(5)2C(s)+2H2(g)+O2(g) ══ CH3COOH(l) ΔH5
下列关于上述反应的焓变的判断正确的是( )
A.ΔH1>0,ΔH2<0
B.ΔH5=2ΔH2+ΔH3-ΔH1
C.ΔH3>0,ΔH5<0
D.ΔH4=ΔH1-2ΔH3
B
解析 物质的燃烧反应是放热的,焓变小于零,ΔH1<0,ΔH2<0,A项错误;利用盖斯定律计算,将(2)×2+(3)-(1),可得2C(s)+2H2(g)+O2(g) ══ CH3COOH(l),反应热随之相加减,可求得反应热,即ΔH5=2ΔH2+ΔH3-ΔH1,B项正确;物质的燃烧反应是放热的,焓变小于零,所以ΔH3<0,C项错误;根据盖斯定律,可得ΔH4=2ΔH3-ΔH1,故D项错误。
6.根据图中各物质间的能量变化图,下列说法错误的是( )
A.ΔH1=ΔH2+ΔH3+ΔH5+ΔH6+ΔH7+ΔH8
B.ΔH3>0,ΔH7<0,ΔH8<0
C.ΔH2+ΔH3>ΔH4+ΔH8
D.将图中的“Cl”改为“Br”,则溴的ΔH3
大于氯的ΔH3
D
解析 根据盖斯定律可知ΔH1=ΔH2+ΔH3+ΔH4+ΔH8或ΔH1=ΔH2+ΔH3+ΔH5+ΔH6+ΔH7+ΔH8,A正确;断裂共价键需要吸收能量,即ΔH3>0,钠离子与氯离子结合形成氯化钠为放热过程,即ΔH7<0,物质从气态到固态放热,即ΔH8<0,B正确;因为ΔH2>0,ΔH3>0,ΔH4<0,ΔH8<0,所以ΔH2+ΔH3>ΔH4+ΔH8,C正确;Cl2(g)分子的键能大于Br2(g)分子的键能,故溴的ΔH3小于氯的ΔH3,D错误。
答案 89.3
解析 根据盖斯定律可知①+②=③,ΔH3=ΔH1+ΔH2=100.3 kJ·mol-1+(-11.0 kJ·mol-1)=89.3 kJ·mol-1。
本 课 结 束
专题1
第一单元 第2课时 反应热的测量与计算
基础落实·必备知识全过关
重难探究·能力素养全提升
目录索引
素养 目标 1.通过交流讨论理解盖斯定律的本质,能用盖斯定律进行有关反应热的简单计算,形成运用盖斯定律进行相关判断或计算的思维模型,培养宏观辨识与微观探析的化学核心素养。
2.通过实验了解定量测定中和反应反应热的基本原理和实验方法,能正确分析误差产生的原因并能采取适当措施减小误差,培养科学探究与创新意识的化学核心素养。
基础落实·必备知识全过关
一、中和反应反应热的测定
强酸和强碱反应生成可溶性盐和水的离子方程式为H++OH- ══ H2O。中和反应反应热可以用实验的方法测得:先将反应器置于绝热容器中,然后在反应器内将酸、碱稀溶液混合,发生中和反应,
,测量出 ,根据水的质量、比热等即可求出反应放出的热量。
放出的热传入水(稀溶液)中
水(稀溶液)的温度变化
1.实验装置
实验过程中,还需要的其他仪器有 。
温度计
50 mL量筒(2个)
2.实验步骤
(1)用量筒量取50 mL 0.50 mol· L-1盐酸,倒入简易量热计中,测量并记录盐酸的温度(T1)。
(2)用另一量筒量取50 mL 0.50 mol· L-1 NaOH溶液,测量并记录NaOH溶液的温度(T2)。
(3)将量筒中的NaOH溶液迅速倒入盛有盐酸的简易量热计中,立即盖上盖板,用 轻轻搅拌,观察温度计的温度变化,准确读出反应体系的 温度(T3)并记录。
(4)假设溶液的比热与水的比热(c=4.18 J· g-1· ℃-1)相等,溶液的密度与水的密度相等,忽略量热计的比热,根据溶液温度升高的数值,计算该反应的反应热并写出热化学方程式。
环形玻璃搅拌棒
最高
3.实验记录表
盐酸的温度(T1)/℃
氢氧化钠溶液的温度(T2)/℃
反应体系的最高温度(T3)/℃
反应体系的温度变化(ΔT=T3- )/℃
反应体系的热容[C=(ρHCl·VHCl+ρNaOH·VNaOH)×4.18]/(J· ℃-1)
生成1 mol H2O时的反应热
教材阅读想一想阅读教材“反应热的测量与计算”中的“实验探究”
思考:以稀盐酸与稀NaOH溶液反应为例,测定H+(aq)+OH-(aq) ══ H2O(l)的反应热,实验过程中,应该测量哪些数据
提示 测量反应前稀盐酸的温度(T1 ℃)、稀NaOH溶液的温度(T2 ℃);测量反应体系的最高温度(T3 ℃);重复实验两次,记录测量数据。
易错辨析判一判
(1)稀NaOH溶液与浓硫酸反应生成1 mol水时释放的能量就是中和热。
( )
(2)1 mol强酸跟强碱反应放出的热量一定是57.3 kJ。( )
(3)中和反应反应热与强酸、强碱的用量没有关系。( )
×
提示 浓硫酸溶于水放热。
×
提示 还要求生成1 mol水。
√
二、盖斯定律
1.盖斯定律
一个化学反应,不论是 完成,还是 完成,其总的热效应是完全相等的。盖斯定律表明,一个化学反应的焓变(ΔH)仅与反应的
和反应的 有关,而与反应的 无关。
一步
分几步
起始状态
最终状态
途径
2.盖斯定律的应用
因为有些反应的反应速率 ,有些反应伴有 发生,还有些反应在通常条件下 ,这给测定反应热造成了困难。应用盖斯定律可以间接地把它们的反应热计算出来。已知:
C(s)+O2(g) ══ CO2(g)
ΔH1=-393.5 kJ·mol-1 ①
CO(g)+ O2(g) ══ CO2(g)
ΔH2=-283.0 kJ·mol-1 ②
反应C(s)+ O2(g) ══ CO(g)的焓变为ΔH3。
很小
副反应
不易直接进行
(1)根据盖斯定律可以得到 ,则
ΔH3= = 。
(2)根据盖斯定律,直接将热化学方程式①、②左右两边分别相减,也可以求得C(s)与O2(g)反应生成CO(g)的焓变。
则ΔH3= = 。
ΔH1=ΔH2+ΔH3
ΔH1-ΔH2
-110.5 kJ·mol-1
ΔH1-ΔH2
-110.5 kJ·mol-1
教材阅读想一想阅读教材“反应热的测量与计算”中的“方法导引”
思考:为什么化学反应的反应热与化学反应的途径无关
提示 化学反应遵循原子守恒和能量守恒。在指定的状态下各种物质的焓都是确定且唯一的,因此,不论反应是一步完成的还是分步完成的,最初的反应物和最终的生成物都是一样的,因此焓变与反应途径无关,即反应热与反应途径无关。
易错辨析判一判
(1)一个反应一步完成或分几步完成,两者相比,经过的步骤越多,放出或吸收的热量越多。( )
(2)化学反应的反应热与化学反应的始态有关,与终态无关。( )
(3)同一反应的反应热ΔH与化学计量数成正比。( )
(4)同温同压下,氢气和氯气分别在光照条件下和点燃的条件下发生反应时的ΔH不同。( )
×
提示 相等。
×
提示 与始态、终态有关。
√
×
提示 相同。
重难探究·能力素养全提升
探究一 中和反应反应热的测定
情境探究
如图为反应热测定的实验。
简易量热计示意图
(1)提高测定反应热准确度的措施有哪些
(2)若用等浓度的醋酸与NaOH溶液反应,对测得的中和反应反应热有什么影响 改用浓硫酸代替盐酸呢
提示 用保温效果较好的量热计;温度计使用后及时冲洗;用环形玻璃搅拌棒匀速搅拌;操作动作迅速;多次测量取平均值。
提示 醋酸电离要吸收热量,测得的中和反应反应热偏大;浓硫酸溶于水放热,测得的中和反应反应热偏小。
方法突破
1.中和反应反应热测量实验中的“三关”
(1)隔热关——装置保温、隔热效果好,减少热量的损失,使用简易量热计,其优点是保温效果好,也可在保温杯中进行。
(2)测量关——温度在测量过程中是重要的参数,测量时要又快又准。
①选择精密温度计,精确到0.1 ℃。
②测量溶液温度时,将温度计插在液体中央,使水银球处于溶液中央位置,水银球不要碰到容器壁或在液面以上。
③温度计不能当搅拌棒用,用环形玻璃搅拌棒搅拌,使溶液迅速、充分混合。
④测量酸和碱溶液的温度时要稳定一会儿再读数,测量反应混合液的温度时要随时读取温度值,记录最高温度。
(3)酸、碱关——注意酸碱的强弱和浓度。
强酸、强碱浓溶液稀释过程中会放出热量,而弱酸、弱碱电离过程中需吸收热量。故通常中和反应反应热是指强酸、强碱在稀溶液中反应生成1 mol水的反应热。
2.中和热测定实验中产生误差的可能原因
(1)量取溶液的体积有误差(测量结果是按50 mL的酸、碱进行计算的,若实际量取时大于50 mL或小于50 mL都会造成误差)。
(2)温度计的读数有误。
(3)实验过程中有液体洒在外面。
(4)混合酸、碱溶液时,动作缓慢,导致实验误差。
(5)隔热操作不到位,致使实验过程中热量损失而导致误差。
(6)测了酸后的温度计未用水清洗便立即去测碱的温度,会引起误差。
3.实验数据处理方法
(1)取三次测量所得数据的平均值作为计算依据。
实验次数 起始温度T1/℃ 终止温度 T2/℃ 温度差
(T2-T1)/℃
盐酸 NaOH溶液 平均值
1
2
3
(2)计算反应热。
为了计算简便,我们近似地认为实验所用酸、碱溶液的密度和比热与水相同,并忽略实验装置的比热,则:
50 mL 0.50 mol· L-1盐酸的质量m1=50 g,50 mL 0.50 mol· L-1NaOH溶液的质量m2=50 g。
中和后生成的溶液的比热c=4.18 J· g-1· ℃-1,则50 mL 0.50 mol· L-1盐酸与 50 mL 0.50 mol· L-1 NaOH溶液发生中和反应时放出的热量为(m1+m2)·c·(T2-T1)=0.418(T2-T1) kJ。
生成1 mol H2O时的反应热
应用体验
视角1中和反应热的测定原理
1.在中和反应反应热的测定实验中,下列操作正确的是( )
A.量取0.50 mol·L-1的醋酸、0.50 mol·L-1的NaOH溶液各50 mL
B.分多次把NaOH溶液倒入盛有硫酸的量热计中
C.环形玻璃搅拌棒上下移动,使酸碱溶液混合
D.用温度计测定NaOH溶液起始温度后直接测定硫酸的温度
C
解析 弱酸电离过程中吸收热量,会使测得的结果产生误差,A项错误;尽量一次快速将NaOH溶液倒入盛有硫酸的量热计中,分多次把NaOH溶液倒入盛有硫酸的量热计中,会导致热量散失较多,则测定的中和反应反应热的数值不准,B项错误;环形玻璃搅拌棒起搅拌作用,应该上下移动,使反应物混合均匀,加快反应速率,减小实验误差,C项正确;测定NaOH溶液起始温度后的温度计直接插入硫酸测温度,由于氢氧化钠与硫酸反应放热,硫酸的起始温度偏高且消耗H2SO4,会造成测得中和反应反应热的数值不准,D项错误。
归纳总结 中和反应反应热测定实验中应注意的事项
(1)用环形玻璃棒搅拌,而不能用金属棒(丝)搅拌;实验时动作要迅速。
(2)可加过量碱液使酸完全反应,碱过量对测定中和反应反应热没有影响。
(3)数据处理时,相差较大的数据可能是偶然误差引起的,应舍去。
2.分别取50 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1氢氧化钠溶液在下列装置中混合后进行中和热的测定,下列说法不正确的是( )
A.仪器A的名称是环形玻璃搅拌棒
B.用稍过量的氢氧化钠溶液可确保盐酸完全反应
C.为减少热量损失,酸碱混合时需将量筒中NaOH溶液快速倒入小烧杯中
D.用稀硫酸和Ba(OH)2溶液代替盐酸和NaOH溶液进行反应,结果也正确
D
解析 根据装置图可知,仪器A的名称是环形玻璃搅拌棒,A正确;HCl与NaOH发生中和反应,为保证盐酸完全反应,加入的NaOH溶液应稍微过量,B正确;为减少酸碱中和反应过程的热量损失,酸碱混合时需将量筒中NaOH溶液一次性快速倒入小烧杯中,C正确;若用稀硫酸和Ba(OH)2溶液代替盐酸和NaOH溶液进行反应,由于此时除了H+与OH-反应产生H2O放出热量外,还有Ba2+与 结合形成BaSO4沉淀也有一定的热效应,因此会导致实验结果不准确,D错误。
视角2中和反应热测定的分析
3.中和反应反应热测定实验中下列说法错误的是( )
A.一组完整实验数据需要测三次温度
B.使用简易量热计,其优点是保温效果好
C.可用铜做的搅拌棒代替环形玻璃搅拌棒,因铜和盐酸不反应
D.在量取NaOH溶液和盐酸体积时均仰视,测得反应热的绝对值将偏大
C
解析 一组完整实验数据需要测实验前酸的温度、碱的温度和反应过程中的最高温度,故A项正确;简易量热计优点是保温效果好,故B项正确;金属的导热性很好,用铜做的搅拌棒代替环形玻璃搅拌棒,会导致热量的散失,实验结果不准确,故C项错误;在量取溶液体积时仰视,则实际量取体积偏高,计算出热量数值大,则测得反应热的绝对值将偏大,故D正确。
探究二 盖斯定律
情境探究
多角度理解盖斯定律
①从反应途径角度
②从能量守恒角度
对于如图所示的过程:
从反应途径角度:A→D ΔH=ΔH1+ΔH2+ΔH3=-(ΔH4+ΔH5+ΔH6);
从能量守恒角度:ΔH1+ΔH2+ΔH3+ΔH4+ΔH5+ΔH6=0。
(1)山的高度与从不同的途径登山有没有关系
提示 山的高度与登山的途径无关,只与起点和终点的相对高度有关。
(2)根据以下两个反应:
C(s)+O2(g) ══ CO2(g) ΔH1=-393.5 kJ·mol-1
CO(g)+ O2(g) ══ CO2(g) ΔH2=-283.0 kJ·mol-1
根据盖斯定律,设计合理的途径,计算出C(s)+ O2(g) ══ CO(g)的反应热ΔH。
提示 根据所给的两个热化学方程式,反应C(s)+O2(g) ══ CO2(g)可设计为如下途径:
ΔH1=ΔH+ΔH2
ΔH=ΔH1-ΔH2=-393.5 kJ·mol-1-(-283.0 kJ·mol-1)=-110.5 kJ·mol-1。
(3)盖斯定律的应用除了“虚拟路径”法外,还有热化学方程式“加和”法,该方法简单易行,便于掌握。试根据上题中的两个热化学方程式,利用“加和”法求C(s)+ O2(g) ══ CO(g)的ΔH。
提示 C(s)+O2(g) ══ CO2(g) ΔH1=-393.5 kJ·mol-1
CO2(g) ══ CO(g)+ O2(g) ΔH2'=283.0 kJ·mol-1
上述两式相加得:
C(s)+ O2(g) ══ CO(g) ΔH=-110.5 kJ·mol-1。
方法突破
盖斯定律的应用方法
(1)加和法。
(2)虚拟路径法。
①方法。先根据题意虚拟转化路径,然后根据盖斯定律列式求解,即可求得待求的反应热。
②举例。
若反应物A变为生成物D,可以有两个途径:
a.由A直接变成D,反应热为ΔH。
b.由A经过B变成C,再由C变成D,每步的反应热分别为ΔH1、ΔH2、ΔH3。
如图所示:
则有:ΔH=ΔH1+ΔH2+ΔH3。
应用体验
视角1盖斯定律的理解
1.下列关于盖斯定律描述不正确的是( )
A.化学反应的反应热不仅与反应体系的始态和终态有关,也与反应的途径有关
B.盖斯定律遵守能量守恒定律
C.利用盖斯定律可间接计算通过实验难测定的反应的反应热
D.利用盖斯定律可以计算有副反应发生的反应的反应热
A
解析 化学反应的反应热与反应体系的始态和终态有关,与反应途径无关。
2.在缺氧条件下,由于兼性脱氮菌的作用,将 和 还原成N2实现脱硝的过程,称为反硝化。污水处理厂以甲醇作碳源实现硝酸盐的反硝化过程分两步进行:
3 (aq)+CH3OH(l) ══ 3 (aq)+CO2(g)+2H2O(l)
ΔH=-398.9 kJ·mol-1
2 (aq)+CH3OH(l) ══ N2(g)+CO2(g)+H2O(l)+2OH-(aq)
ΔH=-91.5 kJ·mol-1
反应6 (aq)+5CH3OH(l) ══ 3N2(g)+5CO2(g)+7H2O(l)+6OH-(aq)的ΔH= kJ·mol-1。
-1 072.3
解析 将已知的两个反应依次编号为反应①、反应②,根据盖斯定律:反应①×2+反应②×3得:6 (aq)+5CH3OH(l) ══ 3N2(g)+5CO2(g)+7H2O(l)+6OH-(aq)的ΔH=-1 072.3 kJ·mol-1。
3.已知反应:
①2H2(g)+O2(g) ══ 2H2O(g) ΔH1
②N2(g)+2O2(g) ══ 2NO2(g) ΔH2
③N2(g)+3H2(g) 2NH3(g) ΔH3,
则反应4NH3(g)+7O2(g) ══ 4NO2(g)+6H2O(g)的ΔH为( )
A.2ΔH1+2ΔH2-2ΔH3
B.ΔH1+ΔH2-ΔH3
C.3ΔH1+2ΔH2-2ΔH3
D.3ΔH1+2ΔH2+2ΔH3
C
解析 已知反应:①2H2(g)+O2(g) ══ 2H2O(g) ΔH1,
②N2(g)+2O2(g) ══ 2NO2(g) ΔH2,
③N2(g)+3H2(g) 2NH3(g) ΔH3,
根据盖斯定律,将①×3+②×2-③×2,整理可得4NH3(g)+7O2(g) ══ 4NO2(g)+6H2O(g) ΔH=3ΔH1+2ΔH2-2ΔH3,故正确选项是C。
归纳总结 盖斯定律解题模型
视角2反应热的计算
4.COS可作为一种粮食熏蒸剂,其制备的原理为CO(g)+H2S(g) ══ COS(g)+H2(g)。已知:
化学键 C≡O H—S C=S C=O H—H
1 072 339 536 745 436
COS的结构与CO2相似。则该制备反应的ΔH为( )
A.82 kJ·mol-1 B.33 kJ·mol-1
C.-285 kJ·mol-1 D.-110 kJ·mol-1
B
解析 由题目给出的化学键键能可计算得该反应的ΔH=∑反应物总键能-∑生成物总键能=1 072 kJ·mol-1+2×339 kJ·mol-1-(536 kJ·mol-1+745 kJ·mol-1 +436 kJ·mol-1)=33 kJ·mol-1,故选B。
5.已知:(1)CH3COOH(l)+2O2(g) ══ 2CO2(g)+2H2O(l) ΔH1
(2)C(s)+O2(g) ══ CO2(g) ΔH2
(3)2H2(g)+O2(g) ══ 2H2O(l) ΔH3
(4)2CO2(g)+4H2(g) ══ CH3COOH(l)+2H2O(l) ΔH4
(5)2C(s)+2H2(g)+O2(g) ══ CH3COOH(l) ΔH5
下列关于上述反应的焓变的判断正确的是( )
A.ΔH1>0,ΔH2<0
B.ΔH5=2ΔH2+ΔH3-ΔH1
C.ΔH3>0,ΔH5<0
D.ΔH4=ΔH1-2ΔH3
B
解析 物质的燃烧反应是放热的,焓变小于零,ΔH1<0,ΔH2<0,A项错误;利用盖斯定律计算,将(2)×2+(3)-(1),可得2C(s)+2H2(g)+O2(g) ══ CH3COOH(l),反应热随之相加减,可求得反应热,即ΔH5=2ΔH2+ΔH3-ΔH1,B项正确;物质的燃烧反应是放热的,焓变小于零,所以ΔH3<0,C项错误;根据盖斯定律,可得ΔH4=2ΔH3-ΔH1,故D项错误。
6.根据图中各物质间的能量变化图,下列说法错误的是( )
A.ΔH1=ΔH2+ΔH3+ΔH5+ΔH6+ΔH7+ΔH8
B.ΔH3>0,ΔH7<0,ΔH8<0
C.ΔH2+ΔH3>ΔH4+ΔH8
D.将图中的“Cl”改为“Br”,则溴的ΔH3
大于氯的ΔH3
D
解析 根据盖斯定律可知ΔH1=ΔH2+ΔH3+ΔH4+ΔH8或ΔH1=ΔH2+ΔH3+ΔH5+ΔH6+ΔH7+ΔH8,A正确;断裂共价键需要吸收能量,即ΔH3>0,钠离子与氯离子结合形成氯化钠为放热过程,即ΔH7<0,物质从气态到固态放热,即ΔH8<0,B正确;因为ΔH2>0,ΔH3>0,ΔH4<0,ΔH8<0,所以ΔH2+ΔH3>ΔH4+ΔH8,C正确;Cl2(g)分子的键能大于Br2(g)分子的键能,故溴的ΔH3小于氯的ΔH3,D错误。
答案 89.3
解析 根据盖斯定律可知①+②=③,ΔH3=ΔH1+ΔH2=100.3 kJ·mol-1+(-11.0 kJ·mol-1)=89.3 kJ·mol-1。
本 课 结 束
