1.1.3 能源的充分利用 课件 (共43张PPT)2023-2024学年高二化学苏教版选择性必修1
文档属性
| 名称 | 1.1.3 能源的充分利用 课件 (共43张PPT)2023-2024学年高二化学苏教版选择性必修1 |  | |
| 格式 | pptx | ||
| 文件大小 | 2.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-08 14:30:58 | ||
图片预览











文档简介
(共43张PPT)
专题1
第一单元 第3课时 能源的充分利用
基础落实·必备知识全过关
重难探究·能力素养全提升
目录索引
素养 目标 1.能举例说明化学在解决能源危机中的重要作用。能分析能源的利用对自然环境和社会发展的影响,培养科学态度与社会责任的化学核心素养。
2.能综合考虑化学变化中的物质变化和能量变化来分析、解决实际问题,如煤炭的综合利用等。
3.通过交流讨论认识标准燃烧热的概念,掌握表示标准燃烧热的热化学方程式的书写和有关标准燃烧热的简单计算,培养学生的计算能力。
基础落实·必备知识全过关
一、标准燃烧热和热值
1.标准燃烧热
在 kPa下, mol物质完全燃烧的反应热叫做该物质的标准燃烧热。完全燃烧是指物质中含有的氮元素转化为 ,氢元素转化为 ,碳元素转化为 。
2.标准燃烧热的计算
由标准燃烧热的定义可知:101 kPa时,可燃物完全燃烧产生的热量=可燃物的物质的量×其标准燃烧热,即Q放=n(可燃物)×|ΔH|;或变换一下求物质的
标准燃烧热: 。此公式中的ΔH是指物质的标准燃烧热,而不是指一般反应的反应热。
101
1
N2(g)
H2O(l)
CO2(g)
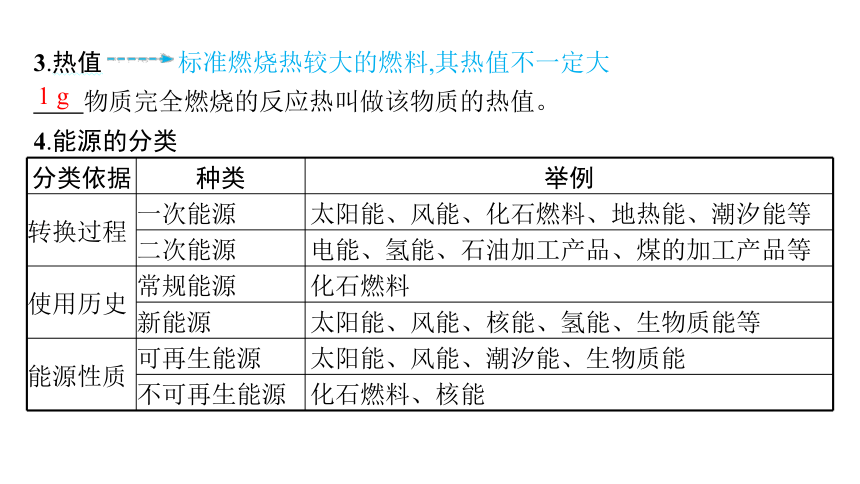
3.热值 标准燃烧热较大的燃料,其热值不一定大
物质完全燃烧的反应热叫做该物质的热值。
4.能源的分类
分类依据 种类 举例
转换过程 一次能源 太阳能、风能、化石燃料、地热能、潮汐能等
二次能源 电能、氢能、石油加工产品、煤的加工产品等
使用历史 常规能源 化石燃料
新能源 太阳能、风能、核能、氢能、生物质能等
能源性质 可再生能源 太阳能、风能、潮汐能、生物质能
不可再生能源 化石燃料、核能
1 g
5.化石燃料和新能源
(1)化石燃料的弊端:蕴藏量有限、不能再生;利用率低;污染环境,特别是会造成 和 。
(2)太阳能是能量巨大的清洁能源,缺点是能量密度小,受地域和季节的影响大。
(3)氢能有三大优点:一是燃烧热值高,二是 ,三是
。缺点是储存、运输困难。
(4)能源危机的解决方法:开发 ,节约 ,提高能源的 。
酸雨
温室效应
资源丰富
无毒、无污染
新能源
现有能源
利用率
教材阅读想一想阅读教材表1-3上面正文部分
思考:理解标准燃烧热的定义时需注意哪些事项
提示 标准燃烧热研究的条件是101 kPa;可燃物的用量是1 mol;反应的程度是完全燃烧,产物是指定稳定产物。
易错辨析判一判
(1)硫完全燃烧生成二氧化硫时,放出的热量为硫的标准燃烧热。( )
(2)在101 kPa时,1 mol碳燃烧所放出的热量为碳的标准燃烧热。( )
(3)在101 kPa时,由2CO(g)+O2(g) ══ 2CO2(g) ΔH=-566 kJ·mol-1可知,CO的标准燃烧热ΔH=-283 kJ·mol-1。( )
(4)乙炔的标准燃烧热ΔH=-1 299.6 kJ·mol-1,则2C2H2(g)+5O2(g) ══ 4CO2(g)+2H2O(g)反应的ΔH=-2 599.2 kJ·mol-1。( )
×
提示 101 kPa时1 mol硫完全燃烧,放出的热量为标准燃烧热。
×
提示 必须完全燃烧。
√
×
提示 氢元素必须转化为H2O(l)。
二、反应热的计算
1.利用热化学方程式计算
25 ℃、101 kPa,使1.0 g Na与足量Cl2反应,生成NaCl晶体并放出17.87 kJ热量,则生成1 mol NaCl的反应热ΔH为 。
2.利用标准燃烧热计算
乙醇的标准燃烧热为ΔH=-1 366.8 kJ·mol-1,则25 ℃、101 kPa时1 kg乙醇完全燃烧放出的热量约为 。
-411.01 kJ·mol-1
2.971×104 kJ
3.利用盖斯定律计算
已知:温度过高时,WO2(s)转变为WO2(g)
①WO2(s)+2H2(g) W(s)+2H2O(g)
ΔH1
②WO2(g)+2H2(g) W(s)+2H2O(g)
ΔH2
则WO2(s)WO2(g)的ΔH= 。
ΔH1-ΔH2
教材阅读想一想阅读教材“能源的充分利用”中的“选择决策”
思考:已知CO的标准燃烧热ΔH=-283.0 kJ·mol-1,CH4的标准燃烧热
ΔH=-890.3 kJ·mol-1,将1 mol CO和3 mol CH4组成的混合气体充分燃烧,释放多少热量
提示 释放的热量为283.0 kJ·mol-1×1 mol+890.3 kJ·mol-1×3 mol
=2 953.9 kJ。
易错辨析判一判
(1)CO(g)的标准燃烧热ΔH=-283.0 kJ·mol-1,则2 mol CO(g)充分燃烧,放出热量566.0 kJ。( )
√
×
×
提示 可逆反应不能进行彻底,则放出的热量小于98.7 kJ。
重难探究·能力素养全提升
探究一 标准燃烧热
情境探究
能源是国民经济和社会发展的重要物质基础,我国目前使用的主要能源来自煤、石油、天然气等化石燃料,例如,乙烯、丙烷、甲醇、汽油、柴油均来自石油的加工。甲醇是化肥、制药和煤炭等行业生产的副产品,也可利用化工原料合成,来源极为广泛,且价格低廉。
(1)已知甲醇的标准燃烧热ΔH=-726.5 kJ·mol-1。请写出甲醇燃烧的热化学方程式。
提示 CH3OH(l)+ O2(g) ══ CO2(g)+2H2O(l)ΔH=-726.5 kJ·mol-1。
(2)已知丙烷的标准燃烧热ΔH=-2 220 kJ·mol-1,若一定量的丙烷完全燃烧后生成1.8 g液态水,则放出的热量为多少
提示 丙烷的分子式是C3H8,1 mol丙烷完全燃烧会产生4 mol水,则丙烷完全燃烧产生1.8 g水,消耗丙烷的物质的量是0.025 mol,所以反应放出的热量是2 220 kJ·mol-1×0.025 mol=55.5 kJ。
方法突破
1.对标准燃烧热定义的理解
2.反应热与标准燃烧热的比较
类型 反应热 标准燃烧热
能量的变化 放热或吸热 放热
ΔH的大小 放热时,ΔH<0; 吸热时,ΔH>0 ΔH<0
反应物的量 不限 1 mol纯物质
生成物 无要求 完全燃烧的产物如
N→N2(g)
C→CO2(g)
H→H2O(l)
应用体验
视角1标准燃烧热的理解
1.25 ℃、101 kPa下,碳、氢气、甲烷和葡萄糖的标准燃烧热ΔH依次是-393.5 kJ·mol-1、-285.8 kJ·mol-1、-890.3 kJ·mol-1、-2 800 kJ·mol-1,则下列热化学方程式正确的是( )
A.C(s)+ O2(g) ══ CO(g) ΔH=-393.5 kJ·mol-1
B.2H2(g)+O2(g) ══ 2H2O(g) ΔH=-571.6 kJ·mol-1
C.CH4(g)+2O2(g) ══ CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
D. C6H12O6(s)+3O2(g) ══ 3CO2(g)+3H2O(l) ΔH=-1 400 kJ·mol-1
D
解析 根据标准燃烧热的定义中物质完全燃烧可知,C元素转化为CO2(g),H元素转化为H2O(l),只有D项正确。
2.下列关于标准燃烧热的说法正确的是( )
A.1 mol物质燃烧时放出的热量
B.常温下,可燃物燃烧时放出的热量
C.在1.01×105 Pa时,1 mol纯物质完全燃烧生成指定产物时所放出的热量
D.与化学方程式中物质化学式前的化学计量数有关
C
解析 依据标准燃烧热的定义可知,C项正确。
3.以下几个热化学方程式,能表示有关物质燃烧时的标准燃烧热的热化学方程式是( )
A.C(s)+ O2(g) ══ CO(g) ΔH=110.5 kJ·mol-1
B.C(s)+O2(g) ══ CO2(g) ΔH=-393.5 kJ·mol-1
C.2H2(g)+O2(g) ══ 2H2O(l) ΔH=-571.6 kJ·mol-1
D.H2(g)+ O2(g) ══ H2O(g) ΔH=-241.8 kJ·mol-1
B
解析 要考虑两个要素:1 mol纯物质和完全燃烧。
视角2标准燃烧热的计算及应用
4.(2023河北张家口部分学校高二期中)已知碳的标准燃烧热ΔH=-393.5 kJ·mol-1,氢气的标准燃烧热ΔH=-285.8 kJ·mol-1,一氧化碳的标准燃烧热ΔH=-283.0 kJ·mol-1。某同学发现在灼热的煤炭上洒少量水,煤炉中会产生淡蓝色火焰,煤炭燃烧更旺。下列有关说法正确的是( )
A.表示氢气标准燃烧热的热化学方程式为H2(g)+ O2(g) ══ H2O(g) ΔH=285.8 kJ·mol-1
B.反应C(s)+ O2(g) ══ CO(g)的ΔH<-393.5 kJ·mol-1
C.“煤炭燃烧得更旺”是因为少量固体碳单质与水反应生成了可燃性气体
D.C(s)+H2O(g) ══ CO(g)+H2(g) ΔH=175.3 kJ·mol-1
C
5.油酸甘油酯(相对分子质量为884)在人体内代谢时可发生如下反应:
C57H104O6(s)+80O2(g) ══ 57CO2(g)+52H2O(l)。
已知1 kg该化合物完全燃烧生成液态水时放出3.8×104 kJ热量,则油酸甘油酯的标准燃烧热( )
A.ΔH=-3.8×104 kJ·mol-1 B.ΔH=3.8×104 kJ·mol-1
C.ΔH=-3.4×104 kJ·mol-1 D.ΔH=3.4×104 kJ·mol-1
C
解析 油酸甘油酯的标准燃烧热ΔH= ×884 g·mol-1≈-3.4×104 kJ·mol-1。
探究二 能源的利用及反应热的计算
情境探究
在科学研究和化工生产中,对化学反应过程中热量的利用、化学反应条件的控制等都涉及反应热的计算问题。反应热的计算有哪些常见题型呢
(1)有关反应物和生成物的键能的计算。
已知反应4HCl+O2 ══ 2Cl2+2H2O中,4 mol HCl被氧化放出115.6 kJ的热量,则断开1 mol H—O键与断开1 mol H—Cl键所需能量相差为多少kJ
提示 由已知可写出反应的热化学方程式:4HCl(g)+O2(g) ══ 2Cl2(g)+2H2O(g) ΔH=-115.6 kJ·mol-1,由于焓变=反应物总键能-生成物总键能,则4E(H—Cl)+498 kJ·mol-1-[2×243 kJ·mol-1+4×E(H—O)]=-115.6 kJ·mol-1,则E(H—O)-E(H—Cl)=31.9 kJ·mol-1,所以断开1 mol H—O键与断开1 mol H—Cl键所需能量相差为31.9 kJ。
(2)有关热化学方程式的计算。
已知:C(s)+O2(g) ══ CO2(g) ΔH=-393.5 kJ·mol-1;2H2(g)+O2(g) ══ 2H2O(l) ΔH=-571.6 kJ·mol-1。现有0.2 mol的炭粉和氢气组成的悬浮气,该混合物在氧气中完全燃烧,共放出63.622 kJ热量,则混合物中C与H2的物质的量之比是多少
提示 设混合物中炭粉的物质的量为x mol,氢气的物质的量为y mol,则
解得:x=0.06,y=0.14,则混合物中C和H2的物质的量之比为3∶7。
方法突破
反应热的计算
计算依据 计算方法
热化学方程式 热化学方程式可以移项同时改变正负号,各项的化学计量数包括ΔH的数值可以同时扩大或缩小相同的倍数
标准燃烧热 可燃物完全燃烧产生的热量=可燃物的物质的量×其标准燃烧热的绝对值
中和反应反应热 中和反应放出的热量=n(H2O)×中和反应反应热的绝对值
化学键的变化 ΔH=反应物的化学键断裂所吸收的能量之和-生成物的化学键形成所放出的能量之和
反应物和生成物的总能量 ΔH=E生成物-E反应物
应用体验
视角1能源的利用
1.计算填空:
(1)在25 ℃、101 kPa时,H2在1.00 mol O2中完全燃烧生成2.00 mol H2O(l)放出571.6 kJ的热量。H2的标准燃烧热ΔH= 。
(2)已知:CH4的标准燃烧热ΔH=-890 kJ·mol-1,H2和CH4混合气体112 L(标准状况下)完全燃烧生成CO2和液态水时放出的热量为3 695 kJ,则混合气体中H2和CH4的体积比约为 。
-285.8 kJ·mol-1
1∶3
解析 (1)H2的标准燃烧热应以燃烧1 mol H2为标准,当H2完全燃烧生成2.00 mol H2O(l)时,需燃烧2.00 mol H2,故H2的标准燃烧热
(2)设混合气体中H2和CH4的物质的量分别为x和y,则有:
解得:x≈1.25 mol,y≈3.75 mol
则V(H2)∶V(CH4)=1∶3。
归纳总结 混合物燃烧的相关计算
(1)利用标准燃烧热求混合物组成,常见的方法有列方程组法、十字交叉法、估算法。其中十字交叉法是利用两组混合物平均量与组分量计算的一种简便方法。
(2)求混合物燃烧所放出的热量时,应首先根据混合物的比例,求出各组分的物质的量,再根据对应的热化学方程式求出各组分放出的热量,最后求放出的总热量。基本思路是“先分后合”,即先分开求热量,再将热量加起来得总热量。
2.能源与可持续发展密切相关。下列说法正确的是( )
A.直接开采的化石燃料完全燃烧不会造成大气污染
B.从海洋中开采的“可燃冰”释放出的可燃性气体与天然气成分相同
C.二氧化碳、水通过人工光合作用生成有机化合物时放出能量
D.“干热岩”(温度大于200 ℃的高温岩体)是最具应用价值和利用潜力的清洁能源,该能源属于化石能源
B
解析 化石燃料中含有硫等元素,完全燃烧会生成二氧化硫,会形成酸雨,造成大气污染,A项错误;可燃冰的主要成分是甲烷水合物,“可燃冰”释放出的可燃性气体是甲烷,天然气的主要成分也是甲烷,B项正确;二氧化碳、水通过人工光合作用生成有机化合物需要吸收能量,C项错误;“干热岩”是一种新兴的地热能,自身具有较高的温度,能向外释放能量,不属于化石能源,D项错误。
3.已知1 mol燃料完全燃烧的数据分别为
燃料 一氧化碳 甲烷 异辛烷(C8H18) 乙醇
ΔH -283.0kJ·mol-1 -890.3kJ·mol-1 -5 461.0kJ·mol-1 -1 366.8kJ·mol-1
使用上述燃料最能体现“低碳经济”理念的是( )
A.一氧化碳 B.甲烷 C.异辛烷 D.乙醇
B
解析 低碳经济即尽可能地减少煤炭、石油等高碳能源消耗,减少温室气体排放,达到经济社会发展与生态环境保护双赢的一种经济发展形态。即每生成1 mol二氧化碳时,放出热量最多的物质符合题意,异辛烷(C8H18)为
4.(2023河北任丘一中高二期末)以太阳能为热源,热化学硫碘循环分解水是一种高效、环保的制氢方法,其流程图如下:
相关反应的热化学方程式为
反应Ⅰ:SO2(g)+I2(g)+2H2O(l) ══ 2HI(aq)+H2SO4(aq) ΔH1=-213 kJ·mol-1
反应Ⅱ:H2SO4(aq) ══ SO2(g)+H2O(l)+ O2(g) ΔH2=327 kJ·mol-1
反应Ⅲ:2HI(aq) ══ H2(g)+I2(g) ΔH3=172 kJ·mol-1
下列说法不正确的是( )
A.该过程实现了太阳能到化学能的转化
B.SO2和I2对总反应起到了催化剂的作用
C.总反应的热化学方程式为2H2O(l) ══ 2H2(g)+O2(g) ΔH=286 kJ·mol-1
D.该过程使水分解制氢反应更加容易发生,但总反应的ΔH不变
C
解析 由图可知利用太阳能使化学反应发生,则太阳能转化为化学能,A正确;由图可知总反应为水分解生成氧气和氢气,则SO2和I2对总反应起到了催化剂的作用,B正确;由盖斯定律可知,Ⅰ+Ⅱ+Ⅲ得到H2O(l) ══ H2(g)+
O2(g) ΔH=(-213 kJ·mol-1)+327 kJ·mol-1+172 kJ·mol-1=286 kJ·mol-1,C错误;ΔH只与反应的始态和终态有关,与反应途径无关,D正确。
视角2反应热的相关计算
5.(2023河北邢台南和区一中高二期中)已知:反应①C(s)+H2O(g) ══ CO(g)+H2(g) ΔH1=131.5 kJ·mol-1;反应②CH4(g)+H2O(g) ══ CO(g)+3H2(g) ΔH2=205.9 kJ·mol-1。在反应CH4(g) ══ C(s)+2H2(g) ΔH中,1 mol C(s)成键释放的热量为709.6 kJ,C—H键的键能为414 kJ·mol-1,则H—H键的键能为( )
A.436 kJ·mol-1 B.436 kJ
C.872 kJ·mol-1 D.872 kJ
A
解析 根据盖斯定律可知,反应②-反应①可得到CH4(g) ══ C(s)+2H2(g),对应焓变ΔH=ΔH2-ΔH1=205.9 kJ·mol-1-131.5 kJ·mol-1=74.4 kJ·mol-1;又因为ΔH=4E(C—H)-E(C)-2E(H—H),所以H—H键的键能E(H—H)=
6.如图为卤素单质(X2)和H2反应的转化过程,相关说法不正确的是( )
A.HX(g) ══ H(g)+X(g) ΔH>0
B.生成HX的反应热与途径无关,ΔH1=ΔH2+ΔH3
C.过程中:H(g)+Cl(g) ══ HCl(g)
ΔH(HCl),H(g)+Br(g) ══ HBr(g) ΔH(HBr),则ΔH(HCl)>ΔH(HBr)
D.化学键在断裂和形成时的能量变化是化学反应中能量变化的主要原因
C
解析 化学键断裂时要吸收能量,即HX(g) ══ H(g)+X(g) ΔH>0,A项正确;依据盖斯定律进行分析,反应的焓变与始态和终态有关,与途径无关,ΔH1=ΔH2+ΔH3,B项正确;非金属性:Cl>Br,非金属性越强,其单质和氢气化合放热越大,而在热化学方程式中,放热反应的焓变为负值,则ΔH(HCl)<ΔH(HBr),C项错误;化学键断裂时要吸收能量,形成时要放出能量,即化学键的变化是化学反应中能量变化的主要原因,D项正确。
7.(1)选择性催化还原(SCR)法可实现烟气脱硝,它是以NH3为还原剂,将烟气中的NOx还原生成N2和H2O。
已知:N2(g)+O2(g) ══ 2NO(g) ΔH=180.6 kJ·mol-1
N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1
2H2(g)+O2(g) ══ 2H2O(g) ΔH=-483.6 kJ·mol-1
则4NO(g)+4NH3(g)+O2(g)══4N2(g)+6H2O(g) ΔH= kJ·mol-1。
(2)FeSO4可转化为FeCO3,FeCO3在空气中加热可制得铁系氧化物材料。
已知25 ℃、101 kPa时:
4Fe(s)+3O2(g) ══ 2Fe2O3(s) ΔH=-1 648 kJ·mol-1
C(s)+O2(g) ══ CO2(g) ΔH=-393 kJ·mol-1
2Fe(s)+2C(s)+3O2(g) ══ 2FeCO3(s) ΔH=-1 480 kJ·mol-1
FeCO3在空气中加热制得Fe2O3的热化学方程式是
。
解析 (1)将已知的3个热化学方程式依次编号为①②③,依据盖斯定律,③×3-②×2-①×2得4NO(g)+4NH3(g)+O2(g) ══ 4N2(g)+6H2O(g)
ΔH=-1 627.2 kJ·mol-1。
(2)将3个已知的热化学方程式依次编号为①②③,根据盖斯定律,
①+4×②-2×③可得所求的热化学方程式:4FeCO3(s)+O2(g) ══ 2Fe2O3(s)+4CO2(g),其反应热ΔH=-1 648 kJ·mol-1+4×(-393 kJ·mol-1)-2×
(-1 480 kJ·mol-1)=-260 kJ·mol-1。
答案 (1)-1 627.2 (2)4FeCO3(s)+O2(g) ══ 2Fe2O3(s)+4CO2(g)
ΔH=-260 kJ·mol-1
本 课 结 束
专题1
第一单元 第3课时 能源的充分利用
基础落实·必备知识全过关
重难探究·能力素养全提升
目录索引
素养 目标 1.能举例说明化学在解决能源危机中的重要作用。能分析能源的利用对自然环境和社会发展的影响,培养科学态度与社会责任的化学核心素养。
2.能综合考虑化学变化中的物质变化和能量变化来分析、解决实际问题,如煤炭的综合利用等。
3.通过交流讨论认识标准燃烧热的概念,掌握表示标准燃烧热的热化学方程式的书写和有关标准燃烧热的简单计算,培养学生的计算能力。
基础落实·必备知识全过关
一、标准燃烧热和热值
1.标准燃烧热
在 kPa下, mol物质完全燃烧的反应热叫做该物质的标准燃烧热。完全燃烧是指物质中含有的氮元素转化为 ,氢元素转化为 ,碳元素转化为 。
2.标准燃烧热的计算
由标准燃烧热的定义可知:101 kPa时,可燃物完全燃烧产生的热量=可燃物的物质的量×其标准燃烧热,即Q放=n(可燃物)×|ΔH|;或变换一下求物质的
标准燃烧热: 。此公式中的ΔH是指物质的标准燃烧热,而不是指一般反应的反应热。
101
1
N2(g)
H2O(l)
CO2(g)
3.热值 标准燃烧热较大的燃料,其热值不一定大
物质完全燃烧的反应热叫做该物质的热值。
4.能源的分类
分类依据 种类 举例
转换过程 一次能源 太阳能、风能、化石燃料、地热能、潮汐能等
二次能源 电能、氢能、石油加工产品、煤的加工产品等
使用历史 常规能源 化石燃料
新能源 太阳能、风能、核能、氢能、生物质能等
能源性质 可再生能源 太阳能、风能、潮汐能、生物质能
不可再生能源 化石燃料、核能
1 g
5.化石燃料和新能源
(1)化石燃料的弊端:蕴藏量有限、不能再生;利用率低;污染环境,特别是会造成 和 。
(2)太阳能是能量巨大的清洁能源,缺点是能量密度小,受地域和季节的影响大。
(3)氢能有三大优点:一是燃烧热值高,二是 ,三是
。缺点是储存、运输困难。
(4)能源危机的解决方法:开发 ,节约 ,提高能源的 。
酸雨
温室效应
资源丰富
无毒、无污染
新能源
现有能源
利用率
教材阅读想一想阅读教材表1-3上面正文部分
思考:理解标准燃烧热的定义时需注意哪些事项
提示 标准燃烧热研究的条件是101 kPa;可燃物的用量是1 mol;反应的程度是完全燃烧,产物是指定稳定产物。
易错辨析判一判
(1)硫完全燃烧生成二氧化硫时,放出的热量为硫的标准燃烧热。( )
(2)在101 kPa时,1 mol碳燃烧所放出的热量为碳的标准燃烧热。( )
(3)在101 kPa时,由2CO(g)+O2(g) ══ 2CO2(g) ΔH=-566 kJ·mol-1可知,CO的标准燃烧热ΔH=-283 kJ·mol-1。( )
(4)乙炔的标准燃烧热ΔH=-1 299.6 kJ·mol-1,则2C2H2(g)+5O2(g) ══ 4CO2(g)+2H2O(g)反应的ΔH=-2 599.2 kJ·mol-1。( )
×
提示 101 kPa时1 mol硫完全燃烧,放出的热量为标准燃烧热。
×
提示 必须完全燃烧。
√
×
提示 氢元素必须转化为H2O(l)。
二、反应热的计算
1.利用热化学方程式计算
25 ℃、101 kPa,使1.0 g Na与足量Cl2反应,生成NaCl晶体并放出17.87 kJ热量,则生成1 mol NaCl的反应热ΔH为 。
2.利用标准燃烧热计算
乙醇的标准燃烧热为ΔH=-1 366.8 kJ·mol-1,则25 ℃、101 kPa时1 kg乙醇完全燃烧放出的热量约为 。
-411.01 kJ·mol-1
2.971×104 kJ
3.利用盖斯定律计算
已知:温度过高时,WO2(s)转变为WO2(g)
①WO2(s)+2H2(g) W(s)+2H2O(g)
ΔH1
②WO2(g)+2H2(g) W(s)+2H2O(g)
ΔH2
则WO2(s)WO2(g)的ΔH= 。
ΔH1-ΔH2
教材阅读想一想阅读教材“能源的充分利用”中的“选择决策”
思考:已知CO的标准燃烧热ΔH=-283.0 kJ·mol-1,CH4的标准燃烧热
ΔH=-890.3 kJ·mol-1,将1 mol CO和3 mol CH4组成的混合气体充分燃烧,释放多少热量
提示 释放的热量为283.0 kJ·mol-1×1 mol+890.3 kJ·mol-1×3 mol
=2 953.9 kJ。
易错辨析判一判
(1)CO(g)的标准燃烧热ΔH=-283.0 kJ·mol-1,则2 mol CO(g)充分燃烧,放出热量566.0 kJ。( )
√
×
×
提示 可逆反应不能进行彻底,则放出的热量小于98.7 kJ。
重难探究·能力素养全提升
探究一 标准燃烧热
情境探究
能源是国民经济和社会发展的重要物质基础,我国目前使用的主要能源来自煤、石油、天然气等化石燃料,例如,乙烯、丙烷、甲醇、汽油、柴油均来自石油的加工。甲醇是化肥、制药和煤炭等行业生产的副产品,也可利用化工原料合成,来源极为广泛,且价格低廉。
(1)已知甲醇的标准燃烧热ΔH=-726.5 kJ·mol-1。请写出甲醇燃烧的热化学方程式。
提示 CH3OH(l)+ O2(g) ══ CO2(g)+2H2O(l)ΔH=-726.5 kJ·mol-1。
(2)已知丙烷的标准燃烧热ΔH=-2 220 kJ·mol-1,若一定量的丙烷完全燃烧后生成1.8 g液态水,则放出的热量为多少
提示 丙烷的分子式是C3H8,1 mol丙烷完全燃烧会产生4 mol水,则丙烷完全燃烧产生1.8 g水,消耗丙烷的物质的量是0.025 mol,所以反应放出的热量是2 220 kJ·mol-1×0.025 mol=55.5 kJ。
方法突破
1.对标准燃烧热定义的理解
2.反应热与标准燃烧热的比较
类型 反应热 标准燃烧热
能量的变化 放热或吸热 放热
ΔH的大小 放热时,ΔH<0; 吸热时,ΔH>0 ΔH<0
反应物的量 不限 1 mol纯物质
生成物 无要求 完全燃烧的产物如
N→N2(g)
C→CO2(g)
H→H2O(l)
应用体验
视角1标准燃烧热的理解
1.25 ℃、101 kPa下,碳、氢气、甲烷和葡萄糖的标准燃烧热ΔH依次是-393.5 kJ·mol-1、-285.8 kJ·mol-1、-890.3 kJ·mol-1、-2 800 kJ·mol-1,则下列热化学方程式正确的是( )
A.C(s)+ O2(g) ══ CO(g) ΔH=-393.5 kJ·mol-1
B.2H2(g)+O2(g) ══ 2H2O(g) ΔH=-571.6 kJ·mol-1
C.CH4(g)+2O2(g) ══ CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
D. C6H12O6(s)+3O2(g) ══ 3CO2(g)+3H2O(l) ΔH=-1 400 kJ·mol-1
D
解析 根据标准燃烧热的定义中物质完全燃烧可知,C元素转化为CO2(g),H元素转化为H2O(l),只有D项正确。
2.下列关于标准燃烧热的说法正确的是( )
A.1 mol物质燃烧时放出的热量
B.常温下,可燃物燃烧时放出的热量
C.在1.01×105 Pa时,1 mol纯物质完全燃烧生成指定产物时所放出的热量
D.与化学方程式中物质化学式前的化学计量数有关
C
解析 依据标准燃烧热的定义可知,C项正确。
3.以下几个热化学方程式,能表示有关物质燃烧时的标准燃烧热的热化学方程式是( )
A.C(s)+ O2(g) ══ CO(g) ΔH=110.5 kJ·mol-1
B.C(s)+O2(g) ══ CO2(g) ΔH=-393.5 kJ·mol-1
C.2H2(g)+O2(g) ══ 2H2O(l) ΔH=-571.6 kJ·mol-1
D.H2(g)+ O2(g) ══ H2O(g) ΔH=-241.8 kJ·mol-1
B
解析 要考虑两个要素:1 mol纯物质和完全燃烧。
视角2标准燃烧热的计算及应用
4.(2023河北张家口部分学校高二期中)已知碳的标准燃烧热ΔH=-393.5 kJ·mol-1,氢气的标准燃烧热ΔH=-285.8 kJ·mol-1,一氧化碳的标准燃烧热ΔH=-283.0 kJ·mol-1。某同学发现在灼热的煤炭上洒少量水,煤炉中会产生淡蓝色火焰,煤炭燃烧更旺。下列有关说法正确的是( )
A.表示氢气标准燃烧热的热化学方程式为H2(g)+ O2(g) ══ H2O(g) ΔH=285.8 kJ·mol-1
B.反应C(s)+ O2(g) ══ CO(g)的ΔH<-393.5 kJ·mol-1
C.“煤炭燃烧得更旺”是因为少量固体碳单质与水反应生成了可燃性气体
D.C(s)+H2O(g) ══ CO(g)+H2(g) ΔH=175.3 kJ·mol-1
C
5.油酸甘油酯(相对分子质量为884)在人体内代谢时可发生如下反应:
C57H104O6(s)+80O2(g) ══ 57CO2(g)+52H2O(l)。
已知1 kg该化合物完全燃烧生成液态水时放出3.8×104 kJ热量,则油酸甘油酯的标准燃烧热( )
A.ΔH=-3.8×104 kJ·mol-1 B.ΔH=3.8×104 kJ·mol-1
C.ΔH=-3.4×104 kJ·mol-1 D.ΔH=3.4×104 kJ·mol-1
C
解析 油酸甘油酯的标准燃烧热ΔH= ×884 g·mol-1≈-3.4×104 kJ·mol-1。
探究二 能源的利用及反应热的计算
情境探究
在科学研究和化工生产中,对化学反应过程中热量的利用、化学反应条件的控制等都涉及反应热的计算问题。反应热的计算有哪些常见题型呢
(1)有关反应物和生成物的键能的计算。
已知反应4HCl+O2 ══ 2Cl2+2H2O中,4 mol HCl被氧化放出115.6 kJ的热量,则断开1 mol H—O键与断开1 mol H—Cl键所需能量相差为多少kJ
提示 由已知可写出反应的热化学方程式:4HCl(g)+O2(g) ══ 2Cl2(g)+2H2O(g) ΔH=-115.6 kJ·mol-1,由于焓变=反应物总键能-生成物总键能,则4E(H—Cl)+498 kJ·mol-1-[2×243 kJ·mol-1+4×E(H—O)]=-115.6 kJ·mol-1,则E(H—O)-E(H—Cl)=31.9 kJ·mol-1,所以断开1 mol H—O键与断开1 mol H—Cl键所需能量相差为31.9 kJ。
(2)有关热化学方程式的计算。
已知:C(s)+O2(g) ══ CO2(g) ΔH=-393.5 kJ·mol-1;2H2(g)+O2(g) ══ 2H2O(l) ΔH=-571.6 kJ·mol-1。现有0.2 mol的炭粉和氢气组成的悬浮气,该混合物在氧气中完全燃烧,共放出63.622 kJ热量,则混合物中C与H2的物质的量之比是多少
提示 设混合物中炭粉的物质的量为x mol,氢气的物质的量为y mol,则
解得:x=0.06,y=0.14,则混合物中C和H2的物质的量之比为3∶7。
方法突破
反应热的计算
计算依据 计算方法
热化学方程式 热化学方程式可以移项同时改变正负号,各项的化学计量数包括ΔH的数值可以同时扩大或缩小相同的倍数
标准燃烧热 可燃物完全燃烧产生的热量=可燃物的物质的量×其标准燃烧热的绝对值
中和反应反应热 中和反应放出的热量=n(H2O)×中和反应反应热的绝对值
化学键的变化 ΔH=反应物的化学键断裂所吸收的能量之和-生成物的化学键形成所放出的能量之和
反应物和生成物的总能量 ΔH=E生成物-E反应物
应用体验
视角1能源的利用
1.计算填空:
(1)在25 ℃、101 kPa时,H2在1.00 mol O2中完全燃烧生成2.00 mol H2O(l)放出571.6 kJ的热量。H2的标准燃烧热ΔH= 。
(2)已知:CH4的标准燃烧热ΔH=-890 kJ·mol-1,H2和CH4混合气体112 L(标准状况下)完全燃烧生成CO2和液态水时放出的热量为3 695 kJ,则混合气体中H2和CH4的体积比约为 。
-285.8 kJ·mol-1
1∶3
解析 (1)H2的标准燃烧热应以燃烧1 mol H2为标准,当H2完全燃烧生成2.00 mol H2O(l)时,需燃烧2.00 mol H2,故H2的标准燃烧热
(2)设混合气体中H2和CH4的物质的量分别为x和y,则有:
解得:x≈1.25 mol,y≈3.75 mol
则V(H2)∶V(CH4)=1∶3。
归纳总结 混合物燃烧的相关计算
(1)利用标准燃烧热求混合物组成,常见的方法有列方程组法、十字交叉法、估算法。其中十字交叉法是利用两组混合物平均量与组分量计算的一种简便方法。
(2)求混合物燃烧所放出的热量时,应首先根据混合物的比例,求出各组分的物质的量,再根据对应的热化学方程式求出各组分放出的热量,最后求放出的总热量。基本思路是“先分后合”,即先分开求热量,再将热量加起来得总热量。
2.能源与可持续发展密切相关。下列说法正确的是( )
A.直接开采的化石燃料完全燃烧不会造成大气污染
B.从海洋中开采的“可燃冰”释放出的可燃性气体与天然气成分相同
C.二氧化碳、水通过人工光合作用生成有机化合物时放出能量
D.“干热岩”(温度大于200 ℃的高温岩体)是最具应用价值和利用潜力的清洁能源,该能源属于化石能源
B
解析 化石燃料中含有硫等元素,完全燃烧会生成二氧化硫,会形成酸雨,造成大气污染,A项错误;可燃冰的主要成分是甲烷水合物,“可燃冰”释放出的可燃性气体是甲烷,天然气的主要成分也是甲烷,B项正确;二氧化碳、水通过人工光合作用生成有机化合物需要吸收能量,C项错误;“干热岩”是一种新兴的地热能,自身具有较高的温度,能向外释放能量,不属于化石能源,D项错误。
3.已知1 mol燃料完全燃烧的数据分别为
燃料 一氧化碳 甲烷 异辛烷(C8H18) 乙醇
ΔH -283.0kJ·mol-1 -890.3kJ·mol-1 -5 461.0kJ·mol-1 -1 366.8kJ·mol-1
使用上述燃料最能体现“低碳经济”理念的是( )
A.一氧化碳 B.甲烷 C.异辛烷 D.乙醇
B
解析 低碳经济即尽可能地减少煤炭、石油等高碳能源消耗,减少温室气体排放,达到经济社会发展与生态环境保护双赢的一种经济发展形态。即每生成1 mol二氧化碳时,放出热量最多的物质符合题意,异辛烷(C8H18)为
4.(2023河北任丘一中高二期末)以太阳能为热源,热化学硫碘循环分解水是一种高效、环保的制氢方法,其流程图如下:
相关反应的热化学方程式为
反应Ⅰ:SO2(g)+I2(g)+2H2O(l) ══ 2HI(aq)+H2SO4(aq) ΔH1=-213 kJ·mol-1
反应Ⅱ:H2SO4(aq) ══ SO2(g)+H2O(l)+ O2(g) ΔH2=327 kJ·mol-1
反应Ⅲ:2HI(aq) ══ H2(g)+I2(g) ΔH3=172 kJ·mol-1
下列说法不正确的是( )
A.该过程实现了太阳能到化学能的转化
B.SO2和I2对总反应起到了催化剂的作用
C.总反应的热化学方程式为2H2O(l) ══ 2H2(g)+O2(g) ΔH=286 kJ·mol-1
D.该过程使水分解制氢反应更加容易发生,但总反应的ΔH不变
C
解析 由图可知利用太阳能使化学反应发生,则太阳能转化为化学能,A正确;由图可知总反应为水分解生成氧气和氢气,则SO2和I2对总反应起到了催化剂的作用,B正确;由盖斯定律可知,Ⅰ+Ⅱ+Ⅲ得到H2O(l) ══ H2(g)+
O2(g) ΔH=(-213 kJ·mol-1)+327 kJ·mol-1+172 kJ·mol-1=286 kJ·mol-1,C错误;ΔH只与反应的始态和终态有关,与反应途径无关,D正确。
视角2反应热的相关计算
5.(2023河北邢台南和区一中高二期中)已知:反应①C(s)+H2O(g) ══ CO(g)+H2(g) ΔH1=131.5 kJ·mol-1;反应②CH4(g)+H2O(g) ══ CO(g)+3H2(g) ΔH2=205.9 kJ·mol-1。在反应CH4(g) ══ C(s)+2H2(g) ΔH中,1 mol C(s)成键释放的热量为709.6 kJ,C—H键的键能为414 kJ·mol-1,则H—H键的键能为( )
A.436 kJ·mol-1 B.436 kJ
C.872 kJ·mol-1 D.872 kJ
A
解析 根据盖斯定律可知,反应②-反应①可得到CH4(g) ══ C(s)+2H2(g),对应焓变ΔH=ΔH2-ΔH1=205.9 kJ·mol-1-131.5 kJ·mol-1=74.4 kJ·mol-1;又因为ΔH=4E(C—H)-E(C)-2E(H—H),所以H—H键的键能E(H—H)=
6.如图为卤素单质(X2)和H2反应的转化过程,相关说法不正确的是( )
A.HX(g) ══ H(g)+X(g) ΔH>0
B.生成HX的反应热与途径无关,ΔH1=ΔH2+ΔH3
C.过程中:H(g)+Cl(g) ══ HCl(g)
ΔH(HCl),H(g)+Br(g) ══ HBr(g) ΔH(HBr),则ΔH(HCl)>ΔH(HBr)
D.化学键在断裂和形成时的能量变化是化学反应中能量变化的主要原因
C
解析 化学键断裂时要吸收能量,即HX(g) ══ H(g)+X(g) ΔH>0,A项正确;依据盖斯定律进行分析,反应的焓变与始态和终态有关,与途径无关,ΔH1=ΔH2+ΔH3,B项正确;非金属性:Cl>Br,非金属性越强,其单质和氢气化合放热越大,而在热化学方程式中,放热反应的焓变为负值,则ΔH(HCl)<ΔH(HBr),C项错误;化学键断裂时要吸收能量,形成时要放出能量,即化学键的变化是化学反应中能量变化的主要原因,D项正确。
7.(1)选择性催化还原(SCR)法可实现烟气脱硝,它是以NH3为还原剂,将烟气中的NOx还原生成N2和H2O。
已知:N2(g)+O2(g) ══ 2NO(g) ΔH=180.6 kJ·mol-1
N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1
2H2(g)+O2(g) ══ 2H2O(g) ΔH=-483.6 kJ·mol-1
则4NO(g)+4NH3(g)+O2(g)══4N2(g)+6H2O(g) ΔH= kJ·mol-1。
(2)FeSO4可转化为FeCO3,FeCO3在空气中加热可制得铁系氧化物材料。
已知25 ℃、101 kPa时:
4Fe(s)+3O2(g) ══ 2Fe2O3(s) ΔH=-1 648 kJ·mol-1
C(s)+O2(g) ══ CO2(g) ΔH=-393 kJ·mol-1
2Fe(s)+2C(s)+3O2(g) ══ 2FeCO3(s) ΔH=-1 480 kJ·mol-1
FeCO3在空气中加热制得Fe2O3的热化学方程式是
。
解析 (1)将已知的3个热化学方程式依次编号为①②③,依据盖斯定律,③×3-②×2-①×2得4NO(g)+4NH3(g)+O2(g) ══ 4N2(g)+6H2O(g)
ΔH=-1 627.2 kJ·mol-1。
(2)将3个已知的热化学方程式依次编号为①②③,根据盖斯定律,
①+4×②-2×③可得所求的热化学方程式:4FeCO3(s)+O2(g) ══ 2Fe2O3(s)+4CO2(g),其反应热ΔH=-1 648 kJ·mol-1+4×(-393 kJ·mol-1)-2×
(-1 480 kJ·mol-1)=-260 kJ·mol-1。
答案 (1)-1 627.2 (2)4FeCO3(s)+O2(g) ══ 2Fe2O3(s)+4CO2(g)
ΔH=-260 kJ·mol-1
本 课 结 束
