1.2.1 原电池的工作原理 课件(共41张PPT) 2023-2024学年高二化学苏教版选择性必修1
文档属性
| 名称 | 1.2.1 原电池的工作原理 课件(共41张PPT) 2023-2024学年高二化学苏教版选择性必修1 |

|
|
| 格式 | pptx | ||
| 文件大小 | 2.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-08 14:31:50 | ||
图片预览










文档简介
(共41张PPT)
专题1
第二单元 第1课时 原电池的工作原理
基础落实·必备知识全过关
重难探究·能力素养全提升
目录索引
素养目标 1.能认识化学能与电能相互转化的实际意义及其重要应用。以铜锌原电池为例,从宏观和微观的角度分析理解原电池的工作原理,能正确判断原电池的正极和负极,会书写电极反应式。
2.能设计简单的原电池,促进证据推理与模型认知的核心素养的发展。
基础落实·必备知识全过关
一、原电池的工作原理
1.原电池
(1)定义:将 转化为 的装置。
(2)构成条件:
①两个 不同的电极(材料可以是 或导电的非金属)。
石墨
② 溶液。
③形成 回路(或两极直接接触)。
④能自发地发生氧化还原反应。
化学能
电能
活泼性
金属
电解质
闭合
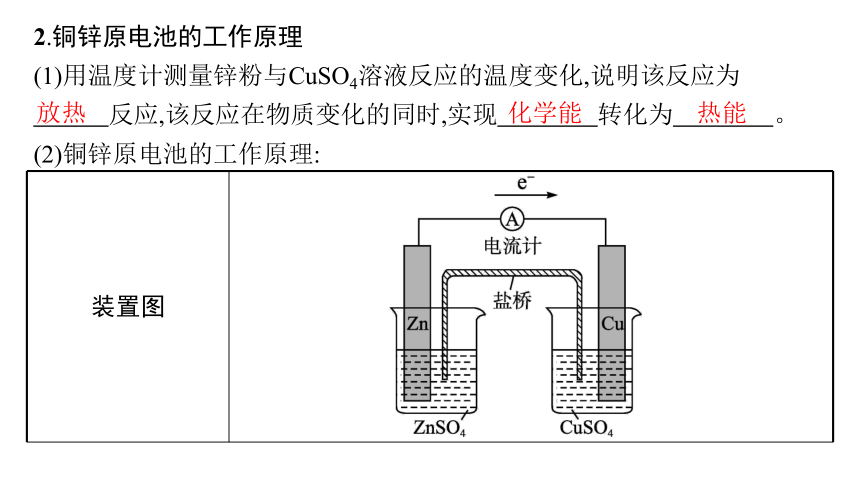
2.铜锌原电池的工作原理
(1)用温度计测量锌粉与CuSO4溶液反应的温度变化,说明该反应为
反应,该反应在物质变化的同时,实现 转化为 。
(2)铜锌原电池的工作原理:
装置图
放热
化学能
热能
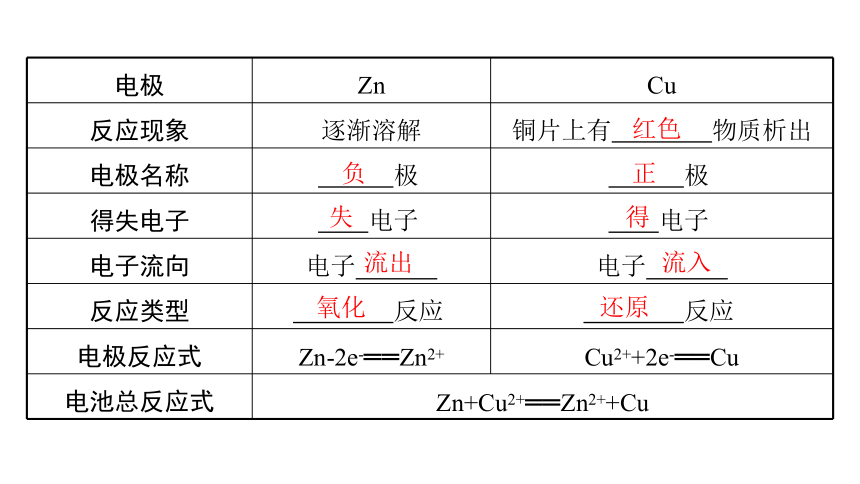
电极 Zn Cu
反应现象 逐渐溶解 铜片上有 物质析出
电极名称 极 极
得失电子 电子 电子
电子流向 电子 电子
反应类型 反应 反应
电极反应式 Zn-2e-══Zn2+ Cu2++2e-══Cu
电池总反应式 Zn+Cu2+══Zn2++Cu
红色
负
正
失
得
流出
流入
氧化
还原
3.盐桥(以铜锌原电池为例)
(1)成分:含有KCl饱和溶液的琼脂。
(2)离子移动方向:Cl-移向 溶液(负极区),K+移向 溶液(正极区)。
(3)盐桥的作用:①使两个半电池形成通路,并保持两溶液的电中性。②避免电极与电解质溶液反应,最大程度地将化学能转化为电能。
ZnSO4
CuSO4
教材阅读想一想阅读教材“原电池的工作原理”中的第1个“实验探究”
思考:可以将铜锌原电池中的Cu电极换成石墨吗 为什么
提示 可以;因为Cu在该原电池中起到传递电子的作用,其本身并未参与电极反应,所以可以把Cu电极换成能导电的石墨。
易错辨析判一判
(1)原电池中电子流出的一极是正极,发生氧化反应。( )
(2)原电池中的盐桥是为了连通电路,也可用金属导线代替。( )
(3)在原电池中阳离子移向正极,阴离子移向负极。( )
(4)铜、锌与硫酸组成的原电池中,锌为负极,质量减少,铜为正极,质量不变。
( )
×
提示 电子流出的一极为负极。
×
提示 离子不能在导线中移动,电子不能在溶液中移动。
√
√
二、原电池原理的应用
1.比较金属活动性强弱
对于酸性电解质,一般是负极金属的活动性 ,正极金属的活动性 。
例如:a和b两种金属,用导线连接后插入稀硫酸中,观察到a极溶解,b极上有气泡产生,则a为 极,b为 极,金属活动性:a b。
2.加快氧化还原反应的速率
构成原电池的反应速率比直接接触的反应速率 。例如:实验室制取氢气时,粗锌比纯锌与稀硫酸反应速率 ;或向溶液中滴入几滴硫酸铜溶液,产生氢气的速率 。
较强
较弱
负
正
>
快
快
加快
3.设计化学电池
(1)理论上,任何自发的 反应都可以设计成原电池。
(2)外电路: 性较强的物质在负极上失去电子, 性较强的物质在正极上得到电子。
(3)内电路:将两电极浸入电解质溶液中,阴、阳离子 移动。
氧化还原
还原
氧化
定向
教材阅读想一想阅读教材“原电池的工作原理”中的第2个“实验探究”
思考:将氧化还原反应Fe+Cu2+ ══ Fe2++Cu设计成原电池,画出原电池装置图,并标出电极材料及电解质溶液(要求:画出两个原电池装置,一个不带盐桥,另一个带有盐桥)。
提示
易错辨析判一判
(1)Mg-Al形成的原电池,Mg一定作为负极。( )
(2)实验室制备H2时,用粗锌(含Cu、Fe等)代替纯锌与盐酸反应效果更佳。
( )
(3)CaO+H2O ══ Ca(OH)2是放热反应,可设计成原电池。( )
×
提示 当电解质溶液为NaOH溶液时,Al作为负极。
√
提示 该反应不是氧化还原反应,不能设计成原电池。
×
重难探究·能力素养全提升
探究一 原电池工作原理
情境探究
市售“热敷贴”的主要成分是铁屑、炭粉、木屑与少量NaCl、水等。它在使用之前与空气隔绝,使用时开启塑料袋上的小孔,轻轻揉搓就会有热量放出,使用完后还会发现有铁锈生成。
(1)“热敷贴”中氯化钠起到什么作用 炭粉的主要作用是什么
(2)原电池中的两极是如何规定的 分别发生什么反应
提示 氯化钠溶于水形成电解质溶液。炭粉作原电池的正极材料,与铁、氯化钠溶液构成原电池,从而加速铁的氧化。
提示 在原电池中,发生氧化反应的一极为负极,发生还原反应的一极为正极。
(3)原电池中电子的流向如何 电子能否通过电解质溶液
(4)在带有盐桥的原电池中,盐桥中的阴、阳离子如何移动
(5)试写出“热敷贴”中正、负极的电极反应式。并归纳原电池的电极反应式的书写思路。
提示 在原电池中,电子由负极沿导线流向正极,电子不能通过电解质溶液。
提示 盐桥中的阴离子向着原电池的负极移动,阳离子向着正极移动。
提示 负极:Fe-2e- ══ Fe2+;正极:O2+4e-+2H2O ══ 4OH-。书写思路:先判断原电池的正、负极,即找出氧化剂和还原剂,再结合电解质溶液的酸碱性确定还原产物和氧化产物,然后根据电荷守恒、原子守恒等书写并配平电极反应式。
方法突破
1.原电池正、负极的判断
2.原电池的电极材料“两注意”
(1)注意电解质溶液对电极类型的影响
一般较活泼金属作负极,较不活泼的金属或导电的非金属作正极,但若是较不活泼的金属发生的氧化还原反应设计的原电池,则是较不活泼的金属作负极。例如:镁铝电极在稀硫酸中构成原电池,镁为负极,铝为正极;但若以氢氧化钠溶液为电解质溶液,则铝为负极,镁为正极。
(2)注意电极材料是否参与反应
负极材料不一定参与反应,如燃料电池;负极和正极材料都参与反应,如铅蓄电池。
3.原电池中阴、阳离子及电子的移动方向
(1)外电路:电子由负极流向正极,与电流方向相反。
(2)内电路:阴离子移向负极,阳离子移向正极。具体情况如图示:
应用体验
视角1原电池的原理
1.某兴趣小组同学利用氧化还原反应:
2KMnO4+10FeSO4+8H2SO4 ══2MnSO4+5Fe2(SO4)3+
K2SO4+8H2O设计如下原电池,
盐桥中装有饱和K2SO4溶液。下列说法正确的是( )
A.b电极上发生还原反应
B.外电路电子的流向是从a到b
C.电池工作时,盐桥中的 移向甲烧杯
D.a电极上发生的反应为 +8H++5e- ══ Mn2++4H2O
D
解析 根据化学方程式和图示判断,b电极上是FeSO4发生氧化反应,为负极,A项错误;b为负极,a为正极,电子从b流向a,B项错误;盐桥中的 移向乙烧杯,C项错误;a极上发生还原反应,Mn元素的化合价降低,电极反应式为
+8H++5e- ══ Mn2++4H2O,D项正确。
2.下列有关原电池的电极名称的叙述错误的是( )
A.发生氧化反应的一极为负极
B.正极为电子流入的一极
C.比较不活泼的金属为负极
D.电流流出的一极为正极
C
解析 原电池中相对活泼的金属为负极,发生氧化反应;相对不活泼的金属(或非金属导体)为正极,正极上发生还原反应,且电解质类型影响电极类型。
视角2原电池的判断及电极反应式的书写
3.某小组为研究原电池原理,设计如图装置。下列叙述正确的是( )
A.若X为Fe,Y为Cu,铁为正极
B.若X为Fe,Y为Cu,在外电路电子由铜片流向铁片
C.若X为Fe,Y为C,碳棒上有红色固体析出
D.若X为Cu,Y为Zn,锌片发生还原反应
C
解析 Fe比Cu活泼,Fe作负极,故A错误;Fe作负极,在外电路电子从Fe流向Cu,故B错误;若X为Fe,Y为C,电解质溶液为硫酸铜溶液,则正极C上析出Cu,故C正确;Zn比Cu活泼,Zn作负极发生氧化反应,故D错误。
4.铜锌原电池(如图)工作时,下列叙述正确的是( )
A.正极反应式为Zn-2e- ══ Zn2+
B.电池总反应为Zn+Cu2+ ══ Zn2++Cu
C.在外电路中,电流从负极流向正极
D.盐桥中的K+移向ZnSO4溶液
B
解析 Zn为活泼金属,作负极,故Zn-2e- ══ Zn2+是负极反应式,A项错误;在外电路中,电流从正极流向负极,电子从负极流向正极,C项错误;盐桥中的K+移向消耗Cu2+的CuSO4溶液,D项错误。
5.Mg-H2O2电池可用于驱动无人驾驶的潜航器。该电池以海水为电解质溶液,示意图如下。该电池工作时,下列说法正确的是( )
A.Mg电极是该电池的正极,发生还原反应:
Mg2++2e- ══ Mg
B.石墨电极反应式为
H2O2+2e- ══ 2OH-
C.H2O2在石墨电极上发生氧化反应
D.溶液中Cl-向正极移动
B
解析 图示原电池中Mg为负极,发生氧化反应,Mg-2e- ══ Mg2+,A项错误;石墨作正极,H2O2得到电子,发生还原反应,H2O2+2e- ══ 2OH-,B项正确,C项错误;放电时,阴离子向负极移动,D项错误。
探究二 原电池原理的应用
情境探究
格林太太是位漂亮、开朗、乐观的妇女,当她开怀大笑的时候,人们可以发现她一口整齐洁白的牙齿中镶有两颗假牙:一颗是黄金的——这是她富有的标志;另一颗是不锈钢的——这是一次车祸后留下的痕迹。
令人百思不解的是,自从车祸以后,格林太太经常头痛、夜间失眠、心情烦躁……医生绞尽了脑汁,格林太太的病情仍未好转……
(1)请你根据所学知识帮格林太太诊断一下。
提示 牙齿中形成原电池,产生电流导致头痛,其中铁为负极,金为正极。
(2)锌片与稀硫酸反应时,加入少量CuSO4溶液能使产生H2的速率加快,试分析其原因。
提示 Zn与CuSO4反应生成的Cu覆盖在锌片表面,Zn、Cu、稀硫酸构成原电池,加快反应速率。
方法突破
设计原电池
设计思路 实例
以自发进行的氧化还原反应为基础 2FeCl3+Cu══2FeCl2+CuCl2
把氧化还原反应分解为氧化反应和还原反应两个半反应,从而确定电极反应 氧化反应(负极):Cu-2e-══Cu2+
还原反应(正极):2Fe3++2e-══2Fe2+
以两极反应为原理,确定电极材料及电解质溶液 负极铜和CuCl2溶液
正极碳(或铂)和FeCl3溶液
设计思路 实例
画出示意图
应用体验
视角1原电池的构成
1.一个原电池的总反应的离子方程式是Zn+Cu2+ ══ Zn2++Cu,该反应的原电池的正确组成是( )
选项 正极 负极 电解质溶液
A Zn Cu CuCl2溶液
B Cu Zn H2SO4溶液
C Cu Zn CuSO4溶液
D Mg Zn CuCl2溶液
C
解析 根据Zn+Cu2+ ══ Zn2++Cu知,Zn发生氧化反应,Zn-2e- ══ Zn2+,是电池负极;正极反应为Cu2++2e- ══ Cu,故正极材料可以是石墨或Cu等活动性弱于Zn的金属,电解质溶液应是可溶性铜盐溶液,C符合。
归纳总结 原电池的设计方法——“两极一液一连线”
(1)根据电池总反应式写出正极和负极的电极反应式。
(2)电极材料的选择:电池的电极必须导电。一般电池中的负极必须能够与电解质溶液反应,容易失去电子,因此负极一般是活泼的金属材料,所以正极和负极不能用同一种材料,两个电极可以是活泼性不同的两种金属或一种金属和一种非金属。
(3)电解质溶液的选择:电解质溶液为正极提供放电的物质,一般能够与负极材料发生氧化还原反应。
(4)形成闭合回路。
2.某电池的总反应为Fe+2Fe3+ ══ 3Fe2+,能实现该反应的原电池是( )
选项 正极 负极 电解质溶液
A Cu Fe FeCl3溶液
B C Fe Fe(NO3)2溶液
C Fe Zn Fe2(SO4)3溶液
D Ag Fe CuSO4溶液
A
解析 能实现反应Fe+2Fe3+ ══ 3Fe2+的原电池应符合以下条件:①负极为Fe,正极材料的活动性比Fe差;②电解质溶液应为含Fe3+的溶液,B、D两项电解质溶液选错;C项负极材料选错。
视角2原电池原理的应用
3.环保部门使用的SO2传感器工作原理如图所示,该装置可监测大气中SO2的含量。下列判断正确的是( )
A.该装置的Pt电极为负极
B.电流是从V2O5电极流向Pt电极
C.V2O5电极反应式为SO2-2e-+O2- ══ SO3
D.该传感器可监测真空装置中的SO2
C
解析 通入氧气的一极为正极,通入二氧化硫的一极为负极,原电池中阴离子移向负极,在V2O5电极上,SO2失电子发生氧化反应生成SO3。O2在Pt电极上得电子生成O2-,故Pt电极为正极,A项错误;电流应该由正极流向负极,B项错误;V2O5电极上SO2失电子生成SO3,C项正确;该传感器Pt电极上需O2参与反应,故真空中无法使用,D项错误。
4.一种基于酸性燃料电池原理设计的酒精检测仪,负极上的反应为CH3CH2OH-4e-+H2O ══ CH3COOH+4H+。下列有关说法正确的是
( )
A.检测时,电解质溶液中的H+向负极移动
B.若有0.4 mol电子转移,则在标准状况下消耗4.48 L氧气
C.电池反应的化学方程式为CH3CH2OH+O2 ══ CH3COOH+H2O
D.正极上发生的反应为O2+4e-+2H2O ══ 4OH-
C
解析 该燃料电池的电极反应式分别为正极:O2+4e-+4H+ ══ 2H2O,负极:CH3CH2OH-4e-+H2O ══ CH3COOH+4H+,电解质溶液中的H+应向正极移动,A不正确;根据正极反应式,若有0.4 mol电子转移,则在标准状况下消耗2.24 L氧气,B不正确;将正负极电极反应式叠加可得CH3CH2OH+O2 ══ CH3COOH+H2O,C正确;酸性条件下正极反应为O2+4e-+4H+ ══ 2H2O,D不正确。
5.依据氧化还原反应2Ag+(aq)+Cu(s) ══ 2Ag(s)+Cu2+(aq)设计的原电池如图所示。
请回答下列问题:
(1)电极X的材料是 ;电解质溶液Y是 。
(2)银电极为电池的 极,发生的电极反应为 ;
X电极上发生的电极反应为
。
(3)外电路中的电子从 电极流向 电极。
解析 该原电池的电池总反应为2Ag+(aq)+Cu(s) ══ 2Ag(s)+Cu2+(aq),由此可知X极是铜,为负极,银为正极,Y应是AgNO3溶液。电子从原电池的负极经导线流向正极,即从铜电极流向银电极。
答案 (1)Cu AgNO3溶液 (2)正 2Ag++2e- ══ 2Ag(或Ag++e- ══ Ag) Cu-2e- ══ Cu2+ (3)Cu(或负) Ag(或正)
本 课 结 束
专题1
第二单元 第1课时 原电池的工作原理
基础落实·必备知识全过关
重难探究·能力素养全提升
目录索引
素养目标 1.能认识化学能与电能相互转化的实际意义及其重要应用。以铜锌原电池为例,从宏观和微观的角度分析理解原电池的工作原理,能正确判断原电池的正极和负极,会书写电极反应式。
2.能设计简单的原电池,促进证据推理与模型认知的核心素养的发展。
基础落实·必备知识全过关
一、原电池的工作原理
1.原电池
(1)定义:将 转化为 的装置。
(2)构成条件:
①两个 不同的电极(材料可以是 或导电的非金属)。
石墨
② 溶液。
③形成 回路(或两极直接接触)。
④能自发地发生氧化还原反应。
化学能
电能
活泼性
金属
电解质
闭合
2.铜锌原电池的工作原理
(1)用温度计测量锌粉与CuSO4溶液反应的温度变化,说明该反应为
反应,该反应在物质变化的同时,实现 转化为 。
(2)铜锌原电池的工作原理:
装置图
放热
化学能
热能
电极 Zn Cu
反应现象 逐渐溶解 铜片上有 物质析出
电极名称 极 极
得失电子 电子 电子
电子流向 电子 电子
反应类型 反应 反应
电极反应式 Zn-2e-══Zn2+ Cu2++2e-══Cu
电池总反应式 Zn+Cu2+══Zn2++Cu
红色
负
正
失
得
流出
流入
氧化
还原
3.盐桥(以铜锌原电池为例)
(1)成分:含有KCl饱和溶液的琼脂。
(2)离子移动方向:Cl-移向 溶液(负极区),K+移向 溶液(正极区)。
(3)盐桥的作用:①使两个半电池形成通路,并保持两溶液的电中性。②避免电极与电解质溶液反应,最大程度地将化学能转化为电能。
ZnSO4
CuSO4
教材阅读想一想阅读教材“原电池的工作原理”中的第1个“实验探究”
思考:可以将铜锌原电池中的Cu电极换成石墨吗 为什么
提示 可以;因为Cu在该原电池中起到传递电子的作用,其本身并未参与电极反应,所以可以把Cu电极换成能导电的石墨。
易错辨析判一判
(1)原电池中电子流出的一极是正极,发生氧化反应。( )
(2)原电池中的盐桥是为了连通电路,也可用金属导线代替。( )
(3)在原电池中阳离子移向正极,阴离子移向负极。( )
(4)铜、锌与硫酸组成的原电池中,锌为负极,质量减少,铜为正极,质量不变。
( )
×
提示 电子流出的一极为负极。
×
提示 离子不能在导线中移动,电子不能在溶液中移动。
√
√
二、原电池原理的应用
1.比较金属活动性强弱
对于酸性电解质,一般是负极金属的活动性 ,正极金属的活动性 。
例如:a和b两种金属,用导线连接后插入稀硫酸中,观察到a极溶解,b极上有气泡产生,则a为 极,b为 极,金属活动性:a b。
2.加快氧化还原反应的速率
构成原电池的反应速率比直接接触的反应速率 。例如:实验室制取氢气时,粗锌比纯锌与稀硫酸反应速率 ;或向溶液中滴入几滴硫酸铜溶液,产生氢气的速率 。
较强
较弱
负
正
>
快
快
加快
3.设计化学电池
(1)理论上,任何自发的 反应都可以设计成原电池。
(2)外电路: 性较强的物质在负极上失去电子, 性较强的物质在正极上得到电子。
(3)内电路:将两电极浸入电解质溶液中,阴、阳离子 移动。
氧化还原
还原
氧化
定向
教材阅读想一想阅读教材“原电池的工作原理”中的第2个“实验探究”
思考:将氧化还原反应Fe+Cu2+ ══ Fe2++Cu设计成原电池,画出原电池装置图,并标出电极材料及电解质溶液(要求:画出两个原电池装置,一个不带盐桥,另一个带有盐桥)。
提示
易错辨析判一判
(1)Mg-Al形成的原电池,Mg一定作为负极。( )
(2)实验室制备H2时,用粗锌(含Cu、Fe等)代替纯锌与盐酸反应效果更佳。
( )
(3)CaO+H2O ══ Ca(OH)2是放热反应,可设计成原电池。( )
×
提示 当电解质溶液为NaOH溶液时,Al作为负极。
√
提示 该反应不是氧化还原反应,不能设计成原电池。
×
重难探究·能力素养全提升
探究一 原电池工作原理
情境探究
市售“热敷贴”的主要成分是铁屑、炭粉、木屑与少量NaCl、水等。它在使用之前与空气隔绝,使用时开启塑料袋上的小孔,轻轻揉搓就会有热量放出,使用完后还会发现有铁锈生成。
(1)“热敷贴”中氯化钠起到什么作用 炭粉的主要作用是什么
(2)原电池中的两极是如何规定的 分别发生什么反应
提示 氯化钠溶于水形成电解质溶液。炭粉作原电池的正极材料,与铁、氯化钠溶液构成原电池,从而加速铁的氧化。
提示 在原电池中,发生氧化反应的一极为负极,发生还原反应的一极为正极。
(3)原电池中电子的流向如何 电子能否通过电解质溶液
(4)在带有盐桥的原电池中,盐桥中的阴、阳离子如何移动
(5)试写出“热敷贴”中正、负极的电极反应式。并归纳原电池的电极反应式的书写思路。
提示 在原电池中,电子由负极沿导线流向正极,电子不能通过电解质溶液。
提示 盐桥中的阴离子向着原电池的负极移动,阳离子向着正极移动。
提示 负极:Fe-2e- ══ Fe2+;正极:O2+4e-+2H2O ══ 4OH-。书写思路:先判断原电池的正、负极,即找出氧化剂和还原剂,再结合电解质溶液的酸碱性确定还原产物和氧化产物,然后根据电荷守恒、原子守恒等书写并配平电极反应式。
方法突破
1.原电池正、负极的判断
2.原电池的电极材料“两注意”
(1)注意电解质溶液对电极类型的影响
一般较活泼金属作负极,较不活泼的金属或导电的非金属作正极,但若是较不活泼的金属发生的氧化还原反应设计的原电池,则是较不活泼的金属作负极。例如:镁铝电极在稀硫酸中构成原电池,镁为负极,铝为正极;但若以氢氧化钠溶液为电解质溶液,则铝为负极,镁为正极。
(2)注意电极材料是否参与反应
负极材料不一定参与反应,如燃料电池;负极和正极材料都参与反应,如铅蓄电池。
3.原电池中阴、阳离子及电子的移动方向
(1)外电路:电子由负极流向正极,与电流方向相反。
(2)内电路:阴离子移向负极,阳离子移向正极。具体情况如图示:
应用体验
视角1原电池的原理
1.某兴趣小组同学利用氧化还原反应:
2KMnO4+10FeSO4+8H2SO4 ══2MnSO4+5Fe2(SO4)3+
K2SO4+8H2O设计如下原电池,
盐桥中装有饱和K2SO4溶液。下列说法正确的是( )
A.b电极上发生还原反应
B.外电路电子的流向是从a到b
C.电池工作时,盐桥中的 移向甲烧杯
D.a电极上发生的反应为 +8H++5e- ══ Mn2++4H2O
D
解析 根据化学方程式和图示判断,b电极上是FeSO4发生氧化反应,为负极,A项错误;b为负极,a为正极,电子从b流向a,B项错误;盐桥中的 移向乙烧杯,C项错误;a极上发生还原反应,Mn元素的化合价降低,电极反应式为
+8H++5e- ══ Mn2++4H2O,D项正确。
2.下列有关原电池的电极名称的叙述错误的是( )
A.发生氧化反应的一极为负极
B.正极为电子流入的一极
C.比较不活泼的金属为负极
D.电流流出的一极为正极
C
解析 原电池中相对活泼的金属为负极,发生氧化反应;相对不活泼的金属(或非金属导体)为正极,正极上发生还原反应,且电解质类型影响电极类型。
视角2原电池的判断及电极反应式的书写
3.某小组为研究原电池原理,设计如图装置。下列叙述正确的是( )
A.若X为Fe,Y为Cu,铁为正极
B.若X为Fe,Y为Cu,在外电路电子由铜片流向铁片
C.若X为Fe,Y为C,碳棒上有红色固体析出
D.若X为Cu,Y为Zn,锌片发生还原反应
C
解析 Fe比Cu活泼,Fe作负极,故A错误;Fe作负极,在外电路电子从Fe流向Cu,故B错误;若X为Fe,Y为C,电解质溶液为硫酸铜溶液,则正极C上析出Cu,故C正确;Zn比Cu活泼,Zn作负极发生氧化反应,故D错误。
4.铜锌原电池(如图)工作时,下列叙述正确的是( )
A.正极反应式为Zn-2e- ══ Zn2+
B.电池总反应为Zn+Cu2+ ══ Zn2++Cu
C.在外电路中,电流从负极流向正极
D.盐桥中的K+移向ZnSO4溶液
B
解析 Zn为活泼金属,作负极,故Zn-2e- ══ Zn2+是负极反应式,A项错误;在外电路中,电流从正极流向负极,电子从负极流向正极,C项错误;盐桥中的K+移向消耗Cu2+的CuSO4溶液,D项错误。
5.Mg-H2O2电池可用于驱动无人驾驶的潜航器。该电池以海水为电解质溶液,示意图如下。该电池工作时,下列说法正确的是( )
A.Mg电极是该电池的正极,发生还原反应:
Mg2++2e- ══ Mg
B.石墨电极反应式为
H2O2+2e- ══ 2OH-
C.H2O2在石墨电极上发生氧化反应
D.溶液中Cl-向正极移动
B
解析 图示原电池中Mg为负极,发生氧化反应,Mg-2e- ══ Mg2+,A项错误;石墨作正极,H2O2得到电子,发生还原反应,H2O2+2e- ══ 2OH-,B项正确,C项错误;放电时,阴离子向负极移动,D项错误。
探究二 原电池原理的应用
情境探究
格林太太是位漂亮、开朗、乐观的妇女,当她开怀大笑的时候,人们可以发现她一口整齐洁白的牙齿中镶有两颗假牙:一颗是黄金的——这是她富有的标志;另一颗是不锈钢的——这是一次车祸后留下的痕迹。
令人百思不解的是,自从车祸以后,格林太太经常头痛、夜间失眠、心情烦躁……医生绞尽了脑汁,格林太太的病情仍未好转……
(1)请你根据所学知识帮格林太太诊断一下。
提示 牙齿中形成原电池,产生电流导致头痛,其中铁为负极,金为正极。
(2)锌片与稀硫酸反应时,加入少量CuSO4溶液能使产生H2的速率加快,试分析其原因。
提示 Zn与CuSO4反应生成的Cu覆盖在锌片表面,Zn、Cu、稀硫酸构成原电池,加快反应速率。
方法突破
设计原电池
设计思路 实例
以自发进行的氧化还原反应为基础 2FeCl3+Cu══2FeCl2+CuCl2
把氧化还原反应分解为氧化反应和还原反应两个半反应,从而确定电极反应 氧化反应(负极):Cu-2e-══Cu2+
还原反应(正极):2Fe3++2e-══2Fe2+
以两极反应为原理,确定电极材料及电解质溶液 负极铜和CuCl2溶液
正极碳(或铂)和FeCl3溶液
设计思路 实例
画出示意图
应用体验
视角1原电池的构成
1.一个原电池的总反应的离子方程式是Zn+Cu2+ ══ Zn2++Cu,该反应的原电池的正确组成是( )
选项 正极 负极 电解质溶液
A Zn Cu CuCl2溶液
B Cu Zn H2SO4溶液
C Cu Zn CuSO4溶液
D Mg Zn CuCl2溶液
C
解析 根据Zn+Cu2+ ══ Zn2++Cu知,Zn发生氧化反应,Zn-2e- ══ Zn2+,是电池负极;正极反应为Cu2++2e- ══ Cu,故正极材料可以是石墨或Cu等活动性弱于Zn的金属,电解质溶液应是可溶性铜盐溶液,C符合。
归纳总结 原电池的设计方法——“两极一液一连线”
(1)根据电池总反应式写出正极和负极的电极反应式。
(2)电极材料的选择:电池的电极必须导电。一般电池中的负极必须能够与电解质溶液反应,容易失去电子,因此负极一般是活泼的金属材料,所以正极和负极不能用同一种材料,两个电极可以是活泼性不同的两种金属或一种金属和一种非金属。
(3)电解质溶液的选择:电解质溶液为正极提供放电的物质,一般能够与负极材料发生氧化还原反应。
(4)形成闭合回路。
2.某电池的总反应为Fe+2Fe3+ ══ 3Fe2+,能实现该反应的原电池是( )
选项 正极 负极 电解质溶液
A Cu Fe FeCl3溶液
B C Fe Fe(NO3)2溶液
C Fe Zn Fe2(SO4)3溶液
D Ag Fe CuSO4溶液
A
解析 能实现反应Fe+2Fe3+ ══ 3Fe2+的原电池应符合以下条件:①负极为Fe,正极材料的活动性比Fe差;②电解质溶液应为含Fe3+的溶液,B、D两项电解质溶液选错;C项负极材料选错。
视角2原电池原理的应用
3.环保部门使用的SO2传感器工作原理如图所示,该装置可监测大气中SO2的含量。下列判断正确的是( )
A.该装置的Pt电极为负极
B.电流是从V2O5电极流向Pt电极
C.V2O5电极反应式为SO2-2e-+O2- ══ SO3
D.该传感器可监测真空装置中的SO2
C
解析 通入氧气的一极为正极,通入二氧化硫的一极为负极,原电池中阴离子移向负极,在V2O5电极上,SO2失电子发生氧化反应生成SO3。O2在Pt电极上得电子生成O2-,故Pt电极为正极,A项错误;电流应该由正极流向负极,B项错误;V2O5电极上SO2失电子生成SO3,C项正确;该传感器Pt电极上需O2参与反应,故真空中无法使用,D项错误。
4.一种基于酸性燃料电池原理设计的酒精检测仪,负极上的反应为CH3CH2OH-4e-+H2O ══ CH3COOH+4H+。下列有关说法正确的是
( )
A.检测时,电解质溶液中的H+向负极移动
B.若有0.4 mol电子转移,则在标准状况下消耗4.48 L氧气
C.电池反应的化学方程式为CH3CH2OH+O2 ══ CH3COOH+H2O
D.正极上发生的反应为O2+4e-+2H2O ══ 4OH-
C
解析 该燃料电池的电极反应式分别为正极:O2+4e-+4H+ ══ 2H2O,负极:CH3CH2OH-4e-+H2O ══ CH3COOH+4H+,电解质溶液中的H+应向正极移动,A不正确;根据正极反应式,若有0.4 mol电子转移,则在标准状况下消耗2.24 L氧气,B不正确;将正负极电极反应式叠加可得CH3CH2OH+O2 ══ CH3COOH+H2O,C正确;酸性条件下正极反应为O2+4e-+4H+ ══ 2H2O,D不正确。
5.依据氧化还原反应2Ag+(aq)+Cu(s) ══ 2Ag(s)+Cu2+(aq)设计的原电池如图所示。
请回答下列问题:
(1)电极X的材料是 ;电解质溶液Y是 。
(2)银电极为电池的 极,发生的电极反应为 ;
X电极上发生的电极反应为
。
(3)外电路中的电子从 电极流向 电极。
解析 该原电池的电池总反应为2Ag+(aq)+Cu(s) ══ 2Ag(s)+Cu2+(aq),由此可知X极是铜,为负极,银为正极,Y应是AgNO3溶液。电子从原电池的负极经导线流向正极,即从铜电极流向银电极。
答案 (1)Cu AgNO3溶液 (2)正 2Ag++2e- ══ 2Ag(或Ag++e- ══ Ag) Cu-2e- ══ Cu2+ (3)Cu(或负) Ag(或正)
本 课 结 束
