2.1.1 化学反应速率的表示方法 课件 (共43张PPT)2023-2024学年高二化学苏教版选择性必修1
文档属性
| 名称 | 2.1.1 化学反应速率的表示方法 课件 (共43张PPT)2023-2024学年高二化学苏教版选择性必修1 |

|
|
| 格式 | pptx | ||
| 文件大小 | 3.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-08 14:34:18 | ||
图片预览











文档简介
(共43张PPT)
专题2
第一单元 第1课时 化学反应速率的表示方法
基础落实·必备知识全过关
重难探究·能力素养全提升
目录索引
素养 目标 1.知道化学反应速率的表示方法。能进行化学反应速率的简单计算。
2.能用化学反应速率的有关知识比较反应的快慢,促进证据推理与模型认知化学核心素养的发展。
3.了解测定化学反应速率的简单方法。
基础落实·必备知识全过关
一、化学反应速率
1.定义 平均反应速率
化学反应速率是用来衡量化学反应进行的 的物理量。
2.表示方法
可以用单位时间内 或者
来表示。
3.表达式及其单位
(1)表达式:v= 。
(2)常用单位: 。
物质的量浓度变化
时间的变化
快慢
反应物浓度(通常使用物质的量浓度)的减少
生成物浓度的增加
mol·L-1·min-1、mol·L-1·s-1
教材阅读想一想阅读教材图2-2
思考:根据数据作图,从图中得到哪些启示
提示 随着反应的进行,相同时间间隔内,H2O2的浓度变化量逐渐减小,化学反应速率逐渐减慢。
易错辨析判一判
(1)对于任何化学反应来说,反应速率越大,反应现象越明显。( )
(2)化学反应速率为0.8 mol·L-1·s-1是指每秒内某物质的浓度变化均为
0.8 mol·L-1。( )
(3)同一化学反应,相同条件下用不同物质表示的反应速率,其数值可能不同,但表示的意义相同。( )
(4)在化学反应过程中,反应物的浓度逐渐变小,所以用反应物表示的化学反应速率为负值。( )
×
提示 反应速率大小与反应现象无必然联系。
×
提示 化学反应速率为一段时间内的平均反应速率。
√
×
提示 化学反应速率为正值。
二、化学反应速率的测定
1.测定原理
观察、测量体系中的某一物质的相关性质,如 或 等,再进行适当的转换和计算。
浓度
质量
2.测定方法
(1)利用能够直接观察的某些性质测定,如通过测量释放出一定体积的气体的 来测定反应速率,或测定一定时间内气体压强的变化来测定反应速率。
(2)在溶液中,当反应物或生成物本身有比较明显的颜色时,可根据
与 的正比关系来确定反应物或生成物在不同时刻的浓度。
(3)利用科学仪器进行测定,如光的吸收、光的发射、导电能力等。
时间
溶液颜色的深浅
有色物质浓度
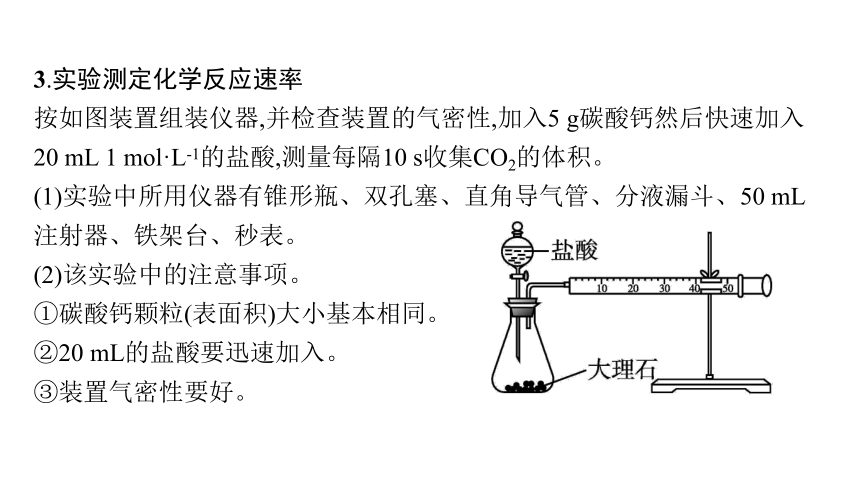
3.实验测定化学反应速率
按如图装置组装仪器,并检查装置的气密性,加入5 g碳酸钙然后快速加入20 mL 1 mol·L-1的盐酸,测量每隔10 s收集CO2的体积。
(1)实验中所用仪器有锥形瓶、双孔塞、直角导气管、分液漏斗、50 mL注射器、铁架台、秒表。
(2)该实验中的注意事项。
①碳酸钙颗粒(表面积)大小基本相同。
②20 mL的盐酸要迅速加入。
③装置气密性要好。
教材阅读想一想阅读教材“实验探究·盐酸与大理石的反应”
思考:除了测定相同时间内收集CO2的多少表示化学反应速率,还可根据哪些量的变化测定其反应速率
提示 (1)测定收集相同体积CO2的时间长短。
(2)测定一段时间内溶液中c(H+)的变化。
(3)测定一段时间内碳酸钙质量的变化。
易错辨析判一判
(1)可以用任一反应物或生成物表示反应速率。( )
(2)可以通过测量相同时间内收集H2的体积来测定化学反应的反应速率。
( )
(3)碳酸钙颗粒(即表面积)大小基本相同时,1 L 4 mol·L-1的盐酸与碳酸钙反应比1 L 1 mol·L-1的盐酸与碳酸钙反应速率快。( )
×
提示 固体或者纯液体的浓度为常数,故不能用其表示反应速率。
√
√
重难探究·能力素养全提升
探究一 化学反应速率的计算
情境探究
有的化学反应进行得很快,如爆炸瞬间完成;有的化学反应进行得很慢,如溶洞的形成,要经历上万年甚至更长的时间。那么如何表示化学反应的快慢
(1)人们常说的化学反应速率是平均速率还是瞬时速率 是正值还是负值
(2)在C(s)+H2O(g) ══ CO(g)+H2(g)的反应中,可用哪些物质表示反应速率 在2Na+2H2O ══ 2NaOH+H2↑的反应中呢
提示 根据化学反应速率的定义,该速率应是平均反应速率,均取正值。
提示 在C(s)+H2O(g) ══ CO(g)+H2(g)反应中,可以用H2O(g)、CO(g)、H2(g)的浓度变化来表示反应速率,而在2Na+2H2O ══ 2NaOH+H2↑的反应中可用NaOH、H2的浓度变化来表示,即不能用固体或纯液体来表示反应速率,因为固体或纯液体的浓度为常数。
(3)在合成氨反应中,若已知N2的化学反应速率,能否确定相同条件下H2和NH3的化学反应速率
提示 能够确定。它们之间的关系为v(NH3)=2v(N2),v(H2)=3v(N2)。
方法突破
化学反应速率的计算方法
(2)“三段式”法:
①计算步骤:写出化学方程式,列出各反应物和生成物的起始量、转化量、某时刻量,再根据变化量之比等于化学计量数之比,列出关系式计算。
②计算模式:
反应 mA + nB ══ pC
③注意事项:
a.对反应物:c(起始)-c(转化)=c(某时刻);
b.对生成物:c(起始)+c(转化)=c(某时刻)。
应用体验
视角1反应速率的计算
1.(2023河北邯郸魏县五中高二期中)一定条件下,向2 L密闭容器中加入2 mol N2和10 mol H2,发生反应N2+3H2 2NH3,2 min后测得剩余N2 1 mol,下列化学反应速率不正确的是( )
A.v(N2)=0.25 mol·L-1·min-1 B.v(H2)=0.75 mol·L-1·min-1
C.v(NH3)=1 mol·L-1·min-1 D.v(NH3)=0.5 mol·L-1·min-1
C
解析 v(N2)= =0.25 mol·L-1·min-1。因为v(N2)∶v(H2)∶v(NH3)=1∶3∶2,故v(H2)=0.75 mol·L-1·min-1,v(NH3)=0.5 mol·L-1·min-1。
归纳总结
视角2反应速率的关系及应用
2.在一密闭容器中充入一定量的H2和N2,经测定反应开始后3 s内v(N2)=0.15 mol·L-1·s-1,则3 s末NH3的浓度为( )
A.0.4 mol·L-1 B.0.6 mol·L-1
C.0.9 mol·L-1 D.1.2 mol·L-1
C
解析 3 s内v(N2)=0.15 mol·L-1·s-1,则3 s内N2浓度的变化为0.45 mol·L-1,根据反应的化学方程式N2+3H2 2NH3可知,3 s末NH3的浓度为0.9 mol·L-1,C项正确。
B
解析 反应速率之比等于相应的化学计量数之比。2v(Cl2)=3v(NH3),A项错误; v(Cl2)=v(N2),B项正确;2v(Cl2)=v(HCl),C项错误;3v(NH3)=v(HCl),D项错误。
4.反应4A(s)+3B(g) 2C(g)+D(g),经过2 min B的浓度减少了0.6 mol·L-1。对此反应速率的正确表示是( )
A.用A表示的反应速率是0.8 mol·L-1·s-1
B.分别用B、C、D表示反应的速率,其比值是3∶2∶1
C.在2 min末时的反应速率,用反应物B来表示是0.3 mol·L-1·min-1
D.在这2 min内用B和C表示的反应速率的值相同
B
解析 反应物A是固体,浓度为常数,通常不用其表示反应速率,A项错误;用B表示的反应速率v(B)= =0.3 mol·L-1·min-1,该速率是2 min内的平均反应速率,而不是2 min末时的反应速率,C项错误;化学方程式中B和C的化学计量数不相同,用B和C表示的反应速率的值不相同,D项错误。
5.一定温度下,向一个容积为2 L的密闭容器中(事先装入催化剂)通入1 mol N2和3 mol H2,3 min后测得密闭容器内的压强是起始时的 ,在此时间内v(H2)是( )
A.0.1 mol·L-1·min-1
B.0.2 mol·L-1·min-1
C.0.3 mol·L-1·min-1
D.0.6 mol·L-1·min-1
C
解析 3 min后测得密闭容器内的压强是起始时的 ,因为同温同体积条件下气体的压强之比等于其物质的量之比,所以3 min后容器内混合气体的物质的量为(1+3) mol× =2.8 mol,设发生反应的氮气的物质的量为x mol,列出三段式:
N2 + 3H2 2NH3
起始量/mol 1 3 0
转化量/mol x 3x 2x
3 min时/mol 1-x 3-3x 2x
则(1-x)+(3-3x)+2x=2.8,解得x=0.6,所以3 min内v(H2)= =
0.3 mol·L-1·min-1,C项正确。
6.某温度下,浓度都是1 mol·L-1的两种气体X2和Y2,在密闭容器中反应生成气体Z,反应2 min后,测得参加反应的X2为0.6 mol·L-1,用Y2变化表示的反应速率v(Y2)=0.1 mol·L-1·min-1,生成的c(Z)=0.4 mol·L-1,则该反应的化学方程式为( )
A.3X2+Y2 ══ 2X3Y
B.2X2+Y2 ══ 2X2Y
C.X2+2Y2 ══ 2XY2
D.X2+3Y2 ══ 2XY3
A
解析 由题意可知,反应中消耗X2和Y2的浓度分别为0.6 mol·L-1、0.1 mol·L-1·min-1×2 min=0.2 mol·L-1,生成Z的浓度为0.4 mol·L-1,则反应物X2、Y2和生成物Z的浓度变化量之比为0.6 mol·L-1∶0.2 mol·L-1∶0.4 mol·L-1 =3∶1∶2,由化学计量数之比等于各物质的浓度变化量之比可得反应的化学方程式为3X2+Y2 ══ 2Z,由反应前后原子守恒可知Z的分子式为X3Y,反应的化学方程式为3X2+Y2 ══ 2X3Y。
7.某温度时,在2 L容器中,某一反应中A、B的物质的量随时间变化的曲线如图所示,由图中数据分析得:
(1)在4 min末时,A、B的物质的量浓度c(A) (填“>”“<”或“=”)c(B)。
(2)从反应开始至4 min时,A的平均反应速率为 。
(3)该反应的化学方程式为 。
答案 (1)= (2)0.05 mol·L-1·min-1 (3)2A ══ B
解析 (1)由题图可以看出,在4 min末n(A)=n(B)=0.4 mol,又因为在同一容器中,所以c(A)=c(B)。
(3)从反应开始至4 min时,反应物和生成物的变化量之比n(A)∶n(B)=0.4 mol∶0.2 mol=2∶1,化学计量数与各组分物质的量的变化量成正比,则该反应的化学方程式为2A ══ B。
探究二 化学反应速率的比较
情境探究
(1)对于反应3A(g)+B(g) ══ 2C(g)+2D(g),在不同条件下,用A、B表示的反应速率分别为:条件①时v(A)=0.6 mol·L-1·min-1,条件②时v(B)=0.45 mol·L-1·min-1。
则该反应在哪个条件下的反应速率快
提示 同一个化学反应,用不同物质表示其反应速率时,数值可能不同,所以比较同一个化学反应的反应速率的相对大小时,不能直接比较数值大小,应先转化为同一物质、同一单位,然后再比较其数值大小,数值越大表明反应速率越快。将条件①的反应速率换算成用B表示的反应速率为v(B)=0.2 mol·L-1·min-1,即条件②的反应速率比条件①的反应速率快。
(2)在不同条件下进行反应mA+nB ══ pC+qD中,其中一种条件下v(A)=4 mol·L-1·min-1,另一种条件下v(B)=1 mol·L-1·min-1,其中A表示的反应速率比B表示的反应速率快,则m、n符合什么关系
提示 相同条件下用不同物质表示的化学反应速率之比=化学计量数之比,即m∶n=v(A)∶v(B),已知v(A)∶v(B)=4∶1,且用A表示的反应速率比用B表示的反应速率快,则m∶n<4∶1。
方法突破
化学反应速率大小的比较方法
(1)定性比较。
通过明显的实验现象(如反应的剧烈程度、产生气泡或沉淀的快慢等)来定性判断化学反应的快慢。
(2)定量比较。
对同一化学反应,用不同物质表示化学反应速率时,数值可能不同。比较时应统一单位。
(3)常见误区。
应用体验
1.(2023河北邢台高二月考)下列数据表示反应4A(g)+5B(g) ══ 4C(g)+6D(g)在四种不同条件下的化学反应速率,其中化学反应速率最快的是( )
A.v(A)=0.4 mol·L-1·s-1
B.v(B)=0.6 mol·L-1·s-1
C.v(C)=27 mol·L-1·min-1
D.v(D)=0.75 mol·L-1·s-1
D
解析 该反应中,各物质表示的反应速率之间存在如下关系: v(A)∶v(B)∶v(C)∶v(D)=4∶5∶4∶6,可按此比例关系将选项中各物质表示的反应速率转化为同一物质表示的反应速率再进行比较,比如都转化为A的反应速率。A项中,v(A)=0.4 mol·L-1·s-1;B项中,v(A)= v(B)=
0.48 mol·L-1·s-1;C项中,v(A)=v(C)=27 mol·L-1·min-1= mol·L-1·s-1=0.45 mol·L-1·s-1;D项中,v(A)= v(D)=0.5 mol·L-1·s-1。则反应速率最快的是D。
2.在四个不同的容器中,在不同条件下利用N2+3H2 2NH3反应来合成氨,根据下列在相同时间内测定的结果判断,生成氨的速率最大的是( )
A.v(H2)=0.1 mol·L-1·min-1
B.v(N2)=0.01 mol·L-1·s-1
C.v(N2)=0.2 mol·L-1·min-1
D.v(NH3)=0.3 mol·L-1·min-1
B
3.对于可逆反应A(g)+3B(g) 2C(g)+2D(g),在不同条件下的化学反应速率如下,其中表示的反应速率最快的是( )
A.v(A)=0.5 mol·L-1·min-1 B.v(B)=0.04 mol·L-1·s-1
C.v(C)=0.02 mol·L-1·s-1 D.v(D)=0.4 mol·L-1·min-1
B
4.用纯净的CaCO3与100 mL稀盐酸反应制取CO2,实验过程记录如图所示(CO2的体积已折算为标准状况下的体积,忽略溶液体积的变化)。下列分析正确的是( )
A.EF段,用盐酸表示该反应的平均反应速率为0.4 mol·L-1·min-1
B.OE段表示的平均速率最快
C.F点收集到的CO2的量最多
D.OE、EF、FG三段中,该反应用二氧化碳表示的平均反应速率之比为2∶6∶7
A
解析 EF段产生的CO2为0.02 mol,由于反应中n(HCl)∶n(CO2)=2∶1,所以该段消耗n(HCl)=0.04 mol,反应时间为1 min,所以用盐酸表示的EF段的平均反应速率是0.4 mol·L-1·min-1,A项正确;由图可知,EF段产生的CO2多,所以该段反应速率最快,B项错误;由题图可知,G点收集到的CO2的体积最多,C项错误;由于反应时间都是1 min,所以三段的反应速率之比等于产生CO2的体积之比,即224∶(672-224)∶(784-672)=2∶4∶1,D项错误。
5.某温度下,在恒容密闭容器中发生反应:2N2O5(g) 4NO2(g)+O2(g)。测得N2O5的浓度随时间变化如下表:
下列说法错误的是( )
A.0~5 min内容器中压强不断增大
B.0~2 min内的速率比2~4 min内的速率大
C.2 min时c(NO2)=1.00 mol·L-1
D.0~2 min内v(O2)=0.25 mol·L-1·min-1
D
解析 2N2O5(g) 4NO2(g)+O2(g)是气体分子总数不断增大的反应,0~5 min内N2O5不断减少,容器中气体分子数、压强不断增大,A项正确;0~2 min内N2O5减少(1.00-0.50)mol·L-1=0.50 mol·L-1,2~4 min内N2O5减少(0.50-0.25) mol·L-1=0.25 mol·L-1,故前者速率大,B项正确;0~2 min内N2O5减少0.50 mol·L-1,则NO2浓度增加1.00 mol·L-1,2 min时二氧化氮的浓度为
1.00 mol·L-1,C项正确;0~2 min内N2O5减少0.50 mol·L-1,则 0~2 min内
本 课 结 束
专题2
第一单元 第1课时 化学反应速率的表示方法
基础落实·必备知识全过关
重难探究·能力素养全提升
目录索引
素养 目标 1.知道化学反应速率的表示方法。能进行化学反应速率的简单计算。
2.能用化学反应速率的有关知识比较反应的快慢,促进证据推理与模型认知化学核心素养的发展。
3.了解测定化学反应速率的简单方法。
基础落实·必备知识全过关
一、化学反应速率
1.定义 平均反应速率
化学反应速率是用来衡量化学反应进行的 的物理量。
2.表示方法
可以用单位时间内 或者
来表示。
3.表达式及其单位
(1)表达式:v= 。
(2)常用单位: 。
物质的量浓度变化
时间的变化
快慢
反应物浓度(通常使用物质的量浓度)的减少
生成物浓度的增加
mol·L-1·min-1、mol·L-1·s-1
教材阅读想一想阅读教材图2-2
思考:根据数据作图,从图中得到哪些启示
提示 随着反应的进行,相同时间间隔内,H2O2的浓度变化量逐渐减小,化学反应速率逐渐减慢。
易错辨析判一判
(1)对于任何化学反应来说,反应速率越大,反应现象越明显。( )
(2)化学反应速率为0.8 mol·L-1·s-1是指每秒内某物质的浓度变化均为
0.8 mol·L-1。( )
(3)同一化学反应,相同条件下用不同物质表示的反应速率,其数值可能不同,但表示的意义相同。( )
(4)在化学反应过程中,反应物的浓度逐渐变小,所以用反应物表示的化学反应速率为负值。( )
×
提示 反应速率大小与反应现象无必然联系。
×
提示 化学反应速率为一段时间内的平均反应速率。
√
×
提示 化学反应速率为正值。
二、化学反应速率的测定
1.测定原理
观察、测量体系中的某一物质的相关性质,如 或 等,再进行适当的转换和计算。
浓度
质量
2.测定方法
(1)利用能够直接观察的某些性质测定,如通过测量释放出一定体积的气体的 来测定反应速率,或测定一定时间内气体压强的变化来测定反应速率。
(2)在溶液中,当反应物或生成物本身有比较明显的颜色时,可根据
与 的正比关系来确定反应物或生成物在不同时刻的浓度。
(3)利用科学仪器进行测定,如光的吸收、光的发射、导电能力等。
时间
溶液颜色的深浅
有色物质浓度
3.实验测定化学反应速率
按如图装置组装仪器,并检查装置的气密性,加入5 g碳酸钙然后快速加入20 mL 1 mol·L-1的盐酸,测量每隔10 s收集CO2的体积。
(1)实验中所用仪器有锥形瓶、双孔塞、直角导气管、分液漏斗、50 mL注射器、铁架台、秒表。
(2)该实验中的注意事项。
①碳酸钙颗粒(表面积)大小基本相同。
②20 mL的盐酸要迅速加入。
③装置气密性要好。
教材阅读想一想阅读教材“实验探究·盐酸与大理石的反应”
思考:除了测定相同时间内收集CO2的多少表示化学反应速率,还可根据哪些量的变化测定其反应速率
提示 (1)测定收集相同体积CO2的时间长短。
(2)测定一段时间内溶液中c(H+)的变化。
(3)测定一段时间内碳酸钙质量的变化。
易错辨析判一判
(1)可以用任一反应物或生成物表示反应速率。( )
(2)可以通过测量相同时间内收集H2的体积来测定化学反应的反应速率。
( )
(3)碳酸钙颗粒(即表面积)大小基本相同时,1 L 4 mol·L-1的盐酸与碳酸钙反应比1 L 1 mol·L-1的盐酸与碳酸钙反应速率快。( )
×
提示 固体或者纯液体的浓度为常数,故不能用其表示反应速率。
√
√
重难探究·能力素养全提升
探究一 化学反应速率的计算
情境探究
有的化学反应进行得很快,如爆炸瞬间完成;有的化学反应进行得很慢,如溶洞的形成,要经历上万年甚至更长的时间。那么如何表示化学反应的快慢
(1)人们常说的化学反应速率是平均速率还是瞬时速率 是正值还是负值
(2)在C(s)+H2O(g) ══ CO(g)+H2(g)的反应中,可用哪些物质表示反应速率 在2Na+2H2O ══ 2NaOH+H2↑的反应中呢
提示 根据化学反应速率的定义,该速率应是平均反应速率,均取正值。
提示 在C(s)+H2O(g) ══ CO(g)+H2(g)反应中,可以用H2O(g)、CO(g)、H2(g)的浓度变化来表示反应速率,而在2Na+2H2O ══ 2NaOH+H2↑的反应中可用NaOH、H2的浓度变化来表示,即不能用固体或纯液体来表示反应速率,因为固体或纯液体的浓度为常数。
(3)在合成氨反应中,若已知N2的化学反应速率,能否确定相同条件下H2和NH3的化学反应速率
提示 能够确定。它们之间的关系为v(NH3)=2v(N2),v(H2)=3v(N2)。
方法突破
化学反应速率的计算方法
(2)“三段式”法:
①计算步骤:写出化学方程式,列出各反应物和生成物的起始量、转化量、某时刻量,再根据变化量之比等于化学计量数之比,列出关系式计算。
②计算模式:
反应 mA + nB ══ pC
③注意事项:
a.对反应物:c(起始)-c(转化)=c(某时刻);
b.对生成物:c(起始)+c(转化)=c(某时刻)。
应用体验
视角1反应速率的计算
1.(2023河北邯郸魏县五中高二期中)一定条件下,向2 L密闭容器中加入2 mol N2和10 mol H2,发生反应N2+3H2 2NH3,2 min后测得剩余N2 1 mol,下列化学反应速率不正确的是( )
A.v(N2)=0.25 mol·L-1·min-1 B.v(H2)=0.75 mol·L-1·min-1
C.v(NH3)=1 mol·L-1·min-1 D.v(NH3)=0.5 mol·L-1·min-1
C
解析 v(N2)= =0.25 mol·L-1·min-1。因为v(N2)∶v(H2)∶v(NH3)=1∶3∶2,故v(H2)=0.75 mol·L-1·min-1,v(NH3)=0.5 mol·L-1·min-1。
归纳总结
视角2反应速率的关系及应用
2.在一密闭容器中充入一定量的H2和N2,经测定反应开始后3 s内v(N2)=0.15 mol·L-1·s-1,则3 s末NH3的浓度为( )
A.0.4 mol·L-1 B.0.6 mol·L-1
C.0.9 mol·L-1 D.1.2 mol·L-1
C
解析 3 s内v(N2)=0.15 mol·L-1·s-1,则3 s内N2浓度的变化为0.45 mol·L-1,根据反应的化学方程式N2+3H2 2NH3可知,3 s末NH3的浓度为0.9 mol·L-1,C项正确。
B
解析 反应速率之比等于相应的化学计量数之比。2v(Cl2)=3v(NH3),A项错误; v(Cl2)=v(N2),B项正确;2v(Cl2)=v(HCl),C项错误;3v(NH3)=v(HCl),D项错误。
4.反应4A(s)+3B(g) 2C(g)+D(g),经过2 min B的浓度减少了0.6 mol·L-1。对此反应速率的正确表示是( )
A.用A表示的反应速率是0.8 mol·L-1·s-1
B.分别用B、C、D表示反应的速率,其比值是3∶2∶1
C.在2 min末时的反应速率,用反应物B来表示是0.3 mol·L-1·min-1
D.在这2 min内用B和C表示的反应速率的值相同
B
解析 反应物A是固体,浓度为常数,通常不用其表示反应速率,A项错误;用B表示的反应速率v(B)= =0.3 mol·L-1·min-1,该速率是2 min内的平均反应速率,而不是2 min末时的反应速率,C项错误;化学方程式中B和C的化学计量数不相同,用B和C表示的反应速率的值不相同,D项错误。
5.一定温度下,向一个容积为2 L的密闭容器中(事先装入催化剂)通入1 mol N2和3 mol H2,3 min后测得密闭容器内的压强是起始时的 ,在此时间内v(H2)是( )
A.0.1 mol·L-1·min-1
B.0.2 mol·L-1·min-1
C.0.3 mol·L-1·min-1
D.0.6 mol·L-1·min-1
C
解析 3 min后测得密闭容器内的压强是起始时的 ,因为同温同体积条件下气体的压强之比等于其物质的量之比,所以3 min后容器内混合气体的物质的量为(1+3) mol× =2.8 mol,设发生反应的氮气的物质的量为x mol,列出三段式:
N2 + 3H2 2NH3
起始量/mol 1 3 0
转化量/mol x 3x 2x
3 min时/mol 1-x 3-3x 2x
则(1-x)+(3-3x)+2x=2.8,解得x=0.6,所以3 min内v(H2)= =
0.3 mol·L-1·min-1,C项正确。
6.某温度下,浓度都是1 mol·L-1的两种气体X2和Y2,在密闭容器中反应生成气体Z,反应2 min后,测得参加反应的X2为0.6 mol·L-1,用Y2变化表示的反应速率v(Y2)=0.1 mol·L-1·min-1,生成的c(Z)=0.4 mol·L-1,则该反应的化学方程式为( )
A.3X2+Y2 ══ 2X3Y
B.2X2+Y2 ══ 2X2Y
C.X2+2Y2 ══ 2XY2
D.X2+3Y2 ══ 2XY3
A
解析 由题意可知,反应中消耗X2和Y2的浓度分别为0.6 mol·L-1、0.1 mol·L-1·min-1×2 min=0.2 mol·L-1,生成Z的浓度为0.4 mol·L-1,则反应物X2、Y2和生成物Z的浓度变化量之比为0.6 mol·L-1∶0.2 mol·L-1∶0.4 mol·L-1 =3∶1∶2,由化学计量数之比等于各物质的浓度变化量之比可得反应的化学方程式为3X2+Y2 ══ 2Z,由反应前后原子守恒可知Z的分子式为X3Y,反应的化学方程式为3X2+Y2 ══ 2X3Y。
7.某温度时,在2 L容器中,某一反应中A、B的物质的量随时间变化的曲线如图所示,由图中数据分析得:
(1)在4 min末时,A、B的物质的量浓度c(A) (填“>”“<”或“=”)c(B)。
(2)从反应开始至4 min时,A的平均反应速率为 。
(3)该反应的化学方程式为 。
答案 (1)= (2)0.05 mol·L-1·min-1 (3)2A ══ B
解析 (1)由题图可以看出,在4 min末n(A)=n(B)=0.4 mol,又因为在同一容器中,所以c(A)=c(B)。
(3)从反应开始至4 min时,反应物和生成物的变化量之比n(A)∶n(B)=0.4 mol∶0.2 mol=2∶1,化学计量数与各组分物质的量的变化量成正比,则该反应的化学方程式为2A ══ B。
探究二 化学反应速率的比较
情境探究
(1)对于反应3A(g)+B(g) ══ 2C(g)+2D(g),在不同条件下,用A、B表示的反应速率分别为:条件①时v(A)=0.6 mol·L-1·min-1,条件②时v(B)=0.45 mol·L-1·min-1。
则该反应在哪个条件下的反应速率快
提示 同一个化学反应,用不同物质表示其反应速率时,数值可能不同,所以比较同一个化学反应的反应速率的相对大小时,不能直接比较数值大小,应先转化为同一物质、同一单位,然后再比较其数值大小,数值越大表明反应速率越快。将条件①的反应速率换算成用B表示的反应速率为v(B)=0.2 mol·L-1·min-1,即条件②的反应速率比条件①的反应速率快。
(2)在不同条件下进行反应mA+nB ══ pC+qD中,其中一种条件下v(A)=4 mol·L-1·min-1,另一种条件下v(B)=1 mol·L-1·min-1,其中A表示的反应速率比B表示的反应速率快,则m、n符合什么关系
提示 相同条件下用不同物质表示的化学反应速率之比=化学计量数之比,即m∶n=v(A)∶v(B),已知v(A)∶v(B)=4∶1,且用A表示的反应速率比用B表示的反应速率快,则m∶n<4∶1。
方法突破
化学反应速率大小的比较方法
(1)定性比较。
通过明显的实验现象(如反应的剧烈程度、产生气泡或沉淀的快慢等)来定性判断化学反应的快慢。
(2)定量比较。
对同一化学反应,用不同物质表示化学反应速率时,数值可能不同。比较时应统一单位。
(3)常见误区。
应用体验
1.(2023河北邢台高二月考)下列数据表示反应4A(g)+5B(g) ══ 4C(g)+6D(g)在四种不同条件下的化学反应速率,其中化学反应速率最快的是( )
A.v(A)=0.4 mol·L-1·s-1
B.v(B)=0.6 mol·L-1·s-1
C.v(C)=27 mol·L-1·min-1
D.v(D)=0.75 mol·L-1·s-1
D
解析 该反应中,各物质表示的反应速率之间存在如下关系: v(A)∶v(B)∶v(C)∶v(D)=4∶5∶4∶6,可按此比例关系将选项中各物质表示的反应速率转化为同一物质表示的反应速率再进行比较,比如都转化为A的反应速率。A项中,v(A)=0.4 mol·L-1·s-1;B项中,v(A)= v(B)=
0.48 mol·L-1·s-1;C项中,v(A)=v(C)=27 mol·L-1·min-1= mol·L-1·s-1=0.45 mol·L-1·s-1;D项中,v(A)= v(D)=0.5 mol·L-1·s-1。则反应速率最快的是D。
2.在四个不同的容器中,在不同条件下利用N2+3H2 2NH3反应来合成氨,根据下列在相同时间内测定的结果判断,生成氨的速率最大的是( )
A.v(H2)=0.1 mol·L-1·min-1
B.v(N2)=0.01 mol·L-1·s-1
C.v(N2)=0.2 mol·L-1·min-1
D.v(NH3)=0.3 mol·L-1·min-1
B
3.对于可逆反应A(g)+3B(g) 2C(g)+2D(g),在不同条件下的化学反应速率如下,其中表示的反应速率最快的是( )
A.v(A)=0.5 mol·L-1·min-1 B.v(B)=0.04 mol·L-1·s-1
C.v(C)=0.02 mol·L-1·s-1 D.v(D)=0.4 mol·L-1·min-1
B
4.用纯净的CaCO3与100 mL稀盐酸反应制取CO2,实验过程记录如图所示(CO2的体积已折算为标准状况下的体积,忽略溶液体积的变化)。下列分析正确的是( )
A.EF段,用盐酸表示该反应的平均反应速率为0.4 mol·L-1·min-1
B.OE段表示的平均速率最快
C.F点收集到的CO2的量最多
D.OE、EF、FG三段中,该反应用二氧化碳表示的平均反应速率之比为2∶6∶7
A
解析 EF段产生的CO2为0.02 mol,由于反应中n(HCl)∶n(CO2)=2∶1,所以该段消耗n(HCl)=0.04 mol,反应时间为1 min,所以用盐酸表示的EF段的平均反应速率是0.4 mol·L-1·min-1,A项正确;由图可知,EF段产生的CO2多,所以该段反应速率最快,B项错误;由题图可知,G点收集到的CO2的体积最多,C项错误;由于反应时间都是1 min,所以三段的反应速率之比等于产生CO2的体积之比,即224∶(672-224)∶(784-672)=2∶4∶1,D项错误。
5.某温度下,在恒容密闭容器中发生反应:2N2O5(g) 4NO2(g)+O2(g)。测得N2O5的浓度随时间变化如下表:
下列说法错误的是( )
A.0~5 min内容器中压强不断增大
B.0~2 min内的速率比2~4 min内的速率大
C.2 min时c(NO2)=1.00 mol·L-1
D.0~2 min内v(O2)=0.25 mol·L-1·min-1
D
解析 2N2O5(g) 4NO2(g)+O2(g)是气体分子总数不断增大的反应,0~5 min内N2O5不断减少,容器中气体分子数、压强不断增大,A项正确;0~2 min内N2O5减少(1.00-0.50)mol·L-1=0.50 mol·L-1,2~4 min内N2O5减少(0.50-0.25) mol·L-1=0.25 mol·L-1,故前者速率大,B项正确;0~2 min内N2O5减少0.50 mol·L-1,则NO2浓度增加1.00 mol·L-1,2 min时二氧化氮的浓度为
1.00 mol·L-1,C项正确;0~2 min内N2O5减少0.50 mol·L-1,则 0~2 min内
本 课 结 束
