2.1.2 影响化学反应速率的因素 课件 (共43张PPT)2023-2024学年高二化学苏教版选择性必修1
文档属性
| 名称 | 2.1.2 影响化学反应速率的因素 课件 (共43张PPT)2023-2024学年高二化学苏教版选择性必修1 |  | |
| 格式 | pptx | ||
| 文件大小 | 2.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-08 14:35:05 | ||
图片预览










文档简介
(共43张PPT)
专题2
第一单元 第2课时 影响化学反应速率的因素
基础落实·必备知识全过关
重难探究·能力素养全提升
目录索引
素养 目标 1.通过实验探究温度、浓度、压强和催化剂对化学反应速率的影响,培养分析、处理数据并从中获取信息的能力,通过实验探究更多影响化学反应速率的外界因素,培养科学探究与创新意识的化学核心素养。
2.理解活化能的概念,并能利用活化能解释外界条件对化学反应速率的影响。
3.认识化学反应速率的调控在生产、生活和科学研究领域中的重要作用。
基础落实·必备知识全过关
一、活化能和碰撞理论
1.基元反应
反应物分子经过一次碰撞就转化为产物分子的反应。
2.有效碰撞
(1)反应发生的先决条件是反应物分子间必须相互碰撞。
(2)反应物分子的每一次碰撞并不是都能发生反应, 的碰撞称为有效碰撞。
能发生反应
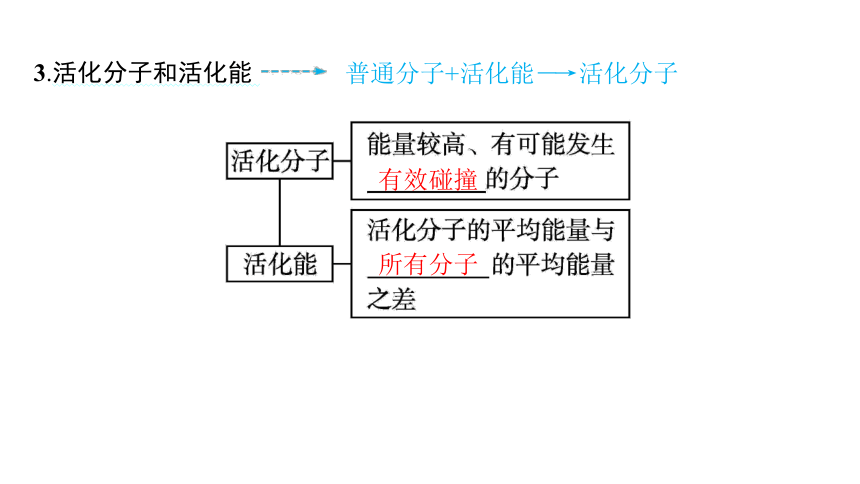
3.活化分子和活化能
普通分子+活化能―→活化分子
有效碰撞
所有分子
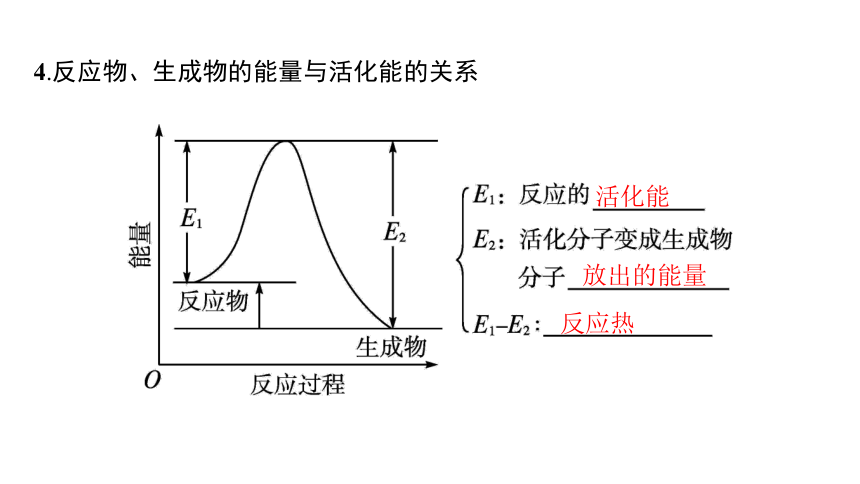
4.反应物、生成物的能量与活化能的关系
活化能
放出的能量
反应热
教材阅读想一想阅读教材图2-6
思考:有效碰撞发生的两个条件是什么
提示 有效碰撞必须满足两个条件:①发生碰撞的分子具有足够高的能量;②分子在一定的方向上发生碰撞。
易错辨析判一判
(1)活化分子间的碰撞一定能发生化学反应。( )
(2)普通分子间的碰撞有时也能发生化学反应。( )
(3)化学反应的实质是原子的重新组合。( )
(4)化学反应的实质是旧化学键的断裂和新化学键的形成过程。( )
×
提示 活化分子需要有合适取向才能发生有效碰撞。
×
提示 普通分子不能进行有效碰撞。
√
√
二、外界因素对化学反应速率的影响
1.浓度
反应物浓度增大→单位体积内活化分子数 →单位时间内有效碰撞次数 →反应速率 ;反之,反应物浓度减小,则与之相反(注意:浓度改变引起了活化分子浓度的改变,而活化分子百分数不变)。
2.压强
对于 的化学反应,若其他条件不变, ,气体体积减小,反应物浓度增大,单位体积内活化分子数增多,有效碰撞次数增多,反应速率 ; ,反应速率 。压强对无气体参加的反应的反应速率 影响。
增多
增加
加快
有气体参加
增大压强
加快
减小压强
减慢
无
3.温度
在浓度一定时,升高温度,反应物分子的能量 ,使一部分原来能量
的分子变成 ,从而增大了反应物分子中活化分子的 ,使 增多,因而使反应速率 。此外,由于温度升高,会使分子的运动速率加快,这样单位时间里反应物分子间的碰撞次数增加,反应速率也会相应地加快。但前者是反应加快的主要原因。
增加
较低
活化分子
百分数
有效碰撞次数
增大
4.催化剂
(1)催化剂能够增大化学反应速率的原因是它可使 发生改变,
反应活化能,使更多的反应物分子成为 ,大大增加单位体积内反应物分子中 所占的百分数,从而可以成千上万倍地增大化学反应速率。
(2)对于一个化学反应,不同催化剂的催化效果不同。实验时应选用合适的催化剂。
反应途径
降低
活化分子
活化分子
教材阅读想一想阅读教材图2-9
思考:催化剂对活化能和反应热有什么影响
提示 催化剂能降低正反应和逆反应的活化能,对反应热无影响。
易错辨析判一判
(1)增大压强一定能加快化学反应速率。( )
(2)用相同质量的锌粉和锌片分别与相同浓度的足量盐酸反应,产生氢气的量和速率都相同。( )
(3)催化剂参与化学反应,但反应前后的化学性质和质量均保持不变。
( )
×
×
提示 锌粉反应速率快。
√
重难探究·能力素养全提升
探究一 活化能和碰撞理论
情境探究
在山区,有的公路需要盘山而建,这样相对于直线行驶,不仅路程上会数倍加大,而且如果海拔过高,还有恶劣的雨雪天气,就会增大行车难度。为了缩短行车距离和避免大坡道而从山岭或丘陵下穿越修建隧道,可使行车路线接近于直线来回于两地之间,这不仅节约了时间,而且更加安全。在化学反应中,有的反应很快,有的反应很慢,取决于什么因素
(1)对于由多个基元反应组成的化学反应,该反应的快慢是由哪步基元反应决定的
提示 由最慢的一步基元反应决定。
(2)反应历程与化学反应速率有什么关系
(3)活化能与反应速率的关系是什么
提示 一个化学反应的快慢取决于反应历程中反应速率最慢的基元反应。反应物的结构和反应条件决定着一个反应的历程,而反应历程的差别又造成了化学反应速率的不同。
提示 活化能越低→活化分子的百分数越大→单位体积内活化分子数越多→有效碰撞次数越多→反应速率越快。
方法突破
活化分子、有效碰撞与反应速率的关系
应用体验
1.改变外界条件可以影响化学反应速率,针对反应H2(g)+I2(g) 2HI(g),其中能使活化分子百分数增加的是( )
①增大反应物浓度 ②压缩容器容积 ③升高体系的温度 ④使用催化剂
A.①② B.②③ C.①④ D.③④
D
解析 ①增大反应物浓度,使单位体积内活化分子数增加,但不能使活化分子百分数增加;②压缩容器容积,增大气体的压强,使单位体积内活化分子数增加,但不能使活化分子百分数增加;③升高体系的温度,使活化分子百分数增加;④催化剂能降低反应的活化能,使活化分子百分数增加。③④符合题意,故选D。
2.下列有关活化分子与活化能的说法正确的是( )
A.活化分子间所发生的碰撞均为有效碰撞
B.活化分子的平均能量称为活化能
C.增大压强一定使单位体积内活化分子数增多,反应速率加快
D.升高温度可使活化分子百分数增加,反应速率加快
D
解析 有效碰撞还需要活化分子在碰撞时具有合适的取向,故A项错误;活化分子的平均能量与所有分子的平均能量之差称为活化能,故B项错误;增大压强,使单位体积内活化分子数增多,只针对于气体,如果不是气体则不成立,故C项错误;升高温度,活化分子百分数增加,单位体积内活化分子数也大大增加,有效碰撞机会增大,反应速率加快,故D项正确。
归纳总结
3.下列说法正确的是( )
A.增大反应物浓度,可增大单位体积内活化分子的百分数,从而使有效碰撞次数增多
B.有气体参加的化学反应,若增大压强(即缩小反应容器的容积),可增大活化分子的百分数,从而使反应速率增大
C.升高温度能使化学反应速率增大的主要原因是减小了反应物分子中活化分子的百分数
D.催化剂能增大单位体积内活化分子的百分数,从而成千上万倍地增大反应速率
D
解析 增大浓度,单位体积内活化分子数目增多,活化分子百分数不变,则使有效碰撞次数增大,反应速率加快,A项错误;有气体参加的化学反应,若增大压强(即缩小反应容器的容积),单位体积内活化分子数目增多,从而使反应速率增大,但活化分子百分数不变,B项错误;升高温度能使化学反应速率增大的主要原因是提供分子发生反应需要的能量,活化分子的百分数增大,从而使有效碰撞次数增大,则反应速率加快,C项错误;催化剂能增大单位体积内活化分子的百分数,从而成千上万倍地增大反应速率,D项正确。
4.合成气(CO和H2)是目前化工方面常用的原料,下面是用甲烷制备合成气的两种方法:
①CH4(g)+H2O(g) CO(g)+3H2(g)
ΔH1=216 kJ·mol-1;
②2CH4(g)+O2(g) ══ 2CO(g)+4H2(g)
ΔH2=-72 kJ·mol-1。
其中一个反应的反应过程与能量变化关系
如图所示。则下列说法正确的是( )
A.E1表示2CH4(g)+O2(g) ══2CO(g)+4H2(g)的活化能
B.E2表示CH4(g)+H2O(g) CO(g)+3H2(g)的活化能
C.该图示为反应②的反应过程与能量变化示意图
D.一般情况下,加入催化剂,既能降低E1,也能降低E2,但不能改变E1与E2的差值
D
解析 已知反应①是吸热反应,反应②是放热反应,而图像所表示的是吸热反应即反应①。所以E1表示CH4(g)+H2O(g) CO(g)+3H2(g)的活化能,A项错误;E2表示CO(g)+3H2(g) CH4(g)+H2O(g)的活化能,B项错误;题图所示为反应①的反应过程与能量变化示意图,C项错误;加入催化剂,正、逆反应的活化能都降低了,即E1、E2都降低,但二者的差值不变,D项正确。
探究二 外界因素对化学反应速率的影响
情境探究
钢铁生锈的条件是水与氧气,空气中水蒸气含量越高,铁越容易生锈;用高压锅煮东西更快;汽车发动机中的活塞快速压缩可燃气体,产生强劲动力;往锅炉燃烧室里通入空气,增大氧气浓度,使燃烧加快等等。想一想,这些反应为什么会加快
(1)温度对化学反应速率有何影响
提示 当其他条件不变时,升高温度,化学反应速率增大;降低温度,化学反应速率减小。
(2)催化剂能够加快反应速率的原理是什么
提示 催化剂降低了反应的活化能,普通分子变成活化分子,活化分子的百分含量增大,因此活化分子的浓度增大,有效碰撞次数增大,从而成千上万倍地增大化学反应速率。
方法突破
外界因素对化学反应速率影响的深化理解
(1)浓度:
①固体或纯液体的浓度为常数,所以增加其用量时,化学反应速率不变。
②增大固体的表面积或将固体溶于一定溶剂,能增大化学反应速率。
(2)温度:
温度对反应速率的影响规律,对吸热反应、放热反应都适用,且不受反应物状态的限制。升温时,化学反应速率增大;降温时,化学反应速率减小。
(3)压强:
①对于没有气体参与的化学反应,由于改变压强,物质的浓度变化很小,可忽略不计,对化学反应速率无影响。
②对于有气体参加的反应。
a.恒温时:
b.恒温、恒容时:
c.恒温、恒压时:
(4)催化剂
①催化剂的使用与反应过程的能量变化:
加入催化剂改变反应的历程,降低反应所需的活化能,反应体系中活化分子百分数提高,使反应速率显著增大,但不改变反应过程中的反应热,能量变化如图。
②催化剂能改变化学反应的速率,但反应前后质量和化学性质不发生改变,催化剂具有选择性,不同的反应有不同的催化剂。
③若催化剂是酶,要注意酶只有在温和条件下催化效果才最好,若温度过高,则酶会变性,从而失去催化作用。
归纳总结 化学反应速率影响因素类试题的分析方法
(1)控制变量法。
当某种物质发生化学反应时,反应速率的大小不仅取决于该物质的本质特性,还受反应物的浓度、温度、压强、催化剂、固体表面积等外界因素的影响。当研究其中某个因素对化学反应速率的影响时,需要控制其他因素不变,这种方法称为控制变量法。
(2)分清主次法。
当多个因素同时影响反应速率时,要分清哪个是主要因素。如锌与稀硫酸反应时,氢气的生成速率先由小变大,再由大变小,这是因为锌与稀硫酸反应时放热,体系温度逐渐升高,此时温度对反应速率的影响占主导地位,所以氢气的生成速率由小变大;一段时间后,反应体系中H+的浓度减小,此时浓度对反应速率的影响占主导地位,所以氢气的生成速率又由大变小。
应用体验
1.决定化学反应速率的主要因素是( )
A.反应物的组成、结构和性质
B.加入催化剂
C.温度和压强
D.各反应物和生成物的浓度
A
解析 决定化学反应速率的主要因素是反应物本身的性质,而影响反应速率的次要因素是浓度、温度、压强、催化剂等。
2.下列四个容积相同的密闭容器中,发生反应:2SO2+O2 2SO3。生成SO3的反应速率最大的是( )
容器 温度/℃ 催化剂
A 2 1 400 无
B 2 2 400 有
C 4 2 500 无
D 4 2 500 有
D
解析 反应物浓度越大、反应温度越高、使用催化剂均能提高反应速率。结合题表中所列条件,生成SO3的反应速率最大的是D。
3.(2023河北邢台高二月考)下列措施不能改变相应化学反应速率的是
( )
A.在铁制品表面刷油漆——铁的腐蚀速率
B.高炉炼铁增加炉高——CO的反应速率
C.食物放在冰箱中储存——食物的腐败速率
D.烧煤时用煤粉代替煤块——煤的燃烧速率
B
解析 铁表面刷油漆,阻止铁与氧气接触反应,降低反应速率,A不符合题意;高炉炼铁增加炉高并不能改变CO反应速率,B符合题意;冰箱中温度低,反应速率减慢,C不符合题意;烧煤时用煤粉代替煤块,增大了固体接触面积,可以提高煤的燃烧速率,D不符合题意。
4.(2023河北部分学校高二联考)生活中处处有化学,下列措施的目的不是改变反应速率的是( )
A.在冰箱或冰柜中冷藏食品
B.将黄铁矿粉碎后再加入沸腾炉
C.制作蛋糕、面包等焙烤食品时加入膨松剂
D.在食品包装袋内放置装有还原铁粉的小袋
C
解析 将食品放入冰箱中的目的是降低食品腐败的速率,A不符合题意;将黄铁矿粉碎的目的是为了增大FeS2与O2的接触面积,从而增大反应速率,B不符合题意;加入膨松剂的目的是为了使食品膨松,C符合题意;在食品包装袋中放置还原铁粉的目的是为了防止食品氧化,减慢食品变质的速率,D不符合题意。
5.在X(s)+2Y(g) 3Z(g)的反应体系中,现采取下列措施:①增加X的量;②缩小气体体积,增大压强;③恒容下充入惰性气体He(不参与反应);④恒压下充入惰性气体He;⑤通入Y,其中能够使反应速率增大的措施是( )
A.①③ B.②⑤
C.②③⑤ D.①②④
B
解析 ①由于X的状态是固体,增加固体的量,不影响反应速率;②该反应是有气体参加的反应,缩小气体体积增大压强,反应速率增大;③恒容条件下,通入惰性气体,未改变反应物的浓度,反应速率不变;④恒压下充入惰性气体,导致体积增大,反应物浓度变小,反应速率减小;⑤通入Y(g),增大反应物浓度,反应速率增大,则②⑤符合题干要求,选B。
6.(2023河北邯郸魏县五中高二期中)一定量的锌粉和6 mol·L-1的过量盐酸反应,当向其中加入少量的下列物质时,能够加快反应速率,又不影响产生H2的总量的是( )
①石墨粉 ②CuO ③铜粉 ④铁粉 ⑤浓盐酸
A.①②⑤ B.①③⑤
C.③④⑤ D.①③④
B
解析 ①石墨、锌及盐酸可构成原电池,锌是负极,能加快反应速率,生成H2的总量不变,符合题意;②氧化铜溶于盐酸生成氯化铜,CuCl2和锌发生置换反应,生成铜,Zn、Cu与盐酸构成原电池,加快反应速率,但由于与盐酸反应的Zn减少,生成的氢气减少,不符合题意;③Zn、Cu与盐酸构成原电池,加快反应速率,生成H2的总量不变,符合题意;④铁能和盐酸反应产生氢气,产生H2总量增多,不符合题意;⑤增大氢离子浓度,反应速率增大,生成H2的总量不变,符合题意;答案选B。
7.下列有关反应速率的说法正确的是( )
A.用铁片和稀硫酸反应制氢气时,改用98%的硫酸可以加快反应速率
B.100 mL 2 mol·L-1的盐酸与锌片反应,加入适量的氯化钠溶液,反应速率
不变
C.SO2的催化氧化反应是一个放热的反应,所以升高温度,反应速率变慢
D.汽车尾气中的NO和CO可以缓慢反应生成N2和CO2,减小压强,反应速率变慢
D
解析 稀硫酸改为98%的硫酸,铁在浓硫酸中钝化而不能产生氢气,A项错误;100 mL 2 mol·L-1的盐酸与锌片反应,加入适量的氯化钠溶液,稀释了盐酸,氢离子浓度下降,故反应速率下降,B项错误;升高温度,反应速率加快,C项错误;有气体参加的反应,减小压强反应速率变慢,D项正确。
8.反应3Fe(s)+4H2O(g) Fe3O4(s)+4H2(g)在一可变容积的密闭容器中进行,试回答:
(1)增加Fe的量,其反应速率 (填“增大”“不变”或“减小”,下同)。
(2)将容器的容积缩小一半,其反应速率 。
(3)保持容积不变,充入N2使体系压强增大,其反应速率 。
(4)保持压强不变,充入N2使容器的容积增大,其反应速率 。
答案 (1)不变 (2)增大 (3)不变 (4)减小
解析 (1)由于Fe是固体,改变Fe的量,反应物浓度不变,故反应速率不变。(2)将容器容积缩小一半,则反应物浓度增大,故反应速率增大。(3)容器容积不变,充入N2,反应物浓度不变,故反应速率不变。(4)保持容器内压强不变,充入N2相当于减小压强,即反应物和生成物浓度均减小,故反应速率减小。
本 课 结 束
专题2
第一单元 第2课时 影响化学反应速率的因素
基础落实·必备知识全过关
重难探究·能力素养全提升
目录索引
素养 目标 1.通过实验探究温度、浓度、压强和催化剂对化学反应速率的影响,培养分析、处理数据并从中获取信息的能力,通过实验探究更多影响化学反应速率的外界因素,培养科学探究与创新意识的化学核心素养。
2.理解活化能的概念,并能利用活化能解释外界条件对化学反应速率的影响。
3.认识化学反应速率的调控在生产、生活和科学研究领域中的重要作用。
基础落实·必备知识全过关
一、活化能和碰撞理论
1.基元反应
反应物分子经过一次碰撞就转化为产物分子的反应。
2.有效碰撞
(1)反应发生的先决条件是反应物分子间必须相互碰撞。
(2)反应物分子的每一次碰撞并不是都能发生反应, 的碰撞称为有效碰撞。
能发生反应
3.活化分子和活化能
普通分子+活化能―→活化分子
有效碰撞
所有分子
4.反应物、生成物的能量与活化能的关系
活化能
放出的能量
反应热
教材阅读想一想阅读教材图2-6
思考:有效碰撞发生的两个条件是什么
提示 有效碰撞必须满足两个条件:①发生碰撞的分子具有足够高的能量;②分子在一定的方向上发生碰撞。
易错辨析判一判
(1)活化分子间的碰撞一定能发生化学反应。( )
(2)普通分子间的碰撞有时也能发生化学反应。( )
(3)化学反应的实质是原子的重新组合。( )
(4)化学反应的实质是旧化学键的断裂和新化学键的形成过程。( )
×
提示 活化分子需要有合适取向才能发生有效碰撞。
×
提示 普通分子不能进行有效碰撞。
√
√
二、外界因素对化学反应速率的影响
1.浓度
反应物浓度增大→单位体积内活化分子数 →单位时间内有效碰撞次数 →反应速率 ;反之,反应物浓度减小,则与之相反(注意:浓度改变引起了活化分子浓度的改变,而活化分子百分数不变)。
2.压强
对于 的化学反应,若其他条件不变, ,气体体积减小,反应物浓度增大,单位体积内活化分子数增多,有效碰撞次数增多,反应速率 ; ,反应速率 。压强对无气体参加的反应的反应速率 影响。
增多
增加
加快
有气体参加
增大压强
加快
减小压强
减慢
无
3.温度
在浓度一定时,升高温度,反应物分子的能量 ,使一部分原来能量
的分子变成 ,从而增大了反应物分子中活化分子的 ,使 增多,因而使反应速率 。此外,由于温度升高,会使分子的运动速率加快,这样单位时间里反应物分子间的碰撞次数增加,反应速率也会相应地加快。但前者是反应加快的主要原因。
增加
较低
活化分子
百分数
有效碰撞次数
增大
4.催化剂
(1)催化剂能够增大化学反应速率的原因是它可使 发生改变,
反应活化能,使更多的反应物分子成为 ,大大增加单位体积内反应物分子中 所占的百分数,从而可以成千上万倍地增大化学反应速率。
(2)对于一个化学反应,不同催化剂的催化效果不同。实验时应选用合适的催化剂。
反应途径
降低
活化分子
活化分子
教材阅读想一想阅读教材图2-9
思考:催化剂对活化能和反应热有什么影响
提示 催化剂能降低正反应和逆反应的活化能,对反应热无影响。
易错辨析判一判
(1)增大压强一定能加快化学反应速率。( )
(2)用相同质量的锌粉和锌片分别与相同浓度的足量盐酸反应,产生氢气的量和速率都相同。( )
(3)催化剂参与化学反应,但反应前后的化学性质和质量均保持不变。
( )
×
×
提示 锌粉反应速率快。
√
重难探究·能力素养全提升
探究一 活化能和碰撞理论
情境探究
在山区,有的公路需要盘山而建,这样相对于直线行驶,不仅路程上会数倍加大,而且如果海拔过高,还有恶劣的雨雪天气,就会增大行车难度。为了缩短行车距离和避免大坡道而从山岭或丘陵下穿越修建隧道,可使行车路线接近于直线来回于两地之间,这不仅节约了时间,而且更加安全。在化学反应中,有的反应很快,有的反应很慢,取决于什么因素
(1)对于由多个基元反应组成的化学反应,该反应的快慢是由哪步基元反应决定的
提示 由最慢的一步基元反应决定。
(2)反应历程与化学反应速率有什么关系
(3)活化能与反应速率的关系是什么
提示 一个化学反应的快慢取决于反应历程中反应速率最慢的基元反应。反应物的结构和反应条件决定着一个反应的历程,而反应历程的差别又造成了化学反应速率的不同。
提示 活化能越低→活化分子的百分数越大→单位体积内活化分子数越多→有效碰撞次数越多→反应速率越快。
方法突破
活化分子、有效碰撞与反应速率的关系
应用体验
1.改变外界条件可以影响化学反应速率,针对反应H2(g)+I2(g) 2HI(g),其中能使活化分子百分数增加的是( )
①增大反应物浓度 ②压缩容器容积 ③升高体系的温度 ④使用催化剂
A.①② B.②③ C.①④ D.③④
D
解析 ①增大反应物浓度,使单位体积内活化分子数增加,但不能使活化分子百分数增加;②压缩容器容积,增大气体的压强,使单位体积内活化分子数增加,但不能使活化分子百分数增加;③升高体系的温度,使活化分子百分数增加;④催化剂能降低反应的活化能,使活化分子百分数增加。③④符合题意,故选D。
2.下列有关活化分子与活化能的说法正确的是( )
A.活化分子间所发生的碰撞均为有效碰撞
B.活化分子的平均能量称为活化能
C.增大压强一定使单位体积内活化分子数增多,反应速率加快
D.升高温度可使活化分子百分数增加,反应速率加快
D
解析 有效碰撞还需要活化分子在碰撞时具有合适的取向,故A项错误;活化分子的平均能量与所有分子的平均能量之差称为活化能,故B项错误;增大压强,使单位体积内活化分子数增多,只针对于气体,如果不是气体则不成立,故C项错误;升高温度,活化分子百分数增加,单位体积内活化分子数也大大增加,有效碰撞机会增大,反应速率加快,故D项正确。
归纳总结
3.下列说法正确的是( )
A.增大反应物浓度,可增大单位体积内活化分子的百分数,从而使有效碰撞次数增多
B.有气体参加的化学反应,若增大压强(即缩小反应容器的容积),可增大活化分子的百分数,从而使反应速率增大
C.升高温度能使化学反应速率增大的主要原因是减小了反应物分子中活化分子的百分数
D.催化剂能增大单位体积内活化分子的百分数,从而成千上万倍地增大反应速率
D
解析 增大浓度,单位体积内活化分子数目增多,活化分子百分数不变,则使有效碰撞次数增大,反应速率加快,A项错误;有气体参加的化学反应,若增大压强(即缩小反应容器的容积),单位体积内活化分子数目增多,从而使反应速率增大,但活化分子百分数不变,B项错误;升高温度能使化学反应速率增大的主要原因是提供分子发生反应需要的能量,活化分子的百分数增大,从而使有效碰撞次数增大,则反应速率加快,C项错误;催化剂能增大单位体积内活化分子的百分数,从而成千上万倍地增大反应速率,D项正确。
4.合成气(CO和H2)是目前化工方面常用的原料,下面是用甲烷制备合成气的两种方法:
①CH4(g)+H2O(g) CO(g)+3H2(g)
ΔH1=216 kJ·mol-1;
②2CH4(g)+O2(g) ══ 2CO(g)+4H2(g)
ΔH2=-72 kJ·mol-1。
其中一个反应的反应过程与能量变化关系
如图所示。则下列说法正确的是( )
A.E1表示2CH4(g)+O2(g) ══2CO(g)+4H2(g)的活化能
B.E2表示CH4(g)+H2O(g) CO(g)+3H2(g)的活化能
C.该图示为反应②的反应过程与能量变化示意图
D.一般情况下,加入催化剂,既能降低E1,也能降低E2,但不能改变E1与E2的差值
D
解析 已知反应①是吸热反应,反应②是放热反应,而图像所表示的是吸热反应即反应①。所以E1表示CH4(g)+H2O(g) CO(g)+3H2(g)的活化能,A项错误;E2表示CO(g)+3H2(g) CH4(g)+H2O(g)的活化能,B项错误;题图所示为反应①的反应过程与能量变化示意图,C项错误;加入催化剂,正、逆反应的活化能都降低了,即E1、E2都降低,但二者的差值不变,D项正确。
探究二 外界因素对化学反应速率的影响
情境探究
钢铁生锈的条件是水与氧气,空气中水蒸气含量越高,铁越容易生锈;用高压锅煮东西更快;汽车发动机中的活塞快速压缩可燃气体,产生强劲动力;往锅炉燃烧室里通入空气,增大氧气浓度,使燃烧加快等等。想一想,这些反应为什么会加快
(1)温度对化学反应速率有何影响
提示 当其他条件不变时,升高温度,化学反应速率增大;降低温度,化学反应速率减小。
(2)催化剂能够加快反应速率的原理是什么
提示 催化剂降低了反应的活化能,普通分子变成活化分子,活化分子的百分含量增大,因此活化分子的浓度增大,有效碰撞次数增大,从而成千上万倍地增大化学反应速率。
方法突破
外界因素对化学反应速率影响的深化理解
(1)浓度:
①固体或纯液体的浓度为常数,所以增加其用量时,化学反应速率不变。
②增大固体的表面积或将固体溶于一定溶剂,能增大化学反应速率。
(2)温度:
温度对反应速率的影响规律,对吸热反应、放热反应都适用,且不受反应物状态的限制。升温时,化学反应速率增大;降温时,化学反应速率减小。
(3)压强:
①对于没有气体参与的化学反应,由于改变压强,物质的浓度变化很小,可忽略不计,对化学反应速率无影响。
②对于有气体参加的反应。
a.恒温时:
b.恒温、恒容时:
c.恒温、恒压时:
(4)催化剂
①催化剂的使用与反应过程的能量变化:
加入催化剂改变反应的历程,降低反应所需的活化能,反应体系中活化分子百分数提高,使反应速率显著增大,但不改变反应过程中的反应热,能量变化如图。
②催化剂能改变化学反应的速率,但反应前后质量和化学性质不发生改变,催化剂具有选择性,不同的反应有不同的催化剂。
③若催化剂是酶,要注意酶只有在温和条件下催化效果才最好,若温度过高,则酶会变性,从而失去催化作用。
归纳总结 化学反应速率影响因素类试题的分析方法
(1)控制变量法。
当某种物质发生化学反应时,反应速率的大小不仅取决于该物质的本质特性,还受反应物的浓度、温度、压强、催化剂、固体表面积等外界因素的影响。当研究其中某个因素对化学反应速率的影响时,需要控制其他因素不变,这种方法称为控制变量法。
(2)分清主次法。
当多个因素同时影响反应速率时,要分清哪个是主要因素。如锌与稀硫酸反应时,氢气的生成速率先由小变大,再由大变小,这是因为锌与稀硫酸反应时放热,体系温度逐渐升高,此时温度对反应速率的影响占主导地位,所以氢气的生成速率由小变大;一段时间后,反应体系中H+的浓度减小,此时浓度对反应速率的影响占主导地位,所以氢气的生成速率又由大变小。
应用体验
1.决定化学反应速率的主要因素是( )
A.反应物的组成、结构和性质
B.加入催化剂
C.温度和压强
D.各反应物和生成物的浓度
A
解析 决定化学反应速率的主要因素是反应物本身的性质,而影响反应速率的次要因素是浓度、温度、压强、催化剂等。
2.下列四个容积相同的密闭容器中,发生反应:2SO2+O2 2SO3。生成SO3的反应速率最大的是( )
容器 温度/℃ 催化剂
A 2 1 400 无
B 2 2 400 有
C 4 2 500 无
D 4 2 500 有
D
解析 反应物浓度越大、反应温度越高、使用催化剂均能提高反应速率。结合题表中所列条件,生成SO3的反应速率最大的是D。
3.(2023河北邢台高二月考)下列措施不能改变相应化学反应速率的是
( )
A.在铁制品表面刷油漆——铁的腐蚀速率
B.高炉炼铁增加炉高——CO的反应速率
C.食物放在冰箱中储存——食物的腐败速率
D.烧煤时用煤粉代替煤块——煤的燃烧速率
B
解析 铁表面刷油漆,阻止铁与氧气接触反应,降低反应速率,A不符合题意;高炉炼铁增加炉高并不能改变CO反应速率,B符合题意;冰箱中温度低,反应速率减慢,C不符合题意;烧煤时用煤粉代替煤块,增大了固体接触面积,可以提高煤的燃烧速率,D不符合题意。
4.(2023河北部分学校高二联考)生活中处处有化学,下列措施的目的不是改变反应速率的是( )
A.在冰箱或冰柜中冷藏食品
B.将黄铁矿粉碎后再加入沸腾炉
C.制作蛋糕、面包等焙烤食品时加入膨松剂
D.在食品包装袋内放置装有还原铁粉的小袋
C
解析 将食品放入冰箱中的目的是降低食品腐败的速率,A不符合题意;将黄铁矿粉碎的目的是为了增大FeS2与O2的接触面积,从而增大反应速率,B不符合题意;加入膨松剂的目的是为了使食品膨松,C符合题意;在食品包装袋中放置还原铁粉的目的是为了防止食品氧化,减慢食品变质的速率,D不符合题意。
5.在X(s)+2Y(g) 3Z(g)的反应体系中,现采取下列措施:①增加X的量;②缩小气体体积,增大压强;③恒容下充入惰性气体He(不参与反应);④恒压下充入惰性气体He;⑤通入Y,其中能够使反应速率增大的措施是( )
A.①③ B.②⑤
C.②③⑤ D.①②④
B
解析 ①由于X的状态是固体,增加固体的量,不影响反应速率;②该反应是有气体参加的反应,缩小气体体积增大压强,反应速率增大;③恒容条件下,通入惰性气体,未改变反应物的浓度,反应速率不变;④恒压下充入惰性气体,导致体积增大,反应物浓度变小,反应速率减小;⑤通入Y(g),增大反应物浓度,反应速率增大,则②⑤符合题干要求,选B。
6.(2023河北邯郸魏县五中高二期中)一定量的锌粉和6 mol·L-1的过量盐酸反应,当向其中加入少量的下列物质时,能够加快反应速率,又不影响产生H2的总量的是( )
①石墨粉 ②CuO ③铜粉 ④铁粉 ⑤浓盐酸
A.①②⑤ B.①③⑤
C.③④⑤ D.①③④
B
解析 ①石墨、锌及盐酸可构成原电池,锌是负极,能加快反应速率,生成H2的总量不变,符合题意;②氧化铜溶于盐酸生成氯化铜,CuCl2和锌发生置换反应,生成铜,Zn、Cu与盐酸构成原电池,加快反应速率,但由于与盐酸反应的Zn减少,生成的氢气减少,不符合题意;③Zn、Cu与盐酸构成原电池,加快反应速率,生成H2的总量不变,符合题意;④铁能和盐酸反应产生氢气,产生H2总量增多,不符合题意;⑤增大氢离子浓度,反应速率增大,生成H2的总量不变,符合题意;答案选B。
7.下列有关反应速率的说法正确的是( )
A.用铁片和稀硫酸反应制氢气时,改用98%的硫酸可以加快反应速率
B.100 mL 2 mol·L-1的盐酸与锌片反应,加入适量的氯化钠溶液,反应速率
不变
C.SO2的催化氧化反应是一个放热的反应,所以升高温度,反应速率变慢
D.汽车尾气中的NO和CO可以缓慢反应生成N2和CO2,减小压强,反应速率变慢
D
解析 稀硫酸改为98%的硫酸,铁在浓硫酸中钝化而不能产生氢气,A项错误;100 mL 2 mol·L-1的盐酸与锌片反应,加入适量的氯化钠溶液,稀释了盐酸,氢离子浓度下降,故反应速率下降,B项错误;升高温度,反应速率加快,C项错误;有气体参加的反应,减小压强反应速率变慢,D项正确。
8.反应3Fe(s)+4H2O(g) Fe3O4(s)+4H2(g)在一可变容积的密闭容器中进行,试回答:
(1)增加Fe的量,其反应速率 (填“增大”“不变”或“减小”,下同)。
(2)将容器的容积缩小一半,其反应速率 。
(3)保持容积不变,充入N2使体系压强增大,其反应速率 。
(4)保持压强不变,充入N2使容器的容积增大,其反应速率 。
答案 (1)不变 (2)增大 (3)不变 (4)减小
解析 (1)由于Fe是固体,改变Fe的量,反应物浓度不变,故反应速率不变。(2)将容器容积缩小一半,则反应物浓度增大,故反应速率增大。(3)容器容积不变,充入N2,反应物浓度不变,故反应速率不变。(4)保持容器内压强不变,充入N2相当于减小压强,即反应物和生成物浓度均减小,故反应速率减小。
本 课 结 束
