2.2.2 化学平衡状态 课件 (共47张PPT)2023-2024学年高二化学苏教版选择性必修1
文档属性
| 名称 | 2.2.2 化学平衡状态 课件 (共47张PPT)2023-2024学年高二化学苏教版选择性必修1 |

|
|
| 格式 | pptx | ||
| 文件大小 | 2.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-08 14:35:47 | ||
图片预览










文档简介
(共47张PPT)
专题2
第二单元 第2课时 化学平衡状态
基础落实·必备知识全过关
重难探究·能力素养全提升
目录索引
素养 目标 1.了解化学反应的可逆性。
2.认识化学平衡状态的特征,能够描述平衡的建立过程,能识别有关化学平衡图像,培养变化观念与平衡思想的化学核心素养。
基础落实·必备知识全过关
一、可逆反应
1.定义
在同一条件下,既能向 方向进行,同时又能向 方向进行的反应。
2.表示方法
可逆反应方程式常用“”连接,把从左向右进行的反应称为 ,把从右向左进行的反应称为 。
正反应
逆反应
正反应
逆反应
3.特点
(1)同一条件下,正反应和逆反应 。
(2)反应 进行到底,反应物不能完全转化为生成物。
反应物的转化率小于100%
(3)反应体系中,与化学反应有关的各种物质 。
(4)反应达到限度时,反应 。
同时发生、同时存在
不能
共存于同一反应体系
仍在进行,没有停止
教材阅读想一想阅读教材“化学平衡状态”中第1个【交流讨论】
思考:可逆反应的特点是什么
提示 可逆反应指在同一条件下,可同时向正、逆两个方向进行的反应,可逆反应存在一定的限度。
易错辨析判一判
(1)可逆反应进行到一定程度时,反应就会停止。( )
(2)H2和I2的化合与HI的分解是可逆反应。( )
(3)电解水生成H2与O2和H2与O2转化成H2O是可逆反应。( )
×
提示 可逆反应为动态平衡。
√
×
提示 反应条件不同,不是可逆反应。
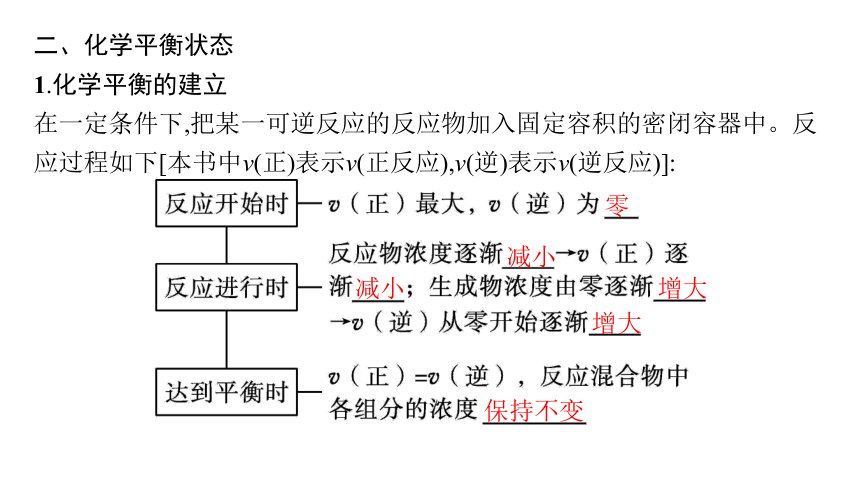
二、化学平衡状态
1.化学平衡的建立
在一定条件下,把某一可逆反应的反应物加入固定容积的密闭容器中。反应过程如下[本书中v(正)表示v(正反应),v(逆)表示v(逆反应)]:
零
减小
减小
增大
增大
保持不变
以上过程可用下图表示:
对于一个确定的可逆反应,如果其他条件一定,反应无论从反应物开始还是从生成物开始,最后都能建立化学平衡状态
2.化学平衡状态
一定条件下,可逆反应中,正反应速率与逆反应速率相等,反应混合物中各种物质的 保持不变的状态。
浓度或质量
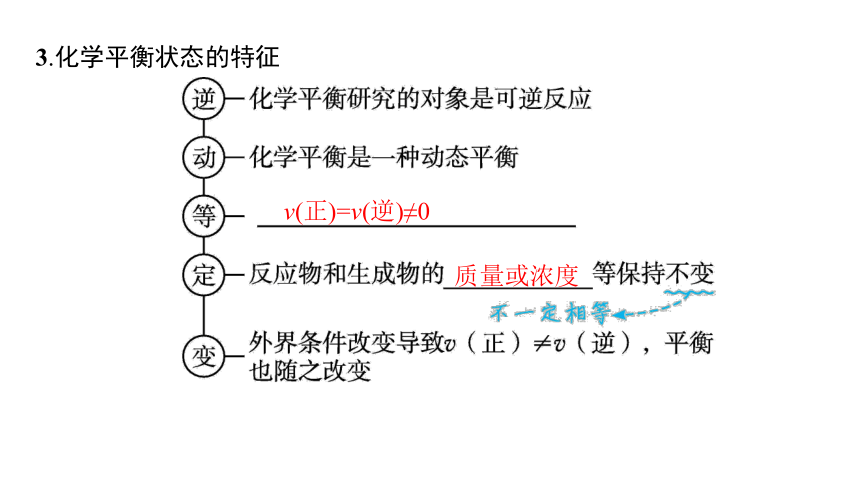
3.化学平衡状态的特征
v(正)=v(逆)≠0
质量或浓度
教材阅读想一想阅读教材“化学平衡状态”中第2个【交流讨论】
思考:可逆反应达平衡状态的标志是什么
提示 v(正)=v(逆)≠0;各组分百分含量不随时间变化而变化。
易错辨析判一判
(1)在化学平衡建立过程中,v(正)一定大于v(逆)。( )
(2)恒温恒容下进行的可逆反应:2SO2(g)+O2(g) 2SO3(g),当SO3的生成速率与SO2的消耗速率相等时,反应达到平衡状态。( )
(3)在一定条件下,向密闭容器中充入1 mol N2和3 mol H2充分反应,可生成
2 mol NH3。( )
×
提示 反应逆向进行时,v(逆)大于v(正)。
×
提示 SO3的生成速率与SO2的消耗速率均表示v(正)。
×
提示 可逆反应存在一定的限度。
重难探究·能力素养全提升
探究一 可逆反应
问题探究
(1)可逆反应等同于可逆过程吗
(2)已知反应:NH3+HCl ══ NH4Cl;NH4Cl NH3↑+HCl↑。这两个反应能称为可逆反应吗 为什么
(3)一定条件下,2 mol N2与3 mol H2充分反应,所得体系中含有哪些成分
提示 不等同。可逆过程包括物理变化和化学变化,而可逆反应属于化学变化。
提示 不能。因为两个反应的反应条件不相同。
提示 N2、H2、NH3。
方法突破
1.可逆反应的特征
(1)双向性:可逆反应分为方向相反的两个反应——正反应和逆反应。
(2)双同性:正、逆反应在相同条件下是同时进行的。
(3)共存性:反应物和生成物共存于同一体系中,反应物的转化率小于100%。
(4)能量转化类型相反:若正反应放热,则逆反应吸热。
2.平衡状态
(1)化学平衡状态是一定条件下可逆反应进行到最大限度的结果。
(2)对于一个给定的可逆反应,如果其他条件一定,不论采取何种途径(反应是从反应物开始或从生成物开始),最后都能建立化学平衡状态。
(3)化学反应达到平衡状态时,各组分的物质的量、体积、浓度等均不变。
3.利用极端假设法确定各物质的浓度范围
假设反应正向或逆向进行到底,求出各物质浓度的最大值和最小值,从而确定它们的浓度范围。
假设反应正向进行到底:
X2(g) + Y2(g) 2Z(g)
假设反应逆向进行到底:
X2(g) + Y2(g) 2Z(g)
平衡体系中各物质的浓度范围为0应用体验
1.一定条件下,A、B、C的起始浓度分别是0.5 mol·L-1、0.1 mol·L-1、1.6 mol·L-1,可逆反应A(g)+B(g) 2C(g)达到平衡时,下列数据合理的是
( )
A.c(A)=1.0 mol·L-1 c(B)=0.2 mol·L-1
B.c(B)=0.5 mol·L-1 c(C)=1.2 mol·L-1
C.c(A)=0.4 mol·L-1 c(C)=1.8 mol·L-1
D.c(A)=0.9 mol·L-1 c(B)=0.5 mol·L-1
D
解析 达到平衡状态时,如果c(A)=1.0 mol·L-1,A增加0.5 mol·L-1,则c(B)=0.6 mol·L-1,A项错误;如果c(B)=0.5 mol·L-1,则C减少0.8 mol·L-1,则c(C)=0.8 mol·L-1,B项错误;如果c(A)=0.4 mol·L-1,则c(B)=0 mol·L-1,可逆反应有一定限度,浓度不可能为0,C项错误;如果c(A)=0.9 mol·L-1,A增加0.4 mol·L-1,则c(B)=0.5 mol·L-1,D项正确。
2.下列反应属于可逆反应的是( )
A.Cl2与水的反应
B.氮气和氧气的反应
C.电解水生成H2和O2,点燃H2和O2的混合物生成H2O
D.甲烷和氯气光照发生的反应
A
解析 氯气与水反应生成盐酸和次氯酸,是可逆反应,A项正确;氮气和氧气在放电条件下反应生成一氧化氮是不可逆反应,B项错误;电解水生成H2和O2需要通电, H2在O2中燃烧生成H2O需要点燃,反应条件不同,不是可逆反应,C项错误;甲烷和氯气光照发生取代反应,不是可逆反应,D项错误。
3.下列各组两个反应互为可逆反应的是( )
C
解析 可逆反应必须是在同一条件下同时向两个方向进行的反应。
4.在密闭容器中有如下反应:X2(g)+Y2(g) 2Z(g)。已知:X2、Y2、Z的起始浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.2 mol·L-1。在一定条件下,当反应达到平衡时,各物质的浓度(单位mol·L-1)可能是( )
A.X2为0.2 B.Y2为0.2
C.Z为0.3 D.Z为0.4
C
解析 已知X2、Y2、Z的起始浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.2 mol·L-1,若将Z完全转化为反应物,由X2(g)+Y2(g) 2Z(g)可知,X2和Y2都增加0.1 mol·L-1,此时c(X2)=0.2 mol·L-1,c(Y2)=0.4 mol·L-1;若将X2完全转化为Z,由X2(g)+Y2(g) 2Z(g)可知,Z增加0.2 mol·L-1,此时c(Z)=0.4 mol·L-1,消耗Y2 0.1 mol·L-1,则c(Y2)=0.2 mol·L-1,但可逆反应不能反应完全,则0探究二 化学平衡状态
情境探究
(1)在19世纪后期,人们发现炼铁高炉排出的高炉气中含有相当量的CO。有人认为是CO与铁矿石的接触时间不长所造成的。英国人耗巨资建成一个高大的炼铁高炉,以增加CO和铁矿石的接触时间,结果发现CO的含量仍然没有减少,你知道是为什么吗
(2)当可逆反应达到平衡状态时,反应停止了吗
炼铁高炉
提示 该反应存在一定的限度,不能进行彻底。
提示 反应没有停止,只是正、逆反应速率相等,但不为零。
(3)在一定温度下的恒容密闭容器中发生反应:N2+3H2 2NH3,当c(N2)∶c(H2)∶c(NH3)=1∶3∶2时,能说明该反应达到平衡状态吗
(4)对于在恒容容器中进行的反应:3A(g)+B(s) 2C(g)+D(g)来说,①气体的总物质的量不变,②压强不变,③气体的密度不变,④混合气体的平均相对分子质量不变。以上哪些可以说明该反应达到平衡状态
提示 不能。当c(N2)、c(H2)、c(NH3)不再随时间变化时,即说明反应达到平衡,且N2、H2、NH3的物质的量之比不一定等于其化学计量数之比。
提示 ③④
方法突破
化学平衡状态的判断
(1)判断依据。
①正反应速率与逆反应速率相等:v(正)=v(逆)。
a.对同一物质,该物质的生成速率等于它的消耗速率。
b.对不同物质,速率之比等于方程式中的化学计量数之比,且必须是不同方向的速率。
②可逆反应在达到平衡过程中的可变量不变。
在可逆反应达到平衡过程中有一些可变量,如浓度、物质的量、百分含量等,当这些可变量不变时,则反应达到平衡。
(2)判断方法。
以反应mA(g)+nB(g) pC(g)+qD(g)为例
v(正)=v(逆) 同一物质 生成速率等于消耗速率
不同物质 化学反应速率之比等于化学计量数之比,且表示不同方向(即“一正一逆”)
可变 量不 变 各物质的量不再变化 各组成成分的质量、物质的量、分子数、物质的量浓度、质量分数、物质的量分数、气体的体积分数等保持不变
气体的总物质的量 m+n≠p+q时,气体的总物质的量一定
恒容条件下的压强 m+n≠p+q时,总压强一定
恒压条件下气体的密度 m+n≠p+q时, 一定
混合气体的平均相对分子质量 当m+n≠p+q时, 一定
有颜色变化的反应 气体的颜色不再变化
应用体验
视角1化学平衡状态的特征
1.一定条件下的某可逆反应,其正反应速率v(正)和逆反应速率v(逆)随反应时间t的变化如图所示。下列判断不正确的是( )
A.t1时刻,v(正)>v(逆)
B.t2时刻,v(正)=v(逆)
C.t2时刻,反应达到最大限度
D.t3时刻,反应停止
D
解析 达到平衡状态时反应并未停止。
2.已知:X(g)+2Y(g) 3Z(g) ΔH=-a kJ·mol-1(a>0)。下列说法不正确的是( )
A.0.1 mol X和0.2 mol Y充分反应生成Z的物质的量一定小于0.3 mol
B.达到化学平衡状态时,X、Y、Z的浓度不再发生变化
C.达到化学平衡状态时,反应体系的温度不再变化
D.升高反应温度,逆反应速率增大、正反应速率减小
D
解析 题给反应属于可逆反应,则0.1 mol X和0.2 mol Y充分反应生成Z的物质的量一定小于0.3 mol,A项正确;达到化学平衡状态时正、逆反应速率相等,X、Y、Z的浓度不再发生变化,B项正确;达到化学平衡状态时,处于动态平衡,则正反应放出的热量等于逆反应吸收的热量,则体系温度不变,C项正确;升高反应温度,正、逆反应速率均增大,D项错误。
视角2化学平衡状态的判断
3.(2023河北任丘一中高二期中)在一定温度下,在固定容积的密闭容器中进行可逆反应:NH2COONH4(s) 2NH3(g)+CO2(g)。不能判断该可逆反应达到平衡的标志是( )
A.v正(NH3)=2v逆(CO2)
B.NH3和CO2的体积分数不随时间而变化
C.容器内的总压强不再随时间而变化
D.混合气体的质量不变
B
解析 化学反应速率之比等于化学计量数之比,平衡状态时v正(NH3)=2v逆(CO2),A不符合题意;NH3和CO2的体积分数始终不随时间而变化,B符合题意;反应中有气体生成,压强一直在改变,当总压强不再随时间而变化时达到平衡状态,C不符合题意;反应中有气体生成,气体质量一直在改变,混合气体的质量不变时反应达到平衡状态,D不符合题意。
4.一定条件下,在容积固定的密闭容器中通入SO3,发生反应2SO3(g) 2SO2(g)+O2(g)。一段时间后,下列情况无法确定反应已达到平衡状态的是
( )
A.浓度:c(SO3)∶c(SO2)∶c(O2)=2∶2∶1
B.速率:v正(SO2)=2v逆(O2)
C.压强:恒温条件下,压强不再发生变化
D.温度:绝热条件下,温度不再发生变化
A
解析 平衡时各组分浓度不变,并不一定为2∶2∶1,A项错误;在任何情况下都存在v正(SO2)=2v正(O2),若v正(SO2)=2v逆(O2),则v正(O2)=v逆(O2),反应达到平衡状态,B项正确;该反应是反应前后气体物质的量不等的反应,反应在恒温、恒容条件下进行,若反应未达到平衡,气体的物质的量发生改变,容器内气体压强就会发生变化,因此当体系压强不变时,反应达到平衡状态,C项正确;反应在绝热条件下进行,若反应正向进行,反应后气体温度会降低,若反应逆向进行,则气体温度会升高,因此当温度不再发生变化时,反应达到平衡状态,D项正确。
5.100 ℃条件下,在2 L的密闭容器中发生反应CO(g)+H2O(g) CO2(g)+H2(g),能说明该反应达到平衡状态的是( )
A.压强不再变化
B.H2的质量不再变化
C.混合气体的密度不变
D.生成H2O的速率和消耗H2的速率相等
B
解析 该反应前后气体的物质的量不变,恒定温度下压强始终不变,故压强不变不能说明该反应达到平衡状态,A不符合题意;H2的质量随着反应正向进行而增加,当其不再变化时,说明该反应达到平衡状态,B符合题意;该反应过程中气体物质总质量不变,恒定温度下气体体积不变,则混合气体的密度始终不变,故密度不变不能说明该反应达到平衡状态,C不符合题意;生成H2O的速率和消耗H2速率均指该反应的逆反应速率,二者始终相等,故不能说明该反应达到平衡状态,D不符合题意。
6.将2 mol SO2和1 mol O2充入一容积固定的密闭容器中,在一定条件下发生反应:2SO2(g)+O2(g) 2SO3(g)。下列物理量不再改变时,并不能说明化学反应已达到平衡状态的是( )
A.混合气体的密度
B.混合气体的压强
C.混合气体的总物质的量
D.混合气体的平均相对分子质量
A
解析 密度是混合气体的质量和容器容积的比值,在反应过程中气体质量和容器容积始终是不变的,则密度不变不能说明反应达到平衡状态,A符合题意;该反应是体积减小的可逆反应,在反应过程中气体的压强也是减小的,因此当气体的总压强不再发生变化时,说明反应达到平衡状态,B不符合题意;该反应是体积减小的可逆反应,在反应过程中气体的总物质的量也是减小的,因此当气体的总物质的量不再发生变化时,可以说明反应达到平衡状态,C不符合题意;混合气体的平均相对分子质量是混合气体的质量和混合气体的总物质的量的比值,质量不变,但物质的量是减小的,因此混合气体的平均相对分子质量不变可说明反应达到平衡状态,D不符合题意。
7.在绝热的某刚性容器中充入1 mol CO和2 mol H2,发生反应:
CO(g)+2H2(g) CH3OH(g) ΔH。下列说法中能够判断该反应一定处于平衡状态的有( )
①容器中CO、H2、CH3OH共存 ②单位时间内生成1 mol CH3OH的同时消耗2 mol H2 ③CO(g)与CH3OH(g)体积之比恒定不变 ④容器中温度恒定不变 ⑤容器中CO、H2、CH3OH的物质的量之比为1∶2∶1
⑥反应容器中压强不随时间变化
A.①②③ B.③④⑥
C.②④⑤ D.②③⑤
B
解析 ①该反应是可逆反应,无论反应是否达到平衡状态,三种物质都存在,所以容器中三种物质共存时不一定达到平衡状态,①错误;②单位时间内生成1 mol CH3OH的同时消耗2 mol H2,只能表明化学反应正向进行,不能体现正逆反应速率相等,②错误;③只要平衡发生移动,CO(g)与CH3OH(g)体积之比就会发生改变,因此当二者体积的比值恒定不变时,反应达平衡状态,③正确;④只要平衡发生移动,容器中温度就会发生改变,则温度恒定不变时,反应达平衡状态,④正确;⑤容器中CO、H2、CH3OH的物质的量之比为1∶2∶1,这与反应的初始物质的量以及反应的转化程度有关,不能确定是否达到平衡状态,⑤错误;⑥该反应是气体体积缩小的反应,只要未达平衡,各物质的浓度就会发生改变,压强也会发生改变,当压强不随时间而改变时,各物质的浓度不变,反应达平衡状态,⑥正确。综合以上分析,③④⑥符合题意,故选B。
8.工业上常用煤和水作原料经过多步反应制得氢气,其中一步反应原理为CO(g)+H2O(g) CO2(g)+H2(g),下面选项的条件中可判断该反应达到平衡状态的是( )
A.单位时间内消耗1 mol的H2O同时生成1 mol的H2
B.两个H—O键断裂的同时有两个C=O键断裂
C.反应容器内的气体密度不再发生变化
D.混合气体的平均相对分子质量不再发生变化
B
解析 单位时间内消耗1 mol的H2O,表示的是正反应速率,生成1 mol的H2表示的也是正反应速率,无法说明反应达到平衡状态,A项错误;两个H—O键断裂表示的是正反应速率,两个C=O键断裂表示的是逆反应速率,且正、逆反应速率相等,说明反应达到平衡状态,B项正确;在恒容密闭容器中,混合气体的质量和体积始终不变,则混合气体的密度始终不变,所以反应容器内的气体密度不再发生变化不能说明反应达到平衡状态,C项错误;该反应是气体的总物质的量和总质量都不变的可逆反应,根据 ,混合气体的平均相对分子质量始终不发生变化,所以平均相对分子质量不变不能说明反应达到平衡状态,D项错误。
9.800 ℃时,在2 L密闭容器内充入一定量的NO(g)和O2(g)发生反应2NO(g)+O2(g) 2NO2(g),n(NO)随时间的变化如下表,各物质的物质的量浓度的变化如图所示(其中有一条是多余的):
时间/s 0 1 2 3 4 5
0.020 0.010 0.008 0.007 0.007 0.007
(1)图中表示NO2的浓度变化曲线的是 。
用O2表示0~2 s内该反应的平均速率v(O2)= 。
(2)能说明该反应已达到平衡状态的是 (填字母)。
A.v(NO2)=2v(O2) B.容器内压强保持不变
C.v逆(NO)=2v正(O2) D.容器内密度保持不变
答案 (1)b 1.5×10-3 mol·L-1·s-1 (2)BC
解析 (1)该反应达到平衡时,n(NO)=0.007 mol,此时n(NO2)=0.013 mol,其浓度变化量为0.006 5 mol·L-1,所以表示NO2浓度变化的曲线是b。(2)A项中没有说明反应进行的方向,不能说明反应已达到平衡状态;D项中容器的容积及气体的总质量都不变,气体的密度始终不变。
本 课 结 束
专题2
第二单元 第2课时 化学平衡状态
基础落实·必备知识全过关
重难探究·能力素养全提升
目录索引
素养 目标 1.了解化学反应的可逆性。
2.认识化学平衡状态的特征,能够描述平衡的建立过程,能识别有关化学平衡图像,培养变化观念与平衡思想的化学核心素养。
基础落实·必备知识全过关
一、可逆反应
1.定义
在同一条件下,既能向 方向进行,同时又能向 方向进行的反应。
2.表示方法
可逆反应方程式常用“”连接,把从左向右进行的反应称为 ,把从右向左进行的反应称为 。
正反应
逆反应
正反应
逆反应
3.特点
(1)同一条件下,正反应和逆反应 。
(2)反应 进行到底,反应物不能完全转化为生成物。
反应物的转化率小于100%
(3)反应体系中,与化学反应有关的各种物质 。
(4)反应达到限度时,反应 。
同时发生、同时存在
不能
共存于同一反应体系
仍在进行,没有停止
教材阅读想一想阅读教材“化学平衡状态”中第1个【交流讨论】
思考:可逆反应的特点是什么
提示 可逆反应指在同一条件下,可同时向正、逆两个方向进行的反应,可逆反应存在一定的限度。
易错辨析判一判
(1)可逆反应进行到一定程度时,反应就会停止。( )
(2)H2和I2的化合与HI的分解是可逆反应。( )
(3)电解水生成H2与O2和H2与O2转化成H2O是可逆反应。( )
×
提示 可逆反应为动态平衡。
√
×
提示 反应条件不同,不是可逆反应。
二、化学平衡状态
1.化学平衡的建立
在一定条件下,把某一可逆反应的反应物加入固定容积的密闭容器中。反应过程如下[本书中v(正)表示v(正反应),v(逆)表示v(逆反应)]:
零
减小
减小
增大
增大
保持不变
以上过程可用下图表示:
对于一个确定的可逆反应,如果其他条件一定,反应无论从反应物开始还是从生成物开始,最后都能建立化学平衡状态
2.化学平衡状态
一定条件下,可逆反应中,正反应速率与逆反应速率相等,反应混合物中各种物质的 保持不变的状态。
浓度或质量
3.化学平衡状态的特征
v(正)=v(逆)≠0
质量或浓度
教材阅读想一想阅读教材“化学平衡状态”中第2个【交流讨论】
思考:可逆反应达平衡状态的标志是什么
提示 v(正)=v(逆)≠0;各组分百分含量不随时间变化而变化。
易错辨析判一判
(1)在化学平衡建立过程中,v(正)一定大于v(逆)。( )
(2)恒温恒容下进行的可逆反应:2SO2(g)+O2(g) 2SO3(g),当SO3的生成速率与SO2的消耗速率相等时,反应达到平衡状态。( )
(3)在一定条件下,向密闭容器中充入1 mol N2和3 mol H2充分反应,可生成
2 mol NH3。( )
×
提示 反应逆向进行时,v(逆)大于v(正)。
×
提示 SO3的生成速率与SO2的消耗速率均表示v(正)。
×
提示 可逆反应存在一定的限度。
重难探究·能力素养全提升
探究一 可逆反应
问题探究
(1)可逆反应等同于可逆过程吗
(2)已知反应:NH3+HCl ══ NH4Cl;NH4Cl NH3↑+HCl↑。这两个反应能称为可逆反应吗 为什么
(3)一定条件下,2 mol N2与3 mol H2充分反应,所得体系中含有哪些成分
提示 不等同。可逆过程包括物理变化和化学变化,而可逆反应属于化学变化。
提示 不能。因为两个反应的反应条件不相同。
提示 N2、H2、NH3。
方法突破
1.可逆反应的特征
(1)双向性:可逆反应分为方向相反的两个反应——正反应和逆反应。
(2)双同性:正、逆反应在相同条件下是同时进行的。
(3)共存性:反应物和生成物共存于同一体系中,反应物的转化率小于100%。
(4)能量转化类型相反:若正反应放热,则逆反应吸热。
2.平衡状态
(1)化学平衡状态是一定条件下可逆反应进行到最大限度的结果。
(2)对于一个给定的可逆反应,如果其他条件一定,不论采取何种途径(反应是从反应物开始或从生成物开始),最后都能建立化学平衡状态。
(3)化学反应达到平衡状态时,各组分的物质的量、体积、浓度等均不变。
3.利用极端假设法确定各物质的浓度范围
假设反应正向或逆向进行到底,求出各物质浓度的最大值和最小值,从而确定它们的浓度范围。
假设反应正向进行到底:
X2(g) + Y2(g) 2Z(g)
假设反应逆向进行到底:
X2(g) + Y2(g) 2Z(g)
平衡体系中各物质的浓度范围为0
1.一定条件下,A、B、C的起始浓度分别是0.5 mol·L-1、0.1 mol·L-1、1.6 mol·L-1,可逆反应A(g)+B(g) 2C(g)达到平衡时,下列数据合理的是
( )
A.c(A)=1.0 mol·L-1 c(B)=0.2 mol·L-1
B.c(B)=0.5 mol·L-1 c(C)=1.2 mol·L-1
C.c(A)=0.4 mol·L-1 c(C)=1.8 mol·L-1
D.c(A)=0.9 mol·L-1 c(B)=0.5 mol·L-1
D
解析 达到平衡状态时,如果c(A)=1.0 mol·L-1,A增加0.5 mol·L-1,则c(B)=0.6 mol·L-1,A项错误;如果c(B)=0.5 mol·L-1,则C减少0.8 mol·L-1,则c(C)=0.8 mol·L-1,B项错误;如果c(A)=0.4 mol·L-1,则c(B)=0 mol·L-1,可逆反应有一定限度,浓度不可能为0,C项错误;如果c(A)=0.9 mol·L-1,A增加0.4 mol·L-1,则c(B)=0.5 mol·L-1,D项正确。
2.下列反应属于可逆反应的是( )
A.Cl2与水的反应
B.氮气和氧气的反应
C.电解水生成H2和O2,点燃H2和O2的混合物生成H2O
D.甲烷和氯气光照发生的反应
A
解析 氯气与水反应生成盐酸和次氯酸,是可逆反应,A项正确;氮气和氧气在放电条件下反应生成一氧化氮是不可逆反应,B项错误;电解水生成H2和O2需要通电, H2在O2中燃烧生成H2O需要点燃,反应条件不同,不是可逆反应,C项错误;甲烷和氯气光照发生取代反应,不是可逆反应,D项错误。
3.下列各组两个反应互为可逆反应的是( )
C
解析 可逆反应必须是在同一条件下同时向两个方向进行的反应。
4.在密闭容器中有如下反应:X2(g)+Y2(g) 2Z(g)。已知:X2、Y2、Z的起始浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.2 mol·L-1。在一定条件下,当反应达到平衡时,各物质的浓度(单位mol·L-1)可能是( )
A.X2为0.2 B.Y2为0.2
C.Z为0.3 D.Z为0.4
C
解析 已知X2、Y2、Z的起始浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.2 mol·L-1,若将Z完全转化为反应物,由X2(g)+Y2(g) 2Z(g)可知,X2和Y2都增加0.1 mol·L-1,此时c(X2)=0.2 mol·L-1,c(Y2)=0.4 mol·L-1;若将X2完全转化为Z,由X2(g)+Y2(g) 2Z(g)可知,Z增加0.2 mol·L-1,此时c(Z)=0.4 mol·L-1,消耗Y2 0.1 mol·L-1,则c(Y2)=0.2 mol·L-1,但可逆反应不能反应完全,则0
情境探究
(1)在19世纪后期,人们发现炼铁高炉排出的高炉气中含有相当量的CO。有人认为是CO与铁矿石的接触时间不长所造成的。英国人耗巨资建成一个高大的炼铁高炉,以增加CO和铁矿石的接触时间,结果发现CO的含量仍然没有减少,你知道是为什么吗
(2)当可逆反应达到平衡状态时,反应停止了吗
炼铁高炉
提示 该反应存在一定的限度,不能进行彻底。
提示 反应没有停止,只是正、逆反应速率相等,但不为零。
(3)在一定温度下的恒容密闭容器中发生反应:N2+3H2 2NH3,当c(N2)∶c(H2)∶c(NH3)=1∶3∶2时,能说明该反应达到平衡状态吗
(4)对于在恒容容器中进行的反应:3A(g)+B(s) 2C(g)+D(g)来说,①气体的总物质的量不变,②压强不变,③气体的密度不变,④混合气体的平均相对分子质量不变。以上哪些可以说明该反应达到平衡状态
提示 不能。当c(N2)、c(H2)、c(NH3)不再随时间变化时,即说明反应达到平衡,且N2、H2、NH3的物质的量之比不一定等于其化学计量数之比。
提示 ③④
方法突破
化学平衡状态的判断
(1)判断依据。
①正反应速率与逆反应速率相等:v(正)=v(逆)。
a.对同一物质,该物质的生成速率等于它的消耗速率。
b.对不同物质,速率之比等于方程式中的化学计量数之比,且必须是不同方向的速率。
②可逆反应在达到平衡过程中的可变量不变。
在可逆反应达到平衡过程中有一些可变量,如浓度、物质的量、百分含量等,当这些可变量不变时,则反应达到平衡。
(2)判断方法。
以反应mA(g)+nB(g) pC(g)+qD(g)为例
v(正)=v(逆) 同一物质 生成速率等于消耗速率
不同物质 化学反应速率之比等于化学计量数之比,且表示不同方向(即“一正一逆”)
可变 量不 变 各物质的量不再变化 各组成成分的质量、物质的量、分子数、物质的量浓度、质量分数、物质的量分数、气体的体积分数等保持不变
气体的总物质的量 m+n≠p+q时,气体的总物质的量一定
恒容条件下的压强 m+n≠p+q时,总压强一定
恒压条件下气体的密度 m+n≠p+q时, 一定
混合气体的平均相对分子质量 当m+n≠p+q时, 一定
有颜色变化的反应 气体的颜色不再变化
应用体验
视角1化学平衡状态的特征
1.一定条件下的某可逆反应,其正反应速率v(正)和逆反应速率v(逆)随反应时间t的变化如图所示。下列判断不正确的是( )
A.t1时刻,v(正)>v(逆)
B.t2时刻,v(正)=v(逆)
C.t2时刻,反应达到最大限度
D.t3时刻,反应停止
D
解析 达到平衡状态时反应并未停止。
2.已知:X(g)+2Y(g) 3Z(g) ΔH=-a kJ·mol-1(a>0)。下列说法不正确的是( )
A.0.1 mol X和0.2 mol Y充分反应生成Z的物质的量一定小于0.3 mol
B.达到化学平衡状态时,X、Y、Z的浓度不再发生变化
C.达到化学平衡状态时,反应体系的温度不再变化
D.升高反应温度,逆反应速率增大、正反应速率减小
D
解析 题给反应属于可逆反应,则0.1 mol X和0.2 mol Y充分反应生成Z的物质的量一定小于0.3 mol,A项正确;达到化学平衡状态时正、逆反应速率相等,X、Y、Z的浓度不再发生变化,B项正确;达到化学平衡状态时,处于动态平衡,则正反应放出的热量等于逆反应吸收的热量,则体系温度不变,C项正确;升高反应温度,正、逆反应速率均增大,D项错误。
视角2化学平衡状态的判断
3.(2023河北任丘一中高二期中)在一定温度下,在固定容积的密闭容器中进行可逆反应:NH2COONH4(s) 2NH3(g)+CO2(g)。不能判断该可逆反应达到平衡的标志是( )
A.v正(NH3)=2v逆(CO2)
B.NH3和CO2的体积分数不随时间而变化
C.容器内的总压强不再随时间而变化
D.混合气体的质量不变
B
解析 化学反应速率之比等于化学计量数之比,平衡状态时v正(NH3)=2v逆(CO2),A不符合题意;NH3和CO2的体积分数始终不随时间而变化,B符合题意;反应中有气体生成,压强一直在改变,当总压强不再随时间而变化时达到平衡状态,C不符合题意;反应中有气体生成,气体质量一直在改变,混合气体的质量不变时反应达到平衡状态,D不符合题意。
4.一定条件下,在容积固定的密闭容器中通入SO3,发生反应2SO3(g) 2SO2(g)+O2(g)。一段时间后,下列情况无法确定反应已达到平衡状态的是
( )
A.浓度:c(SO3)∶c(SO2)∶c(O2)=2∶2∶1
B.速率:v正(SO2)=2v逆(O2)
C.压强:恒温条件下,压强不再发生变化
D.温度:绝热条件下,温度不再发生变化
A
解析 平衡时各组分浓度不变,并不一定为2∶2∶1,A项错误;在任何情况下都存在v正(SO2)=2v正(O2),若v正(SO2)=2v逆(O2),则v正(O2)=v逆(O2),反应达到平衡状态,B项正确;该反应是反应前后气体物质的量不等的反应,反应在恒温、恒容条件下进行,若反应未达到平衡,气体的物质的量发生改变,容器内气体压强就会发生变化,因此当体系压强不变时,反应达到平衡状态,C项正确;反应在绝热条件下进行,若反应正向进行,反应后气体温度会降低,若反应逆向进行,则气体温度会升高,因此当温度不再发生变化时,反应达到平衡状态,D项正确。
5.100 ℃条件下,在2 L的密闭容器中发生反应CO(g)+H2O(g) CO2(g)+H2(g),能说明该反应达到平衡状态的是( )
A.压强不再变化
B.H2的质量不再变化
C.混合气体的密度不变
D.生成H2O的速率和消耗H2的速率相等
B
解析 该反应前后气体的物质的量不变,恒定温度下压强始终不变,故压强不变不能说明该反应达到平衡状态,A不符合题意;H2的质量随着反应正向进行而增加,当其不再变化时,说明该反应达到平衡状态,B符合题意;该反应过程中气体物质总质量不变,恒定温度下气体体积不变,则混合气体的密度始终不变,故密度不变不能说明该反应达到平衡状态,C不符合题意;生成H2O的速率和消耗H2速率均指该反应的逆反应速率,二者始终相等,故不能说明该反应达到平衡状态,D不符合题意。
6.将2 mol SO2和1 mol O2充入一容积固定的密闭容器中,在一定条件下发生反应:2SO2(g)+O2(g) 2SO3(g)。下列物理量不再改变时,并不能说明化学反应已达到平衡状态的是( )
A.混合气体的密度
B.混合气体的压强
C.混合气体的总物质的量
D.混合气体的平均相对分子质量
A
解析 密度是混合气体的质量和容器容积的比值,在反应过程中气体质量和容器容积始终是不变的,则密度不变不能说明反应达到平衡状态,A符合题意;该反应是体积减小的可逆反应,在反应过程中气体的压强也是减小的,因此当气体的总压强不再发生变化时,说明反应达到平衡状态,B不符合题意;该反应是体积减小的可逆反应,在反应过程中气体的总物质的量也是减小的,因此当气体的总物质的量不再发生变化时,可以说明反应达到平衡状态,C不符合题意;混合气体的平均相对分子质量是混合气体的质量和混合气体的总物质的量的比值,质量不变,但物质的量是减小的,因此混合气体的平均相对分子质量不变可说明反应达到平衡状态,D不符合题意。
7.在绝热的某刚性容器中充入1 mol CO和2 mol H2,发生反应:
CO(g)+2H2(g) CH3OH(g) ΔH。下列说法中能够判断该反应一定处于平衡状态的有( )
①容器中CO、H2、CH3OH共存 ②单位时间内生成1 mol CH3OH的同时消耗2 mol H2 ③CO(g)与CH3OH(g)体积之比恒定不变 ④容器中温度恒定不变 ⑤容器中CO、H2、CH3OH的物质的量之比为1∶2∶1
⑥反应容器中压强不随时间变化
A.①②③ B.③④⑥
C.②④⑤ D.②③⑤
B
解析 ①该反应是可逆反应,无论反应是否达到平衡状态,三种物质都存在,所以容器中三种物质共存时不一定达到平衡状态,①错误;②单位时间内生成1 mol CH3OH的同时消耗2 mol H2,只能表明化学反应正向进行,不能体现正逆反应速率相等,②错误;③只要平衡发生移动,CO(g)与CH3OH(g)体积之比就会发生改变,因此当二者体积的比值恒定不变时,反应达平衡状态,③正确;④只要平衡发生移动,容器中温度就会发生改变,则温度恒定不变时,反应达平衡状态,④正确;⑤容器中CO、H2、CH3OH的物质的量之比为1∶2∶1,这与反应的初始物质的量以及反应的转化程度有关,不能确定是否达到平衡状态,⑤错误;⑥该反应是气体体积缩小的反应,只要未达平衡,各物质的浓度就会发生改变,压强也会发生改变,当压强不随时间而改变时,各物质的浓度不变,反应达平衡状态,⑥正确。综合以上分析,③④⑥符合题意,故选B。
8.工业上常用煤和水作原料经过多步反应制得氢气,其中一步反应原理为CO(g)+H2O(g) CO2(g)+H2(g),下面选项的条件中可判断该反应达到平衡状态的是( )
A.单位时间内消耗1 mol的H2O同时生成1 mol的H2
B.两个H—O键断裂的同时有两个C=O键断裂
C.反应容器内的气体密度不再发生变化
D.混合气体的平均相对分子质量不再发生变化
B
解析 单位时间内消耗1 mol的H2O,表示的是正反应速率,生成1 mol的H2表示的也是正反应速率,无法说明反应达到平衡状态,A项错误;两个H—O键断裂表示的是正反应速率,两个C=O键断裂表示的是逆反应速率,且正、逆反应速率相等,说明反应达到平衡状态,B项正确;在恒容密闭容器中,混合气体的质量和体积始终不变,则混合气体的密度始终不变,所以反应容器内的气体密度不再发生变化不能说明反应达到平衡状态,C项错误;该反应是气体的总物质的量和总质量都不变的可逆反应,根据 ,混合气体的平均相对分子质量始终不发生变化,所以平均相对分子质量不变不能说明反应达到平衡状态,D项错误。
9.800 ℃时,在2 L密闭容器内充入一定量的NO(g)和O2(g)发生反应2NO(g)+O2(g) 2NO2(g),n(NO)随时间的变化如下表,各物质的物质的量浓度的变化如图所示(其中有一条是多余的):
时间/s 0 1 2 3 4 5
0.020 0.010 0.008 0.007 0.007 0.007
(1)图中表示NO2的浓度变化曲线的是 。
用O2表示0~2 s内该反应的平均速率v(O2)= 。
(2)能说明该反应已达到平衡状态的是 (填字母)。
A.v(NO2)=2v(O2) B.容器内压强保持不变
C.v逆(NO)=2v正(O2) D.容器内密度保持不变
答案 (1)b 1.5×10-3 mol·L-1·s-1 (2)BC
解析 (1)该反应达到平衡时,n(NO)=0.007 mol,此时n(NO2)=0.013 mol,其浓度变化量为0.006 5 mol·L-1,所以表示NO2浓度变化的曲线是b。(2)A项中没有说明反应进行的方向,不能说明反应已达到平衡状态;D项中容器的容积及气体的总质量都不变,气体的密度始终不变。
本 课 结 束
