8.2化学品的合理使用《探究亚硝酸钠的性质》课件(共16张PPT)2023-2024学年高一下学期化学人教版(2019)必修第二册
文档属性
| 名称 | 8.2化学品的合理使用《探究亚硝酸钠的性质》课件(共16张PPT)2023-2024学年高一下学期化学人教版(2019)必修第二册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 9.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-08 00:00:00 | ||
图片预览





文档简介
(共16张PPT)
探究亚硝酸钠的性质
生活情境
知识卡片——认识亚硝酸钠
白色或淡黄色晶体、有咸味、易溶于水。熔点为271℃
亚硝酸钠
氯化钠
白色固体、有咸味、易溶于水。熔点为801℃
学生活动1:
请利用价类二维图预测亚硝酸钠可能具有的化学性质。
已知:25 ℃ 时,Ka(HNO2)=5.6×10-4 ,
Ksp(AgNO2)=5.86×10-4
环节一:预测亚硝酸钠的化学性质
学生活动2:
环节二:探究亚硝酸钠的化学性质
请根据所给试剂讨论并设计实验方案,进行实验,完成实验报告。
化学试剂:NaNO2溶液、酸性KMnO4溶液、FeSO4溶液、KSCN溶液、稀硫酸、KI-淀粉试纸、AgNO3溶液、稀硝酸。
学生活动3:
环节二:探究亚硝酸钠的化学性质
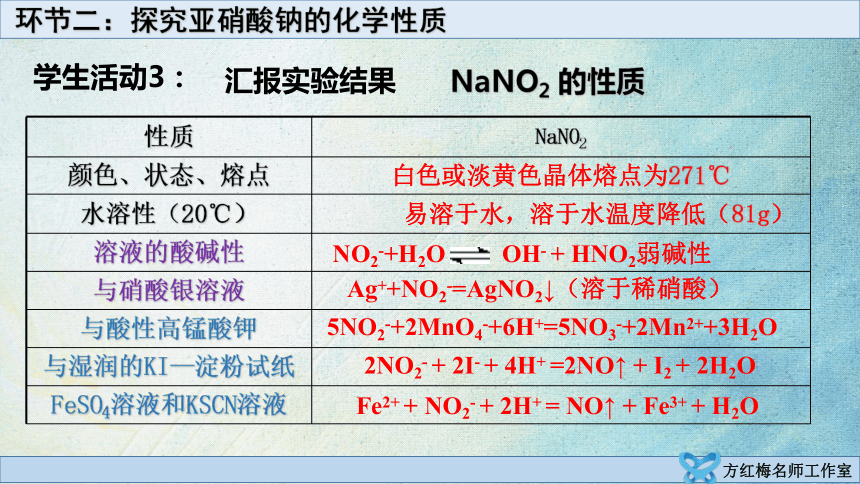
汇报实验结果
性质 NaNO2
颜色、状态、熔点 白色或淡黄色晶体熔点为271℃
水溶性(20℃) 易溶于水,溶于水温度降低(81g)
溶液的酸碱性
与硝酸银溶液
与酸性高锰酸钾
与湿润的KI—淀粉试纸
FeSO4溶液和KSCN溶液
Ag++NO2-=AgNO2↓(溶于稀硝酸)
5NO2-+2MnO4-+6H+=5NO3-+2Mn2++3H2O
2NO2- + 2I- + 4H+ =2NO↑ + I2 + 2H2O
Fe2+ + NO2- + 2H+ = NO↑ + Fe3+ + H2O
NaNO2 的性质
NO2-+H2O OH- + HNO2弱碱性
环节三:实际应用
问题情境1:肉类零食为什么要加亚硝酸钠?
环节三:实际应用
【知识卡片】亚硝酸钠的用途
亚硝酸钠在工业生产中有重要的用途,亚硝酸钠用于纤维纺织品的染色和漂白、照相、生产橡胶、制药等领域,它还广泛用作防锈剂,是建筑业常用的一种混凝土添加剂,也常用于鱼类、肉类等食品的染色和防腐。
环节三:实际应用
问题情境2:亚硝酸钠外观与食盐相似,且均有咸味,你可以用哪些方法区分亚硝酸钠和氯化钠?
问题情境3:误食亚硝酸钠可能导致全身发紫,呼吸困难,呕吐等症状,请你运用学到的知识分析中毒原理和解毒方法。
学生活动4:思考与讨论下列问题
环节三:实际应用
问题情境2:亚硝酸钠外观与食盐相似,且均有咸味,你可以用哪些方法区分亚硝酸钠和氯化钠?
KI-淀粉试纸、稀硫酸
硫酸亚铁溶液和硫氰化钾溶液
测水溶液的pH
固体可以观察外观或加热
环节三:实际应用
小百科
苹果中的多酚类物质在多酚氧化酶的作用下能被空气中的氧气氧化为醌类而变褐色。
滴加有亚硝酸钠溶液的苹果表面快速变成褐色
静置1min
静置5min
静置10min
中毒机理:亚硝酸钠能将血红蛋白氧化为高铁血红蛋白(Fe2+变成了Fe3+).高铁血红蛋白不能携带氧,因此造成人体缺氧中毒。
解毒方法:催吐,洗胃(高锰酸钾),维C,血液清洗。
环节三:实际应用
问题情境3:误食亚硝酸钠可能导致全身发紫,呼吸困难,呕吐等症状,请你运用学到的知识分析中毒原理和解毒方法。
环节四:课堂小结
价类观或原子结构预测物质性质
设计实验方案进行实验探究
研究物质性质的一般思路
分析实验现象得出实验结果
性质决定用途(物质的实际应用)
非氧化还原反应:沉淀、水解、气体
氧化还原反应
当堂检测
1.工业废水中含有亚硝酸盐,以氯化铵处理亚硝酸盐的新工艺已在工业上广泛使用。该反应的生成物不会给环境带来任何污染,写出反应的离子方程式。
NH4++NO2- = N2↑ + 2H2O
2NO2-+ CO(NH2)2 +2H+=CO2 ↑ +2N2↑+3H2O
当堂检测
2. NaNO2像食盐一样有咸味,毒性很强,误食会导致血红蛋白中的Fe2+转化为Fe3+ ,可服用维生素C解毒。关于该过程的叙述,不正确的是________(填字母)。
A.亚硝酸钠的氧化性强于Fe3+ B.维生素C是还原剂
C.维生素C的还原性强于Fe2+ D.亚硝酸钠是还原剂
D
感谢各位的观看
FOR WATCHING
探究亚硝酸钠的性质
生活情境
知识卡片——认识亚硝酸钠
白色或淡黄色晶体、有咸味、易溶于水。熔点为271℃
亚硝酸钠
氯化钠
白色固体、有咸味、易溶于水。熔点为801℃
学生活动1:
请利用价类二维图预测亚硝酸钠可能具有的化学性质。
已知:25 ℃ 时,Ka(HNO2)=5.6×10-4 ,
Ksp(AgNO2)=5.86×10-4
环节一:预测亚硝酸钠的化学性质
学生活动2:
环节二:探究亚硝酸钠的化学性质
请根据所给试剂讨论并设计实验方案,进行实验,完成实验报告。
化学试剂:NaNO2溶液、酸性KMnO4溶液、FeSO4溶液、KSCN溶液、稀硫酸、KI-淀粉试纸、AgNO3溶液、稀硝酸。
学生活动3:
环节二:探究亚硝酸钠的化学性质
汇报实验结果
性质 NaNO2
颜色、状态、熔点 白色或淡黄色晶体熔点为271℃
水溶性(20℃) 易溶于水,溶于水温度降低(81g)
溶液的酸碱性
与硝酸银溶液
与酸性高锰酸钾
与湿润的KI—淀粉试纸
FeSO4溶液和KSCN溶液
Ag++NO2-=AgNO2↓(溶于稀硝酸)
5NO2-+2MnO4-+6H+=5NO3-+2Mn2++3H2O
2NO2- + 2I- + 4H+ =2NO↑ + I2 + 2H2O
Fe2+ + NO2- + 2H+ = NO↑ + Fe3+ + H2O
NaNO2 的性质
NO2-+H2O OH- + HNO2弱碱性
环节三:实际应用
问题情境1:肉类零食为什么要加亚硝酸钠?
环节三:实际应用
【知识卡片】亚硝酸钠的用途
亚硝酸钠在工业生产中有重要的用途,亚硝酸钠用于纤维纺织品的染色和漂白、照相、生产橡胶、制药等领域,它还广泛用作防锈剂,是建筑业常用的一种混凝土添加剂,也常用于鱼类、肉类等食品的染色和防腐。
环节三:实际应用
问题情境2:亚硝酸钠外观与食盐相似,且均有咸味,你可以用哪些方法区分亚硝酸钠和氯化钠?
问题情境3:误食亚硝酸钠可能导致全身发紫,呼吸困难,呕吐等症状,请你运用学到的知识分析中毒原理和解毒方法。
学生活动4:思考与讨论下列问题
环节三:实际应用
问题情境2:亚硝酸钠外观与食盐相似,且均有咸味,你可以用哪些方法区分亚硝酸钠和氯化钠?
KI-淀粉试纸、稀硫酸
硫酸亚铁溶液和硫氰化钾溶液
测水溶液的pH
固体可以观察外观或加热
环节三:实际应用
小百科
苹果中的多酚类物质在多酚氧化酶的作用下能被空气中的氧气氧化为醌类而变褐色。
滴加有亚硝酸钠溶液的苹果表面快速变成褐色
静置1min
静置5min
静置10min
中毒机理:亚硝酸钠能将血红蛋白氧化为高铁血红蛋白(Fe2+变成了Fe3+).高铁血红蛋白不能携带氧,因此造成人体缺氧中毒。
解毒方法:催吐,洗胃(高锰酸钾),维C,血液清洗。
环节三:实际应用
问题情境3:误食亚硝酸钠可能导致全身发紫,呼吸困难,呕吐等症状,请你运用学到的知识分析中毒原理和解毒方法。
环节四:课堂小结
价类观或原子结构预测物质性质
设计实验方案进行实验探究
研究物质性质的一般思路
分析实验现象得出实验结果
性质决定用途(物质的实际应用)
非氧化还原反应:沉淀、水解、气体
氧化还原反应
当堂检测
1.工业废水中含有亚硝酸盐,以氯化铵处理亚硝酸盐的新工艺已在工业上广泛使用。该反应的生成物不会给环境带来任何污染,写出反应的离子方程式。
NH4++NO2- = N2↑ + 2H2O
2NO2-+ CO(NH2)2 +2H+=CO2 ↑ +2N2↑+3H2O
当堂检测
2. NaNO2像食盐一样有咸味,毒性很强,误食会导致血红蛋白中的Fe2+转化为Fe3+ ,可服用维生素C解毒。关于该过程的叙述,不正确的是________(填字母)。
A.亚硝酸钠的氧化性强于Fe3+ B.维生素C是还原剂
C.维生素C的还原性强于Fe2+ D.亚硝酸钠是还原剂
D
感谢各位的观看
FOR WATCHING
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
