3.3.1 盐类水解的原理 影响盐类水解的因素 课件(共48张PPT) 2023-2024学年高二化学苏教版选择性必修1
文档属性
| 名称 | 3.3.1 盐类水解的原理 影响盐类水解的因素 课件(共48张PPT) 2023-2024学年高二化学苏教版选择性必修1 |

|
|
| 格式 | pptx | ||
| 文件大小 | 2.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-08 14:56:57 | ||
图片预览










文档简介
(共48张PPT)
专题3
第三单元 第1课时 盐类水解的原理 影响盐类水解的因素
基础落实·必备知识全过关
重难探究·能力素养全提升
目录索引
素养 目标 1.知道可以通过分析、推理等方法认识盐类水解的本质特征,建立模型。能运用模型解释盐类水解平衡的移动,揭示现象的本质和规律。
2.会判断盐溶液的酸碱性,学会盐类水解的表示方法——水解离子方程式的书写。
3.认识盐类水解有一定限度,是可以调控的。能多角度、动态地分析盐类水解平衡,培养变化观念与平衡思想的化学核心素养。
基础落实·必备知识全过关
一、盐类水解的原理
1.盐溶液的酸碱性
(1)盐的分类(按生成盐的酸、碱的强弱划分)
NaCl、KNO3
NH4Cl、AlCl3、Fe2(SO4)3
强碱弱酸盐
弱酸弱碱盐
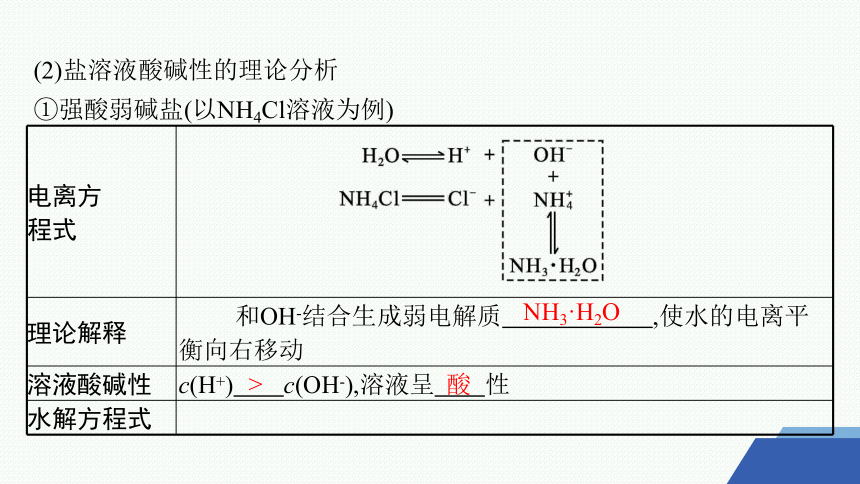
(2)盐溶液酸碱性的理论分析
①强酸弱碱盐(以NH4Cl溶液为例)
电离方 程式
理论解释 和OH-结合生成弱电解质 ,使水的电离平衡向右移动
溶液酸碱性 c(H+) c(OH-),溶液呈 性
水解方程式
NH3·H2O
>
酸
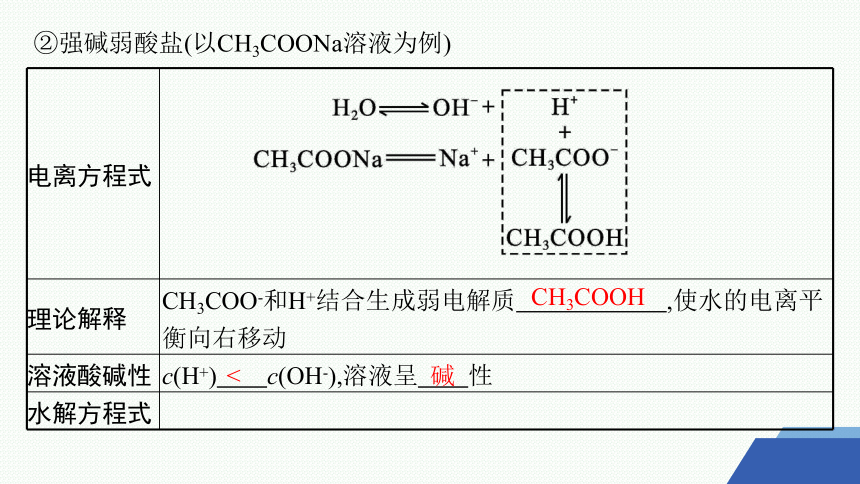
②强碱弱酸盐(以CH3COONa溶液为例)
电离方程式
理论解释 CH3COO-和H+结合生成弱电解质 ,使水的电离平衡向右移动
溶液酸碱性 c(H+) c(OH-),溶液呈 性
水解方程式
CH3COOH
<
碱
③强酸强碱盐(以NaCl溶液为例)
电离过程:NaCl ══ Na++Cl-,H2O H++OH-。水的电离平衡:溶液中没有弱电解质生成,水的电离平衡未受到影响,溶液中c(H+) c(OH-),溶液呈 性。
=
中
2.盐类的水解
(1)定义
盐在水溶液中 与水电离出的 结合生成 的反应。
(2)特征
①一般是 反应,在一定条件下达到化学平衡。
②盐类水解反应是中和反应的逆反应,盐类水解是 热反应。
电离出的离子
H+或OH-
弱电解质
可逆
吸
(3)书写要求
①一般来说,盐类水解的程度不大,应该用可逆号“ ”表示。盐类水解一般不会产生沉淀和气体,所以不用符号“↓”和“↑”表示水解产物。
②多元弱酸盐的水解是分步进行的,水解离子方程式要分步表示。
③多元弱碱阳离子的水解简化成一步写出。
④水解相互促进且水解程度较大,书写时要用“══”“↑”“↓”等。
教材阅读想一想阅读教材图3-22
思考:盐类发生水解时,对水的电离有何影响 酸或碱对水的电离有何影响
提示 盐类的水解促进水的电离,酸或碱抑制水的电离。
易错辨析判一判
(1)碳酸钠溶液显碱性,是因为溶液中c(OH-)>c(H+)。( )
(2)CH3COONa溶液中存在的粒子只有H2O、CH3COO-、Na+、H+、OH-。
( )
(3)盐类的水解过程促进了水的电离。( )
(4)盐类水解后,溶液不是显酸性就是显碱性。( )
√
×
提示 还有CH3COOH。
√
×
提示 也可以显中性,如醋酸铵溶液。
二、影响盐类水解平衡的因素
1.实验探究盐类水解平衡的影响因素
已知0.1 mol·L-1 Fe(NO3)3发生水解反应的离子方程式:Fe3++3H2O Fe(OH)3+3H+。用pH计测量该溶液的pH,根据实验操作填写下表:
可能影响因素 实验操作 现象 解释与结论
盐的 浓度 加水稀释,测溶液的pH 溶液颜色变 ,溶液的pH 加水稀释,c(Fe3+)
,水解平衡向
方向移动
浅
变大
变小
正反应
可能影响因素 实验操作 现象 解释与结论
溶液 的酸 碱性 加硝酸后,测溶液的pH 溶液颜色变 ,溶液的pH 加入硝酸,c(H+)增大,水解平衡向 方向移动,但c(H+)仍比原平衡中c(H+)大
加入少量NaOH溶液 产生 色沉淀,溶液的pH 加入氢氧化钠,OH-消耗H+,c(H+)减小,水解平衡向
方向移动
温度 升高温度 溶液颜色变 ,溶液的pH 升高温度,水解平衡向
方向移动
浅
变小
逆反应
红褐
变大
正反应
深
变小
正反应
2.影响盐类水解平衡的因素及结论
(1)内因:盐本身的性质。组成盐的弱酸根阴离子相对应的酸越弱(或弱碱阳离子对应的碱越弱),水解程度就 。
(2)外因:受温度、浓度及外加酸碱等因素的影响。
①温度:盐的水解是吸热反应,因此升高温度,盐的水解程度 。
②浓度:稀释盐溶液,可以 水解,盐的浓度越小,水解程度 。
③外加酸碱:水解呈酸性的盐溶液,加碱会 水解;加酸会_______ 水解。水解呈碱性的盐溶液,加碱会 水解;加酸会 水解。
④外加盐:加入与盐的水解性质相反的盐会使盐的水解程度 。
越大
增大
促进
越大
促进
抑制
抑制
促进
增大
教材阅读想一想阅读教材“影响盐类水解的因素”中的“批判性思维”
易错辨析判一判
(1)升高温度,碳酸钠溶液的碱性增强。( )
(2)向FeCl3溶液中加入FeCl3固体,其水解程度增大。( )
(3)将氯化铵溶液加水稀释,其水解程度增大。( )
(4)向氯化铁溶液中加氯化铵固体,其水解程度减小。( )
√
×
√
√
重难探究·能力素养全提升
探究一 盐类水解的原理
情境探究
我们知道酸溶液呈酸性,碱溶液呈碱性,那么盐溶液是否呈中性呢 在焊接金属时,往往对接口处进行打磨、清洗。清洗时常用NH4Cl或ZnCl2溶液作为清洗液,因为这两种盐溶液能够溶解接口处的锈斑(主要成分是Fe2O3)。你能解释NH4Cl或ZnCl2溶液除去铁锈的原理吗 通过本节课知识的学习,你就能了解以上事例的原理,了解其中的奥秘。
(1)NaHSO4溶液显酸性还是碱性 原因是什么
(2)pH均为4的H2SO4溶液和NH4Cl溶液中,水电离出的c(H+)相等吗
(3)如何比较同浓度的CH3COONa和NaClO溶液水解的程度
(4)已知在相同条件下NH3·H2O与CH3COOH电离程度几乎相等,CH3COOH的酸性比H2CO3强,那么NH4HCO3溶液显酸性、碱性还是中性
提示 不相等。H2SO4抑制水的电离,NH4Cl能水解,从而促进水的电离,所以NH4Cl溶液中水电离出的c(H+)大。
提示 越弱越水解。
(5)NaHCO3溶液显碱性的原因是什么 用离子方程式分析。
(6)NaHSO3溶液显酸性的原因是什么 用离子方程式分析。
方法突破
1.盐类水解的规律
水解规律:水解看组成,有弱才水解,无弱不水解;越弱越水解,都弱都水解;谁强显谁性,同强显中性,规律要记清。
(1)“有弱才水解,无弱不水解”——盐中有弱酸阴离子或弱碱阳离子才水解;若没有,则不发生水解反应。
(2)“越弱越水解”——弱酸阴离子对应的酸越弱,水解程度越大;弱碱阳离子对应的碱越弱,其水解程度越大。
(3)“都弱都水解”——弱酸弱碱盐电离出的弱酸阴离子和弱碱阳离子都发生水解,且相互促进。
(4)“谁强显谁性”——当盐中的阴离子对应的酸比阳离子对应的碱更容易电离时,水解后盐溶液呈酸性,反之,呈碱性,即强酸弱碱盐溶液显酸性,强碱弱酸盐溶液显碱性。
图解:
2.盐类水解离子方程式的书写
(1)盐类水解的离子方程式一般用“ ”连接,由于水解程度较小,水解生成的弱电解质的浓度很小,一般不生成沉淀或气体,即一般不标“↓”或“↑”符号。
应用体验
视角1水解方程式的书写和正误判断
1.下列反应不属于水解反应或水解方程式不正确的是( )
A.①② B.③④
C.①②④ D.全部
D
解析 ①HCl+H2O ══ H3O++Cl-属于盐酸的电离方程式,故①符合题意;②ZnCl2+2H2O ══ Zn(OH)2+2HCl中,“等号”要改为“可逆号”,故②符合题意;③Na2CO3+2H2O H2CO3+2NaOH中,碳酸钠的水解是分步进行的,不能一步完成,故③符合题意;④Al2(CO3)3+3H2O ══ 2Al(OH)3↓+3CO2↑,水解进行彻底,故④符合题意。
2.下列物质在常温下发生水解时,对应的离子方程式正确的是( )
B
视角2判断盐溶液的酸碱性
3.相同温度、相同物质的量浓度的四种溶液:
①CH3COONa ②NaHSO4 ③NaCl ④C6H5ONa。按pH由大到小的顺序排列,正确的是( )
A.④>①>③>② B.①>④>③>②
C.①>②>③>④ D.④>③>①>②
A
解析 在盐溶液中,由于盐电离产生的离子与水电离出来的H+或OH-结合生成弱电解质,从而破坏了水的电离平衡,使水的电离平衡向电离的方向移动,溶液显示出酸性或碱性。
②NaHSO4不水解但可以电离出H+,溶液呈酸性;③NaCl溶液呈中性;①CH3COONa和④C6H5ONa水解使溶液呈碱性,根据“越弱越水解”的规律, C6H5ONa溶液的碱性强于CH3COONa溶液的碱性。
4.根据表中信息,判断0.10 mol·L-1的下列各物质的溶液pH最大的是( )
酸 电离常数(常温下)
CH3COOH Ka=1.76×10-5
H2CO3 Ka1=4.30×10-7,Ka2=5.61×10-11
H2S Ka1=9.1×10-8,Ka2=1.1×10-12
A.CH3COONa B.Na2CO3 C.NaHCO3 D.Na2S
D
5.已知某温度下,Ka(HCN)=6.2×10-10,Ka(HF)=6.8×10-4, Ka(CH3COOH)=1.7×10-5,Ka(HNO2)=5.1×10-4。物质的量浓度均为
0.1 mol·L-1的下列溶液,pH由大到小的顺序是( )
A.NaCN>NaNO2>CH3COONa>NaF
B.NaF>NaNO2>CH3COONa>NaCN
C.NaCN>CH3COONa>NaNO2>NaF
D.NaCN>CH3COONa>NaF>NaNO2
C
解析 由Ka(HF)>Ka(HNO2)>Ka(CH3COOH)>Ka(HCN)可知,酸性: HF>HNO2>CH3COOH>HCN,则水解能力:CN->CH3COO-> >F-,相同条件下,弱酸根离子的水解能力越强,对应盐溶液的碱性越强,pH越大。
视角3根据盐溶液的酸碱性判断弱酸、弱碱的强弱
6.物质的量浓度相同的三种盐NaX、NaY和NaZ的溶液,其pH依次为8、9、10,则HX、HY、HZ的酸性由强到弱的顺序是( )
A.HX、HZ、HY B.HZ、HY、HX
C.HX、HY、HZ D.HY、HZ、HX
C
解析 同浓度的三种盐溶液,pH越大,说明水解程度越大,所对应的弱酸酸性越弱,即酸性:HX>HY>HZ。
7.(2023广东承德高二检测)已知在常温下测得浓度均为0.1 mol·L-1的下列三种溶液的pH:
溶质 NaHCO3 Na2CO3 NaCN
pH 9.7 11.6 11.1
下列说法中正确的是( )
A.阳离子的物质的量浓度之和:Na2CO3>NaCN>NaHCO3
B.相同条件下的酸性:H2CO3C.三种溶液中均存在电离平衡和水解平衡
D.升高Na2CO3溶液的温度, 减小
C
解析 三种溶液中的阳离子均为Na+和H+,Na2CO3溶液中Na+浓度是其他两种溶液的2倍,阳离子浓度最大,NaCN溶液和NaHCO3溶液中Na+浓度相等,NaCN溶液中H+浓度小于NaHCO3溶液,故阳离子浓度之和的大小顺序为Na2CO3>NaHCO3>NaCN,A项错误; 的水解能力小于CN-,故酸性H2CO3>HCN,B项错误;升高Na2CO3溶液的温度,促进其水解, 增大,D项错误。
探究二 影响水解反应的因素
情境探究
在我们的教学楼、实验室、宿舍等的墙壁上都挂有一种泡沫灭火器。泡沫灭火器内一个容器装有NaHCO3饱和溶液,灭火器内另有一个容器装有Al2(SO4)3溶液。当意外失火时,将泡沫灭火器倒过来即可使两种液体混合,喷出CO2和Al(OH)3,阻止火势蔓延。
(1)泡沫灭火器的使用方法:可手提灭火器上部的提环(注意不得使灭火器过分倾斜,更不能横拿或颠倒),当距离燃烧点10 m左右时,将灭火器颠倒,一只手紧握提环,另一只手挂住灭火器底圈,对准燃烧点,由近至远进行喷射。泡沫灭火器的化学原理是什么
提示 Al3+水解产生H+, 水解产生OH-,则Al3+与 相互促进水解,总反应为Al2(SO4)3+6NaHCO3 ══ 3Na2SO4+2Al(OH)3↓+6CO2↑。
(2)向CH3COONa溶液中再加CH3COONa(s),CH3COO-的水解平衡右移,水解程度为什么减小
(3)为使Na2S溶液中 的值减小,可以采取什么措施 加入NaOH、NaHS是否可以
提示 向CH3COONa溶液中加入CH3COONa(s)平衡右移,但根据勒夏特列原理,CH3COO-浓度增大程度更大,所以水解程度减小。
提示 降温、加入KOH或KHS。
加入NaOH、NaHS不可以,因为水解平衡虽然左移,c(S2-)增大,但c(Na+)增大更多,致使 增大。
(4)NH4Cl溶液加水稀释时c(H+)变小,c(OH-)怎么变
(5)已知:常温下,H2C2O4的电离常数分别是Ka1≈5.90×10-2,Ka2≈6.40×10-5。草酸的钾盐有K2C2O4、KHC2O4。常温下,KHC2O4的水解常数为多少 KHC2O4溶液的酸碱性如何
提示 水解导致溶液呈酸性,稀释NH4Cl溶液时c(H+)变小,c(OH-)应增大。
方法突破
1.盐类水解的平衡常数
(1)水解平衡常数的定义。
在一定温度下,能水解的盐在水溶液中达到水解平衡时,生成的弱酸(或弱碱)浓度和氢氧根离子(或氢离子)浓度之积与溶液中未水解的弱酸根阴离子(或弱碱阳离子)浓度之比是一个常数,该常数就称为水解平衡常数。
(2)水解平衡常数(Kh)与电离常数的定量关系。
其中Kh为水解平衡常数,Ka、Kb分别为弱酸、弱碱的电离平衡常数,KW为水的离子积常数。
因而Ka(或Kb)与KW、Kh的定量关系为Ka·Kh=KW(或Kb·Kh=KW)。
(3)水解平衡常数是描述能水解的盐水解平衡的主要参数。它只受温度的影响,因水解过程是吸热过程,故水解程度随温度的升高而增大。
2.从定性、定量两角度理解影响盐类水解的因素
(1)盐类水解易受温度、浓度、溶液的酸碱性等因素的影响,以氯化铁水解为例,当改变条件如升温、通入HCl气体、加水、加铁粉、加碳酸氢钠等时,应从平衡移动方向、pH的变化、水解程度、现象等方面归纳总结。
(2)水解平衡常数(Kh)只受温度的影响。
应用体验
视角1盐类水解平衡常数
A.稀释溶液,水解平衡常数增大 B.通入CO2,平衡向正反应方向移动
C.升高温度,水解平衡常数增大 D.加入NaOH固体,溶液pH减小
C
解析 水解平衡常数只与温度有关,A错;CO2与Na2CO3反应生成NaHCO3,
浓度减小, 浓度增大,平衡逆向移动,B错;水解是吸热反应,温度升高平衡正向移动,水解平衡常数增大,C对;NaOH是强碱,加入NaOH固体溶液的碱性增强,溶液pH增大,D错。
2.(2023山东菏泽高二期末)在一定条件下,Na2S溶液中存在水解平衡:
S2-+H2O HS-+OH-。下列说法正确的是( )
A.稀释溶液,水解平衡常数增大
C.加入CuSO4固体,HS-浓度减小
D.加入NaOH固体,溶液pH减小
C
视角2影响盐类水解的因素探究
3.在一定条件下,NaF溶液存在水解平衡:F-+H2O HF+OH-。下列说法正确的是( )
B.通入HCl,HF浓度降低
C.稀释溶液,水解平衡常数减小
D.加入NaOH固体,溶液pH减小
A
解析 水解反应是吸热反应,升温促进水解,平衡正向移动,c(F-)减小,c(HF)增大,所以 增大,故A正确;通入HCl,H+与OH-结合成水,水解平衡正向移动,HF浓度升高,故B错误;水解平衡常数只与温度有关,温度不变,则稀释时水解平衡常数是不变的,故C错误;加入NaOH固体,溶液pH增大,故D错误。
4.如图所示三个烧瓶中分别装入含酚酞的0.01 mol·L-1 CH3COONa溶液,并分别放置在盛有水的烧杯中,然后向烧杯①中加入生石灰,向烧杯③中加入NH4NO3晶体,烧杯②中不加任何物质。则下列叙述正确的是( )
A.①说明水解反应为放热反应
B.③说明水解反应为吸热反应
C.①中溶液红色变浅
D.③中溶液红色变深
B
解析 在CH3COONa溶液中存在水解平衡:CH3COO-+H2O CH3COOH+OH-。①中加入生石灰,生石灰溶于水放热,温度升高,烧瓶中溶液的红色加深,说明水解反应为吸热反应,A项错误、C项错误;③中加入NH4NO3晶体,NH4NO3溶于水吸热,温度降低,烧瓶中溶液的红色变浅,说明水解反应为吸热反应,B项正确、D项错误。
本 课 结 束
专题3
第三单元 第1课时 盐类水解的原理 影响盐类水解的因素
基础落实·必备知识全过关
重难探究·能力素养全提升
目录索引
素养 目标 1.知道可以通过分析、推理等方法认识盐类水解的本质特征,建立模型。能运用模型解释盐类水解平衡的移动,揭示现象的本质和规律。
2.会判断盐溶液的酸碱性,学会盐类水解的表示方法——水解离子方程式的书写。
3.认识盐类水解有一定限度,是可以调控的。能多角度、动态地分析盐类水解平衡,培养变化观念与平衡思想的化学核心素养。
基础落实·必备知识全过关
一、盐类水解的原理
1.盐溶液的酸碱性
(1)盐的分类(按生成盐的酸、碱的强弱划分)
NaCl、KNO3
NH4Cl、AlCl3、Fe2(SO4)3
强碱弱酸盐
弱酸弱碱盐
(2)盐溶液酸碱性的理论分析
①强酸弱碱盐(以NH4Cl溶液为例)
电离方 程式
理论解释 和OH-结合生成弱电解质 ,使水的电离平衡向右移动
溶液酸碱性 c(H+) c(OH-),溶液呈 性
水解方程式
NH3·H2O
>
酸
②强碱弱酸盐(以CH3COONa溶液为例)
电离方程式
理论解释 CH3COO-和H+结合生成弱电解质 ,使水的电离平衡向右移动
溶液酸碱性 c(H+) c(OH-),溶液呈 性
水解方程式
CH3COOH
<
碱
③强酸强碱盐(以NaCl溶液为例)
电离过程:NaCl ══ Na++Cl-,H2O H++OH-。水的电离平衡:溶液中没有弱电解质生成,水的电离平衡未受到影响,溶液中c(H+) c(OH-),溶液呈 性。
=
中
2.盐类的水解
(1)定义
盐在水溶液中 与水电离出的 结合生成 的反应。
(2)特征
①一般是 反应,在一定条件下达到化学平衡。
②盐类水解反应是中和反应的逆反应,盐类水解是 热反应。
电离出的离子
H+或OH-
弱电解质
可逆
吸
(3)书写要求
①一般来说,盐类水解的程度不大,应该用可逆号“ ”表示。盐类水解一般不会产生沉淀和气体,所以不用符号“↓”和“↑”表示水解产物。
②多元弱酸盐的水解是分步进行的,水解离子方程式要分步表示。
③多元弱碱阳离子的水解简化成一步写出。
④水解相互促进且水解程度较大,书写时要用“══”“↑”“↓”等。
教材阅读想一想阅读教材图3-22
思考:盐类发生水解时,对水的电离有何影响 酸或碱对水的电离有何影响
提示 盐类的水解促进水的电离,酸或碱抑制水的电离。
易错辨析判一判
(1)碳酸钠溶液显碱性,是因为溶液中c(OH-)>c(H+)。( )
(2)CH3COONa溶液中存在的粒子只有H2O、CH3COO-、Na+、H+、OH-。
( )
(3)盐类的水解过程促进了水的电离。( )
(4)盐类水解后,溶液不是显酸性就是显碱性。( )
√
×
提示 还有CH3COOH。
√
×
提示 也可以显中性,如醋酸铵溶液。
二、影响盐类水解平衡的因素
1.实验探究盐类水解平衡的影响因素
已知0.1 mol·L-1 Fe(NO3)3发生水解反应的离子方程式:Fe3++3H2O Fe(OH)3+3H+。用pH计测量该溶液的pH,根据实验操作填写下表:
可能影响因素 实验操作 现象 解释与结论
盐的 浓度 加水稀释,测溶液的pH 溶液颜色变 ,溶液的pH 加水稀释,c(Fe3+)
,水解平衡向
方向移动
浅
变大
变小
正反应
可能影响因素 实验操作 现象 解释与结论
溶液 的酸 碱性 加硝酸后,测溶液的pH 溶液颜色变 ,溶液的pH 加入硝酸,c(H+)增大,水解平衡向 方向移动,但c(H+)仍比原平衡中c(H+)大
加入少量NaOH溶液 产生 色沉淀,溶液的pH 加入氢氧化钠,OH-消耗H+,c(H+)减小,水解平衡向
方向移动
温度 升高温度 溶液颜色变 ,溶液的pH 升高温度,水解平衡向
方向移动
浅
变小
逆反应
红褐
变大
正反应
深
变小
正反应
2.影响盐类水解平衡的因素及结论
(1)内因:盐本身的性质。组成盐的弱酸根阴离子相对应的酸越弱(或弱碱阳离子对应的碱越弱),水解程度就 。
(2)外因:受温度、浓度及外加酸碱等因素的影响。
①温度:盐的水解是吸热反应,因此升高温度,盐的水解程度 。
②浓度:稀释盐溶液,可以 水解,盐的浓度越小,水解程度 。
③外加酸碱:水解呈酸性的盐溶液,加碱会 水解;加酸会_______ 水解。水解呈碱性的盐溶液,加碱会 水解;加酸会 水解。
④外加盐:加入与盐的水解性质相反的盐会使盐的水解程度 。
越大
增大
促进
越大
促进
抑制
抑制
促进
增大
教材阅读想一想阅读教材“影响盐类水解的因素”中的“批判性思维”
易错辨析判一判
(1)升高温度,碳酸钠溶液的碱性增强。( )
(2)向FeCl3溶液中加入FeCl3固体,其水解程度增大。( )
(3)将氯化铵溶液加水稀释,其水解程度增大。( )
(4)向氯化铁溶液中加氯化铵固体,其水解程度减小。( )
√
×
√
√
重难探究·能力素养全提升
探究一 盐类水解的原理
情境探究
我们知道酸溶液呈酸性,碱溶液呈碱性,那么盐溶液是否呈中性呢 在焊接金属时,往往对接口处进行打磨、清洗。清洗时常用NH4Cl或ZnCl2溶液作为清洗液,因为这两种盐溶液能够溶解接口处的锈斑(主要成分是Fe2O3)。你能解释NH4Cl或ZnCl2溶液除去铁锈的原理吗 通过本节课知识的学习,你就能了解以上事例的原理,了解其中的奥秘。
(1)NaHSO4溶液显酸性还是碱性 原因是什么
(2)pH均为4的H2SO4溶液和NH4Cl溶液中,水电离出的c(H+)相等吗
(3)如何比较同浓度的CH3COONa和NaClO溶液水解的程度
(4)已知在相同条件下NH3·H2O与CH3COOH电离程度几乎相等,CH3COOH的酸性比H2CO3强,那么NH4HCO3溶液显酸性、碱性还是中性
提示 不相等。H2SO4抑制水的电离,NH4Cl能水解,从而促进水的电离,所以NH4Cl溶液中水电离出的c(H+)大。
提示 越弱越水解。
(5)NaHCO3溶液显碱性的原因是什么 用离子方程式分析。
(6)NaHSO3溶液显酸性的原因是什么 用离子方程式分析。
方法突破
1.盐类水解的规律
水解规律:水解看组成,有弱才水解,无弱不水解;越弱越水解,都弱都水解;谁强显谁性,同强显中性,规律要记清。
(1)“有弱才水解,无弱不水解”——盐中有弱酸阴离子或弱碱阳离子才水解;若没有,则不发生水解反应。
(2)“越弱越水解”——弱酸阴离子对应的酸越弱,水解程度越大;弱碱阳离子对应的碱越弱,其水解程度越大。
(3)“都弱都水解”——弱酸弱碱盐电离出的弱酸阴离子和弱碱阳离子都发生水解,且相互促进。
(4)“谁强显谁性”——当盐中的阴离子对应的酸比阳离子对应的碱更容易电离时,水解后盐溶液呈酸性,反之,呈碱性,即强酸弱碱盐溶液显酸性,强碱弱酸盐溶液显碱性。
图解:
2.盐类水解离子方程式的书写
(1)盐类水解的离子方程式一般用“ ”连接,由于水解程度较小,水解生成的弱电解质的浓度很小,一般不生成沉淀或气体,即一般不标“↓”或“↑”符号。
应用体验
视角1水解方程式的书写和正误判断
1.下列反应不属于水解反应或水解方程式不正确的是( )
A.①② B.③④
C.①②④ D.全部
D
解析 ①HCl+H2O ══ H3O++Cl-属于盐酸的电离方程式,故①符合题意;②ZnCl2+2H2O ══ Zn(OH)2+2HCl中,“等号”要改为“可逆号”,故②符合题意;③Na2CO3+2H2O H2CO3+2NaOH中,碳酸钠的水解是分步进行的,不能一步完成,故③符合题意;④Al2(CO3)3+3H2O ══ 2Al(OH)3↓+3CO2↑,水解进行彻底,故④符合题意。
2.下列物质在常温下发生水解时,对应的离子方程式正确的是( )
B
视角2判断盐溶液的酸碱性
3.相同温度、相同物质的量浓度的四种溶液:
①CH3COONa ②NaHSO4 ③NaCl ④C6H5ONa。按pH由大到小的顺序排列,正确的是( )
A.④>①>③>② B.①>④>③>②
C.①>②>③>④ D.④>③>①>②
A
解析 在盐溶液中,由于盐电离产生的离子与水电离出来的H+或OH-结合生成弱电解质,从而破坏了水的电离平衡,使水的电离平衡向电离的方向移动,溶液显示出酸性或碱性。
②NaHSO4不水解但可以电离出H+,溶液呈酸性;③NaCl溶液呈中性;①CH3COONa和④C6H5ONa水解使溶液呈碱性,根据“越弱越水解”的规律, C6H5ONa溶液的碱性强于CH3COONa溶液的碱性。
4.根据表中信息,判断0.10 mol·L-1的下列各物质的溶液pH最大的是( )
酸 电离常数(常温下)
CH3COOH Ka=1.76×10-5
H2CO3 Ka1=4.30×10-7,Ka2=5.61×10-11
H2S Ka1=9.1×10-8,Ka2=1.1×10-12
A.CH3COONa B.Na2CO3 C.NaHCO3 D.Na2S
D
5.已知某温度下,Ka(HCN)=6.2×10-10,Ka(HF)=6.8×10-4, Ka(CH3COOH)=1.7×10-5,Ka(HNO2)=5.1×10-4。物质的量浓度均为
0.1 mol·L-1的下列溶液,pH由大到小的顺序是( )
A.NaCN>NaNO2>CH3COONa>NaF
B.NaF>NaNO2>CH3COONa>NaCN
C.NaCN>CH3COONa>NaNO2>NaF
D.NaCN>CH3COONa>NaF>NaNO2
C
解析 由Ka(HF)>Ka(HNO2)>Ka(CH3COOH)>Ka(HCN)可知,酸性: HF>HNO2>CH3COOH>HCN,则水解能力:CN->CH3COO-> >F-,相同条件下,弱酸根离子的水解能力越强,对应盐溶液的碱性越强,pH越大。
视角3根据盐溶液的酸碱性判断弱酸、弱碱的强弱
6.物质的量浓度相同的三种盐NaX、NaY和NaZ的溶液,其pH依次为8、9、10,则HX、HY、HZ的酸性由强到弱的顺序是( )
A.HX、HZ、HY B.HZ、HY、HX
C.HX、HY、HZ D.HY、HZ、HX
C
解析 同浓度的三种盐溶液,pH越大,说明水解程度越大,所对应的弱酸酸性越弱,即酸性:HX>HY>HZ。
7.(2023广东承德高二检测)已知在常温下测得浓度均为0.1 mol·L-1的下列三种溶液的pH:
溶质 NaHCO3 Na2CO3 NaCN
pH 9.7 11.6 11.1
下列说法中正确的是( )
A.阳离子的物质的量浓度之和:Na2CO3>NaCN>NaHCO3
B.相同条件下的酸性:H2CO3
D.升高Na2CO3溶液的温度, 减小
C
解析 三种溶液中的阳离子均为Na+和H+,Na2CO3溶液中Na+浓度是其他两种溶液的2倍,阳离子浓度最大,NaCN溶液和NaHCO3溶液中Na+浓度相等,NaCN溶液中H+浓度小于NaHCO3溶液,故阳离子浓度之和的大小顺序为Na2CO3>NaHCO3>NaCN,A项错误; 的水解能力小于CN-,故酸性H2CO3>HCN,B项错误;升高Na2CO3溶液的温度,促进其水解, 增大,D项错误。
探究二 影响水解反应的因素
情境探究
在我们的教学楼、实验室、宿舍等的墙壁上都挂有一种泡沫灭火器。泡沫灭火器内一个容器装有NaHCO3饱和溶液,灭火器内另有一个容器装有Al2(SO4)3溶液。当意外失火时,将泡沫灭火器倒过来即可使两种液体混合,喷出CO2和Al(OH)3,阻止火势蔓延。
(1)泡沫灭火器的使用方法:可手提灭火器上部的提环(注意不得使灭火器过分倾斜,更不能横拿或颠倒),当距离燃烧点10 m左右时,将灭火器颠倒,一只手紧握提环,另一只手挂住灭火器底圈,对准燃烧点,由近至远进行喷射。泡沫灭火器的化学原理是什么
提示 Al3+水解产生H+, 水解产生OH-,则Al3+与 相互促进水解,总反应为Al2(SO4)3+6NaHCO3 ══ 3Na2SO4+2Al(OH)3↓+6CO2↑。
(2)向CH3COONa溶液中再加CH3COONa(s),CH3COO-的水解平衡右移,水解程度为什么减小
(3)为使Na2S溶液中 的值减小,可以采取什么措施 加入NaOH、NaHS是否可以
提示 向CH3COONa溶液中加入CH3COONa(s)平衡右移,但根据勒夏特列原理,CH3COO-浓度增大程度更大,所以水解程度减小。
提示 降温、加入KOH或KHS。
加入NaOH、NaHS不可以,因为水解平衡虽然左移,c(S2-)增大,但c(Na+)增大更多,致使 增大。
(4)NH4Cl溶液加水稀释时c(H+)变小,c(OH-)怎么变
(5)已知:常温下,H2C2O4的电离常数分别是Ka1≈5.90×10-2,Ka2≈6.40×10-5。草酸的钾盐有K2C2O4、KHC2O4。常温下,KHC2O4的水解常数为多少 KHC2O4溶液的酸碱性如何
提示 水解导致溶液呈酸性,稀释NH4Cl溶液时c(H+)变小,c(OH-)应增大。
方法突破
1.盐类水解的平衡常数
(1)水解平衡常数的定义。
在一定温度下,能水解的盐在水溶液中达到水解平衡时,生成的弱酸(或弱碱)浓度和氢氧根离子(或氢离子)浓度之积与溶液中未水解的弱酸根阴离子(或弱碱阳离子)浓度之比是一个常数,该常数就称为水解平衡常数。
(2)水解平衡常数(Kh)与电离常数的定量关系。
其中Kh为水解平衡常数,Ka、Kb分别为弱酸、弱碱的电离平衡常数,KW为水的离子积常数。
因而Ka(或Kb)与KW、Kh的定量关系为Ka·Kh=KW(或Kb·Kh=KW)。
(3)水解平衡常数是描述能水解的盐水解平衡的主要参数。它只受温度的影响,因水解过程是吸热过程,故水解程度随温度的升高而增大。
2.从定性、定量两角度理解影响盐类水解的因素
(1)盐类水解易受温度、浓度、溶液的酸碱性等因素的影响,以氯化铁水解为例,当改变条件如升温、通入HCl气体、加水、加铁粉、加碳酸氢钠等时,应从平衡移动方向、pH的变化、水解程度、现象等方面归纳总结。
(2)水解平衡常数(Kh)只受温度的影响。
应用体验
视角1盐类水解平衡常数
A.稀释溶液,水解平衡常数增大 B.通入CO2,平衡向正反应方向移动
C.升高温度,水解平衡常数增大 D.加入NaOH固体,溶液pH减小
C
解析 水解平衡常数只与温度有关,A错;CO2与Na2CO3反应生成NaHCO3,
浓度减小, 浓度增大,平衡逆向移动,B错;水解是吸热反应,温度升高平衡正向移动,水解平衡常数增大,C对;NaOH是强碱,加入NaOH固体溶液的碱性增强,溶液pH增大,D错。
2.(2023山东菏泽高二期末)在一定条件下,Na2S溶液中存在水解平衡:
S2-+H2O HS-+OH-。下列说法正确的是( )
A.稀释溶液,水解平衡常数增大
C.加入CuSO4固体,HS-浓度减小
D.加入NaOH固体,溶液pH减小
C
视角2影响盐类水解的因素探究
3.在一定条件下,NaF溶液存在水解平衡:F-+H2O HF+OH-。下列说法正确的是( )
B.通入HCl,HF浓度降低
C.稀释溶液,水解平衡常数减小
D.加入NaOH固体,溶液pH减小
A
解析 水解反应是吸热反应,升温促进水解,平衡正向移动,c(F-)减小,c(HF)增大,所以 增大,故A正确;通入HCl,H+与OH-结合成水,水解平衡正向移动,HF浓度升高,故B错误;水解平衡常数只与温度有关,温度不变,则稀释时水解平衡常数是不变的,故C错误;加入NaOH固体,溶液pH增大,故D错误。
4.如图所示三个烧瓶中分别装入含酚酞的0.01 mol·L-1 CH3COONa溶液,并分别放置在盛有水的烧杯中,然后向烧杯①中加入生石灰,向烧杯③中加入NH4NO3晶体,烧杯②中不加任何物质。则下列叙述正确的是( )
A.①说明水解反应为放热反应
B.③说明水解反应为吸热反应
C.①中溶液红色变浅
D.③中溶液红色变深
B
解析 在CH3COONa溶液中存在水解平衡:CH3COO-+H2O CH3COOH+OH-。①中加入生石灰,生石灰溶于水放热,温度升高,烧瓶中溶液的红色加深,说明水解反应为吸热反应,A项错误、C项错误;③中加入NH4NO3晶体,NH4NO3溶于水吸热,温度降低,烧瓶中溶液的红色变浅,说明水解反应为吸热反应,B项正确、D项错误。
本 课 结 束
