初中化学人教版九年级上册课件 4.4 化学式与化合价(共31张PPT)
文档属性
| 名称 | 初中化学人教版九年级上册课件 4.4 化学式与化合价(共31张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-08 14:49:20 | ||
图片预览











文档简介
(共31张PPT)
课题4 化学式与化合价
第四单元 自然界的水
一、化学式
1.化学式的定义
水 氧气 氢气 。
H2O
O2
H2
化学式
O
H
H
H
H
O
O
化学式:用元素符号和数字组合表示物质组成的式子。
思考
1. 任何物质都有化学式吗?
2. 同种物质可以有不同的化学式吗?
3. 化学式可以任意的书写吗?
只有纯净物才能用化学式表示其组成。
一种物质只能用一个化学式来表示,
因为每种纯净物的组成是固定不变的。
化学式的书写必须依据实验的结果,不能随意编造。
空气
含有多种气体,是混合物,没有化学式。
冰
水
水蒸气
H2O
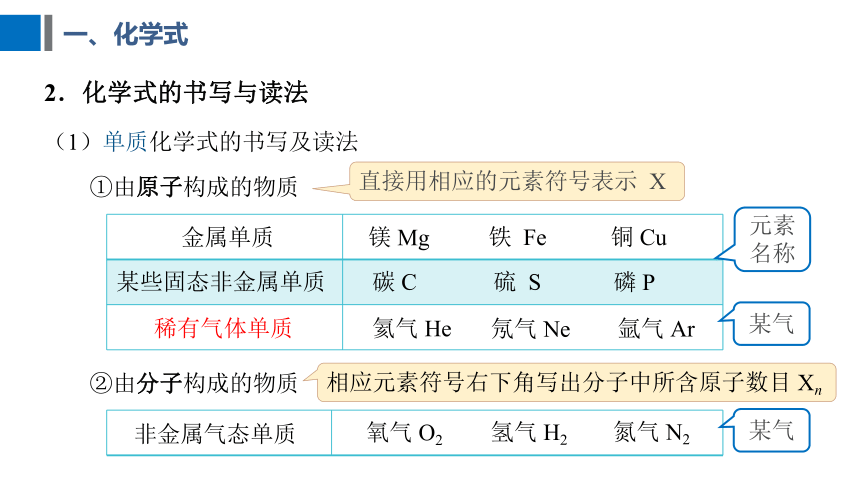
一、化学式
(1)单质化学式的书写及读法
①由原子构成的物质
金属单质
某些固态非金属单质
稀有气体单质
碳 C
镁 Mg
氦气 He
硫 S
铁 Fe
氖气 Ne
磷 P
铜 Cu
氩气 Ar
元素名称
某气
直接用相应的元素符号表示 X
②由分子构成的物质
非金属气态单质
氧气 O2
氢气 H2
氮气 N2
相应元素符号右下角写出分子中所含原子数目 Xn
某气
一、化学式
2.化学式的书写与读法
①当某组成元素原子个数比是1时,1省略不写;
氧化铜 CuO 氧化钙 CaO
②氧化物化学式的书写,一般把氧的元素符号写在右边;
二氧化碳 CO2 一氧化碳 CO 五氧化二磷 P2O5
③由金属与非金属元素组成的化合物,一般金属元素的符号在左,
非金属元素的符号在右。
氯化钠 NaCl 氯化钾 KCl 氧化钙 CaO
几氧化几某
某化某
一、化学式
(2)化合物化学式的书写及读法
小试牛刀
氧化钙 二氧化锰 五氧化二氮 ;
氩气 氮气 铁 水 。
NaCl MgO CaS HF ;
CO2 P2O5 N2 Ar 。
1. 请你写出下列物质的化学式。
2. 请你读出下列物质的名称。
CaO
MnO2
N2O5
Ar
N2
Fe
H2O
氯化钠
氧化镁
硫化钙
氟化氢
二氧化碳
五氧化二磷
氮气
氩气
你知道“H2O” 能表示出哪些意义吗?
表示水这种物质
表示1个水分子
表示水由氢元素
和氧元素组成
表示1个水分子由2个氢
原子和1个氧原子构成
宏 观
微 观
一、化学式
思考
H2O
(1)由分子构成的物质
①表示一种物质
②表示一种物质的元素组成
宏观意义
微观意义
③表示物质的一个分子
④表示物质一个分子的构成
练习:“CO2”的意义
①二氧化碳这种物质
②二氧化碳由碳元素和氧元素组成
③1个二氧化碳分子
④1个二氧化碳分子由1个碳原子和2个氧原子构成
若化学式前加入数字,就只有微观意义:表示几个某分子
一、化学式
3.化学式的意义
微观意义
③表示物质的一个
④表示物质一个分子的构成
“Cu”的意义
①铜这种物质
②铜由铜元素组成
③1个铜原子
分子
原子
(2)由原子构成的物质
一、化学式
①表示一种物质
②表示一种物质的元素组成
宏观意义
微观意义
③表示物质构成中离子个数的最简比
“NaCl”的意义
①氯化钠这种物质
②氯化钠由钠元素和氯元素组成
③构成氯化钠的钠离子和氯离子个数比为1∶1
(3)由离子构成的物质
一、化学式
①表示一种物质
②表示一种物质的元素组成
宏观意义
1. 元素符号及化学式前面的数字有什么意义?
2H 2H2
2个氢原子
2个氢分子
表示原子或分子的个数
2. 化学式中元素符号右下角数字有什么意义?
H2 CO2
1个氢分子中含有2个氢原子
1个二氧化碳分子中含有2个氧原子
表示1个分子中含该原子的个数
一、化学式
思考
1. 说说符号N、N2、2N、2N2各具有什么含义?
(一般2个意义)
① 表示氮元素
② 表示一个氮原子
N
元素符号
N2
(一般4个意义)
① 表示氮气
② 表示氮气由氮元素组成
③ 表示1个氮分子
④ 表示1个氮分子由2个氮原子构成
数字+化学式
2N
表示两个氮原子
数字+元素符号
2N2
化学式
表示两个氮分子
小试牛刀
2. 2N2 表示( )
A. 4个氮原子 B. 2个氮分子 C. 4个氮分子 D. 2个氮原子
3. SO2读法是( )
A. 氧化硫 B. 二氧化硫 C. 硫化氧 D. 硫化二氧
4. 五氧化二氮的化学式是( )
A. 5O2N B. O5N2 C. N2O5 D. 2N5O
B
B
C
小试牛刀
物质 氯化氢 水 氯化钠 二氧化碳 三氧化二铁
化学式 HCl H2O NaCl CO2 Fe2O3
原子个数比 1∶1 2∶1 1∶1 1∶2 2∶3
我们知道物质的组成是固定的,其化学式也是一定的,为何在化学式中各元素的原子个数比不同呢?
化学式:
用元素符号和数字的组合表示物质组成的式子。
思考交流
1.化合价的定义
不同元素化合时表现出来的性质不一样,这种性质就叫“化合价”。
+1
-2
2
+1
-1
注意:元素只有在形成化合物时,才讲化合价,即单质的化合价为零。
化合价有正负、数值大小之分。在化合物中,各元素正负化合价的代数和为零。
二、化合价
离子符号 Na+ Mg2+ Al3+ F- O2-
化合价 Na Mg Al F O
+1
+2
+3
-1
-2
离子符号和化合价的表示方法区别:
离子:数字在前,数字1省略,“+”“-”号在后;写在右上角。
化合价:数字在后,数字1不能省略,“+”“-”号在前;写在正上方。
化合价与离子所带电荷的联系:数字相同,正负号相同。
2.离子符号和化合价的比较
二、化合价
元素和根的名称 元素和根的符号 常见的化合价
氯 Cl -1,+1,+5,+7
溴 Br -1
氧 O -2
硫 S -2,+4,+6
碳 C +2,+4
硅 Si +4
氮 N -3,+2,+3,+4,+5
磷 P -3,+3,+5
氢氧根 OH- -1
硝酸根 -1
硫酸根 -2
碳酸根 -2
铵根 +1
元素和根的名称 元素和根的符号 常见的化合价
钾 K +1
钠 Na +1
银 Ag +1
钙 Ca +2
镁 Mg +2
钡 Ba +2
铜 Cu +1,+2
铁 Fe +2,+3
铝 Al +3
锰 Mn +2,+4,+6,+7
锌 Zn +2
氢 H +1
氟 F -1
一些常见元素和根的化合价
根据表格所给信息,你能得出哪些规律?
二、化合价
(2)金属元素与非金属元素化合时,金属元素显正价,非金属元素显负价; 非金属元素与氧化合时通常显正价;
(3)一些元素在不同物质中可显不同化合价;
(4)在单质中,元素的化合价为0。
CO2
+4
CO
+2
H2
He
NaCl
+1
P2O5
+5
Na2S
-2
SO2
+4
(1)在化合物里,氧元素通常显-2价,氢元素通常显+1价;
3.化合价的有关规律
二、化合价
原子团:作为一个整体参加反应的原子集团,也叫做根。
注意:①原子团不能单独存在;
②带电荷的原子团也是离子。
二、化合价
NaOH、 Ca(OH)2 、Cu(NO3)2、NH4NO3、BaSO4、CaCO3、 H3PO4
根:
离子:
OH-:
氢氧根离子
铵根离子
硝酸根离子
碳酸根离子
硫酸根离子
磷酸根离子
(1)根据化学式求化合价
依据:
在化合物中正负化合价的代数和为零
例:求SO2、H2SO4中硫元素化合价
SO2
x
-2
x
(-2)
×
2
=
0
+
x
=
+4
H2SO4
x
-2
1
x
(-2)
×
4
=
0
+
2
+
×
x
=
+6
+1
4.化合价的应用
二、化合价
(1)ClO2中氯元素的化合价为 ;
N2O5中氮元素的化合价为 ;
(2)KMnO4中Mn的化合价为 ;
K2MnO4中Mn的化合价为 ;
1. 根据化学式计算某元素的化合价。
+4
+5
+7
+6
C
小试牛刀
2. 中硫元素的化合价为( )
A. -2 B. +4 C. +6 D. +8
化合价交叉法
例:请写出氧化铝的化学式: 。
Al2O3
Al
O
-2
+3
=0
(+3)×2
(-2)×3
+
①元素排序标价
②交叉
③化简
④检验
3
2
(2)根据化合价写化学式
4.化合价的应用
二、化合价
氧化铜
氯化钙
写出下列物质的化学式
氧化铁
氧化亚铁
Cu O
Fe O
Fe O
Ca Cl
- 1
+2
2
+2
-2
+3
-2
+2
-2
2
3
硝酸钙
氢氧化镁
硫酸铁
硫酸亚铁
Mg OH
( )2
- 1
+2
Ca NO3
( )2
- 1
+2
Fe SO4
+3
-2
2( )3
Fe SO4
+2
-2
小试牛刀
H
H
O
H
H
O
H2O
1个水分子是由 个氢原子和 个氧原子构成的。
1个水分子的质量= + 。
2
1
2个氢原子的质量
1个氧原子的质量
分子、原子质量都很小。为了方便,原子采用相对原子质量,那么分子呢?
相对分子质量
思考交流
相对分子质量:化学式中各原子的相对原子质量的总和。(符号为Mr)
H
H
O
H
O
相对原子量为1
相对原子量为16
Mr(H2O)=
=18
1
×2
+
16
×1
2个
1个
g
关键:搞清楚组成元素的种类,及对应原子数目
H2O的相对分子质量=
相对分子质量也是比值,单位为1
三、有关相对分子质量的计算
1.计算相对分子质量
相对原子质量: H-1 N-14 O-16 Al-27 S-32 K-39
1. 计算 NH4NO3的相对分子质量
2. 计算Al2(SO4)3的相对分子质量
Mr[Al2(SO4)3] = 27×2 +(32×1+16×4)×3
= 342
Mr[NH4NO3] =14×2 + 1×4 + 16×3
=80
3. 计算KAl(SO4)2·12H2O的相对分子质量
Mr[KAl(SO4)2·12H2O] = 39 + 27 + (32+16×4)×2 + 12×(1×2+16)
= 474
三、有关相对分子质量的计算
元素的质量比:各元素的所有原子相对原子质量总和之比。
H
H
O
H
O
相对原子量为1
相对原子量为16
2个
1个
H2O
=1∶8
1
×2
∶
16
×1
H
O
中
m
m
∶
=
注意:1.前后对应; 2.元素质量比 ≠ 原子个数比
2.计算物质组成元素的质量比
三、有关相对分子质量的计算
1. 硝酸铵(NH4NO3 )中,氮、氢、氧三种元素的质量比
m(N) ∶ m(H) ∶ m(O)
=(14×2)∶ (1×4) ∶ (16×3)
= 7 ∶ 1 ∶ 12
2. 氢氧化钙(Ca(OH)2 )中,钙、氢、氧三种元素的质量比
m(Ca) ∶ m(H) ∶ m(O)
=(40×1)∶ (1×2) ∶ (16×2)
= 20 ∶ 1 ∶ 16
相对原子质量: H-1 N-14 O-16 Ca-40
三、有关相对分子质量的计算
相对分子质量
该元素的相对原子质量
×
该元素的原子个数
元素的质量分数
×
100%
=
元素的质量分数:该元素的质量与组成物质的元素总质量之比。
×100%
1
×2
1
×2
+
16
×1
×100%
H2O中氢元素的质量分数=
=
3.计算物质中某元素的质量分数
三、有关相对分子质量的计算
1. 硝酸铵(NH4NO3 )中,氮元素的质量分数
2. 尿素(CO(NH2)2)中,氧元素的质量分数
相对原子质量: H-1 C-12 N-14 O-16
三、有关相对分子质量的计算
ω(N)=
14 × 2
14×2+1×4+16×3
×100%
=35%
ω(O)=
16 × 1
12×1+16×1+14×2+1×4
×100%
=26.7%
本节内容结束
课题4 化学式与化合价
第四单元 自然界的水
一、化学式
1.化学式的定义
水 氧气 氢气 。
H2O
O2
H2
化学式
O
H
H
H
H
O
O
化学式:用元素符号和数字组合表示物质组成的式子。
思考
1. 任何物质都有化学式吗?
2. 同种物质可以有不同的化学式吗?
3. 化学式可以任意的书写吗?
只有纯净物才能用化学式表示其组成。
一种物质只能用一个化学式来表示,
因为每种纯净物的组成是固定不变的。
化学式的书写必须依据实验的结果,不能随意编造。
空气
含有多种气体,是混合物,没有化学式。
冰
水
水蒸气
H2O
一、化学式
(1)单质化学式的书写及读法
①由原子构成的物质
金属单质
某些固态非金属单质
稀有气体单质
碳 C
镁 Mg
氦气 He
硫 S
铁 Fe
氖气 Ne
磷 P
铜 Cu
氩气 Ar
元素名称
某气
直接用相应的元素符号表示 X
②由分子构成的物质
非金属气态单质
氧气 O2
氢气 H2
氮气 N2
相应元素符号右下角写出分子中所含原子数目 Xn
某气
一、化学式
2.化学式的书写与读法
①当某组成元素原子个数比是1时,1省略不写;
氧化铜 CuO 氧化钙 CaO
②氧化物化学式的书写,一般把氧的元素符号写在右边;
二氧化碳 CO2 一氧化碳 CO 五氧化二磷 P2O5
③由金属与非金属元素组成的化合物,一般金属元素的符号在左,
非金属元素的符号在右。
氯化钠 NaCl 氯化钾 KCl 氧化钙 CaO
几氧化几某
某化某
一、化学式
(2)化合物化学式的书写及读法
小试牛刀
氧化钙 二氧化锰 五氧化二氮 ;
氩气 氮气 铁 水 。
NaCl MgO CaS HF ;
CO2 P2O5 N2 Ar 。
1. 请你写出下列物质的化学式。
2. 请你读出下列物质的名称。
CaO
MnO2
N2O5
Ar
N2
Fe
H2O
氯化钠
氧化镁
硫化钙
氟化氢
二氧化碳
五氧化二磷
氮气
氩气
你知道“H2O” 能表示出哪些意义吗?
表示水这种物质
表示1个水分子
表示水由氢元素
和氧元素组成
表示1个水分子由2个氢
原子和1个氧原子构成
宏 观
微 观
一、化学式
思考
H2O
(1)由分子构成的物质
①表示一种物质
②表示一种物质的元素组成
宏观意义
微观意义
③表示物质的一个分子
④表示物质一个分子的构成
练习:“CO2”的意义
①二氧化碳这种物质
②二氧化碳由碳元素和氧元素组成
③1个二氧化碳分子
④1个二氧化碳分子由1个碳原子和2个氧原子构成
若化学式前加入数字,就只有微观意义:表示几个某分子
一、化学式
3.化学式的意义
微观意义
③表示物质的一个
④表示物质一个分子的构成
“Cu”的意义
①铜这种物质
②铜由铜元素组成
③1个铜原子
分子
原子
(2)由原子构成的物质
一、化学式
①表示一种物质
②表示一种物质的元素组成
宏观意义
微观意义
③表示物质构成中离子个数的最简比
“NaCl”的意义
①氯化钠这种物质
②氯化钠由钠元素和氯元素组成
③构成氯化钠的钠离子和氯离子个数比为1∶1
(3)由离子构成的物质
一、化学式
①表示一种物质
②表示一种物质的元素组成
宏观意义
1. 元素符号及化学式前面的数字有什么意义?
2H 2H2
2个氢原子
2个氢分子
表示原子或分子的个数
2. 化学式中元素符号右下角数字有什么意义?
H2 CO2
1个氢分子中含有2个氢原子
1个二氧化碳分子中含有2个氧原子
表示1个分子中含该原子的个数
一、化学式
思考
1. 说说符号N、N2、2N、2N2各具有什么含义?
(一般2个意义)
① 表示氮元素
② 表示一个氮原子
N
元素符号
N2
(一般4个意义)
① 表示氮气
② 表示氮气由氮元素组成
③ 表示1个氮分子
④ 表示1个氮分子由2个氮原子构成
数字+化学式
2N
表示两个氮原子
数字+元素符号
2N2
化学式
表示两个氮分子
小试牛刀
2. 2N2 表示( )
A. 4个氮原子 B. 2个氮分子 C. 4个氮分子 D. 2个氮原子
3. SO2读法是( )
A. 氧化硫 B. 二氧化硫 C. 硫化氧 D. 硫化二氧
4. 五氧化二氮的化学式是( )
A. 5O2N B. O5N2 C. N2O5 D. 2N5O
B
B
C
小试牛刀
物质 氯化氢 水 氯化钠 二氧化碳 三氧化二铁
化学式 HCl H2O NaCl CO2 Fe2O3
原子个数比 1∶1 2∶1 1∶1 1∶2 2∶3
我们知道物质的组成是固定的,其化学式也是一定的,为何在化学式中各元素的原子个数比不同呢?
化学式:
用元素符号和数字的组合表示物质组成的式子。
思考交流
1.化合价的定义
不同元素化合时表现出来的性质不一样,这种性质就叫“化合价”。
+1
-2
2
+1
-1
注意:元素只有在形成化合物时,才讲化合价,即单质的化合价为零。
化合价有正负、数值大小之分。在化合物中,各元素正负化合价的代数和为零。
二、化合价
离子符号 Na+ Mg2+ Al3+ F- O2-
化合价 Na Mg Al F O
+1
+2
+3
-1
-2
离子符号和化合价的表示方法区别:
离子:数字在前,数字1省略,“+”“-”号在后;写在右上角。
化合价:数字在后,数字1不能省略,“+”“-”号在前;写在正上方。
化合价与离子所带电荷的联系:数字相同,正负号相同。
2.离子符号和化合价的比较
二、化合价
元素和根的名称 元素和根的符号 常见的化合价
氯 Cl -1,+1,+5,+7
溴 Br -1
氧 O -2
硫 S -2,+4,+6
碳 C +2,+4
硅 Si +4
氮 N -3,+2,+3,+4,+5
磷 P -3,+3,+5
氢氧根 OH- -1
硝酸根 -1
硫酸根 -2
碳酸根 -2
铵根 +1
元素和根的名称 元素和根的符号 常见的化合价
钾 K +1
钠 Na +1
银 Ag +1
钙 Ca +2
镁 Mg +2
钡 Ba +2
铜 Cu +1,+2
铁 Fe +2,+3
铝 Al +3
锰 Mn +2,+4,+6,+7
锌 Zn +2
氢 H +1
氟 F -1
一些常见元素和根的化合价
根据表格所给信息,你能得出哪些规律?
二、化合价
(2)金属元素与非金属元素化合时,金属元素显正价,非金属元素显负价; 非金属元素与氧化合时通常显正价;
(3)一些元素在不同物质中可显不同化合价;
(4)在单质中,元素的化合价为0。
CO2
+4
CO
+2
H2
He
NaCl
+1
P2O5
+5
Na2S
-2
SO2
+4
(1)在化合物里,氧元素通常显-2价,氢元素通常显+1价;
3.化合价的有关规律
二、化合价
原子团:作为一个整体参加反应的原子集团,也叫做根。
注意:①原子团不能单独存在;
②带电荷的原子团也是离子。
二、化合价
NaOH、 Ca(OH)2 、Cu(NO3)2、NH4NO3、BaSO4、CaCO3、 H3PO4
根:
离子:
OH-:
氢氧根离子
铵根离子
硝酸根离子
碳酸根离子
硫酸根离子
磷酸根离子
(1)根据化学式求化合价
依据:
在化合物中正负化合价的代数和为零
例:求SO2、H2SO4中硫元素化合价
SO2
x
-2
x
(-2)
×
2
=
0
+
x
=
+4
H2SO4
x
-2
1
x
(-2)
×
4
=
0
+
2
+
×
x
=
+6
+1
4.化合价的应用
二、化合价
(1)ClO2中氯元素的化合价为 ;
N2O5中氮元素的化合价为 ;
(2)KMnO4中Mn的化合价为 ;
K2MnO4中Mn的化合价为 ;
1. 根据化学式计算某元素的化合价。
+4
+5
+7
+6
C
小试牛刀
2. 中硫元素的化合价为( )
A. -2 B. +4 C. +6 D. +8
化合价交叉法
例:请写出氧化铝的化学式: 。
Al2O3
Al
O
-2
+3
=0
(+3)×2
(-2)×3
+
①元素排序标价
②交叉
③化简
④检验
3
2
(2)根据化合价写化学式
4.化合价的应用
二、化合价
氧化铜
氯化钙
写出下列物质的化学式
氧化铁
氧化亚铁
Cu O
Fe O
Fe O
Ca Cl
- 1
+2
2
+2
-2
+3
-2
+2
-2
2
3
硝酸钙
氢氧化镁
硫酸铁
硫酸亚铁
Mg OH
( )2
- 1
+2
Ca NO3
( )2
- 1
+2
Fe SO4
+3
-2
2( )3
Fe SO4
+2
-2
小试牛刀
H
H
O
H
H
O
H2O
1个水分子是由 个氢原子和 个氧原子构成的。
1个水分子的质量= + 。
2
1
2个氢原子的质量
1个氧原子的质量
分子、原子质量都很小。为了方便,原子采用相对原子质量,那么分子呢?
相对分子质量
思考交流
相对分子质量:化学式中各原子的相对原子质量的总和。(符号为Mr)
H
H
O
H
O
相对原子量为1
相对原子量为16
Mr(H2O)=
=18
1
×2
+
16
×1
2个
1个
g
关键:搞清楚组成元素的种类,及对应原子数目
H2O的相对分子质量=
相对分子质量也是比值,单位为1
三、有关相对分子质量的计算
1.计算相对分子质量
相对原子质量: H-1 N-14 O-16 Al-27 S-32 K-39
1. 计算 NH4NO3的相对分子质量
2. 计算Al2(SO4)3的相对分子质量
Mr[Al2(SO4)3] = 27×2 +(32×1+16×4)×3
= 342
Mr[NH4NO3] =14×2 + 1×4 + 16×3
=80
3. 计算KAl(SO4)2·12H2O的相对分子质量
Mr[KAl(SO4)2·12H2O] = 39 + 27 + (32+16×4)×2 + 12×(1×2+16)
= 474
三、有关相对分子质量的计算
元素的质量比:各元素的所有原子相对原子质量总和之比。
H
H
O
H
O
相对原子量为1
相对原子量为16
2个
1个
H2O
=1∶8
1
×2
∶
16
×1
H
O
中
m
m
∶
=
注意:1.前后对应; 2.元素质量比 ≠ 原子个数比
2.计算物质组成元素的质量比
三、有关相对分子质量的计算
1. 硝酸铵(NH4NO3 )中,氮、氢、氧三种元素的质量比
m(N) ∶ m(H) ∶ m(O)
=(14×2)∶ (1×4) ∶ (16×3)
= 7 ∶ 1 ∶ 12
2. 氢氧化钙(Ca(OH)2 )中,钙、氢、氧三种元素的质量比
m(Ca) ∶ m(H) ∶ m(O)
=(40×1)∶ (1×2) ∶ (16×2)
= 20 ∶ 1 ∶ 16
相对原子质量: H-1 N-14 O-16 Ca-40
三、有关相对分子质量的计算
相对分子质量
该元素的相对原子质量
×
该元素的原子个数
元素的质量分数
×
100%
=
元素的质量分数:该元素的质量与组成物质的元素总质量之比。
×100%
1
×2
1
×2
+
16
×1
×100%
H2O中氢元素的质量分数=
=
3.计算物质中某元素的质量分数
三、有关相对分子质量的计算
1. 硝酸铵(NH4NO3 )中,氮元素的质量分数
2. 尿素(CO(NH2)2)中,氧元素的质量分数
相对原子质量: H-1 C-12 N-14 O-16
三、有关相对分子质量的计算
ω(N)=
14 × 2
14×2+1×4+16×3
×100%
=35%
ω(O)=
16 × 1
12×1+16×1+14×2+1×4
×100%
=26.7%
本节内容结束
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
