3.4 离子反应 同步练习题(含解析) 2023-2024学年高二上学期化学鲁科版(2019)选择性必修1
文档属性
| 名称 | 3.4 离子反应 同步练习题(含解析) 2023-2024学年高二上学期化学鲁科版(2019)选择性必修1 |  | |
| 格式 | docx | ||
| 文件大小 | 502.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-08 15:06:48 | ||
图片预览



文档简介
3.4 离子反应 同步练习题
一、选择题
1.室温下,下列各组离子在指定溶液中可能大量共存的是
A.与铝粉反应放出H2的透明溶液:Cu2+、Cl-、Na+、SO
B.含有大量I-的溶液:Br-、Cl-、Fe3+、H+
C.使紫色石蕊试液变红的溶液:Mg2+、Na+、ClO-、NO
D.c(Ca2+)=0.1mol L-1的溶液中:NH、CO、Cl-、Br-
2.下列有关实验操作的叙述错误的是
A.滴定管用水洗净后,加入待装液
B.配制溶液时,容量瓶不需干燥
C.测结晶水含量时,加热后的坩埚必须放在干燥器中冷却
D.过滤操作中,漏斗的尖端应接触烧杯内壁
3.已知25℃,醋酸、次氯酸、碳酸、亚硫酸的电离平衡常数如表:
酸 电离平衡常数
醋酸 Ki=1.75×10-5
次氯酸 Ki=2.98×10-8
碳酸 Ki1=4.30×10-7 Ki2=5.61×10-11
亚硫酸 Ki1=1.54×10-2 Ki2=1.02×10-7
下列叙述正确的是
A.将0.1mol/L的醋酸加水不断稀释,所有离子浓度均减小
B.少量CO2通入NaClO溶液中反应的离子方程式为:CO2+H2O+2ClO-→CO+2HClO
C.少量的SO2通入Ca(ClO)2溶液中反应的离子方程式为:SO2+H2O+Ca2++2ClO-→CaSO3↓+2HClO
D.25℃,等浓度的CH3COONa、NaClO、Na2CO3和Na2SO3溶液中,碱性最强的是Na2CO3
4.室温下,下列各组离子一定能在指定溶液中共存的是
A.的溶液中:、、、
B.的溶液中:、、、
C.的溶液中:、、、
D.的溶液中:、、、
5.从下列实验事实所得出的相应结论不正确的是
实验事实 结论
A 铁与硫单质生成FeS,与Cl2生成FeCl3 氧化性:Cl2>S
B 将CO2通入到时Na2SiO3溶液中产生白色浑浊(H2SiO3) 酸性:H2CO3>H2SiO3
C 将燃烧的镁条放入CO2中能继续燃烧 还原性:Mg>C
D 某无色溶液加入盐酸酸化的氯化钡溶液产生白色沉淀 原溶液一定有
A.A B.B C.C D.D
6.下列化学反应的离子方程式书写正确的是
A.海水提溴中用的水溶液富集溴:
B.向溶液中滴入溶液至恰好沉淀完全:
C.少量与溶液反应:
D.溶液和溶液等体积、等浓度混合:
7.下列离子组在指定溶液中能大量共存的是
A.无色透明的溶液中:
B.碱性溶液中:
C.含有大量的溶液中:
D.使紫色石蕊试液呈红色的溶液中:
8.下列离子方程式正确的是
A.铁与稀硫酸反应:
B.碳酸钙与稀硝酸:
C.盐酸与氢氧化钠溶液:
D.硫酸铜溶液与氢氧化钡溶液:
9.下列实验操作正确的是
A.可用图1装置进行KMnO4溶液滴定未知浓度的FeSO4溶液实验
B.如图2所示,记录滴定终点读数为19.90 mL
C.中和滴定时,选用图3滴定管盛装NaOH标准溶液
D.选用图3滴定管量取20.50 mLNaCl溶液
10.已知:25℃时,。该温度下,用0.100的氨水滴定10.00mL 0.100HA的溶液,滴定过程中加入氨水的体积(V)与溶液中的关系如图所示。下列说法正确的是
A.HA为弱酸
B.
C.当滴入10mL氨水时,溶液中存在
D.当滴入20mL氨水时,溶液中存在
二、填空题
11.硅是无机非金属材料的主角,硅的氧化物和硅酸盐约占地壳质量的90%以上。请回答下列问题:
(1)Si元素位于元素周期表 ,在SiO2中,硅原子和氧原子以 (选填“极性共价键”、“非极性共价键”、“离子键”)连接形成立体网状结构,所以SiO2硬度大。
(2)国家速滑馆用到建筑黏合剂和防火剂硅酸钠,硅酸钠可由SiO2溶解在NaOH溶液中反应来制备,反应的离子方程式为 。
(3)生产磨砂玻璃时可以用HF溶蚀玻璃,是因为HF溶液可与SiO2反应,其化学反应方程式为 。
(4)由SiO2制备高纯度硅的工业流程如图所示,X为 ,可以循环使用的物质为H2和 。
12.二氧化氯是一种绿色消毒剂,常温常压下为黄绿色气体,易溶于水。常见的化学合成方法有氧化法和电解法等。
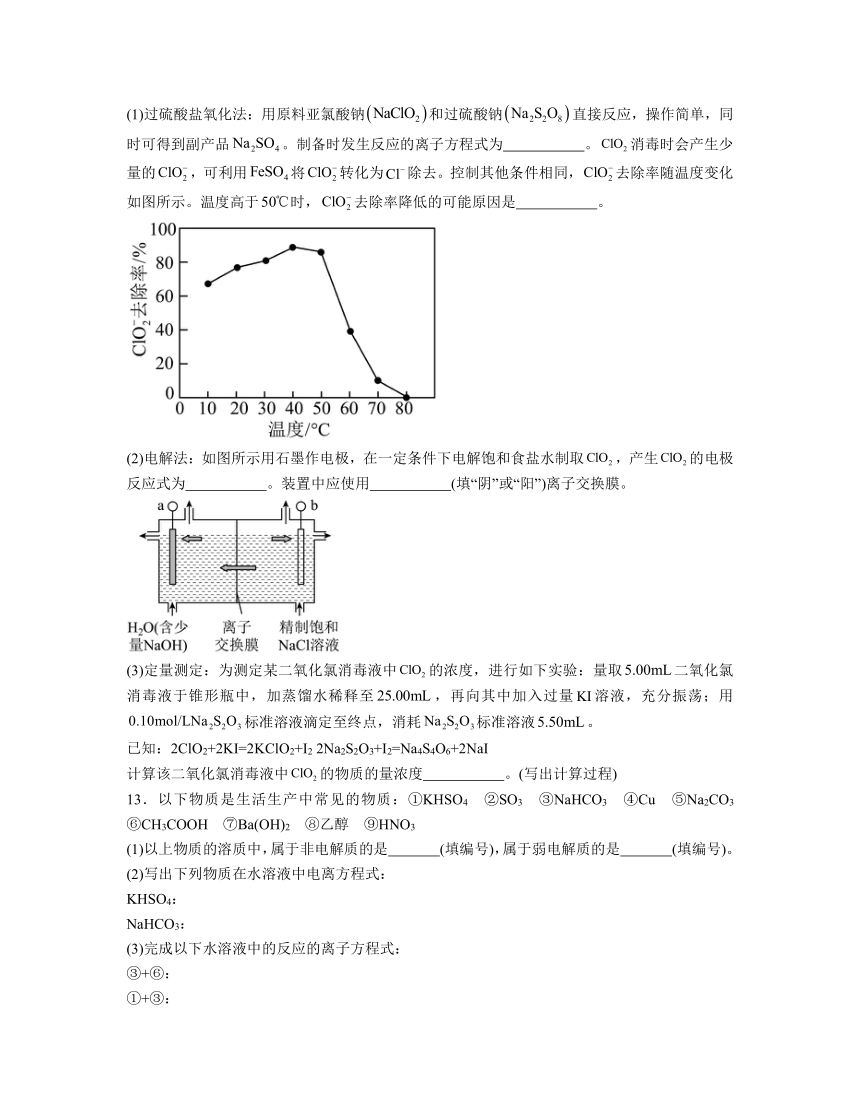
(1)过硫酸盐氧化法:用原料亚氯酸钠和过硫酸钠直接反应,操作简单,同时可得到副产品。制备时发生反应的离子方程式为 。消毒时会产生少量的,可利用将转化为除去。控制其他条件相同,去除率随温度变化如图所示。温度高于时,去除率降低的可能原因是 。
(2)电解法:如图所示用石墨作电极,在一定条件下电解饱和食盐水制取,产生的电极反应式为 。装置中应使用 (填“阴”或“阳”)离子交换膜。
(3)定量测定:为测定某二氧化氯消毒液中的浓度,进行如下实验:量取二氧化氯消毒液于锥形瓶中,加蒸馏水稀释至,再向其中加入过量溶液,充分振荡;用标准溶液滴定至终点,消耗标准溶液。
已知:2ClO2+2KI=2KClO2+I2 2Na2S2O3+I2=Na4S4O6+2NaI
计算该二氧化氯消毒液中的物质的量浓度 。(写出计算过程)
13.以下物质是生活生产中常见的物质:①KHSO4 ②SO3 ③NaHCO3 ④Cu ⑤Na2CO3 ⑥CH3COOH ⑦Ba(OH)2 ⑧乙醇 ⑨HNO3
(1)以上物质的溶质中,属于非电解质的是 (填编号),属于弱电解质的是 (填编号)。
(2)写出下列物质在水溶液中电离方程式:
KHSO4:
NaHCO3:
(3)完成以下水溶液中的反应的离子方程式:
③+⑥:
①+③:
(4)④与⑨的稀溶液反应的化学方程式为:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O
i.写出该反应的离子方程式
ii.用双线桥标注该氧化还原反应
iii.该反应中还原剂与氧化剂的物质的量之比
14.通过下列方法测定产品纯度:准确称取0.5000gCuSO4·5H2O样品,加适量水溶解,转移至碘量瓶中,加过量KI溶液并用稀H2SO4酸化,以淀粉溶液为指示剂,用0.1000mol L 1Na2S2O3标准溶液滴定至终点,消耗Na2S2O3的溶液19.80mL。测定过程中发生下列反应:2Cu2++4I-=2CuI↓+I2、2+I2=+2I-。计算CuSO4·5H2O样品的纯度(写出计算过程): 。
15.有一瓶溶液只含Cl-、CO、SO、Na+、Cu2+、Mg2+六种离子中的某几种。
经实验:
①原溶液加入过量的NaOH溶液,产生白色沉淀;
②原溶液中加BaCl2溶液不产生沉淀;
③原溶液中加AgNO3溶液产生白色沉淀,再加稀硝酸白色沉淀不溶解
回答下列问题:
(1)试分析原溶液中一定含有的离子是 ,一定不含有的离子是 ,可能含有的离子是 。
(2)有的同学认为实验③可以省略,你认为是否正确(填“是”或“否”) 说明理由 。
(3)若溶液中确定有Na+,其他阳离子与阴离子个数比为1:3,则溶液中几种离子个数比 。
16.请选择适当的化学试剂和实验用品,用下图所示的装置进行实验,验证过氧化钠可在呼吸面具和潜水艇中做供氧剂。
(1)A装置中分别加入大理石和稀盐酸,其中仪器a的名称是 。
(2)B装置中加入饱和NaHCO3溶液的目的是 。
(3)写出C中发生反应的化学方程式 。
(4)为了保证F中收集到较纯的气体,装置D中应加入的下列试剂中的 (填序号)。
①浓硫酸 ②NaOH溶液
(5)F中得到的气体是 (填化学式)。
【参考答案】
一、选择题
1.A
解析:A.该条件为酸性或碱性条件,酸性条件下这些离子不产生沉淀、气体、弱电解质、氧化还原反应等能大量共存,A项符合题意;
B.I-与Fe3+发生氧化还原反应不能大量共存,B项不符合题意;
C.紫色石蕊变红为强酸性,但ClO-与H+结合产生HClO具有漂白性不可能使溶液呈红色,即ClO-在此溶液不能大量共存,C项不符合题意;
D.Ca2+与碳酸根产生沉淀而不能大量共存,D项不符合题意;
故选A。
2.A
解析:A.滴定管用水洗净后,再使用待装液润洗后才能加入待装液,A错误;
B.底部含有蒸馏水不影响溶液浓度,配制溶液时,容量瓶不需干燥,B正确;
C.测结晶水含量时,加热后的坩埚必须放在干燥器中冷却,防止空气中水蒸气影响实验结果,C正确;
D.过滤操作中,漏斗的尖端应接触烧杯内壁,防止滤液溅出,D正确;
故选A。
3.D
解析:A.将0.1mol/L的醋酸加水不断稀释,OH-浓度增大,故A错误;
B.根据电离平衡常数,可知酸性H2CO3>HClO>,所以少量CO2通入NaClO溶液中生成次氯酸和碳酸氢钠,反应的离子方程式为:CO2+H2O+ClO-=+HClO,故B错误;
C.二氧化硫能被次氯酸钙氧化,少量的SO2通入Ca(ClO)2溶液中生成硫酸钙沉淀、次氯酸、氯化钙,反应的离子方程式为:SO2+H2O+Ca2++3ClO-=CaSO4↓+2HClO+ Cl-,故C错误;
D.25℃,醋酸的Ki=1.75×10-5、次氯酸的Ki=2.98×10-8、碳酸的Ki2=5.61×10-11、亚硫酸的Ki2=1.02×10-7,电离平衡常数越小,酸根离子的水解沉淀越大,等浓度的CH3COONa、NaClO、Na2CO3和Na2SO3溶液中,碱性最强的是Na2CO3,故D正确;
选D。
4.D
解析:A.与会发生氧化还原反应,溶液中不能含有大量,A项错误;
B. 酸性条件下,具有强氧化性,与,不能共存,B项错误;
C.与会发生双水解,即,不能大量共存,C项错误;
D.溶液中、、、、、、之间不能发生任何反应,可以大量共存,D项正确;
答案选D。
5.D
解析:A.氯气能把铁氧化生成氯化铁,而S只能把铁氧化为FeS,所以氧化性氯气强于S,A正确;
B.根据较强酸制备较弱酸可知CO2能制备硅酸,说明酸性是碳酸强于硅酸,B正确;
C.镁能在CO2中燃烧生成氧化镁和C,所以还原性是镁强于C,C正确;
D.产生的沉淀也可能是氯化银,因此也可能含有银离子,D错误;
答案选D。
6.D
解析:A.二氧化硫和溴反应生成硫酸和氢溴酸,,A错误;
B.向溶液中滴入溶液至恰好沉淀完全,则碳酸氢根离子过量,氢离子、硫酸根离子完全反应:,B错误;
C.少量与溶液反应生成硫酸根离子、氯离子和次氯酸:,C错误;
D.溶液和溶液等体积、等浓度混合生成草酸氢钠:,D正确。
故选D。
7.B
解析:A.无色透明溶液中不能含大量显黄色的,A错误;
B.与四种离子均能大量共存,且之间不反应,B正确;
C.和都能与反应而不能大量共存,C错误;
D.溶液呈酸性,含有大量,与不能大量共存,且和反应生成沉淀而不能大量共存,D错误;
故选B。
8.C
解析:A.铁与稀硫酸反应生成硫酸亚铁和氢气:,A错误;
B. 碳酸钙与稀硝酸生成硝酸钙、二氧化碳和水:,B错误;
C. 盐酸与氢氧化钠溶液发生中和反应生成氯化钠和水:,C正确;
D. 硫酸铜溶液与氢氧化钡溶液生成硫酸钡沉淀和氢氧化铜沉淀:,D错误;
答案选C。
9.D
解析:A.KMnO4溶液具有强氧化性,会腐蚀碱式滴定管的橡胶管,应放于酸式滴定管中,并且在滴定时,滴定管的尖嘴不能插入锥形瓶中,A错误;
B.滴定管“0”刻度在上方,从上至下依次增大,虚线处读数为18.10 mL,B错误;
C.图3为酸式滴定管,不能盛放碱NaOH溶液,C错误;
D.滴定管的精确度为0.01 mL,精确度高,可以量取一定体积的溶解,D正确;
故合理选项是D。
10.B
解析:A.根据图像,0.1的一元酸HA溶液中,则,结合 ,解得,则HA为强酸,A项错误;
B.若,则二者恰好完全反应生成,该铵盐水解,溶液显酸性,,结合图像可知,当时,,B项正确;
C.因HA为强酸,故溶液中无HA,C项错误;
D.当滴入氨水的体积时得到等物质的量浓度的和氨水的混合液,由于的电离常数大于的水解常数,则的电离程度大于的水解程度,所以、,则,D项错误;
故选B。
二、填空题
11.(1) 第三周期第ⅣA族 极性共价键
(2)SiO2+2OH-=SiO+H2O
(3)SiO2+4HF=SiF4↑+2H2O
(4)CO H2和HCl
解析:(1)Si元素位于元素周期表第三周期第ⅣA族;在SiO2中,硅原子和氧原子以极性共价键连接形成立体网状结构,所以SiO2硬度大。
(2)硅酸钠可由SiO2溶解在NaOH溶液中反应来制备,反应的离子方程式为SiO2+2OH-=SiO+H2O。
(3)HF溶液可与SiO2反应生成SiF4和H2O,方程式为SiO2+4HF=SiF4↑+2H2O。
(4)反应①为SiO2+2CSi+2CO↑,可知X为CO气体,由生产高纯硅的流程示意图可知,H2和HCI既是反应物,又是生成物,所以可重复利用的物质是H2和HCl。
12.(1) 温度高于50℃时,有较多的Fe2+水解,Fe2+浓度减小,去除率降低
(2)Cl--5e-+2H2O=ClO2↑+4H+ 阳
(3)0.11
解析:(1)亚氯酸钠(NaClO2)为氧化剂,过硫酸钠(Na2S2O8)为还原剂被氧化为Na2SO4,根据电子守恒和电荷守恒,则制备二氧化氯(ClO2)发生反应的离子方程式为:;FeSO4是强酸弱碱盐,升高温度促进了Fe2+水解,使更多的Fe2+水解生成Fe(OH)2,导致参与氧化还原反应的Fe2+减少,去除率降低,故答案为:有较多的Fe2+水解;
(2)根据题意可以知道,氯离子放电生成ClO2为阳极,接电源的正极,由元素守恒可以知道,有水参加反应,同时生成氢离子,电极反应式为:Cl--5e-+2H2O=ClO2↑+4H+,a极为阴极,溶液中阳离子移向阴极,根据溶液中电荷守恒的规律,图中应使用阳离子交换膜,故答案为:阳;
(3)消耗Na2S2O3标准液的物质的量为0.1mol/L×5.5mL×10-3L/mL=5.5×10-4mol,设ClO2的物质的量为xmol,依据反应原理得关系式:2ClO2~I2~2Na2S2O3,则有,解得x=5.5×10-4mol,该二氧化氯消毒液中的物质的量浓度为。
13.(1) ②⑧ ⑥
(2)KHSO4=K++H++SO NaHCO3=Na++HCO
(3)HCO+CH3COOH=CH3COO-+CO2↑+H2O HCO+H+=H2O+CO2↑
(4)3Cu+8H++2NO=3Cu2++2NO↑+4H2O 3:2
解析:(1)
电解质是溶于水或在熔融状态下能够导电的化合物;非电解质是溶于水或在熔融状态下不能够导电的化合物;强电解质是溶于水或在熔融状态下能够完全电离的化合物;弱电解质是溶于水或在熔融状态下不能够完全电离的化合物;
以上物质的溶质中,属于非电解质的是②SO3⑧乙醇,属于弱电解质的是⑥CH3COOH。
(2)
硫酸为强酸,KHSO4在水溶液中完全电离,KHSO4=K++H++SO。
碳酸为弱酸,NaHCO3在水溶液中完全电离出钠离子和碳酸氢根离子,NaHCO3=Na++HCO。
(3)
③+⑥反应为碳酸氢钠和醋酸生成二氧化碳和水、醋酸钠,HCO+CH3COOH=CH3COO-+CO2↑+H2O。
①+③反应为氢离子和碳酸氢根离子反应生成二氧化碳和水,HCO+H+=H2O+CO2↑。
(4)
i.该反应的离子方程式为铜和氢离子、硝酸根离子生成铜离子、水和一氧化氮,3Cu+8H++2NO=3Cu2++2NO↑+4H2O。
ii.双线桥表示了反应中电子的得失情况,。
iii.该反应中还原剂与氧化剂分别为铜、硝酸,其中每3molCu会和8molHNO3中的2mol HNO3,反应的物质的量之比为3:2。
14.99%
解析:依据题目所给方程式可得关系式:2CuSO4·5H2O~I2~2Na2S2O3,则样品中CuSO4·5H2O的物质的量与Na2S2O3的物质的量相等,为0.1000mol L 1×0.0198L=0.00198mol,CuSO4·5H2O的质量为0.00198mol×250g/mol=0.495g,则CuSO4·5H2O样品的纯度为。
15.(1) Cl-、Mg2+; CO、SO、Cu2+; Na+;
(2)是; 溶液呈电中性,必须同时含有阴离子、阳离子;
(3)Cl-、Mg2+、Na+的个数比为3:1:1。
【分析】Cl-、CO、SO、Na+、Cu2+、Mg2+六种离子中只有Mg2+能和氢氧化钠反应生成沉淀,说明一定含有Mg2+;Mg2+和CO反应生成沉淀,二者不能共存,氢氧化铜为蓝色沉淀,故无CO、Cu2+;原溶液中加BaCl2溶液不产生沉淀,说明不含SO;原溶液中加AgNO3溶液产生白色沉淀,再加稀硝酸白色沉淀不溶解,说明含Cl-,据此分析。
解析:(1)由以上分析可知,原溶液中一定含有的离子是Cl-、Mg2+,一定不含有的离子是CO、SO、Cu2+,可能含有Na+,故答案为: Cl-、Mg2+;CO、SO、Cu2+;Na+;
(2)实验③可以省略,因溶液呈电中性,必须同时含有阴、阳离子,又因为一定无CO、SO,所以一定有Cl-;答案为:是;溶液呈电中性,必须同时含有阴离子、阳离子;
(3)溶液中有Cl-、Mg2+、Na+,根据电荷守恒,可得Cl-、Mg2+、Na+的个数比为3:1:1。答案为:3:1:1。
16.(1)分液漏斗
(2)吸收挥发出来的HCl
(3)Na2O2+2CO2= 2NaCO3+O2、2Na2O2+2H2O= 4NaOH+O2↑
(4)②
(5)O2
【分析】A中碳酸钙和稀盐酸生成二氧化碳气体,通过饱和NaHCO3溶液除去杂质氯化氢,二氧化碳气体通过过氧化钠反应生成氧气,再通过氢氧化钠溶液除去不反应的二氧化碳气体,使用排水法收集氧气。
解析:(1)仪器a的名称是分液漏斗;
(2)盐酸具有挥发性,导致生成的二氧化碳气体中含有氯化氢气体杂质,B装置中加入饱和NaHCO3溶液的目的是吸收挥发出来的HCl;
(3)进入C中气体为二氧化碳及二氧化碳从装置AB中带出的水蒸气,二氧化碳和水均可与过氧化钠反应生成氧气,C中发生反应为Na2O2+2CO2=2NaCO3+O2、2Na2O2+2H2O= 4NaOH+O2↑;
(4)C中部分二氧化碳可能反应不完全,氢氧化钠可以吸收二氧化碳,故装置D中应加入NaOH溶液,选②;
(5)氧气不易溶于水,F中得到的气体是氧气O2
一、选择题
1.室温下,下列各组离子在指定溶液中可能大量共存的是
A.与铝粉反应放出H2的透明溶液:Cu2+、Cl-、Na+、SO
B.含有大量I-的溶液:Br-、Cl-、Fe3+、H+
C.使紫色石蕊试液变红的溶液:Mg2+、Na+、ClO-、NO
D.c(Ca2+)=0.1mol L-1的溶液中:NH、CO、Cl-、Br-
2.下列有关实验操作的叙述错误的是
A.滴定管用水洗净后,加入待装液
B.配制溶液时,容量瓶不需干燥
C.测结晶水含量时,加热后的坩埚必须放在干燥器中冷却
D.过滤操作中,漏斗的尖端应接触烧杯内壁
3.已知25℃,醋酸、次氯酸、碳酸、亚硫酸的电离平衡常数如表:
酸 电离平衡常数
醋酸 Ki=1.75×10-5
次氯酸 Ki=2.98×10-8
碳酸 Ki1=4.30×10-7 Ki2=5.61×10-11
亚硫酸 Ki1=1.54×10-2 Ki2=1.02×10-7
下列叙述正确的是
A.将0.1mol/L的醋酸加水不断稀释,所有离子浓度均减小
B.少量CO2通入NaClO溶液中反应的离子方程式为:CO2+H2O+2ClO-→CO+2HClO
C.少量的SO2通入Ca(ClO)2溶液中反应的离子方程式为:SO2+H2O+Ca2++2ClO-→CaSO3↓+2HClO
D.25℃,等浓度的CH3COONa、NaClO、Na2CO3和Na2SO3溶液中,碱性最强的是Na2CO3
4.室温下,下列各组离子一定能在指定溶液中共存的是
A.的溶液中:、、、
B.的溶液中:、、、
C.的溶液中:、、、
D.的溶液中:、、、
5.从下列实验事实所得出的相应结论不正确的是
实验事实 结论
A 铁与硫单质生成FeS,与Cl2生成FeCl3 氧化性:Cl2>S
B 将CO2通入到时Na2SiO3溶液中产生白色浑浊(H2SiO3) 酸性:H2CO3>H2SiO3
C 将燃烧的镁条放入CO2中能继续燃烧 还原性:Mg>C
D 某无色溶液加入盐酸酸化的氯化钡溶液产生白色沉淀 原溶液一定有
A.A B.B C.C D.D
6.下列化学反应的离子方程式书写正确的是
A.海水提溴中用的水溶液富集溴:
B.向溶液中滴入溶液至恰好沉淀完全:
C.少量与溶液反应:
D.溶液和溶液等体积、等浓度混合:
7.下列离子组在指定溶液中能大量共存的是
A.无色透明的溶液中:
B.碱性溶液中:
C.含有大量的溶液中:
D.使紫色石蕊试液呈红色的溶液中:
8.下列离子方程式正确的是
A.铁与稀硫酸反应:
B.碳酸钙与稀硝酸:
C.盐酸与氢氧化钠溶液:
D.硫酸铜溶液与氢氧化钡溶液:
9.下列实验操作正确的是
A.可用图1装置进行KMnO4溶液滴定未知浓度的FeSO4溶液实验
B.如图2所示,记录滴定终点读数为19.90 mL
C.中和滴定时,选用图3滴定管盛装NaOH标准溶液
D.选用图3滴定管量取20.50 mLNaCl溶液
10.已知:25℃时,。该温度下,用0.100的氨水滴定10.00mL 0.100HA的溶液,滴定过程中加入氨水的体积(V)与溶液中的关系如图所示。下列说法正确的是
A.HA为弱酸
B.
C.当滴入10mL氨水时,溶液中存在
D.当滴入20mL氨水时,溶液中存在
二、填空题
11.硅是无机非金属材料的主角,硅的氧化物和硅酸盐约占地壳质量的90%以上。请回答下列问题:
(1)Si元素位于元素周期表 ,在SiO2中,硅原子和氧原子以 (选填“极性共价键”、“非极性共价键”、“离子键”)连接形成立体网状结构,所以SiO2硬度大。
(2)国家速滑馆用到建筑黏合剂和防火剂硅酸钠,硅酸钠可由SiO2溶解在NaOH溶液中反应来制备,反应的离子方程式为 。
(3)生产磨砂玻璃时可以用HF溶蚀玻璃,是因为HF溶液可与SiO2反应,其化学反应方程式为 。
(4)由SiO2制备高纯度硅的工业流程如图所示,X为 ,可以循环使用的物质为H2和 。
12.二氧化氯是一种绿色消毒剂,常温常压下为黄绿色气体,易溶于水。常见的化学合成方法有氧化法和电解法等。
(1)过硫酸盐氧化法:用原料亚氯酸钠和过硫酸钠直接反应,操作简单,同时可得到副产品。制备时发生反应的离子方程式为 。消毒时会产生少量的,可利用将转化为除去。控制其他条件相同,去除率随温度变化如图所示。温度高于时,去除率降低的可能原因是 。
(2)电解法:如图所示用石墨作电极,在一定条件下电解饱和食盐水制取,产生的电极反应式为 。装置中应使用 (填“阴”或“阳”)离子交换膜。
(3)定量测定:为测定某二氧化氯消毒液中的浓度,进行如下实验:量取二氧化氯消毒液于锥形瓶中,加蒸馏水稀释至,再向其中加入过量溶液,充分振荡;用标准溶液滴定至终点,消耗标准溶液。
已知:2ClO2+2KI=2KClO2+I2 2Na2S2O3+I2=Na4S4O6+2NaI
计算该二氧化氯消毒液中的物质的量浓度 。(写出计算过程)
13.以下物质是生活生产中常见的物质:①KHSO4 ②SO3 ③NaHCO3 ④Cu ⑤Na2CO3 ⑥CH3COOH ⑦Ba(OH)2 ⑧乙醇 ⑨HNO3
(1)以上物质的溶质中,属于非电解质的是 (填编号),属于弱电解质的是 (填编号)。
(2)写出下列物质在水溶液中电离方程式:
KHSO4:
NaHCO3:
(3)完成以下水溶液中的反应的离子方程式:
③+⑥:
①+③:
(4)④与⑨的稀溶液反应的化学方程式为:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O
i.写出该反应的离子方程式
ii.用双线桥标注该氧化还原反应
iii.该反应中还原剂与氧化剂的物质的量之比
14.通过下列方法测定产品纯度:准确称取0.5000gCuSO4·5H2O样品,加适量水溶解,转移至碘量瓶中,加过量KI溶液并用稀H2SO4酸化,以淀粉溶液为指示剂,用0.1000mol L 1Na2S2O3标准溶液滴定至终点,消耗Na2S2O3的溶液19.80mL。测定过程中发生下列反应:2Cu2++4I-=2CuI↓+I2、2+I2=+2I-。计算CuSO4·5H2O样品的纯度(写出计算过程): 。
15.有一瓶溶液只含Cl-、CO、SO、Na+、Cu2+、Mg2+六种离子中的某几种。
经实验:
①原溶液加入过量的NaOH溶液,产生白色沉淀;
②原溶液中加BaCl2溶液不产生沉淀;
③原溶液中加AgNO3溶液产生白色沉淀,再加稀硝酸白色沉淀不溶解
回答下列问题:
(1)试分析原溶液中一定含有的离子是 ,一定不含有的离子是 ,可能含有的离子是 。
(2)有的同学认为实验③可以省略,你认为是否正确(填“是”或“否”) 说明理由 。
(3)若溶液中确定有Na+,其他阳离子与阴离子个数比为1:3,则溶液中几种离子个数比 。
16.请选择适当的化学试剂和实验用品,用下图所示的装置进行实验,验证过氧化钠可在呼吸面具和潜水艇中做供氧剂。
(1)A装置中分别加入大理石和稀盐酸,其中仪器a的名称是 。
(2)B装置中加入饱和NaHCO3溶液的目的是 。
(3)写出C中发生反应的化学方程式 。
(4)为了保证F中收集到较纯的气体,装置D中应加入的下列试剂中的 (填序号)。
①浓硫酸 ②NaOH溶液
(5)F中得到的气体是 (填化学式)。
【参考答案】
一、选择题
1.A
解析:A.该条件为酸性或碱性条件,酸性条件下这些离子不产生沉淀、气体、弱电解质、氧化还原反应等能大量共存,A项符合题意;
B.I-与Fe3+发生氧化还原反应不能大量共存,B项不符合题意;
C.紫色石蕊变红为强酸性,但ClO-与H+结合产生HClO具有漂白性不可能使溶液呈红色,即ClO-在此溶液不能大量共存,C项不符合题意;
D.Ca2+与碳酸根产生沉淀而不能大量共存,D项不符合题意;
故选A。
2.A
解析:A.滴定管用水洗净后,再使用待装液润洗后才能加入待装液,A错误;
B.底部含有蒸馏水不影响溶液浓度,配制溶液时,容量瓶不需干燥,B正确;
C.测结晶水含量时,加热后的坩埚必须放在干燥器中冷却,防止空气中水蒸气影响实验结果,C正确;
D.过滤操作中,漏斗的尖端应接触烧杯内壁,防止滤液溅出,D正确;
故选A。
3.D
解析:A.将0.1mol/L的醋酸加水不断稀释,OH-浓度增大,故A错误;
B.根据电离平衡常数,可知酸性H2CO3>HClO>,所以少量CO2通入NaClO溶液中生成次氯酸和碳酸氢钠,反应的离子方程式为:CO2+H2O+ClO-=+HClO,故B错误;
C.二氧化硫能被次氯酸钙氧化,少量的SO2通入Ca(ClO)2溶液中生成硫酸钙沉淀、次氯酸、氯化钙,反应的离子方程式为:SO2+H2O+Ca2++3ClO-=CaSO4↓+2HClO+ Cl-,故C错误;
D.25℃,醋酸的Ki=1.75×10-5、次氯酸的Ki=2.98×10-8、碳酸的Ki2=5.61×10-11、亚硫酸的Ki2=1.02×10-7,电离平衡常数越小,酸根离子的水解沉淀越大,等浓度的CH3COONa、NaClO、Na2CO3和Na2SO3溶液中,碱性最强的是Na2CO3,故D正确;
选D。
4.D
解析:A.与会发生氧化还原反应,溶液中不能含有大量,A项错误;
B. 酸性条件下,具有强氧化性,与,不能共存,B项错误;
C.与会发生双水解,即,不能大量共存,C项错误;
D.溶液中、、、、、、之间不能发生任何反应,可以大量共存,D项正确;
答案选D。
5.D
解析:A.氯气能把铁氧化生成氯化铁,而S只能把铁氧化为FeS,所以氧化性氯气强于S,A正确;
B.根据较强酸制备较弱酸可知CO2能制备硅酸,说明酸性是碳酸强于硅酸,B正确;
C.镁能在CO2中燃烧生成氧化镁和C,所以还原性是镁强于C,C正确;
D.产生的沉淀也可能是氯化银,因此也可能含有银离子,D错误;
答案选D。
6.D
解析:A.二氧化硫和溴反应生成硫酸和氢溴酸,,A错误;
B.向溶液中滴入溶液至恰好沉淀完全,则碳酸氢根离子过量,氢离子、硫酸根离子完全反应:,B错误;
C.少量与溶液反应生成硫酸根离子、氯离子和次氯酸:,C错误;
D.溶液和溶液等体积、等浓度混合生成草酸氢钠:,D正确。
故选D。
7.B
解析:A.无色透明溶液中不能含大量显黄色的,A错误;
B.与四种离子均能大量共存,且之间不反应,B正确;
C.和都能与反应而不能大量共存,C错误;
D.溶液呈酸性,含有大量,与不能大量共存,且和反应生成沉淀而不能大量共存,D错误;
故选B。
8.C
解析:A.铁与稀硫酸反应生成硫酸亚铁和氢气:,A错误;
B. 碳酸钙与稀硝酸生成硝酸钙、二氧化碳和水:,B错误;
C. 盐酸与氢氧化钠溶液发生中和反应生成氯化钠和水:,C正确;
D. 硫酸铜溶液与氢氧化钡溶液生成硫酸钡沉淀和氢氧化铜沉淀:,D错误;
答案选C。
9.D
解析:A.KMnO4溶液具有强氧化性,会腐蚀碱式滴定管的橡胶管,应放于酸式滴定管中,并且在滴定时,滴定管的尖嘴不能插入锥形瓶中,A错误;
B.滴定管“0”刻度在上方,从上至下依次增大,虚线处读数为18.10 mL,B错误;
C.图3为酸式滴定管,不能盛放碱NaOH溶液,C错误;
D.滴定管的精确度为0.01 mL,精确度高,可以量取一定体积的溶解,D正确;
故合理选项是D。
10.B
解析:A.根据图像,0.1的一元酸HA溶液中,则,结合 ,解得,则HA为强酸,A项错误;
B.若,则二者恰好完全反应生成,该铵盐水解,溶液显酸性,,结合图像可知,当时,,B项正确;
C.因HA为强酸,故溶液中无HA,C项错误;
D.当滴入氨水的体积时得到等物质的量浓度的和氨水的混合液,由于的电离常数大于的水解常数,则的电离程度大于的水解程度,所以、,则,D项错误;
故选B。
二、填空题
11.(1) 第三周期第ⅣA族 极性共价键
(2)SiO2+2OH-=SiO+H2O
(3)SiO2+4HF=SiF4↑+2H2O
(4)CO H2和HCl
解析:(1)Si元素位于元素周期表第三周期第ⅣA族;在SiO2中,硅原子和氧原子以极性共价键连接形成立体网状结构,所以SiO2硬度大。
(2)硅酸钠可由SiO2溶解在NaOH溶液中反应来制备,反应的离子方程式为SiO2+2OH-=SiO+H2O。
(3)HF溶液可与SiO2反应生成SiF4和H2O,方程式为SiO2+4HF=SiF4↑+2H2O。
(4)反应①为SiO2+2CSi+2CO↑,可知X为CO气体,由生产高纯硅的流程示意图可知,H2和HCI既是反应物,又是生成物,所以可重复利用的物质是H2和HCl。
12.(1) 温度高于50℃时,有较多的Fe2+水解,Fe2+浓度减小,去除率降低
(2)Cl--5e-+2H2O=ClO2↑+4H+ 阳
(3)0.11
解析:(1)亚氯酸钠(NaClO2)为氧化剂,过硫酸钠(Na2S2O8)为还原剂被氧化为Na2SO4,根据电子守恒和电荷守恒,则制备二氧化氯(ClO2)发生反应的离子方程式为:;FeSO4是强酸弱碱盐,升高温度促进了Fe2+水解,使更多的Fe2+水解生成Fe(OH)2,导致参与氧化还原反应的Fe2+减少,去除率降低,故答案为:有较多的Fe2+水解;
(2)根据题意可以知道,氯离子放电生成ClO2为阳极,接电源的正极,由元素守恒可以知道,有水参加反应,同时生成氢离子,电极反应式为:Cl--5e-+2H2O=ClO2↑+4H+,a极为阴极,溶液中阳离子移向阴极,根据溶液中电荷守恒的规律,图中应使用阳离子交换膜,故答案为:阳;
(3)消耗Na2S2O3标准液的物质的量为0.1mol/L×5.5mL×10-3L/mL=5.5×10-4mol,设ClO2的物质的量为xmol,依据反应原理得关系式:2ClO2~I2~2Na2S2O3,则有,解得x=5.5×10-4mol,该二氧化氯消毒液中的物质的量浓度为。
13.(1) ②⑧ ⑥
(2)KHSO4=K++H++SO NaHCO3=Na++HCO
(3)HCO+CH3COOH=CH3COO-+CO2↑+H2O HCO+H+=H2O+CO2↑
(4)3Cu+8H++2NO=3Cu2++2NO↑+4H2O 3:2
解析:(1)
电解质是溶于水或在熔融状态下能够导电的化合物;非电解质是溶于水或在熔融状态下不能够导电的化合物;强电解质是溶于水或在熔融状态下能够完全电离的化合物;弱电解质是溶于水或在熔融状态下不能够完全电离的化合物;
以上物质的溶质中,属于非电解质的是②SO3⑧乙醇,属于弱电解质的是⑥CH3COOH。
(2)
硫酸为强酸,KHSO4在水溶液中完全电离,KHSO4=K++H++SO。
碳酸为弱酸,NaHCO3在水溶液中完全电离出钠离子和碳酸氢根离子,NaHCO3=Na++HCO。
(3)
③+⑥反应为碳酸氢钠和醋酸生成二氧化碳和水、醋酸钠,HCO+CH3COOH=CH3COO-+CO2↑+H2O。
①+③反应为氢离子和碳酸氢根离子反应生成二氧化碳和水,HCO+H+=H2O+CO2↑。
(4)
i.该反应的离子方程式为铜和氢离子、硝酸根离子生成铜离子、水和一氧化氮,3Cu+8H++2NO=3Cu2++2NO↑+4H2O。
ii.双线桥表示了反应中电子的得失情况,。
iii.该反应中还原剂与氧化剂分别为铜、硝酸,其中每3molCu会和8molHNO3中的2mol HNO3,反应的物质的量之比为3:2。
14.99%
解析:依据题目所给方程式可得关系式:2CuSO4·5H2O~I2~2Na2S2O3,则样品中CuSO4·5H2O的物质的量与Na2S2O3的物质的量相等,为0.1000mol L 1×0.0198L=0.00198mol,CuSO4·5H2O的质量为0.00198mol×250g/mol=0.495g,则CuSO4·5H2O样品的纯度为。
15.(1) Cl-、Mg2+; CO、SO、Cu2+; Na+;
(2)是; 溶液呈电中性,必须同时含有阴离子、阳离子;
(3)Cl-、Mg2+、Na+的个数比为3:1:1。
【分析】Cl-、CO、SO、Na+、Cu2+、Mg2+六种离子中只有Mg2+能和氢氧化钠反应生成沉淀,说明一定含有Mg2+;Mg2+和CO反应生成沉淀,二者不能共存,氢氧化铜为蓝色沉淀,故无CO、Cu2+;原溶液中加BaCl2溶液不产生沉淀,说明不含SO;原溶液中加AgNO3溶液产生白色沉淀,再加稀硝酸白色沉淀不溶解,说明含Cl-,据此分析。
解析:(1)由以上分析可知,原溶液中一定含有的离子是Cl-、Mg2+,一定不含有的离子是CO、SO、Cu2+,可能含有Na+,故答案为: Cl-、Mg2+;CO、SO、Cu2+;Na+;
(2)实验③可以省略,因溶液呈电中性,必须同时含有阴、阳离子,又因为一定无CO、SO,所以一定有Cl-;答案为:是;溶液呈电中性,必须同时含有阴离子、阳离子;
(3)溶液中有Cl-、Mg2+、Na+,根据电荷守恒,可得Cl-、Mg2+、Na+的个数比为3:1:1。答案为:3:1:1。
16.(1)分液漏斗
(2)吸收挥发出来的HCl
(3)Na2O2+2CO2= 2NaCO3+O2、2Na2O2+2H2O= 4NaOH+O2↑
(4)②
(5)O2
【分析】A中碳酸钙和稀盐酸生成二氧化碳气体,通过饱和NaHCO3溶液除去杂质氯化氢,二氧化碳气体通过过氧化钠反应生成氧气,再通过氢氧化钠溶液除去不反应的二氧化碳气体,使用排水法收集氧气。
解析:(1)仪器a的名称是分液漏斗;
(2)盐酸具有挥发性,导致生成的二氧化碳气体中含有氯化氢气体杂质,B装置中加入饱和NaHCO3溶液的目的是吸收挥发出来的HCl;
(3)进入C中气体为二氧化碳及二氧化碳从装置AB中带出的水蒸气,二氧化碳和水均可与过氧化钠反应生成氧气,C中发生反应为Na2O2+2CO2=2NaCO3+O2、2Na2O2+2H2O= 4NaOH+O2↑;
(4)C中部分二氧化碳可能反应不完全,氢氧化钠可以吸收二氧化碳,故装置D中应加入NaOH溶液,选②;
(5)氧气不易溶于水,F中得到的气体是氧气O2
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
