2.2化学平衡 同步练习 (含解析) 2023-2024学年高二上学期人教版(2019)化学选择性必修1
文档属性
| 名称 | 2.2化学平衡 同步练习 (含解析) 2023-2024学年高二上学期人教版(2019)化学选择性必修1 |

|
|
| 格式 | docx | ||
| 文件大小 | 545.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-08 00:00:00 | ||
图片预览



文档简介
2.2化学平衡同步练习题
一、选择题
1.下列有关能量的判断和表示方法正确的是
A.已知ΔH=a ΔH=b,则aB.已知:ΔH= 92.4kJ mo 1,则在一定条件下向密闭容器中充入0.5molN2(g)和1.5molH2(g)充分反应放出46.2kJ的热量
C.已知: ΔH= 57.3kJ mol 1,则H2SO4和Ba(OH)2反应的反应热ΔH=2×( 57.3)kJ mol 1
D.已知P4(白磷,s)=4P(红磷,s) ΔH<0,则白磷比红磷稳定
2.已知:,向一恒温恒容的密闭容器中充入和发生反应,时达到平衡状态Ⅰ,在时改变某一条件,时重新达到平衡状态Ⅱ,正反应速率随时间的变化如图所示。下列说是正确的是
A.容器内压强不变,表明反应达到平衡
B.时改变的条件:向容器中加入C
C.平衡时A的体积分数:
D.平衡常数:
3.如图表示合成氨反应过程中的能量变化。关于合成氨反应,下列说法不正确的是
A.升高温度有利于提高的平衡转化率
B.提高与的投料比可增大的转化率
C.增大压强能提高的反应速率和转化率
D.使用催化剂能缩短该反应到达平衡的时间
4.一定条件下,二氧化氮和四氧化二氮之间存在下列平衡: ,在测定二氧化氮的相对分子质量时,下列条件中,测定结果与真实值最接近的是
A.温度130℃、压强 B.温度25℃、压强
C.温度130℃、压强 D.温度0℃、压强
5.在接触法制硫酸的工业生产中,下列生产操作及其原因解释二者都正确的是
A.硫铁矿燃烧前需要粉碎,因为块状硫铁矿不能燃烧
B.SO2氧化为SO3时需要高压,这样可以提高SO2的转化率
C.SO2氧化为SO3时需要使用催化剂,这样可以提高SO2的转化率
D.用98.3%的浓H2SO4吸收SO3,可以防止形成酸雾阻碍SO3的吸收
6.可逆反应的正、逆反应速率可用各反应物或生成物浓度的变化来表示,下列各关系中能说明反应已达到最大限度(即化学平衡)的是
A.N2将完全转化为NH3 B.N2、H2和NH3的物质的量浓度相等
C.N2、H2和NH3的物质的量浓度不再变化 D.正反应和逆反应的速率都为零
7.二氧化硫的催化氧化反应:是工业制硫酸中的重要反应。某温度下,在一密闭容器中探究二氧化硫的催化氧化反应,下列叙述正确的是
A.加入合适催化剂可以提高的平衡产率
B.缩小容器容积可以增大活化分子百分含量
C.扩大容器容积可以提高的平衡产率
D.缩小容器容积可以增大反应速率
8.2SO2+O22SO3△H<0是工业上接触法制硫酸的重要反应。下列关于该反应的说法不正确的是
A.增加O2的浓度提高SO2的转化率
B.利用该反应放出的热量对SO2、O2预热
C.升高体系温度能提高SO3的平衡产率
D.即使增大压强也不能使SO2全部转化为SO3
二、非选择题
9.温度对化学平衡移动的影响规律
(1)温度对化学平衡的影响是通过改变平衡常数实现的,升高温度,吸热反应的平衡常数___________,平衡向___________的方向移动。降低温度,放热反应的平衡常数___________,平衡向___________的方向移动。
(2)温度对化学平衡的影响是通过改变平衡常数实现的,升高温度,放热反应的平衡常数___________,平衡向___________的方向移动。降低温度,吸热反应的平衡常数___________,平衡向___________的方向移动。
10.合成氨工业对国民经济和社会发展具有重要的意义。其原理为:
据此回答以下问题:
(1)当有0.5molN2反应完,放出的热量是___________kJ
(2)此反应能自发进行的条件是___________
(3)某温度下,若把与置于体积为的密闭容器内,反应2min达到平衡状态时,测得混合气体中氨的体积分数为,则用N2表示该反应的平均反应速率为___________,能说明该反应达到化学平衡状态的是___________ (填字母)。
容器内的密度保持不变 容器内压强保持不变
υ正υ逆(NH3) d.混合气体中不变
(4)对于合成氨反应而言,下列有关图象一定正确的是(选填序号)___________。
a. b. c.
(5)相同温度下,有恒容密闭容器和恒压密闭容器,两容器中均充入和,此时两容器的体积相等。在一定条件下反应达到平衡状态,中的体积分数为,放出热量中的体积分数为,放出热量。则:a_______b填“”、“”或“”,下同Q1______Q2
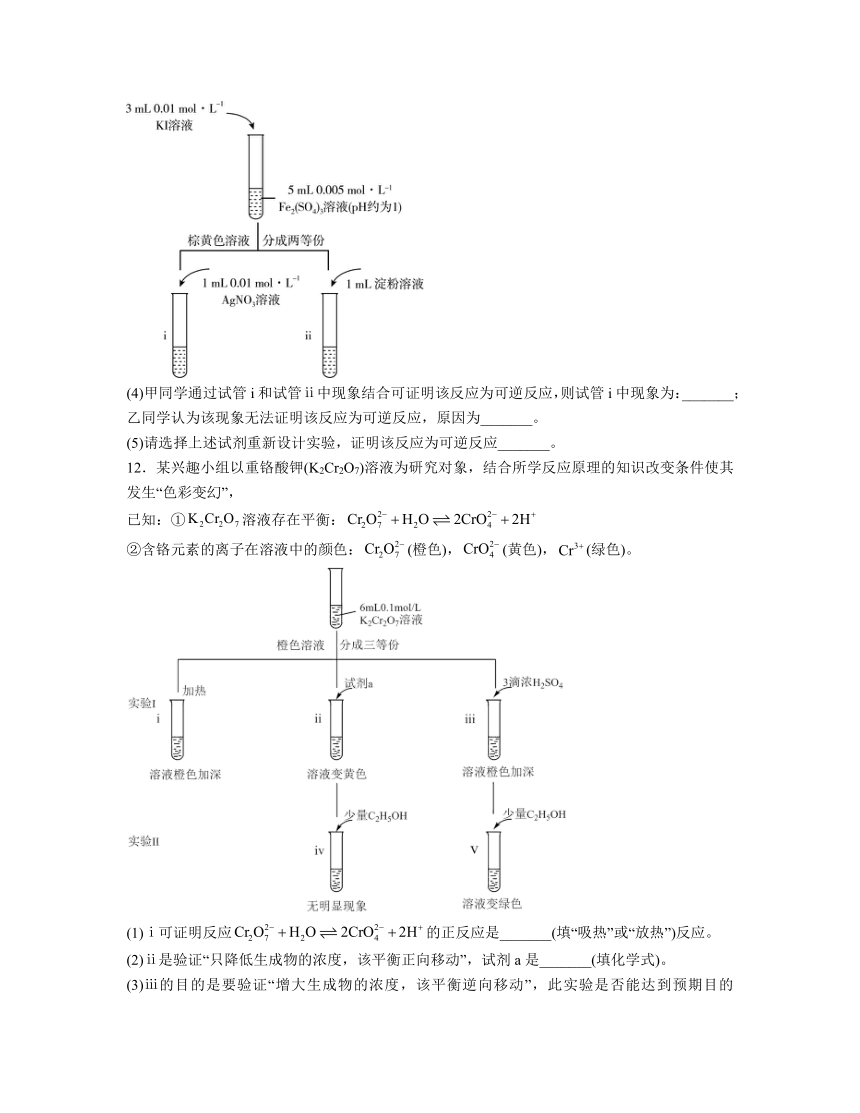
11.碘化钾是常用的化工原料。某实验小组设计实验探究的还原性。
I.探究不同条件下空气中氧气氧化的速率。
组别 温度 溶液 溶液 蒸馏水 淀粉溶液
V V
1 3滴
2 3滴
3 3滴
(1)酸性条件下能被空气中氧气氧化,发生反应的离子方程式为_______。
(2)通过实验组别1和组别2探究温度对氧化速率的影响。其中_______,_______。
(3)设计实验组别3的目的是_______。
Ⅱ.探究反应“”为可逆反应。
试剂:溶液,溶液,淀粉溶液,溶液,溶液。实验如下:
(4)甲同学通过试管i和试管ⅱ中现象结合可证明该反应为可逆反应,则试管i中现象为:_______;乙同学认为该现象无法证明该反应为可逆反应,原因为_______。
(5)请选择上述试剂重新设计实验,证明该反应为可逆反应_______。
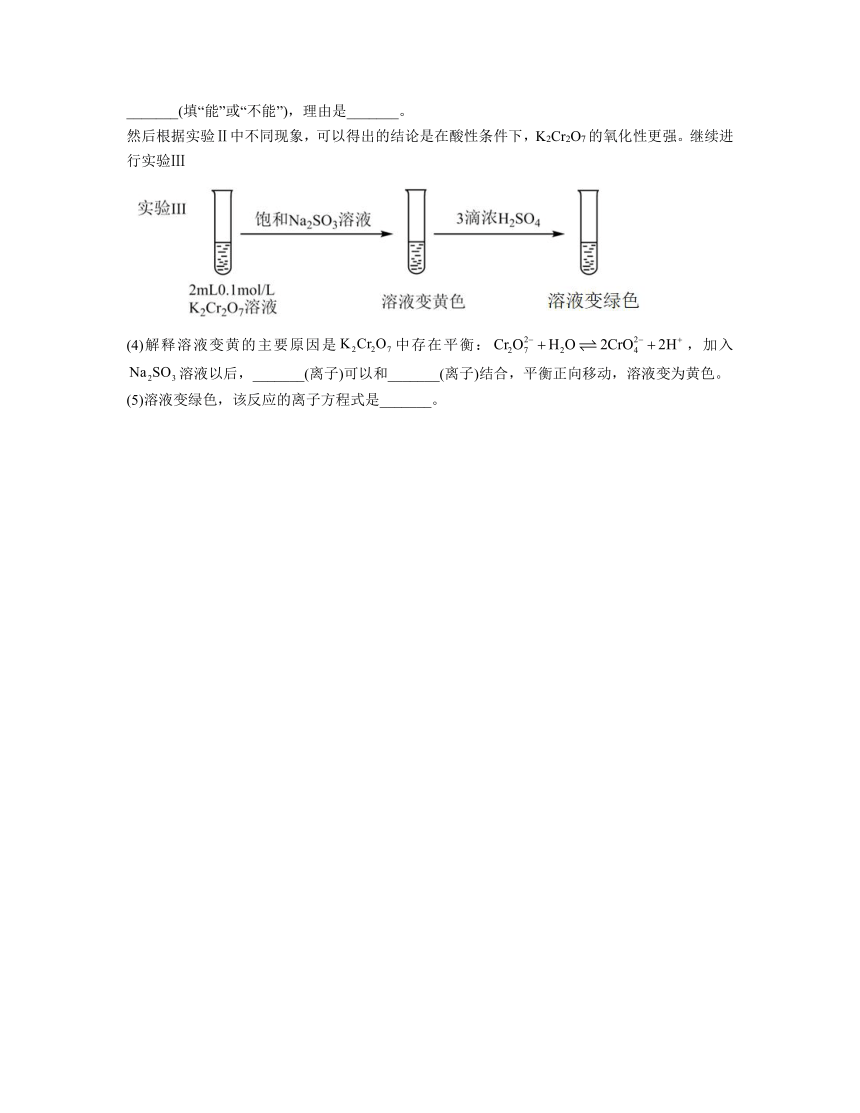
12.某兴趣小组以重铬酸钾(K2Cr2O7)溶液为研究对象,结合所学反应原理的知识改变条件使其发生“色彩变幻”,
已知:①溶液存在平衡:
②含铬元素的离子在溶液中的颜色:(橙色),(黄色),(绿色)。
(1)ⅰ可证明反应的正反应是_______(填“吸热”或“放热”)反应。
(2)ⅱ是验证“只降低生成物的浓度,该平衡正向移动”,试剂a是_______(填化学式)。
(3)ⅲ的目的是要验证“增大生成物的浓度,该平衡逆向移动”,此实验是否能达到预期目的_______(填“能”或“不能”),理由是_______。
然后根据实验Ⅱ中不同现象,可以得出的结论是在酸性条件下,K2Cr2O7的氧化性更强。继续进行实验Ⅲ
(4)解释溶液变黄的主要原因是中存在平衡:,加入溶液以后,_______(离子)可以和_______(离子)结合,平衡正向移动,溶液变为黄色。
(5)溶液变绿色,该反应的离子方程式是_______。
【参考答案】
一、选择题
1.A
解析:A.所有的燃烧反应均是放热反应,完全燃烧比不完全燃烧放出热量多,而所以aB.此反应是可逆反应,充入0.5molN2(g)和1.5molH2(g)时两者不能完全反应放出热量小于46.2kJ,B错误;
C.中和热是指稀的强酸和稀的强碱反应生成1摩尔液态水时的反应热,硫酸与氢氧化钡反应生成的是硫酸钡沉淀和水,所以利用现有条件不能求出反应热,C错误;
D.白磷转化成红磷是放热的,所以红磷的能力低于白磷,能量越低越稳定,所以红磷比白磷稳定,D错误;
故选A。
2.B
解析:A.反应前后气体分子数不变,故容器内压强始终不变,无法判断反应是否达到平衡状态,故A错误;
B.由图可知,t2时,正反应速率不变,逆反应速率增大,改变的条件为向容器中加入C,故B正确;
C.t2时改变的条件为向容器中加入C,相当于对原平衡加压,加压,平衡不移动,A的体积分数不变,A的体积分数φ:φ(Ⅱ)=φ(Ⅰ),故C错误;
D.t2时改变的条件为向容器中加入C,温度不变,K值不变,故D错误;
故答案选B。
【点睛】本题考查化学平衡,掌握外界条件改变对化学平衡的影响是解题的关键。
3.A
解析:A.由图可知,反应放热,升高温度,平衡逆向移动,N2的平衡转化率降低,故A错误;
B.提高N2与H2的投料比,平衡正向移动,氢气转化率增大,氮气转化率变小,故B正确;
C.增大压强,化学反应速率加快,反应正向气体分子数减小,加压,平衡正向移动,故C正确;
D.使用催化剂能降低反应所需的活化能,加快化学反应速率,缩短该反应到达平衡的时间,故D正确;
故答案选A。
【点睛】本题考查化学平衡,掌握外界条件改变对平衡的影响是解题的关键。
4.C
解析:由于NO2体系中存在平衡,N2O4的存在会影响NO2的相对分子质量测定,故应采取措施使平衡向左移动,减小N2O4的含量,该反应正反应是体积减小的放热反应,减小压强平衡向逆反应移动,升高温度平衡向逆反应移动,故应采取高温低压,故题给条件最优为C项。
5.D
解析:A.硫铁矿燃烧前需要粉碎,是为了增大接触面,加快反应速率,A错误;
B.,高压下,平衡正向移动,可以提高的转化率,但是高压对设备要求较高,提高生产成本,B错误;
C.催化剂可以加快反应速率,但不能使平衡移动,不能提高的转化率,C错误;
D.用98.3%的浓吸收形成发烟硫酸,可以防止酸雾的生成阻碍的吸收,D正确;
故选D。
6.C
解析:A.是可逆反应,反应物不能全部转化为生成物,故A错误;
B.N2、H2和NH3的物质的量浓度相等时,该反应不一定达到平衡状态,与反应物初始物质的量、转化率有关,所以不能据此判断平衡状态,故B错误;
C.N2、H2和NH3的物质的量浓度不再变化时,正逆反应速率相等,能说明达到平衡状态,故C正确;
D.化学平衡状态是动态平衡,当反应达到平衡状态时,正反应和逆反应的速率相等,但是速率不为零,故D错误。
7.D
解析:A.催化剂只加快反应速率,不影响平衡产率,A错误;
B.缩小容器容积增大单位体积内活化分子的数目,不能改变活化分子百分含量,B错误;
C.扩大容器容积会使平衡逆向移动,降低的平衡产率,C错误;
D.缩小容器容积可增大反应物的浓度,可以加快反应速率,D正确;
故选D。
8.C
解析:A.增加O2的浓度,平衡正向移动,SO2的转化率增大,A正确;
B.该反应放热,利用放出的热量对SO2、O2预热,可增大反应速率,B正确;
C.正反应放热,升高温度平衡逆向移动,二氧化硫平衡产率下降,C错误;
D.该反应为可逆反应,反应物不可能完全转化,D正确;
故选C。
二、非选择题
9.(1) 增大 吸热 增大 放热
(2) 减小 吸热 减小 放热
解析:略
10.(1)46.2
(2)低温
(3) mol·L-1·min-1 或0.17 mol·L-1·min-1 bd
(4)ac
(5)
解析:(1)根据 知,1mol氮气完全反应完,放出92.4kJ的热量,当有0.5molN2反应完,放出的热量是46.2kJ;故答案为:46.2。
(2)该反应是体积减小的放热反应即ΔH<0,ΔS<0,根据ΔG=ΔH-TΔS<0,此反应能自发进行的条件是低温;故答案为:低温。
(3)某温度下,若把与置于体积为的密闭容器内,反应2min达到平衡状态时,测得混合气体中氨的体积分数为,建立三段式,,解得,则用N2表示该反应的平均反应速率为;混合气体密度等于气体质量除以容器体积,气体质量不变,容器体积不变,密度始终不变,因此容器内的密度保持不变,不能作为判断平衡标志,故a不符合题意;该反应是体积减小的反应,压强在不断减小,当容器内压强保持不变,则达到平衡,故b符合题意;υ正υ逆(NH3),一个正向速率,一个逆反应速率,两个不同方向,不满足速率比等于计量数之比,故c不符合题意;d.正向反应,氨气浓度不断减小,当混合气体中不变,可以作为判断平衡不标志,故d符合题意;故答案为: mol·L-1·min-1 或0.17 mol·L-1·min-1;bd。
(4)a.根据“先拐先平衡数值大”即T2>T1,该反应是放热反应,从T2到T1,温度降低,平衡正向移动,氨气体积分数增大,故a正确;b.加入时氮气和氢气浓度为1:3,氮气、氢气浓度降低且降低的浓度之比也是1:3,氨气浓度增大,但达到平衡时,氮气和氢气浓度之比也等于1:3,因此b错误;c.加入催化剂,反应速率加快,平衡不移动,达到平衡所需时间减少,故c正确;综上所述,答案为:ac。
(5)相同温度下,有恒容密闭容器和恒压密闭容器,两容器中均充入和,此时两容器的体积相等。该反应是体积减小的反应,在一定条件下反应达到平衡状态,中的体积分数为a,放出热量B容器相对A容器来说,体积减小,对A来说,B相当于加压,平衡正向移动,氨气体积分数增大,放出的热量增多;则:ab;Q1Q2;故答案为:;。
11.(1)
(2) 5 0.1
(3)探究硫酸的浓度对氧化速率的影响
(4) 产生黄色沉淀 含的溶液中加入也能产生黄色沉淀
(5)向5mL(过量)溶液中加入3mL(少量)溶液,再向其中加入KSCN溶液,溶液变红,说明含有过量的溶液中存在,即可证明该反应为可逆反应
解析:(1)酸性条件下KI能被空气中氧气氧化,发生反应的离子方程式为;
(2)根据控制单一变量的原则可知a=5,b=0.1;
(3)实验3的反应温度是298K,温度相同,混合溶液总体积相同,KI溶液浓度相同,但H2SO4溶液浓度不相同,因此设计实验组别3的目的是为了与组别1对比,从而探究硫酸的浓度对氧化速率的影响;
(4)由题意可知实验i中现象为产生黄色沉淀;乙同学认为该现象无法证明该反应为可逆反应,原因为含的溶液中加入也能产生黄色沉淀;
(5)向5mL溶液中加入3mL(少量)溶液,再向其中加入KSCN溶液,溶液变红,说明含有过量的溶液中存在,即可证明该反应为可逆反应[或向溶液中加入5mL(过量)溶液,再向其中加入KSCN溶液,溶液变红,说明含有过量的溶液中存在,即可证明该反应为可逆反应]。
12.(1)放热
(2)KOH溶液
(3) 不能 浓硫酸溶于水放出大量的热,平衡会逆向移动,所以溶液橙色加深,不能说明是由于氢离子浓度的增大平衡逆向移动的
(4) SO H+
(5)Cr2O+3SO+8H+=2Cr3++3SO+4H2O
解析:(1)加热橙色加深,说明c(Cr2O)增大,平衡逆向移动,逆反应为吸热反应,正向为放热反应;
(2)试剂是KOH溶液,该试剂能与氢离子反应,降低生成物浓度,平衡正向移动,CrO浓度增大,现象是溶液变黄;
(3)加入浓硫酸,不但增加氢离子浓度平衡逆向移动的情况,同时考虑浓硫酸溶于水放出大量的热的情况,浓硫酸溶于水放出大量的热,平衡也会逆向移动;
(4)K2Cr2O7溶液存在平衡:Cr2O(橙色)+H2O 2CrO(黄色)+2H+,SO结合溶液中的氢离子,c(H+)减小,平衡正向移动,溶液变为黄色;
(5)K2Cr2O7与亚硫酸钠发生氧化还原反应,生成Cr3+和SO,由电子守恒可得该反应的离子方程式是Cr2O+3SO+8H+=2Cr3++3SO+4H2O
一、选择题
1.下列有关能量的判断和表示方法正确的是
A.已知ΔH=a ΔH=b,则a
C.已知: ΔH= 57.3kJ mol 1,则H2SO4和Ba(OH)2反应的反应热ΔH=2×( 57.3)kJ mol 1
D.已知P4(白磷,s)=4P(红磷,s) ΔH<0,则白磷比红磷稳定
2.已知:,向一恒温恒容的密闭容器中充入和发生反应,时达到平衡状态Ⅰ,在时改变某一条件,时重新达到平衡状态Ⅱ,正反应速率随时间的变化如图所示。下列说是正确的是
A.容器内压强不变,表明反应达到平衡
B.时改变的条件:向容器中加入C
C.平衡时A的体积分数:
D.平衡常数:
3.如图表示合成氨反应过程中的能量变化。关于合成氨反应,下列说法不正确的是
A.升高温度有利于提高的平衡转化率
B.提高与的投料比可增大的转化率
C.增大压强能提高的反应速率和转化率
D.使用催化剂能缩短该反应到达平衡的时间
4.一定条件下,二氧化氮和四氧化二氮之间存在下列平衡: ,在测定二氧化氮的相对分子质量时,下列条件中,测定结果与真实值最接近的是
A.温度130℃、压强 B.温度25℃、压强
C.温度130℃、压强 D.温度0℃、压强
5.在接触法制硫酸的工业生产中,下列生产操作及其原因解释二者都正确的是
A.硫铁矿燃烧前需要粉碎,因为块状硫铁矿不能燃烧
B.SO2氧化为SO3时需要高压,这样可以提高SO2的转化率
C.SO2氧化为SO3时需要使用催化剂,这样可以提高SO2的转化率
D.用98.3%的浓H2SO4吸收SO3,可以防止形成酸雾阻碍SO3的吸收
6.可逆反应的正、逆反应速率可用各反应物或生成物浓度的变化来表示,下列各关系中能说明反应已达到最大限度(即化学平衡)的是
A.N2将完全转化为NH3 B.N2、H2和NH3的物质的量浓度相等
C.N2、H2和NH3的物质的量浓度不再变化 D.正反应和逆反应的速率都为零
7.二氧化硫的催化氧化反应:是工业制硫酸中的重要反应。某温度下,在一密闭容器中探究二氧化硫的催化氧化反应,下列叙述正确的是
A.加入合适催化剂可以提高的平衡产率
B.缩小容器容积可以增大活化分子百分含量
C.扩大容器容积可以提高的平衡产率
D.缩小容器容积可以增大反应速率
8.2SO2+O22SO3△H<0是工业上接触法制硫酸的重要反应。下列关于该反应的说法不正确的是
A.增加O2的浓度提高SO2的转化率
B.利用该反应放出的热量对SO2、O2预热
C.升高体系温度能提高SO3的平衡产率
D.即使增大压强也不能使SO2全部转化为SO3
二、非选择题
9.温度对化学平衡移动的影响规律
(1)温度对化学平衡的影响是通过改变平衡常数实现的,升高温度,吸热反应的平衡常数___________,平衡向___________的方向移动。降低温度,放热反应的平衡常数___________,平衡向___________的方向移动。
(2)温度对化学平衡的影响是通过改变平衡常数实现的,升高温度,放热反应的平衡常数___________,平衡向___________的方向移动。降低温度,吸热反应的平衡常数___________,平衡向___________的方向移动。
10.合成氨工业对国民经济和社会发展具有重要的意义。其原理为:
据此回答以下问题:
(1)当有0.5molN2反应完,放出的热量是___________kJ
(2)此反应能自发进行的条件是___________
(3)某温度下,若把与置于体积为的密闭容器内,反应2min达到平衡状态时,测得混合气体中氨的体积分数为,则用N2表示该反应的平均反应速率为___________,能说明该反应达到化学平衡状态的是___________ (填字母)。
容器内的密度保持不变 容器内压强保持不变
υ正υ逆(NH3) d.混合气体中不变
(4)对于合成氨反应而言,下列有关图象一定正确的是(选填序号)___________。
a. b. c.
(5)相同温度下,有恒容密闭容器和恒压密闭容器,两容器中均充入和,此时两容器的体积相等。在一定条件下反应达到平衡状态,中的体积分数为,放出热量中的体积分数为,放出热量。则:a_______b填“”、“”或“”,下同Q1______Q2
11.碘化钾是常用的化工原料。某实验小组设计实验探究的还原性。
I.探究不同条件下空气中氧气氧化的速率。
组别 温度 溶液 溶液 蒸馏水 淀粉溶液
V V
1 3滴
2 3滴
3 3滴
(1)酸性条件下能被空气中氧气氧化,发生反应的离子方程式为_______。
(2)通过实验组别1和组别2探究温度对氧化速率的影响。其中_______,_______。
(3)设计实验组别3的目的是_______。
Ⅱ.探究反应“”为可逆反应。
试剂:溶液,溶液,淀粉溶液,溶液,溶液。实验如下:
(4)甲同学通过试管i和试管ⅱ中现象结合可证明该反应为可逆反应,则试管i中现象为:_______;乙同学认为该现象无法证明该反应为可逆反应,原因为_______。
(5)请选择上述试剂重新设计实验,证明该反应为可逆反应_______。
12.某兴趣小组以重铬酸钾(K2Cr2O7)溶液为研究对象,结合所学反应原理的知识改变条件使其发生“色彩变幻”,
已知:①溶液存在平衡:
②含铬元素的离子在溶液中的颜色:(橙色),(黄色),(绿色)。
(1)ⅰ可证明反应的正反应是_______(填“吸热”或“放热”)反应。
(2)ⅱ是验证“只降低生成物的浓度,该平衡正向移动”,试剂a是_______(填化学式)。
(3)ⅲ的目的是要验证“增大生成物的浓度,该平衡逆向移动”,此实验是否能达到预期目的_______(填“能”或“不能”),理由是_______。
然后根据实验Ⅱ中不同现象,可以得出的结论是在酸性条件下,K2Cr2O7的氧化性更强。继续进行实验Ⅲ
(4)解释溶液变黄的主要原因是中存在平衡:,加入溶液以后,_______(离子)可以和_______(离子)结合,平衡正向移动,溶液变为黄色。
(5)溶液变绿色,该反应的离子方程式是_______。
【参考答案】
一、选择题
1.A
解析:A.所有的燃烧反应均是放热反应,完全燃烧比不完全燃烧放出热量多,而所以a
C.中和热是指稀的强酸和稀的强碱反应生成1摩尔液态水时的反应热,硫酸与氢氧化钡反应生成的是硫酸钡沉淀和水,所以利用现有条件不能求出反应热,C错误;
D.白磷转化成红磷是放热的,所以红磷的能力低于白磷,能量越低越稳定,所以红磷比白磷稳定,D错误;
故选A。
2.B
解析:A.反应前后气体分子数不变,故容器内压强始终不变,无法判断反应是否达到平衡状态,故A错误;
B.由图可知,t2时,正反应速率不变,逆反应速率增大,改变的条件为向容器中加入C,故B正确;
C.t2时改变的条件为向容器中加入C,相当于对原平衡加压,加压,平衡不移动,A的体积分数不变,A的体积分数φ:φ(Ⅱ)=φ(Ⅰ),故C错误;
D.t2时改变的条件为向容器中加入C,温度不变,K值不变,故D错误;
故答案选B。
【点睛】本题考查化学平衡,掌握外界条件改变对化学平衡的影响是解题的关键。
3.A
解析:A.由图可知,反应放热,升高温度,平衡逆向移动,N2的平衡转化率降低,故A错误;
B.提高N2与H2的投料比,平衡正向移动,氢气转化率增大,氮气转化率变小,故B正确;
C.增大压强,化学反应速率加快,反应正向气体分子数减小,加压,平衡正向移动,故C正确;
D.使用催化剂能降低反应所需的活化能,加快化学反应速率,缩短该反应到达平衡的时间,故D正确;
故答案选A。
【点睛】本题考查化学平衡,掌握外界条件改变对平衡的影响是解题的关键。
4.C
解析:由于NO2体系中存在平衡,N2O4的存在会影响NO2的相对分子质量测定,故应采取措施使平衡向左移动,减小N2O4的含量,该反应正反应是体积减小的放热反应,减小压强平衡向逆反应移动,升高温度平衡向逆反应移动,故应采取高温低压,故题给条件最优为C项。
5.D
解析:A.硫铁矿燃烧前需要粉碎,是为了增大接触面,加快反应速率,A错误;
B.,高压下,平衡正向移动,可以提高的转化率,但是高压对设备要求较高,提高生产成本,B错误;
C.催化剂可以加快反应速率,但不能使平衡移动,不能提高的转化率,C错误;
D.用98.3%的浓吸收形成发烟硫酸,可以防止酸雾的生成阻碍的吸收,D正确;
故选D。
6.C
解析:A.是可逆反应,反应物不能全部转化为生成物,故A错误;
B.N2、H2和NH3的物质的量浓度相等时,该反应不一定达到平衡状态,与反应物初始物质的量、转化率有关,所以不能据此判断平衡状态,故B错误;
C.N2、H2和NH3的物质的量浓度不再变化时,正逆反应速率相等,能说明达到平衡状态,故C正确;
D.化学平衡状态是动态平衡,当反应达到平衡状态时,正反应和逆反应的速率相等,但是速率不为零,故D错误。
7.D
解析:A.催化剂只加快反应速率,不影响平衡产率,A错误;
B.缩小容器容积增大单位体积内活化分子的数目,不能改变活化分子百分含量,B错误;
C.扩大容器容积会使平衡逆向移动,降低的平衡产率,C错误;
D.缩小容器容积可增大反应物的浓度,可以加快反应速率,D正确;
故选D。
8.C
解析:A.增加O2的浓度,平衡正向移动,SO2的转化率增大,A正确;
B.该反应放热,利用放出的热量对SO2、O2预热,可增大反应速率,B正确;
C.正反应放热,升高温度平衡逆向移动,二氧化硫平衡产率下降,C错误;
D.该反应为可逆反应,反应物不可能完全转化,D正确;
故选C。
二、非选择题
9.(1) 增大 吸热 增大 放热
(2) 减小 吸热 减小 放热
解析:略
10.(1)46.2
(2)低温
(3) mol·L-1·min-1 或0.17 mol·L-1·min-1 bd
(4)ac
(5)
解析:(1)根据 知,1mol氮气完全反应完,放出92.4kJ的热量,当有0.5molN2反应完,放出的热量是46.2kJ;故答案为:46.2。
(2)该反应是体积减小的放热反应即ΔH<0,ΔS<0,根据ΔG=ΔH-TΔS<0,此反应能自发进行的条件是低温;故答案为:低温。
(3)某温度下,若把与置于体积为的密闭容器内,反应2min达到平衡状态时,测得混合气体中氨的体积分数为,建立三段式,,解得,则用N2表示该反应的平均反应速率为;混合气体密度等于气体质量除以容器体积,气体质量不变,容器体积不变,密度始终不变,因此容器内的密度保持不变,不能作为判断平衡标志,故a不符合题意;该反应是体积减小的反应,压强在不断减小,当容器内压强保持不变,则达到平衡,故b符合题意;υ正υ逆(NH3),一个正向速率,一个逆反应速率,两个不同方向,不满足速率比等于计量数之比,故c不符合题意;d.正向反应,氨气浓度不断减小,当混合气体中不变,可以作为判断平衡不标志,故d符合题意;故答案为: mol·L-1·min-1 或0.17 mol·L-1·min-1;bd。
(4)a.根据“先拐先平衡数值大”即T2>T1,该反应是放热反应,从T2到T1,温度降低,平衡正向移动,氨气体积分数增大,故a正确;b.加入时氮气和氢气浓度为1:3,氮气、氢气浓度降低且降低的浓度之比也是1:3,氨气浓度增大,但达到平衡时,氮气和氢气浓度之比也等于1:3,因此b错误;c.加入催化剂,反应速率加快,平衡不移动,达到平衡所需时间减少,故c正确;综上所述,答案为:ac。
(5)相同温度下,有恒容密闭容器和恒压密闭容器,两容器中均充入和,此时两容器的体积相等。该反应是体积减小的反应,在一定条件下反应达到平衡状态,中的体积分数为a,放出热量B容器相对A容器来说,体积减小,对A来说,B相当于加压,平衡正向移动,氨气体积分数增大,放出的热量增多;则:ab;Q1Q2;故答案为:;。
11.(1)
(2) 5 0.1
(3)探究硫酸的浓度对氧化速率的影响
(4) 产生黄色沉淀 含的溶液中加入也能产生黄色沉淀
(5)向5mL(过量)溶液中加入3mL(少量)溶液,再向其中加入KSCN溶液,溶液变红,说明含有过量的溶液中存在,即可证明该反应为可逆反应
解析:(1)酸性条件下KI能被空气中氧气氧化,发生反应的离子方程式为;
(2)根据控制单一变量的原则可知a=5,b=0.1;
(3)实验3的反应温度是298K,温度相同,混合溶液总体积相同,KI溶液浓度相同,但H2SO4溶液浓度不相同,因此设计实验组别3的目的是为了与组别1对比,从而探究硫酸的浓度对氧化速率的影响;
(4)由题意可知实验i中现象为产生黄色沉淀;乙同学认为该现象无法证明该反应为可逆反应,原因为含的溶液中加入也能产生黄色沉淀;
(5)向5mL溶液中加入3mL(少量)溶液,再向其中加入KSCN溶液,溶液变红,说明含有过量的溶液中存在,即可证明该反应为可逆反应[或向溶液中加入5mL(过量)溶液,再向其中加入KSCN溶液,溶液变红,说明含有过量的溶液中存在,即可证明该反应为可逆反应]。
12.(1)放热
(2)KOH溶液
(3) 不能 浓硫酸溶于水放出大量的热,平衡会逆向移动,所以溶液橙色加深,不能说明是由于氢离子浓度的增大平衡逆向移动的
(4) SO H+
(5)Cr2O+3SO+8H+=2Cr3++3SO+4H2O
解析:(1)加热橙色加深,说明c(Cr2O)增大,平衡逆向移动,逆反应为吸热反应,正向为放热反应;
(2)试剂是KOH溶液,该试剂能与氢离子反应,降低生成物浓度,平衡正向移动,CrO浓度增大,现象是溶液变黄;
(3)加入浓硫酸,不但增加氢离子浓度平衡逆向移动的情况,同时考虑浓硫酸溶于水放出大量的热的情况,浓硫酸溶于水放出大量的热,平衡也会逆向移动;
(4)K2Cr2O7溶液存在平衡:Cr2O(橙色)+H2O 2CrO(黄色)+2H+,SO结合溶液中的氢离子,c(H+)减小,平衡正向移动,溶液变为黄色;
(5)K2Cr2O7与亚硫酸钠发生氧化还原反应,生成Cr3+和SO,由电子守恒可得该反应的离子方程式是Cr2O+3SO+8H+=2Cr3++3SO+4H2O
