1.3.2 气体摩尔体积课件(共40张PPT)2023-2024学年高一化学鲁科版必修第一册
文档属性
| 名称 | 1.3.2 气体摩尔体积课件(共40张PPT)2023-2024学年高一化学鲁科版必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 4.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-08 15:50:48 | ||
图片预览








文档简介
(共40张PPT)
第1章 认识化学科学
第3节 第2课时 气体摩尔体积
素 养 目 标
1.通过对1 mol气体的体积的交流研讨,提出气体摩尔体积这个概念,理解气体摩尔体积的定义及影响因素,养成宏观辨识与微观探析的化学核心素养。
2.了解物质的量与微观粒子数之间的关系,能够运用物质的量、摩尔质量、气体摩尔体积的相互关系进行简单计算,形成证据推理与模型认知的化学核心素养。
3.通过对相同状况下不同气体的体积的研究,理解阿伏加德罗定律及其推论,并能够解决实际问题,养成证据推理与模型认知的化学核心素养。
基础落实·必备知识全过关
重难探究·能力素养全提升
目 录 索 引
学以致用·随堂检测全达标
基础落实·必备知识全过关
自主梳理
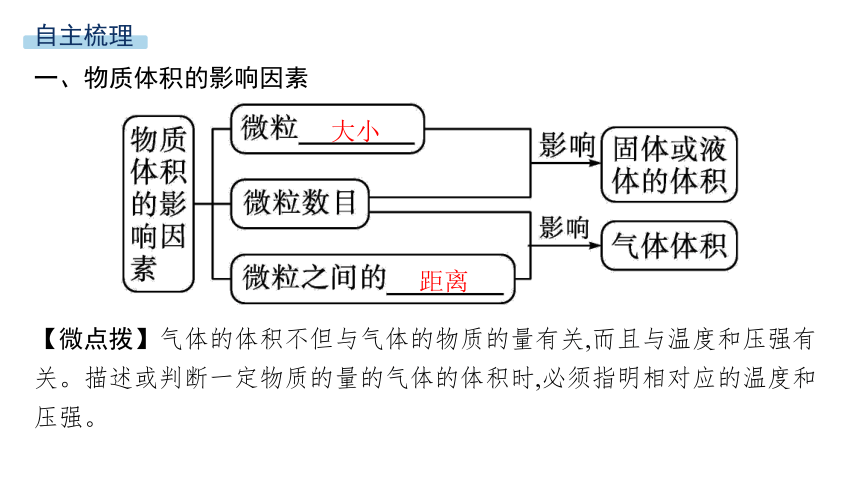
一、物质体积的影响因素
【微点拨】气体的体积不但与气体的物质的量有关,而且与温度和压强有关。描述或判断一定物质的量的气体的体积时,必须指明相对应的温度和压强。
大小
距离
二、气体摩尔体积
1.定义
在一定的温度和压强下, 的气体所占的体积叫作气体摩尔体积。符号为Vm。
2.单位
或 。
3.标准状况下的气体摩尔体积
在标准状况(0 ℃、101 kPa)下任何气体的气体摩尔体积约为 。
4.气体体积、气体摩尔体积、物质的量三者之间的关系
Vm= 。
单位物质的量
L·mol-1
m3·mol-1
22.4 L·mol-1
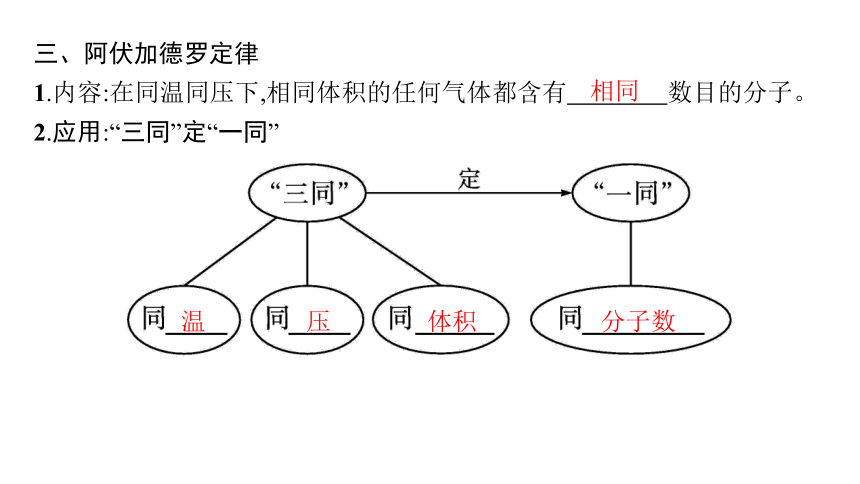
三、阿伏加德罗定律
1.内容:在同温同压下,相同体积的任何气体都含有 数目的分子。
2.应用:“三同”定“一同”
相同
温
压
体积
分子数
自我检测
判断下列说法是否正确,正确的画“√”,错误的画“×”。
1.在标准状况下,1 mol O2与1 mol H2O的体积相同。( )
2.在标准状况下,1 mol气体的体积约是22.4 L,在非标准状况下,1 mol气体的体积则一定不是22.4 L。( )
3.同温同压下,等体积的两种气体单质一定具有相同的原子数。( )
4.标准状况下,氢气的气体摩尔体积为22.4 L。( )
5.同温同体积条件下,等质量的SO2和O2两种气体对应的压强之比为1∶2。
( )
6.在相同条件下(均为气态),相同物质的量的CO、N2的混合气体与O2的分子个数相同,原子个数也相同。( )
×
×
×
×
√
√
重难探究·能力素养全提升
问题探究
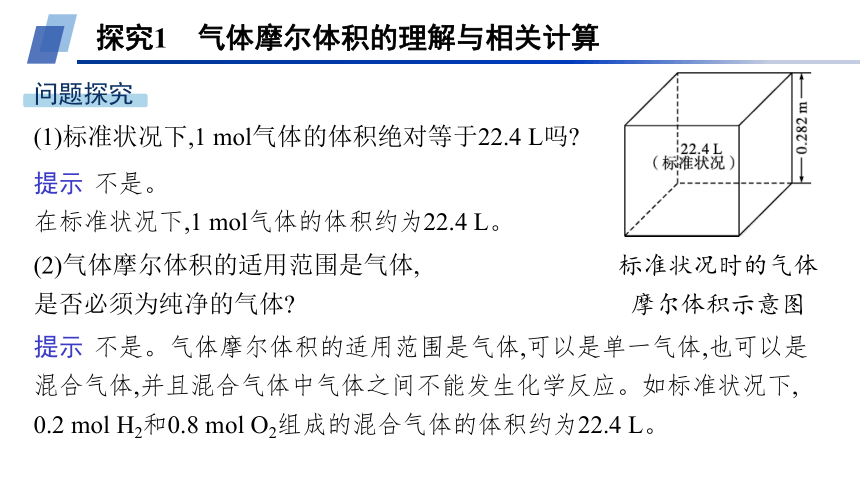
探究1 气体摩尔体积的理解与相关计算
(1)标准状况下,1 mol气体的体积绝对等于22.4 L吗
(2)气体摩尔体积的适用范围是气体,
是否必须为纯净的气体
标准状况时的气体
摩尔体积示意图
提示 不是。
在标准状况下,1 mol气体的体积约为22.4 L。
提示 不是。气体摩尔体积的适用范围是气体,可以是单一气体,也可以是混合气体,并且混合气体中气体之间不能发生化学反应。如标准状况下, 0.2 mol H2和0.8 mol O2组成的混合气体的体积约为22.4 L。
【微探究1】当1 mol气体的体积为22.4 L时,能否说明该气体一定处于标准状况
提示 不能。标准状况下,1 mol气体的体积约为22.4 L,但1 mol气体的体积为22.4 L时,并不一定说明该气体处于标准状况下,比如适当的升高温度(气体膨胀)、增大压强(压缩气体),也能使1 mol气体的体积变为22.4 L。
归纳拓展
标准状况下,气体摩尔体积的相关计算
应用体验
1.下列说法正确的是( )
①标准状况下,6.02×1023个分子所占的体积约是22.4 L ②0.5 mol H2所占体积为11.2 L ③标准状况下,1 mol H2O的体积为22.4 L ④标准状况下,28 g CO与N2的混合气体的体积约为22.4 L ⑤各种气体的气体摩尔体积都约为22.4 L·mol-1 ⑥标准状况下,体积相同的气体所含的分子数相同
A.①③⑤ B.④⑥
C.②④⑥ D.①④⑥
B
解析 ①物质在标准状况下不一定是气体;②没有限定处于标准状况下,0.5 mol H2所占体积不一定为11.2 L;③标准状况下, H2O不是气体;⑤各种气体的摩尔体积在标准状况下都约为22.4 L·mol-1。
易错警示 计算中使用“22.4 L·mol-1”的三注意
(1)使用“条件”:标准状况。
(2)使用对象:必须是气态物质,可以是单一气体,也可以是混合气体。水、乙醇、SO3、CCl4等物质在标准状况下不是气体。
(3)在标准状况下,气体摩尔体积约为22.4 L·mol-1。其他条件下的气体摩尔体积不一定不是22.4 L·mol-1。
2.[2023山东烟台高一期中]已知a g气体XY3含有b个原子,设阿伏加德罗常数的值为NA,气体摩尔体积为c L·mol-1,则该条件下11.2 L该气体的质量为
( )
A
问题探究
探究2 阿伏加德罗定律及推论
(1)同温同压下,气体的体积大小与什么有关
(2)同温同压下,相同体积的任何气体都具有相同的质量吗
提示 同温同压下,气体分子之间的距离相同,所以分子数越多,气体体积越大,即同温同压下,气体的体积与其物质的量有关。
提示 不一定。同温同压下,相同体积的任何气体都具有相同的物质的量的分子,当气体的摩尔质量不同时,相同物质的量的气体的质量也不相同。
(3)相同容积的两个容器,一个盛放氧气,一个盛放氢气,若两容器的温度和压强相同,则两容器中气体分子数目有何关系
【微探究2】同温、同压下,不同气体的密度相同吗
提示 两容器中的气体分子数目相同。
提示 不一定相同。
归纳拓展
1.阿伏加德罗定律
即“三同(T、p、V)”定“一同(N)”。
注意 同温、同压、同体积的气体所含分子数相同,但不同气体分子中所含原子数目不一定相同。
2.阿伏加德罗定律的重要推论
应用体验
1.下列叙述不正确的是( )
A.常温常压下,两种气体的密度之比等于摩尔质量之比
B.在同温同体积下,两种气体的物质的量之比等于压强之比
C.在标准状况下,两种气体的体积之比等于摩尔质量之比
D.在同温同压下,相同体积的两种气体的质量之比等于摩尔质量之比
C
2.[2023山东德州高一期中]下列说法正确的是( )
A.同温同压下,N2和H2的密度之比为14∶1
B.同温下,等体积Cl2和O2的压强之比为1∶1
C.同温同压下,等质量的NO2、N2O4中氧原子个数比为1∶2
D.同温同压下,等体积的CH4和CO2的质量之比为11∶4
A
问题探究
探究3 各物质的物理量在化学方程式中的关系
已知参与反应的各物质的物理量之间的比例关系如下:
aA+ bB══cC+ dD
系数比: a ∶ b ∶ c ∶ d
质量比: aMA ∶ bMB∶ cMC ∶ dMD
物质的量比: a ∶ b ∶ c ∶ d
(1)在相同条件下,若上述反应中参加反应的物质均为气态,则反应的各气体体积之间有怎样的定量关系
提示 在同温同压下,参加反应的气体体积之比等于化学方程式中各物质化学式之前的系数之比,即V(A)∶V(B)∶V(C)∶V(D)=a∶b∶c∶d。
(2)已知下列反应中各物质的定量关系:
2H2(g) + O2(g)══ 2H2O(l)
系数 2 1 2
物质的量 2 mol 1 mol 2 mol
质量 2 mol×2 g·mol-1 1 mol×32 g·mol-1 2 mol×18 g·mol-1
标准状况
下气体体积 2 mol×22.4 L·mol-1 1 mol×22.4 L·mol-1
计算标准状况下4.48 L H2与足量O2反应生成H2O的质量。
提示 方法一:先把4.48 L换算成物质的量为0.2 mol,再根据物质的量之比等于化学方程式中化学式前的系数之比算出可生成0.2 mol H2O,最后用公式m=n×M算出H2O的质量为3.6 g。
方法二:找出直接关系。44.8 L H2生成36 g H2O,则4.48 L H2生成3.6 g H2O。
【微探究3】在化学反应中,反应物的总物质的量一定等于生成物的总物质的量吗
提示 不一定。化学反应过程中,反应前后物质的总质量不变,但物质的总物质的量可能不变、减小或增大,与化学方程式中各物质化学式前的系数有关。
归纳拓展
根据化学方程式的计算
物质的量应用于化学方程式的计算,其步骤可归纳为“2个未知”和“2个式子”。即根据题意设未知量,根据化学方程式列关系式,根据关系式列比例式,根据比例式求未知数。
(1)设未知量:根据题意设出未知量。
(2)列关系式:根据方程式列关系式时,不同的物质可以用不同的单位,同一种物质只能用同一种单位,即上下单位相同,左右单位对应。
(3)列比例式:根据关系式列比例式时,要注意比例式等号两边物质的比例关系要相对应。
(4)求未知数:根据比例式求未知数,要注意挖掘题干中对数字位数要求的隐含信息,主要体现为保留小数点后几位或保留几位有效数字。
应用体验
1.(1)将9.2 g钠投入足量的水中,生成NaOH g,生成H2的体积在标准状况下为 。
(2)400 mL某浓度的NaOH溶液恰好与5.6 L Cl2(标准状况)完全反应,生成NaClO的物质的量为 。
答案 (1)16 4.48 L (2)0.25 mol
解析 (1)依据题意→写出正确的化学方程式→找出量的关系→列比例求解:
2Na+2H2O══2NaOH + H2↑
46 g 80 g 22.4 L
9.2 g m(NaOH) V(H2)
2NaOH+Cl2══NaCl+NaClO+H2O
1 mol 1 mol
0.25 mol n(NaClO)
0.25 mol∶n(NaClO)=1∶1,则n(NaClO)=0.25 mol。
2.过氧化钠能与水发生反应,某同学欲用该反应制取标准状况下的氧气1.12 L。
(1)计算至少需要称取过氧化钠的质量是多少
(2)反应后生成NaOH的物质的量是多少
解 设需要过氧化钠的质量为m,生成NaOH的物质的量为n,则
2Na2O2+2H2O══4NaOH + O2↑
2×78 g 4 mol 22.4 L
m(Na2O2) n(NaOH) 1.12 L
答:(1)至少需要称取过氧化钠7.8 g。
(2)反应后生成NaOH的物质的量为0.2 mol。
学以致用·随堂检测全达标
1
2
3
4
5
1.[2023湖南邵阳高一期中]设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.1 mol任何气体的摩尔体积都约是22.4 L
B.标准状况时,体积均为22.4 L的O2与CO2含有相同的分子数
C.标准状况下,0.1NA个水分子所占的体积约为2.24 L
D.标准状况时,2 mol任何物质的体积均约为44.8 L
B
解析 标准状况1 mol任何气体都约是22.4 L,温度、压强不同,体积可能不同,A错误;标准状况时,体积均为22.4 L的O2与CO2,气体物质的量都是1 mol,故含有相同的分子数NA,B正确;水在标准状况下是非气体,0.1 mol水的体积不是2.24 L,C错误;标准状况下1 mol任何气体的体积约为22.4 L,固体和液体不符合,D错误。
1
2
3
4
5
2.用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
A.常温常压下,含有NA个氮原子的氮气体积约为11.2 L
B.标准状况下,64 g SO2中含有的原子数为3NA
C.在常温常压下,11.2 L Cl2含有的分子数为0.5NA
D.标准状况下,11.2 L H2O含有的分子数为0.5NA
B
解析 含有NA个氮原子的氮气的物质的量为0.5 mol,标准状况下体积为11.2 L,常温常压下气体摩尔体积大于22.4 L·mol-1,故A错误;标准状况下,64 g SO2的物质的量为 =1 mol,含有的原子数为3NA,故B正确;常温常压下,气体摩尔体积大于22.4 L·mol-1,故11.2 L氯气的物质的量小于0.5 mol,则分子数小于0.5NA,故C错误;标准状况下,H2O不是气体,故D错误。
1
2
3
4
5
3.下列有关说法正确的是( )
A.22.4 L任何气体,其物质的量均为1 mol
B.非标准状况下,1 mol任何气体体积一定不是22.4 L
C.0.6 mol H2、0.2 mol O2和0.2 mol CO2组成的混合气体在标准状况下的体积约为22.4 L
D.气体摩尔体积指的是在标准状况下1 mol气体的体积
C
解析 22.4 L气体所处条件未知,A错误;在非标准状况下,1 mol气体的体积不一定是22.4 L,故B错误;标准状况下气体摩尔体积是22.4 L·mol-1,0.6 mol H2、0.2 mol O2和0.2 mol CO2组成的混合气体共1 mol,混合气体的体积约为22.4 L,故C正确;气体摩尔体积指的是单位物质的量的气体所占的体积,不一定在标准状况下,故D错误。
1
2
3
4
5
4.下列叙述正确的是( )
A.标准状况下,1 L HCl和1 L H2O的物质的量相同
B.28 g CO的体积为22.4 L
C.两种物质的物质的量相同,则它们在标准状况下的体积也相同
D.同温同体积时,气体的物质的量越大,则压强越大
D
解析 标准状况下,HCl是气体,H2O是非气体,1 L HCl和1 L H2O的物质的量不同,A错误;28 g CO的物质的量为1 mol,但其体积不一定是22.4 L,B错误;两种物质的物质的量相同,若均为气体,在标准状况下的体积相同,否则可能不同,C错误;同温同体积时,气体的压强与其物质的量成正比,气体的物质的量越大,压强越大,D正确。
1
2
3
4
5
5.物质的量是把宏观物质和微观粒子联系起来的纽带。下列说法正确的是( )
A.等物质的量的甲烷和氧气的质量之比为2∶1
B.在标准状况下,等质量的甲烷和氧气的体积之比为1∶2
C.等质量的甲烷和氧气的原子数之比为5∶1
D.同温同压下,甲烷和氧气的密度之比为2∶1
C
1
2
3
4
5
解析 等物质的量的甲烷和氧气的质量之比为16∶32=1∶2,A错误;标准状况下,等质量的甲烷和氧气的物质的量之比为 =2∶1,根据阿伏加德罗定律可知,CH4和O2的体积之比等于其物质的量之比,即2∶1,B错误;由B分析可知,等质量的甲烷和氧气的物质的量之比为2∶1,则所含原子数之比为(2×5)∶(1×2)=5∶1,C正确;根据阿伏加德罗定律及推论可知,同温同压下,甲烷和氧气的密度之比等于其摩尔质量之比,即1∶2,D错误。
本 课 结 束
第1章 认识化学科学
第3节 第2课时 气体摩尔体积
素 养 目 标
1.通过对1 mol气体的体积的交流研讨,提出气体摩尔体积这个概念,理解气体摩尔体积的定义及影响因素,养成宏观辨识与微观探析的化学核心素养。
2.了解物质的量与微观粒子数之间的关系,能够运用物质的量、摩尔质量、气体摩尔体积的相互关系进行简单计算,形成证据推理与模型认知的化学核心素养。
3.通过对相同状况下不同气体的体积的研究,理解阿伏加德罗定律及其推论,并能够解决实际问题,养成证据推理与模型认知的化学核心素养。
基础落实·必备知识全过关
重难探究·能力素养全提升
目 录 索 引
学以致用·随堂检测全达标
基础落实·必备知识全过关
自主梳理
一、物质体积的影响因素
【微点拨】气体的体积不但与气体的物质的量有关,而且与温度和压强有关。描述或判断一定物质的量的气体的体积时,必须指明相对应的温度和压强。
大小
距离
二、气体摩尔体积
1.定义
在一定的温度和压强下, 的气体所占的体积叫作气体摩尔体积。符号为Vm。
2.单位
或 。
3.标准状况下的气体摩尔体积
在标准状况(0 ℃、101 kPa)下任何气体的气体摩尔体积约为 。
4.气体体积、气体摩尔体积、物质的量三者之间的关系
Vm= 。
单位物质的量
L·mol-1
m3·mol-1
22.4 L·mol-1
三、阿伏加德罗定律
1.内容:在同温同压下,相同体积的任何气体都含有 数目的分子。
2.应用:“三同”定“一同”
相同
温
压
体积
分子数
自我检测
判断下列说法是否正确,正确的画“√”,错误的画“×”。
1.在标准状况下,1 mol O2与1 mol H2O的体积相同。( )
2.在标准状况下,1 mol气体的体积约是22.4 L,在非标准状况下,1 mol气体的体积则一定不是22.4 L。( )
3.同温同压下,等体积的两种气体单质一定具有相同的原子数。( )
4.标准状况下,氢气的气体摩尔体积为22.4 L。( )
5.同温同体积条件下,等质量的SO2和O2两种气体对应的压强之比为1∶2。
( )
6.在相同条件下(均为气态),相同物质的量的CO、N2的混合气体与O2的分子个数相同,原子个数也相同。( )
×
×
×
×
√
√
重难探究·能力素养全提升
问题探究
探究1 气体摩尔体积的理解与相关计算
(1)标准状况下,1 mol气体的体积绝对等于22.4 L吗
(2)气体摩尔体积的适用范围是气体,
是否必须为纯净的气体
标准状况时的气体
摩尔体积示意图
提示 不是。
在标准状况下,1 mol气体的体积约为22.4 L。
提示 不是。气体摩尔体积的适用范围是气体,可以是单一气体,也可以是混合气体,并且混合气体中气体之间不能发生化学反应。如标准状况下, 0.2 mol H2和0.8 mol O2组成的混合气体的体积约为22.4 L。
【微探究1】当1 mol气体的体积为22.4 L时,能否说明该气体一定处于标准状况
提示 不能。标准状况下,1 mol气体的体积约为22.4 L,但1 mol气体的体积为22.4 L时,并不一定说明该气体处于标准状况下,比如适当的升高温度(气体膨胀)、增大压强(压缩气体),也能使1 mol气体的体积变为22.4 L。
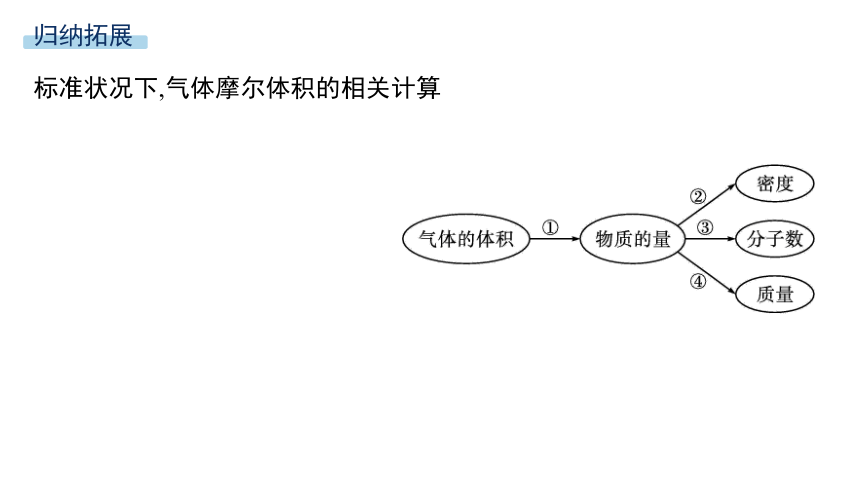
归纳拓展
标准状况下,气体摩尔体积的相关计算
应用体验
1.下列说法正确的是( )
①标准状况下,6.02×1023个分子所占的体积约是22.4 L ②0.5 mol H2所占体积为11.2 L ③标准状况下,1 mol H2O的体积为22.4 L ④标准状况下,28 g CO与N2的混合气体的体积约为22.4 L ⑤各种气体的气体摩尔体积都约为22.4 L·mol-1 ⑥标准状况下,体积相同的气体所含的分子数相同
A.①③⑤ B.④⑥
C.②④⑥ D.①④⑥
B
解析 ①物质在标准状况下不一定是气体;②没有限定处于标准状况下,0.5 mol H2所占体积不一定为11.2 L;③标准状况下, H2O不是气体;⑤各种气体的摩尔体积在标准状况下都约为22.4 L·mol-1。
易错警示 计算中使用“22.4 L·mol-1”的三注意
(1)使用“条件”:标准状况。
(2)使用对象:必须是气态物质,可以是单一气体,也可以是混合气体。水、乙醇、SO3、CCl4等物质在标准状况下不是气体。
(3)在标准状况下,气体摩尔体积约为22.4 L·mol-1。其他条件下的气体摩尔体积不一定不是22.4 L·mol-1。
2.[2023山东烟台高一期中]已知a g气体XY3含有b个原子,设阿伏加德罗常数的值为NA,气体摩尔体积为c L·mol-1,则该条件下11.2 L该气体的质量为
( )
A
问题探究
探究2 阿伏加德罗定律及推论
(1)同温同压下,气体的体积大小与什么有关
(2)同温同压下,相同体积的任何气体都具有相同的质量吗
提示 同温同压下,气体分子之间的距离相同,所以分子数越多,气体体积越大,即同温同压下,气体的体积与其物质的量有关。
提示 不一定。同温同压下,相同体积的任何气体都具有相同的物质的量的分子,当气体的摩尔质量不同时,相同物质的量的气体的质量也不相同。
(3)相同容积的两个容器,一个盛放氧气,一个盛放氢气,若两容器的温度和压强相同,则两容器中气体分子数目有何关系
【微探究2】同温、同压下,不同气体的密度相同吗
提示 两容器中的气体分子数目相同。
提示 不一定相同。
归纳拓展
1.阿伏加德罗定律
即“三同(T、p、V)”定“一同(N)”。
注意 同温、同压、同体积的气体所含分子数相同,但不同气体分子中所含原子数目不一定相同。
2.阿伏加德罗定律的重要推论
应用体验
1.下列叙述不正确的是( )
A.常温常压下,两种气体的密度之比等于摩尔质量之比
B.在同温同体积下,两种气体的物质的量之比等于压强之比
C.在标准状况下,两种气体的体积之比等于摩尔质量之比
D.在同温同压下,相同体积的两种气体的质量之比等于摩尔质量之比
C
2.[2023山东德州高一期中]下列说法正确的是( )
A.同温同压下,N2和H2的密度之比为14∶1
B.同温下,等体积Cl2和O2的压强之比为1∶1
C.同温同压下,等质量的NO2、N2O4中氧原子个数比为1∶2
D.同温同压下,等体积的CH4和CO2的质量之比为11∶4
A
问题探究
探究3 各物质的物理量在化学方程式中的关系
已知参与反应的各物质的物理量之间的比例关系如下:
aA+ bB══cC+ dD
系数比: a ∶ b ∶ c ∶ d
质量比: aMA ∶ bMB∶ cMC ∶ dMD
物质的量比: a ∶ b ∶ c ∶ d
(1)在相同条件下,若上述反应中参加反应的物质均为气态,则反应的各气体体积之间有怎样的定量关系
提示 在同温同压下,参加反应的气体体积之比等于化学方程式中各物质化学式之前的系数之比,即V(A)∶V(B)∶V(C)∶V(D)=a∶b∶c∶d。
(2)已知下列反应中各物质的定量关系:
2H2(g) + O2(g)══ 2H2O(l)
系数 2 1 2
物质的量 2 mol 1 mol 2 mol
质量 2 mol×2 g·mol-1 1 mol×32 g·mol-1 2 mol×18 g·mol-1
标准状况
下气体体积 2 mol×22.4 L·mol-1 1 mol×22.4 L·mol-1
计算标准状况下4.48 L H2与足量O2反应生成H2O的质量。
提示 方法一:先把4.48 L换算成物质的量为0.2 mol,再根据物质的量之比等于化学方程式中化学式前的系数之比算出可生成0.2 mol H2O,最后用公式m=n×M算出H2O的质量为3.6 g。
方法二:找出直接关系。44.8 L H2生成36 g H2O,则4.48 L H2生成3.6 g H2O。
【微探究3】在化学反应中,反应物的总物质的量一定等于生成物的总物质的量吗
提示 不一定。化学反应过程中,反应前后物质的总质量不变,但物质的总物质的量可能不变、减小或增大,与化学方程式中各物质化学式前的系数有关。
归纳拓展
根据化学方程式的计算
物质的量应用于化学方程式的计算,其步骤可归纳为“2个未知”和“2个式子”。即根据题意设未知量,根据化学方程式列关系式,根据关系式列比例式,根据比例式求未知数。
(1)设未知量:根据题意设出未知量。
(2)列关系式:根据方程式列关系式时,不同的物质可以用不同的单位,同一种物质只能用同一种单位,即上下单位相同,左右单位对应。
(3)列比例式:根据关系式列比例式时,要注意比例式等号两边物质的比例关系要相对应。
(4)求未知数:根据比例式求未知数,要注意挖掘题干中对数字位数要求的隐含信息,主要体现为保留小数点后几位或保留几位有效数字。
应用体验
1.(1)将9.2 g钠投入足量的水中,生成NaOH g,生成H2的体积在标准状况下为 。
(2)400 mL某浓度的NaOH溶液恰好与5.6 L Cl2(标准状况)完全反应,生成NaClO的物质的量为 。
答案 (1)16 4.48 L (2)0.25 mol
解析 (1)依据题意→写出正确的化学方程式→找出量的关系→列比例求解:
2Na+2H2O══2NaOH + H2↑
46 g 80 g 22.4 L
9.2 g m(NaOH) V(H2)
2NaOH+Cl2══NaCl+NaClO+H2O
1 mol 1 mol
0.25 mol n(NaClO)
0.25 mol∶n(NaClO)=1∶1,则n(NaClO)=0.25 mol。
2.过氧化钠能与水发生反应,某同学欲用该反应制取标准状况下的氧气1.12 L。
(1)计算至少需要称取过氧化钠的质量是多少
(2)反应后生成NaOH的物质的量是多少
解 设需要过氧化钠的质量为m,生成NaOH的物质的量为n,则
2Na2O2+2H2O══4NaOH + O2↑
2×78 g 4 mol 22.4 L
m(Na2O2) n(NaOH) 1.12 L
答:(1)至少需要称取过氧化钠7.8 g。
(2)反应后生成NaOH的物质的量为0.2 mol。
学以致用·随堂检测全达标
1
2
3
4
5
1.[2023湖南邵阳高一期中]设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.1 mol任何气体的摩尔体积都约是22.4 L
B.标准状况时,体积均为22.4 L的O2与CO2含有相同的分子数
C.标准状况下,0.1NA个水分子所占的体积约为2.24 L
D.标准状况时,2 mol任何物质的体积均约为44.8 L
B
解析 标准状况1 mol任何气体都约是22.4 L,温度、压强不同,体积可能不同,A错误;标准状况时,体积均为22.4 L的O2与CO2,气体物质的量都是1 mol,故含有相同的分子数NA,B正确;水在标准状况下是非气体,0.1 mol水的体积不是2.24 L,C错误;标准状况下1 mol任何气体的体积约为22.4 L,固体和液体不符合,D错误。
1
2
3
4
5
2.用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
A.常温常压下,含有NA个氮原子的氮气体积约为11.2 L
B.标准状况下,64 g SO2中含有的原子数为3NA
C.在常温常压下,11.2 L Cl2含有的分子数为0.5NA
D.标准状况下,11.2 L H2O含有的分子数为0.5NA
B
解析 含有NA个氮原子的氮气的物质的量为0.5 mol,标准状况下体积为11.2 L,常温常压下气体摩尔体积大于22.4 L·mol-1,故A错误;标准状况下,64 g SO2的物质的量为 =1 mol,含有的原子数为3NA,故B正确;常温常压下,气体摩尔体积大于22.4 L·mol-1,故11.2 L氯气的物质的量小于0.5 mol,则分子数小于0.5NA,故C错误;标准状况下,H2O不是气体,故D错误。
1
2
3
4
5
3.下列有关说法正确的是( )
A.22.4 L任何气体,其物质的量均为1 mol
B.非标准状况下,1 mol任何气体体积一定不是22.4 L
C.0.6 mol H2、0.2 mol O2和0.2 mol CO2组成的混合气体在标准状况下的体积约为22.4 L
D.气体摩尔体积指的是在标准状况下1 mol气体的体积
C
解析 22.4 L气体所处条件未知,A错误;在非标准状况下,1 mol气体的体积不一定是22.4 L,故B错误;标准状况下气体摩尔体积是22.4 L·mol-1,0.6 mol H2、0.2 mol O2和0.2 mol CO2组成的混合气体共1 mol,混合气体的体积约为22.4 L,故C正确;气体摩尔体积指的是单位物质的量的气体所占的体积,不一定在标准状况下,故D错误。
1
2
3
4
5
4.下列叙述正确的是( )
A.标准状况下,1 L HCl和1 L H2O的物质的量相同
B.28 g CO的体积为22.4 L
C.两种物质的物质的量相同,则它们在标准状况下的体积也相同
D.同温同体积时,气体的物质的量越大,则压强越大
D
解析 标准状况下,HCl是气体,H2O是非气体,1 L HCl和1 L H2O的物质的量不同,A错误;28 g CO的物质的量为1 mol,但其体积不一定是22.4 L,B错误;两种物质的物质的量相同,若均为气体,在标准状况下的体积相同,否则可能不同,C错误;同温同体积时,气体的压强与其物质的量成正比,气体的物质的量越大,压强越大,D正确。
1
2
3
4
5
5.物质的量是把宏观物质和微观粒子联系起来的纽带。下列说法正确的是( )
A.等物质的量的甲烷和氧气的质量之比为2∶1
B.在标准状况下,等质量的甲烷和氧气的体积之比为1∶2
C.等质量的甲烷和氧气的原子数之比为5∶1
D.同温同压下,甲烷和氧气的密度之比为2∶1
C
1
2
3
4
5
解析 等物质的量的甲烷和氧气的质量之比为16∶32=1∶2,A错误;标准状况下,等质量的甲烷和氧气的物质的量之比为 =2∶1,根据阿伏加德罗定律可知,CH4和O2的体积之比等于其物质的量之比,即2∶1,B错误;由B分析可知,等质量的甲烷和氧气的物质的量之比为2∶1,则所含原子数之比为(2×5)∶(1×2)=5∶1,C正确;根据阿伏加德罗定律及推论可知,同温同压下,甲烷和氧气的密度之比等于其摩尔质量之比,即1∶2,D错误。
本 课 结 束
