2.3.1 认识氧化还原反应课件(共37张PPT)2023-2024学年高一化学鲁科版必修第一册
文档属性
| 名称 | 2.3.1 认识氧化还原反应课件(共37张PPT)2023-2024学年高一化学鲁科版必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 4.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-08 16:08:28 | ||
图片预览










文档简介
(共37张PPT)
第2章 元素与物质世界
第3节 第1课时 认识氧化还原反应
素 养 目 标
1.通过对化合价升降及得失电子的认识,由表及里地学习氧化还原反应的有关概念,逐步培养宏观辨识与微观探析的能力。
2.探究元素化合价升降是电子转移的外在表现,从微观角度认识表示氧化还原反应的两种常见方法——双线桥法和单线桥法,培养电子守恒观念,建立证据推理与模型认知的核心素养。
基础落实·必备知识全过关
重难探究·能力素养全提升
目 录 索 引
学以致用·随堂检测全达标
基础落实·必备知识全过关
自主梳理
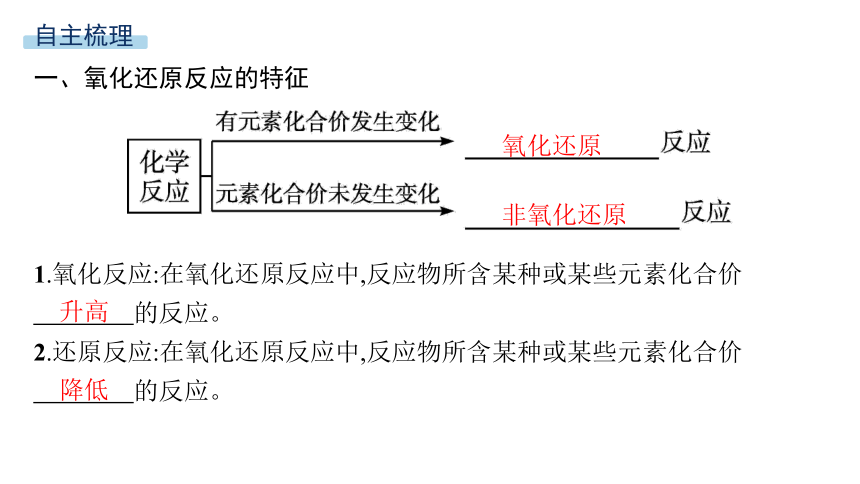
一、氧化还原反应的特征
1.氧化反应:在氧化还原反应中,反应物所含某种或某些元素化合价
的反应。
2.还原反应:在氧化还原反应中,反应物所含某种或某些元素化合价
的反应。
氧化还原
非氧化还原
升高
降低
【微思考1】凡是有单质参与的反应一定是氧化还原反应吗
【微点拨】判断一个反应是不是氧化还原反应,关键是看反应前后元素化合价是否发生变化。
【微思考2】所有的化学反应都可以按照四种基本反应类型和氧化还原反应的标准划分吗
提示 不一定。如O2与O3的转化不属于氧化还原反应。
提示 不可以。根据化合价是否发生变化,所有化学反应可分为氧化还原反应和非氧化还原反应;而四种基本反应类型不能包括所有的反应,如3CO+Fe2O3 3CO2+2Fe不属于四种基本反应类型。
二、氧化还原反应的实质
1.以钠与氯气反应为例探究氧化还原反应的本质
2Na+Cl2 2NaCl
(1)钠原子 电子,化合价 ,发生 反应。
(2)氯原子 电子,化合价 ,发生 反应。
2.以金属铁与CuSO4溶液反应为例探究氧化还原反应的本质
Cu2++Fe ══Cu+ Fe2+
(1)铁原子失电子,化合价 ,发生 反应。
(2)铜离子得电子,化合价 ,发生 反应。
3.结论
氧化还原反应的实质是发生了 。
失
升高
氧化
得
降低
还原
升高
氧化
降低
还原
电子转移
得到的电子数和失去的电子数相等
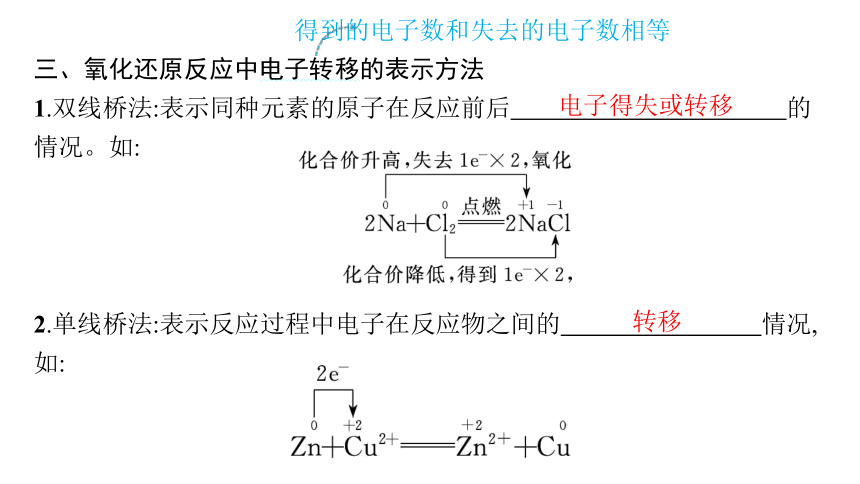
三、氧化还原反应中电子转移的表示方法
1.双线桥法:表示同种元素的原子在反应前后 的情况。如:
2.单线桥法:表示反应过程中电子在反应物之间的 情况,如:
电子得失或转移
转移
【微思考3】下面的氧化还原反应中,电子转移方向和数目的表示正确吗 请说明理由。
提示 不正确。箭头连接方式不对,应该由氢元素指向铜元素。
自我检测
判断下列说法是否正确,正确的画“√”,错误的画“×”。
1.反应后有单质生成的化学反应一定是氧化还原反应。( )
2.金属阳离子一定只具有氧化性。( )
3.氧化还原反应中有一种元素被氧化时,一定有另一种元素被还原。( )
4.氧化还原反应中的反应物不是氧化剂就是还原剂。( )
5.某元素从游离态变为化合态,该元素可能被氧化也可能被还原。( )
6.1 mol Cl2与Ca(OH)2完全反应,转移的电子数是2NA。( )
×
×
×
×
√
×
重难探究·能力素养全提升
问题探究
探究1 氧化还原反应与四种基本反应类型的关系
(1)如何理解氧化反应和还原反应的关系
(2)复分解反应都不是氧化还原反应,你认为这个说法正确吗 说明你的理由。
提示 氧化反应和还原反应同时存在于一个反应中,不能独立存在,所以人们把这样的一类化学反应叫作氧化还原反应。
提示 正确。复分解反应是化合物相互交换成分,重新组合为新的化合物的反应,没有元素化合价的变化,一定不是氧化还原反应,属于非氧化还原反应。
(3)化合反应、分解反应不一定是氧化还原反应,你能举出相应的实例吗
归纳拓展
氧化还原反应与四种基本反应类型的关系
(1)置换反应一定是氧化还原反应。
(2)复分解反应一定不是氧化还原反应。
(3)有单质参加的化合反应是氧化还原反应。
(4)有单质生成的分解反应是氧化还原反应。
应用体验
下列对上述三个反应的叙述不正确的是( )
A.①③反应为置换反应
B.①②③反应均为氧化还原反应
C.三个反应的反应物中硅元素化合价均升高
D.②为化合反应
C
解析 ①③反应为置换反应,A正确;①②③中均有单质参与反应,且有化合价的变化,均为氧化还原反应,B正确;①③中Si元素的化合价由+4价降低到0价,②中硅元素化合价由0价升高到+4价,C错误;②为两种反应物生成一种化合物,为化合反应,D正确。
易错警示 (1)凡是有元素化合价升降的化学反应都是氧化还原反应。氧化还原反应不一定有氧得失。在氧化还原反应中,并不一定是所有的元素化合价都发生改变,故不一定所有的元素都发生氧化还原反应。
(2)氧化还原反应中,电子得失总数相等,化合价升降总数相等,且化合价的升降总数等于电子得失总数。
(3)凡有单质参加的化合反应、有单质生成的分解反应和置换反应都是氧化还原反应,没有单质参加的化合反应也有可能是氧化还原反应,如反应SO2+Na2O2══Na2SO4。有单质参加的反应不一定是氧化还原反应,如反应3O2 2O3。
(4)一种元素被氧化,不一定有另一种元素被还原,被氧化和被还原的元素可以是同一种元素。
2.下列说法正确的是( )
A.氧化还原反应的实质是氧元素的转移
B.置换反应不一定是氧化还原反应
C.氧化还原反应中并不一定是所有元素的化合价都发生变化
D.反应物中有单质的反应一定属于氧化还原反应
C
解析 氧化还原反应的特征为有元素化合价发生变化,其实质是电子的转移,故A错误;置换反应是一种单质和一种化合物作用生成另外一种单质与另外一种化合物的反应,一定有元素的化合价变化,一定是氧化还原反应,故B错误;氧化还原反应中并不一定是所有的元素化合价都发生变化,故C正确;反应2O3══3O2中,氧元素的化合价没有发生变化,属于非氧化还原反应,故D错误。
问题探究
探究2 氧化还原反应中电子转移的表示方法
(1)氧化还原反应的实质是电子的转移,如钠与氯气的反应过程中钠原子失电子、氯原子得电子,如何表示氧化还原反应中电子的转移呢
提示
(2)在 反应中,1 mol Fe2O3参加反应转移
电子的物质的量是12 mol吗
提示 不是。1 mol Fe2O3参加反应转移电子的物质的量是6 mol。
归纳拓展
1.氧化还原反应中微粒间的转化关系
2.氧化还原反应中电子转移的表示方法
(1)双线桥法。
①基本步骤:
②注意事项:
a.箭头、箭尾指向化合价变化的同种元素。
b.失去电子总数与得到电子总数相等。
如:
(2)单线桥法。
①基本步骤:
②注意事项:
a.单线桥必须画在反应物中。
b.标明电子转移的总数,不标“得、失”。
应用体验
1.下列化学反应中所标注电子转移方向与数目错误的是( )
D
解析 A项,Fe与HCl反应时,Fe失去电子变成Fe2+,+1价H得到电子生成H2,1 mol Fe反应时转移电子为2 mol,正确;B项,NO→HNO3,氮元素由+2价升高到+5价,4 mol NO反应时失去电子为4×3 mol,O2中氧元素由0价降低到-2价,3 mol O2得到电子为6×2 mol,正确;C项,Cl2→CaCl2,1 mol Cl2得到2 mol e-,Cl2→Ca(ClO)2,1 mol Cl2失去2 mol e-,正确;D项,KClO3中Cl元素由+5价降低到0价,1 mol Cl原子得到5 mol e-,错误。
2.[2023广东阳江四校高一联考]下列电子转移表示不正确的是( )
B
解析 B项反应中Cl元素的化合价既升高又降低,转移的电子数为e-,正确的
表示为 ,故B错误。
易错警示 (1)转移电子总数=得到的电子数=失去的电子数,即氧化还原反应中转移的电子总数与得到的电子数或失去的电子数相等,而不是二者的加和。如1 mol CuO参加反应生成Cu总共转移了2 mol电子,而不是4 mol电子。
(2)单线桥和双线桥两种方法的形式不同,实质相同。在分析氧化还原反应中电子转移、化合价升降、元素被氧化(或被还原)等关系时,用“双线桥”方便,在表示电子转移的方向和数目时用“单线桥”方便。
(3)用双线桥法标电子转移时,电子转移数用be-×a形式表示,a表示发生氧化或还原反应的原子或离子的个数,b表示每个原子或离子得到或失去的电子数。
学以致用·随堂检测全达标
1
2
3
4
5
1.[2023北京第四中学高一期中]矿泉水在开采过程中会含有少量溴化物(KBr),在后续生产过程中经臭氧(O3)处理逐渐转化成溴酸盐(KBrO3): KBr+O3══KBrO3。下列有关该过程的认识不正确的是( )
A.该反应是氧化还原反应 B.该反应中臭氧(O3)得到电子
C.该反应中溴元素被氧化 D.该反应中O3发生氧化反应
D
解析 该反应中,Br元素由-1价升高到+5价,O元素由0价降低到-2价,Br和O元素化合价变化,故属于氧化还原反应,A正确;O3→KBrO3,O元素化合价降低,故臭氧(O3)得到电子,发生还原反应,B正确、D错误;KBr→KBrO3,Br元素化合价升高,故溴元素被氧化,C正确。
1
2
3
4
5
2.下列表示电子转移的方向和数目中不合理的是( )
B
解析 KClO3分解反应中,-2价氧元素失去电子变为0价,+5价氯元素得到电
子变为-1价,正确的形式应为 ,B错误。
1
2
3
4
5
3.下列关于氧化还原反应的叙述,正确的是( )
A.有一种元素发生氧化反应,肯定有另一种元素发生还原反应
B.在反应中元素的化合价可能发生变化,也可能不发生变化
C.置换反应和复分解反应不可能是氧化还原反应
D.化合反应和置换反应一定是氧化还原反应
B
解析 A项,有可能是同种元素之间的氧化还原反应;C项,置换反应一定是氧化还原反应;D项,化合反应不一定是氧化还原反应。
1
2
3
4
5
4.下列反应不属于四种基本反应类型,但属于氧化还原反应的是( )
A.Fe+CuSO4══FeSO4+Cu
B
1
2
3
4
5
解析 反应Fe+CuSO4══FeSO4+Cu是置换反应,反应中有元素化合价的变化,属于氧化还原反应,A不符合题意;CO和Fe2O3在高温下的反应不属于任何一种基本反应类型,反应中有元素化合价的变化,属于氧化还原反应,B符合题意;AgNO3和NaCl的反应属于复分解反应,反应中元素化合价没有变化,不属于氧化还原反应,C不符合题意;D项反应属于分解反应,反应过程中元素化合价发生了变化,属于氧化还原反应,D不符合题意。
1
2
3
4
5
5.[2023河北唐山高一期中]工业上通过反应2Al2O3+3C+6Cl2 4AlCl3+3CO2制取无水氯化铝,关于该反应下列说法正确的是( )
A.该反应中,Al元素被氧化
B.每生成1个CO2分子,转移2个电子
C.该反应中,Cl2得电子被还原
D.该反应中,C发生还原反应
C
解析 Al2O3和AlCl3中Al元素均显+3价,Al元素化合价未变化,A错误; C→CO2,C元素由0价升高到+4价,发生氧化反应,故生成1个CO2分子时转移4个电子,B、D错误;Cl2→AlCl3,Cl元素由0价降低到-1价,故Cl2得电子被还原,C正确。
本 课 结 束
第2章 元素与物质世界
第3节 第1课时 认识氧化还原反应
素 养 目 标
1.通过对化合价升降及得失电子的认识,由表及里地学习氧化还原反应的有关概念,逐步培养宏观辨识与微观探析的能力。
2.探究元素化合价升降是电子转移的外在表现,从微观角度认识表示氧化还原反应的两种常见方法——双线桥法和单线桥法,培养电子守恒观念,建立证据推理与模型认知的核心素养。
基础落实·必备知识全过关
重难探究·能力素养全提升
目 录 索 引
学以致用·随堂检测全达标
基础落实·必备知识全过关
自主梳理
一、氧化还原反应的特征
1.氧化反应:在氧化还原反应中,反应物所含某种或某些元素化合价
的反应。
2.还原反应:在氧化还原反应中,反应物所含某种或某些元素化合价
的反应。
氧化还原
非氧化还原
升高
降低
【微思考1】凡是有单质参与的反应一定是氧化还原反应吗
【微点拨】判断一个反应是不是氧化还原反应,关键是看反应前后元素化合价是否发生变化。
【微思考2】所有的化学反应都可以按照四种基本反应类型和氧化还原反应的标准划分吗
提示 不一定。如O2与O3的转化不属于氧化还原反应。
提示 不可以。根据化合价是否发生变化,所有化学反应可分为氧化还原反应和非氧化还原反应;而四种基本反应类型不能包括所有的反应,如3CO+Fe2O3 3CO2+2Fe不属于四种基本反应类型。
二、氧化还原反应的实质
1.以钠与氯气反应为例探究氧化还原反应的本质
2Na+Cl2 2NaCl
(1)钠原子 电子,化合价 ,发生 反应。
(2)氯原子 电子,化合价 ,发生 反应。
2.以金属铁与CuSO4溶液反应为例探究氧化还原反应的本质
Cu2++Fe ══Cu+ Fe2+
(1)铁原子失电子,化合价 ,发生 反应。
(2)铜离子得电子,化合价 ,发生 反应。
3.结论
氧化还原反应的实质是发生了 。
失
升高
氧化
得
降低
还原
升高
氧化
降低
还原
电子转移
得到的电子数和失去的电子数相等
三、氧化还原反应中电子转移的表示方法
1.双线桥法:表示同种元素的原子在反应前后 的情况。如:
2.单线桥法:表示反应过程中电子在反应物之间的 情况,如:
电子得失或转移
转移
【微思考3】下面的氧化还原反应中,电子转移方向和数目的表示正确吗 请说明理由。
提示 不正确。箭头连接方式不对,应该由氢元素指向铜元素。
自我检测
判断下列说法是否正确,正确的画“√”,错误的画“×”。
1.反应后有单质生成的化学反应一定是氧化还原反应。( )
2.金属阳离子一定只具有氧化性。( )
3.氧化还原反应中有一种元素被氧化时,一定有另一种元素被还原。( )
4.氧化还原反应中的反应物不是氧化剂就是还原剂。( )
5.某元素从游离态变为化合态,该元素可能被氧化也可能被还原。( )
6.1 mol Cl2与Ca(OH)2完全反应,转移的电子数是2NA。( )
×
×
×
×
√
×
重难探究·能力素养全提升
问题探究
探究1 氧化还原反应与四种基本反应类型的关系
(1)如何理解氧化反应和还原反应的关系
(2)复分解反应都不是氧化还原反应,你认为这个说法正确吗 说明你的理由。
提示 氧化反应和还原反应同时存在于一个反应中,不能独立存在,所以人们把这样的一类化学反应叫作氧化还原反应。
提示 正确。复分解反应是化合物相互交换成分,重新组合为新的化合物的反应,没有元素化合价的变化,一定不是氧化还原反应,属于非氧化还原反应。
(3)化合反应、分解反应不一定是氧化还原反应,你能举出相应的实例吗
归纳拓展
氧化还原反应与四种基本反应类型的关系
(1)置换反应一定是氧化还原反应。
(2)复分解反应一定不是氧化还原反应。
(3)有单质参加的化合反应是氧化还原反应。
(4)有单质生成的分解反应是氧化还原反应。
应用体验
下列对上述三个反应的叙述不正确的是( )
A.①③反应为置换反应
B.①②③反应均为氧化还原反应
C.三个反应的反应物中硅元素化合价均升高
D.②为化合反应
C
解析 ①③反应为置换反应,A正确;①②③中均有单质参与反应,且有化合价的变化,均为氧化还原反应,B正确;①③中Si元素的化合价由+4价降低到0价,②中硅元素化合价由0价升高到+4价,C错误;②为两种反应物生成一种化合物,为化合反应,D正确。
易错警示 (1)凡是有元素化合价升降的化学反应都是氧化还原反应。氧化还原反应不一定有氧得失。在氧化还原反应中,并不一定是所有的元素化合价都发生改变,故不一定所有的元素都发生氧化还原反应。
(2)氧化还原反应中,电子得失总数相等,化合价升降总数相等,且化合价的升降总数等于电子得失总数。
(3)凡有单质参加的化合反应、有单质生成的分解反应和置换反应都是氧化还原反应,没有单质参加的化合反应也有可能是氧化还原反应,如反应SO2+Na2O2══Na2SO4。有单质参加的反应不一定是氧化还原反应,如反应3O2 2O3。
(4)一种元素被氧化,不一定有另一种元素被还原,被氧化和被还原的元素可以是同一种元素。
2.下列说法正确的是( )
A.氧化还原反应的实质是氧元素的转移
B.置换反应不一定是氧化还原反应
C.氧化还原反应中并不一定是所有元素的化合价都发生变化
D.反应物中有单质的反应一定属于氧化还原反应
C
解析 氧化还原反应的特征为有元素化合价发生变化,其实质是电子的转移,故A错误;置换反应是一种单质和一种化合物作用生成另外一种单质与另外一种化合物的反应,一定有元素的化合价变化,一定是氧化还原反应,故B错误;氧化还原反应中并不一定是所有的元素化合价都发生变化,故C正确;反应2O3══3O2中,氧元素的化合价没有发生变化,属于非氧化还原反应,故D错误。
问题探究
探究2 氧化还原反应中电子转移的表示方法
(1)氧化还原反应的实质是电子的转移,如钠与氯气的反应过程中钠原子失电子、氯原子得电子,如何表示氧化还原反应中电子的转移呢
提示
(2)在 反应中,1 mol Fe2O3参加反应转移
电子的物质的量是12 mol吗
提示 不是。1 mol Fe2O3参加反应转移电子的物质的量是6 mol。
归纳拓展
1.氧化还原反应中微粒间的转化关系
2.氧化还原反应中电子转移的表示方法
(1)双线桥法。
①基本步骤:
②注意事项:
a.箭头、箭尾指向化合价变化的同种元素。
b.失去电子总数与得到电子总数相等。
如:
(2)单线桥法。
①基本步骤:
②注意事项:
a.单线桥必须画在反应物中。
b.标明电子转移的总数,不标“得、失”。
应用体验
1.下列化学反应中所标注电子转移方向与数目错误的是( )
D
解析 A项,Fe与HCl反应时,Fe失去电子变成Fe2+,+1价H得到电子生成H2,1 mol Fe反应时转移电子为2 mol,正确;B项,NO→HNO3,氮元素由+2价升高到+5价,4 mol NO反应时失去电子为4×3 mol,O2中氧元素由0价降低到-2价,3 mol O2得到电子为6×2 mol,正确;C项,Cl2→CaCl2,1 mol Cl2得到2 mol e-,Cl2→Ca(ClO)2,1 mol Cl2失去2 mol e-,正确;D项,KClO3中Cl元素由+5价降低到0价,1 mol Cl原子得到5 mol e-,错误。
2.[2023广东阳江四校高一联考]下列电子转移表示不正确的是( )
B
解析 B项反应中Cl元素的化合价既升高又降低,转移的电子数为e-,正确的
表示为 ,故B错误。
易错警示 (1)转移电子总数=得到的电子数=失去的电子数,即氧化还原反应中转移的电子总数与得到的电子数或失去的电子数相等,而不是二者的加和。如1 mol CuO参加反应生成Cu总共转移了2 mol电子,而不是4 mol电子。
(2)单线桥和双线桥两种方法的形式不同,实质相同。在分析氧化还原反应中电子转移、化合价升降、元素被氧化(或被还原)等关系时,用“双线桥”方便,在表示电子转移的方向和数目时用“单线桥”方便。
(3)用双线桥法标电子转移时,电子转移数用be-×a形式表示,a表示发生氧化或还原反应的原子或离子的个数,b表示每个原子或离子得到或失去的电子数。
学以致用·随堂检测全达标
1
2
3
4
5
1.[2023北京第四中学高一期中]矿泉水在开采过程中会含有少量溴化物(KBr),在后续生产过程中经臭氧(O3)处理逐渐转化成溴酸盐(KBrO3): KBr+O3══KBrO3。下列有关该过程的认识不正确的是( )
A.该反应是氧化还原反应 B.该反应中臭氧(O3)得到电子
C.该反应中溴元素被氧化 D.该反应中O3发生氧化反应
D
解析 该反应中,Br元素由-1价升高到+5价,O元素由0价降低到-2价,Br和O元素化合价变化,故属于氧化还原反应,A正确;O3→KBrO3,O元素化合价降低,故臭氧(O3)得到电子,发生还原反应,B正确、D错误;KBr→KBrO3,Br元素化合价升高,故溴元素被氧化,C正确。
1
2
3
4
5
2.下列表示电子转移的方向和数目中不合理的是( )
B
解析 KClO3分解反应中,-2价氧元素失去电子变为0价,+5价氯元素得到电
子变为-1价,正确的形式应为 ,B错误。
1
2
3
4
5
3.下列关于氧化还原反应的叙述,正确的是( )
A.有一种元素发生氧化反应,肯定有另一种元素发生还原反应
B.在反应中元素的化合价可能发生变化,也可能不发生变化
C.置换反应和复分解反应不可能是氧化还原反应
D.化合反应和置换反应一定是氧化还原反应
B
解析 A项,有可能是同种元素之间的氧化还原反应;C项,置换反应一定是氧化还原反应;D项,化合反应不一定是氧化还原反应。
1
2
3
4
5
4.下列反应不属于四种基本反应类型,但属于氧化还原反应的是( )
A.Fe+CuSO4══FeSO4+Cu
B
1
2
3
4
5
解析 反应Fe+CuSO4══FeSO4+Cu是置换反应,反应中有元素化合价的变化,属于氧化还原反应,A不符合题意;CO和Fe2O3在高温下的反应不属于任何一种基本反应类型,反应中有元素化合价的变化,属于氧化还原反应,B符合题意;AgNO3和NaCl的反应属于复分解反应,反应中元素化合价没有变化,不属于氧化还原反应,C不符合题意;D项反应属于分解反应,反应过程中元素化合价发生了变化,属于氧化还原反应,D不符合题意。
1
2
3
4
5
5.[2023河北唐山高一期中]工业上通过反应2Al2O3+3C+6Cl2 4AlCl3+3CO2制取无水氯化铝,关于该反应下列说法正确的是( )
A.该反应中,Al元素被氧化
B.每生成1个CO2分子,转移2个电子
C.该反应中,Cl2得电子被还原
D.该反应中,C发生还原反应
C
解析 Al2O3和AlCl3中Al元素均显+3价,Al元素化合价未变化,A错误; C→CO2,C元素由0价升高到+4价,发生氧化反应,故生成1个CO2分子时转移4个电子,B、D错误;Cl2→AlCl3,Cl元素由0价降低到-1价,故Cl2得电子被还原,C正确。
本 课 结 束
