第1节 第1课时 亚铁盐和铁盐课件(共42张PPT)2023-2024学年高一化学鲁科版必修第一册
文档属性
| 名称 | 第1节 第1课时 亚铁盐和铁盐课件(共42张PPT)2023-2024学年高一化学鲁科版必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 2.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-08 16:09:51 | ||
图片预览











文档简介
(共42张PPT)
第3章 物质的性质与转化
第1节 第1课时 亚铁盐和铁盐
素 养 目 标
1.基于元素的价态和物质的所属类别,完整有序地写出含有铁元素的物质的化学式,培养宏观辨识与微观探析的化学核心素养。
2.根据生产、生活中的应用实例或通过实验探究,掌握亚铁盐和铁盐的物理性质、化学性质、典型实验现象,能书写主要的化学方程式和离子方程式,培养科学探究与创新意识的化学核心素养。
3.知道含有铁元素的物质在生产、生活中的应用,知道Fe3+的检验方法,能独立或与同学合作完成实验,记录实验现象和数据,完成实验报告,并能主动进行交流,逐步提升证据推理与模型认知的化学核心素养。
基础落实·必备知识全过关
重难探究·能力素养全提升
目 录 索 引
学以致用·随堂检测全达标
基础落实·必备知识全过关
自主梳理
一、铁元素的存在
1.含量
铁元素在地壳中的含量仅次于 、 和铝。
2.存在形态
(1)游离态:存在于 中。
(2)化合态:主要以 价铁的化合物存在。如黄铁矿( )、赤铁矿( )、磁铁矿(Fe3O4)、菱铁矿(FeCO3)等。
氧
硅
陨铁
+2、+3
FeS2
Fe2O3
二、Fe2+、Fe3+的性质
1.组成及实例
类别 亚铁盐 铁盐
组成 组成中含有 的盐 组成中含有 的盐
实例 FeSO4、FeCl2、Fe(NO3)2等 Fe2(SO4)3、FeCl3、Fe(NO3)3等
Fe2+
Fe3+
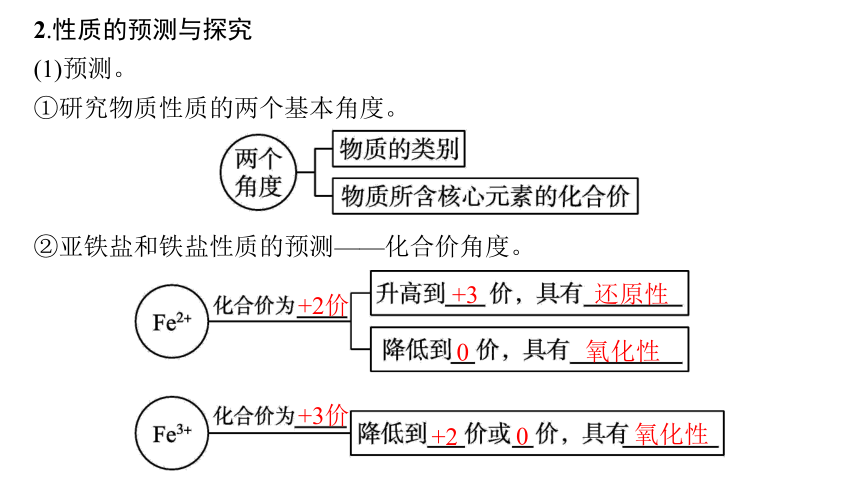
2.性质的预测与探究
(1)预测。
①研究物质性质的两个基本角度。
②亚铁盐和铁盐性质的预测——化合价角度。
+2价
+3
还原性
0
氧化性
+3价
+2
0
氧化性
(2)探究——以FeSO4、FeCl3为例。
①知识支持:Fe3+和KSCN溶液发生反应,生成 溶液。
②可供选择的试剂:FeSO4溶液、FeCl3溶液、酸性KMnO4溶液、氯水、KI溶液、0.1 mol·L-1 KSCN(硫氰酸钾)溶液、淀粉溶液、NaOH溶液、铁粉、锌片、铜片。
红色
③探究实验:
物质 预测性质 操作及现象
FeSO4 还原性 向FeSO4溶液中加入KSCN溶液, ;
再滴加氯水,
向酸性KMnO4溶液中逐滴加入FeSO4溶液至过量,酸性KMnO4溶液的
氧化性 向FeSO4溶液中加入足量锌片,溶液
FeCl3 氧化性 向FeCl3溶液中加入KSCN溶液, ;再加入足量铁粉,
向FeCl3溶液中加入KSCN溶液, ;再加入足量铜片,溶液由
向FeCl3溶液中加入KI溶液,再加入淀粉溶液,溶液
无明显现象
溶液呈红色
紫色逐渐褪去
由浅绿色变为无色
溶液变红色
红色褪去
溶液变红色
红色变为蓝色
变蓝色
④结论:
a.亚铁盐具有还原性,能被常见的氧化剂氧化,如能使酸性KMnO4溶液
,能被氯气氧化,离子方程式为 ;亚铁盐具有氧化性,能被常见的还原剂还原,如与Zn反应的离子方程式为
。
b.铁盐具有氧化性,能被常见的还原剂还原,
如与Cu反应的离子方程式为 ;
与Fe反应的离子方程式为 ;
与KI溶液反应的离子方程式为 。
褪色
2Fe2++Cl2══2Fe3++2Cl-
Fe2++Zn══Fe+Zn2+
2Fe3++Cu══2Fe2++Cu2+
2Fe3++Fe══3Fe2+
2Fe3++2I-══2Fe2++I2
【微思考1】实验室中盛FeSO4溶液的试剂瓶中,通常加些铁屑或铁钉,这是为什么
【微思考2】如何除去FeCl3溶液中混有的杂质FeCl2
提示 Fe2+具有较强还原性,易被氧化而变质。因此向盛有亚铁盐溶液的试剂瓶中加铁屑或铁钉的目的是防止Fe2+被氧化。
提示 通入Cl2或滴加氯水或加入“绿色”氧化剂H2O2溶液:
2Fe2++Cl2══2Fe3++2Cl-、2Fe2++H2O2+2H+══2H2O+2Fe3+。
自我检测
判断下列说法是否正确,正确的画“√”,错误的画“×”。
1.Fe分别与氯气和盐酸反应所得氯化物相同。( )
2.FeCl3、FeCl2和Fe(OH)3都可以通过化合反应制取。( )
3.Fe在足量Cl2中燃烧生成FeCl3,在少量Cl2中燃烧生成FeCl2。( )
4.Fe与Cl2反应生成FeCl3,推测Fe与I2反应生成FeI3。( )
5.铁表面自然形成的氧化层能保护内层金属不被空气氧化。( )
×
√
×
×
×
重难探究·能力素养全提升
问题探究
探究1 Fe2+、Fe3+的性质
在FeCl3和CuCl2的混合溶液中,加入过量的铁粉,充分反应后,溶液中的金属离子有哪些
提示 氧化性Fe3+>Cu2+,加入过量铁粉,发生反应:2Fe3++Fe══3Fe2+, Fe+Cu2+══Cu+Fe2+,则充分反应后溶液中的金属离子是Fe2+。
归纳拓展
1.铁盐、亚铁盐的性质
(1)Fe2+既具有还原性又具有氧化性,可以被氧化为Fe3+,也可以被还原为Fe。
①当Fe2+遇到强氧化剂时,被氧化为Fe3+,如2Fe2++Cl2══2Fe3++2Cl-。
②当Fe2+遇到C、Al、Zn、CO等还原剂时,在一定条件下可以被还原为Fe,如Fe2++Zn══Zn2++Fe,FeO+CO Fe+CO2。
(2)Fe3+具有较强的氧化性,可被还原为Fe2+或Fe。
①Fe3+被C、CO、Al等在一定条件下还原为Fe,
如Fe2O3+3CO 2Fe+3CO2,Fe2O3+2Al 2Fe+Al2O3。
②Fe3+被Fe、Cu等还原为Fe2+,如2Fe3++Cu══2Fe2++Cu2+。
2.含铁物质的分离与提纯
主要物质 杂质 除杂方法
Fe2+ Fe3+ 加过量铁粉后过滤
FeCl3 FeCl2 加适量氯水或双氧水
Fe2+ Cu2+ 加过量铁粉后过滤
应用体验
1.某同学用如下实验探究Fe2+、Fe3+的性质。请回答下列问题:
(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1 mol·L-1的溶液。在FeCl2溶液中需加入少量铁屑,其目的是 。
(2)甲同学取2 mL FeCl2溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化生成Fe3+。FeCl2溶液与氯水反应的离子方程式为
。
(3)乙同学认为甲同学的实验不够严谨,该同学在2 mL FeCl2溶液中先加入0.5 mL煤油,再于液面下依次加入1滴KSCN溶液和几滴氯水,溶液变红,煤油的作用是 。
(4)丙同学取10 mL 0.1 mol·L-1KI溶液,加入6 mL 0.1 mol·L-1FeCl3溶液混合。充分反应后取2 mL混合溶液置于试管中,加入1 mL CCl4(CCl4是一种有机溶剂,与水互不相溶,密度比水大)充分振荡、静置,CCl4层显紫色。写出发生反应的离子方程式: 。
(5)丁同学向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,发生反应的离子方程式为 。
答案 (1)防止Fe2+被氧化
(2)2Fe2++Cl2══2Fe3++2Cl-
(3)隔绝空气(排除氧气对实验的影响)
(4)2Fe3++2I-══2Fe2++I2
(5)H2O2+2Fe2++2H+══2Fe3++2H2O
解析 (1)铁和氯化铁反应生成氯化亚铁,在FeCl2溶液中需加入少量铁屑,其目的是防止氯化亚铁被氧化。
(2)氯气具有氧化性,能氧化氯化亚铁生成氯化铁,反应的离子方程式为2Fe2++Cl2══2Fe3++2Cl-。
(3)煤油不溶于水,密度比水小,可以隔绝空气,从而排除氧气对实验的影响。
(4)CCl4层显紫色说明有单质碘生成,发生反应的离子方程式为2Fe3++2I-══2Fe2++I2。
(5)向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,说明过氧化氢氧化亚铁离子生成铁离子,反应的离子方程式为H2O2+2Fe2++2H+══2Fe3++2H2O。
方法点拨 铁、铜及其化合物在溶液中的共存规律
(1)Fe能与Fe3+、Cu2+发生反应,因而当溶液中有Fe粉剩余时,溶液中不可能大量存在Fe3+、Cu2+。由于氧化性Fe3+>Cu2+,所以向Fe3+、Cu2+的混合溶液中加入铁粉,铁先与Fe3+反应;由于还原性Fe>Cu,所以向Fe3+的溶液中加入Fe、Cu的混合物,Fe先反应。
(2)Cu能与Fe3+发生反应,因此当有Cu析出时,溶液中不可能大量存在Fe3+。
(3)Fe2+与Fe3+、Cu2+、Fe、Cu均能大量共存。
2.[2023湖南衡阳高一期中]电子工业常用FeCl3溶液腐蚀绝缘板上的铜箔,制造印刷电路板。从腐蚀废液(主要含FeCl3、FeCl2、CuCl2)中回收铜,并重新获得FeCl3溶液。废液处理流程如下:
(1)物质A的化学式是 。
(2)取少量滤液B置于试管中,滴加NaOH溶液,产生的现象是 。
请写出此过程中属于氧化还原反应的化学方程式: 。
(3)写出步骤(Ⅱ)中生成FeCl3的离子方程式: 。
(4)将FeCl3饱和溶液滴入 中,并继续煮沸至红褐色,可制得Fe(OH)3胶体。
(5)将一定量的铜粉加入FeCl3溶液中,完全反应后,所得溶液中的Cu2+和Fe3+的物质的量恰好相等,则已反应的Fe3+和未反应的Fe3+的物质的量之比为
。
答案 (1)Fe
(2)生成的白色沉淀迅速变成灰绿色,最终变为红褐色 4Fe(OH)2+O2+2H2O══4Fe(OH)3
(3)2Fe2++Cl2══2Fe3++2Cl-
(4)沸水
(5)2∶1
解析 由流程可知,向废液(主要含FeCl3、FeCl2、CuCl2)中加入过量铁,铁与氯化铁生成氯化亚铁、与氯化铜生成铜和氯化亚铁,故过量A是铁,滤液B中含有氯化亚铁,固体中含有过量的铁和生成的铜;固体中加入过量盐酸,盐酸与铜不反应、与铁反应生成氢气和氯化亚铁,故D为氢气、滤液C中含有过量盐酸和生成的氯化亚铁;滤液B与滤液C混合后通入氯气,氯气和氯化亚铁反应得到氯化铁溶液。
(5)铜粉放入三氯化铁溶液中,发生反应:Cu+2Fe3+══2Fe2++Cu2+,假设已反应的Fe3+的物质的量为n,则有Cu+2Fe3+══2Fe2++Cu2+
2 1
n 0.5n
溶液中的Fe3+和Cu2+的物质的量浓度相等,溶液中未反应的Fe3+的物质的量为0.5n,故已反应的Fe3+和未反应的Fe3+的物质的量之比=n∶0.5n=2∶1。
问题探究
探究2 Fe2+、Fe3+的检验
某同学为了检验家中一盒补铁剂是否变质,查阅资料后结合所学知识设计了如下实验:
将药片除去糖衣研细后,溶解过滤,取滤液分别加入两支试管中,在一支试管中滴入酸性高锰酸钾溶液,在另一支试管中滴入KSCN溶液。请分析并回答下列问题。
(1)若滴入酸性高锰酸钾溶液后褪色,滴入KSCN溶液后不变红,可以得出什么结论 在滴入KSCN溶液后的溶液中再滴加氯水,会观察到什么现象
(2)若滴入酸性高锰酸钾溶液后不褪色,滴入KSCN溶液后变红,可以得出什么结论
提示 根据实验现象分析,酸性高锰酸钾溶液褪色说明有Fe2+,KSCN溶液不变红说明没有Fe3+,从而确定药品没有被氧化;在滴入KSCN溶液后的溶液中再加入氯水,会将Fe2+氧化为Fe3+,溶液变红。
提示 根据实验现象分析,酸性高锰酸钾溶液不褪色说明没有Fe2+,滴入KSCN溶液变红说明有Fe3+,从而确定药品完全被氧化而变质。
(3)①若滴入酸性高锰酸钾溶液后褪色,滴入KSCN溶液后变红,可以得出什么结论
②在①中操作后的情况下,向其中一支试管中滴加适量的氢氧化钠溶液,根据现象能证明滤液中含有Fe2+吗
提示 ①根据实验现象分析,酸性高锰酸钾溶液褪色说明有Fe2+,滴入KSCN溶液变红说明有Fe3+,从而确定药品部分被氧化;②在①中操作后的两溶液中都含有Fe3+,滴加氢氧化钠溶液立即生成红褐色沉淀,干扰“生成的白色沉淀变为灰绿色,最后变成红褐色”现象的观察,即不能证明滤液中含有Fe2+。
归纳拓展
Fe2+、Fe3+的检验方法
方法 Fe3+ Fe2+
溶液颜色 (棕)黄色 浅绿色
加碱溶液 (如NaOH 溶液) 现象 红褐色沉淀 白色沉淀→灰绿色沉淀→红褐色沉淀
离子 方程式 Fe3++3OH-══Fe(OH)3↓ Fe2++2OH-══Fe(OH)2↓
4Fe(OH)2+O2+2H2O══4Fe(OH)3
加KSCN 溶液 现象 显红色(常用方法) 无明显现象,再加氯水显红色
离子方程式 Fe3++3SCN-══Fe(SCN)3 2Fe2++Cl2══2Fe3++2Cl-
Fe3++3SCN-══Fe(SCN)3
酸性KMnO4溶液 无明显现象 紫色褪去
应用体验
1.能验证某溶液中含有Fe2+,不含Fe3+的实验事实是( )
A.向溶液中滴加KSCN溶液,溶液变红
B.向溶液中滴加KSCN溶液,无明显变化;再滴加几滴氯水,溶液变红
C.向溶液中依次滴加氯水、KSCN溶液,溶液变红
D.向溶液中滴加少量NaOH溶液,产生红褐色沉淀
B
解析 向溶液中滴加KSCN溶液,溶液变红说明含Fe3+,A错误;向溶液中滴加KSCN溶液,无明显变化,说明不含Fe3+,再滴加几滴氯水,溶液变红,说明Fe2+被氯单质氧化为Fe3+,B正确;氯水能把Fe2+氧化为Fe3+,向溶液中依次滴加氯水、KSCN溶液,溶液变红,说明溶液中含有Fe2+或Fe3+或二者都有,C错误;Fe3+和OH-反应生成红褐色氢氧化铁沉淀,向溶液中滴加少量NaOH溶液,产生红褐色沉淀,证明含有Fe3+,D错误。
方法规律 (1)Fe3+的检验方法很多,但在没有特殊要求的条件下,最好选择KSCN溶液,因为此法最灵敏。
(2)检验Fe2+的最好方法:加KSCN溶液(无明显现象),然后加氯水(溶液变红色)。试剂顺序不能颠倒,若先滴入氯水,再加入KSCN溶液,溶液显红色,排除不了原溶液中可能含Fe3+的干扰。也不能选用加KSCN溶液(无明显现象),然后加酸性高锰酸钾溶液(溶液变红色)的方案,因为KMnO4本身显紫色,对实验现象有所干扰。
(3)若溶液中同时含有Fe3+、Fe2+,因为Fe3+对Fe2+的检验造成干扰,通常取少量溶液置于试管中,向溶液中滴加适量酸性高锰酸钾溶液(或溴水),溶液紫色(或橙黄色)褪去,说明含有Fe2+。另取少量溶液置于试管中加入KSCN溶液,显红色,说明溶液中含Fe3+。
2.选择合适试剂完成甲、乙两组实验。
甲组:检验含Fe3+的溶液中是否含有Fe2+;
乙组:检验含Fe2+的溶液中是否含有Fe3+。
下列试剂及加入试剂顺序能达到实验目的的是( )
选项 甲组 乙组
A 新制氯水、KSCN溶液 NaOH溶液
B 酸性KMnO4溶液 KSCN溶液
C KOH溶液 溴水
D 溴水 酸性KMnO4溶液
B
解析 甲组,在Fe3+存在的条件下检验Fe2+,要排除Fe3+的干扰。所选试剂具备下列条件:一是能与Fe2+发生有明显现象的反应;二是与Fe3+不反应。只有酸性KMnO4溶液符合条件:5Fe2++ +8H+══5Fe3++Mn2++4H2O,实验现象是紫色变浅(或褪去)。乙组,在Fe2+存在的条件下,用KSCN溶液检验Fe3+,Fe2+无干扰。
学以致用·随堂检测全达标
1
2
3
4
1.电子工业中利用FeCl3溶液作为“腐蚀液”制作印刷电路板,检验浸泡过覆铜板的“腐蚀液”中是否有Fe3+剩余,可选用的试剂是( )
A.氯水 B.酸性KMnO4溶液
C.KSCN溶液 D.H2O2溶液
C
解析 检验“腐蚀液”中是否有Fe3+剩余,可滴加KSCN溶液,若溶液变为红色,说明有Fe3+剩余,若不变色,则Fe3+没有剩余。
1
2
3
4
2.把一定量的铁粉、铜粉置于盛有FeCl3溶液的烧杯中,充分反应后加入KSCN溶液无明显现象,下列情况不能成立的是( )
A.烧杯中无铁粉剩余,有铜粉剩余
B.烧杯中铁粉、铜粉均剩余
C.烧杯中铁粉剩余,溶液中含Cu2+
D.烧杯中铜粉剩余,溶液中含Fe2+
C
1
2
3
4
解析 充分反应后加入硫氰酸钾溶液无明显现象,说明没有铁离子。铁首先与氯化铁反应生成氯化亚铁,FeCl3还有剩余时铜和氯化铁反应生成氯化亚铁和氯化铜。所以可能无铁粉剩余,但有铜粉剩余,故A正确;若氯化铁很少时,铁和铜都可以有剩余,故B正确;铁粉有剩余时,溶液中不存在铜离子,故C错误;根据上述分析可知,可能有铜粉剩余,溶液中进行的反应中都产生亚铁离子,所以一定有亚铁离子,故D正确。
1
2
3
4
3.将铁粉放入盐酸、MgCl2溶液、FeCl3溶液、CuCl2溶液组成的混合液中,充分反应后,铁粉有剩余,则此时溶液中含有的大量阳离子是( )
A.Cu2+和Fe2+ B.Fe2+和Mg2+
C.Fe3+和Fe2+ D.H+和Cu2+
B
解析 混合溶液中加入铁粉发生如下反应:2H++Fe══Fe2++H2↑, 2Fe3++Fe══3Fe2+,Cu2++Fe══Fe2++Cu,由于铁粉有剩余,故此时溶液中阳离子主要有Mg2+和Fe2+。
1
2
3
4
4.[2023湖北鄂州高一期中]为探究某食品包装袋内一小包脱氧剂中的还原铁粉是否变质,分别取少量样品溶于盐酸,再进行下列实验,其结论正确的是( )
A.滴加KSCN溶液,溶液变红,说明铁粉变质
B.滴加KSCN溶液,溶液未变红,说明铁粉未变质
C.依次滴加氯水、KSCN溶液,溶液变红,说明铁粉全部变质
D.滴加KSCN溶液,溶液未变红,再滴加氯水,溶液变红,说明铁粉全部变质
A
1
2
3
4
解析 取少量样品溶于盐酸,滴加KSCN溶液,溶液变红,则含有Fe3+,说明铁粉变质,A正确;滴加KSCN溶液,溶液未变红,则不含Fe3+,但还原铁粉有可能被氧化为Fe2+,B错误;依次滴加氯水、KSCN溶液,溶液变红,不能判断铁粉是否全部变质,C错误;滴加KSCN溶液,溶液未变红,再滴加氯水,溶液变红,说明溶液中含有Fe2+,Fe2+可能是Fe与盐酸反应产生的,D错误。
本 课 结 束
第3章 物质的性质与转化
第1节 第1课时 亚铁盐和铁盐
素 养 目 标
1.基于元素的价态和物质的所属类别,完整有序地写出含有铁元素的物质的化学式,培养宏观辨识与微观探析的化学核心素养。
2.根据生产、生活中的应用实例或通过实验探究,掌握亚铁盐和铁盐的物理性质、化学性质、典型实验现象,能书写主要的化学方程式和离子方程式,培养科学探究与创新意识的化学核心素养。
3.知道含有铁元素的物质在生产、生活中的应用,知道Fe3+的检验方法,能独立或与同学合作完成实验,记录实验现象和数据,完成实验报告,并能主动进行交流,逐步提升证据推理与模型认知的化学核心素养。
基础落实·必备知识全过关
重难探究·能力素养全提升
目 录 索 引
学以致用·随堂检测全达标
基础落实·必备知识全过关
自主梳理
一、铁元素的存在
1.含量
铁元素在地壳中的含量仅次于 、 和铝。
2.存在形态
(1)游离态:存在于 中。
(2)化合态:主要以 价铁的化合物存在。如黄铁矿( )、赤铁矿( )、磁铁矿(Fe3O4)、菱铁矿(FeCO3)等。
氧
硅
陨铁
+2、+3
FeS2
Fe2O3
二、Fe2+、Fe3+的性质
1.组成及实例
类别 亚铁盐 铁盐
组成 组成中含有 的盐 组成中含有 的盐
实例 FeSO4、FeCl2、Fe(NO3)2等 Fe2(SO4)3、FeCl3、Fe(NO3)3等
Fe2+
Fe3+
2.性质的预测与探究
(1)预测。
①研究物质性质的两个基本角度。
②亚铁盐和铁盐性质的预测——化合价角度。
+2价
+3
还原性
0
氧化性
+3价
+2
0
氧化性
(2)探究——以FeSO4、FeCl3为例。
①知识支持:Fe3+和KSCN溶液发生反应,生成 溶液。
②可供选择的试剂:FeSO4溶液、FeCl3溶液、酸性KMnO4溶液、氯水、KI溶液、0.1 mol·L-1 KSCN(硫氰酸钾)溶液、淀粉溶液、NaOH溶液、铁粉、锌片、铜片。
红色
③探究实验:
物质 预测性质 操作及现象
FeSO4 还原性 向FeSO4溶液中加入KSCN溶液, ;
再滴加氯水,
向酸性KMnO4溶液中逐滴加入FeSO4溶液至过量,酸性KMnO4溶液的
氧化性 向FeSO4溶液中加入足量锌片,溶液
FeCl3 氧化性 向FeCl3溶液中加入KSCN溶液, ;再加入足量铁粉,
向FeCl3溶液中加入KSCN溶液, ;再加入足量铜片,溶液由
向FeCl3溶液中加入KI溶液,再加入淀粉溶液,溶液
无明显现象
溶液呈红色
紫色逐渐褪去
由浅绿色变为无色
溶液变红色
红色褪去
溶液变红色
红色变为蓝色
变蓝色
④结论:
a.亚铁盐具有还原性,能被常见的氧化剂氧化,如能使酸性KMnO4溶液
,能被氯气氧化,离子方程式为 ;亚铁盐具有氧化性,能被常见的还原剂还原,如与Zn反应的离子方程式为
。
b.铁盐具有氧化性,能被常见的还原剂还原,
如与Cu反应的离子方程式为 ;
与Fe反应的离子方程式为 ;
与KI溶液反应的离子方程式为 。
褪色
2Fe2++Cl2══2Fe3++2Cl-
Fe2++Zn══Fe+Zn2+
2Fe3++Cu══2Fe2++Cu2+
2Fe3++Fe══3Fe2+
2Fe3++2I-══2Fe2++I2
【微思考1】实验室中盛FeSO4溶液的试剂瓶中,通常加些铁屑或铁钉,这是为什么
【微思考2】如何除去FeCl3溶液中混有的杂质FeCl2
提示 Fe2+具有较强还原性,易被氧化而变质。因此向盛有亚铁盐溶液的试剂瓶中加铁屑或铁钉的目的是防止Fe2+被氧化。
提示 通入Cl2或滴加氯水或加入“绿色”氧化剂H2O2溶液:
2Fe2++Cl2══2Fe3++2Cl-、2Fe2++H2O2+2H+══2H2O+2Fe3+。
自我检测
判断下列说法是否正确,正确的画“√”,错误的画“×”。
1.Fe分别与氯气和盐酸反应所得氯化物相同。( )
2.FeCl3、FeCl2和Fe(OH)3都可以通过化合反应制取。( )
3.Fe在足量Cl2中燃烧生成FeCl3,在少量Cl2中燃烧生成FeCl2。( )
4.Fe与Cl2反应生成FeCl3,推测Fe与I2反应生成FeI3。( )
5.铁表面自然形成的氧化层能保护内层金属不被空气氧化。( )
×
√
×
×
×
重难探究·能力素养全提升
问题探究
探究1 Fe2+、Fe3+的性质
在FeCl3和CuCl2的混合溶液中,加入过量的铁粉,充分反应后,溶液中的金属离子有哪些
提示 氧化性Fe3+>Cu2+,加入过量铁粉,发生反应:2Fe3++Fe══3Fe2+, Fe+Cu2+══Cu+Fe2+,则充分反应后溶液中的金属离子是Fe2+。
归纳拓展
1.铁盐、亚铁盐的性质
(1)Fe2+既具有还原性又具有氧化性,可以被氧化为Fe3+,也可以被还原为Fe。
①当Fe2+遇到强氧化剂时,被氧化为Fe3+,如2Fe2++Cl2══2Fe3++2Cl-。
②当Fe2+遇到C、Al、Zn、CO等还原剂时,在一定条件下可以被还原为Fe,如Fe2++Zn══Zn2++Fe,FeO+CO Fe+CO2。
(2)Fe3+具有较强的氧化性,可被还原为Fe2+或Fe。
①Fe3+被C、CO、Al等在一定条件下还原为Fe,
如Fe2O3+3CO 2Fe+3CO2,Fe2O3+2Al 2Fe+Al2O3。
②Fe3+被Fe、Cu等还原为Fe2+,如2Fe3++Cu══2Fe2++Cu2+。
2.含铁物质的分离与提纯
主要物质 杂质 除杂方法
Fe2+ Fe3+ 加过量铁粉后过滤
FeCl3 FeCl2 加适量氯水或双氧水
Fe2+ Cu2+ 加过量铁粉后过滤
应用体验
1.某同学用如下实验探究Fe2+、Fe3+的性质。请回答下列问题:
(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1 mol·L-1的溶液。在FeCl2溶液中需加入少量铁屑,其目的是 。
(2)甲同学取2 mL FeCl2溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化生成Fe3+。FeCl2溶液与氯水反应的离子方程式为
。
(3)乙同学认为甲同学的实验不够严谨,该同学在2 mL FeCl2溶液中先加入0.5 mL煤油,再于液面下依次加入1滴KSCN溶液和几滴氯水,溶液变红,煤油的作用是 。
(4)丙同学取10 mL 0.1 mol·L-1KI溶液,加入6 mL 0.1 mol·L-1FeCl3溶液混合。充分反应后取2 mL混合溶液置于试管中,加入1 mL CCl4(CCl4是一种有机溶剂,与水互不相溶,密度比水大)充分振荡、静置,CCl4层显紫色。写出发生反应的离子方程式: 。
(5)丁同学向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,发生反应的离子方程式为 。
答案 (1)防止Fe2+被氧化
(2)2Fe2++Cl2══2Fe3++2Cl-
(3)隔绝空气(排除氧气对实验的影响)
(4)2Fe3++2I-══2Fe2++I2
(5)H2O2+2Fe2++2H+══2Fe3++2H2O
解析 (1)铁和氯化铁反应生成氯化亚铁,在FeCl2溶液中需加入少量铁屑,其目的是防止氯化亚铁被氧化。
(2)氯气具有氧化性,能氧化氯化亚铁生成氯化铁,反应的离子方程式为2Fe2++Cl2══2Fe3++2Cl-。
(3)煤油不溶于水,密度比水小,可以隔绝空气,从而排除氧气对实验的影响。
(4)CCl4层显紫色说明有单质碘生成,发生反应的离子方程式为2Fe3++2I-══2Fe2++I2。
(5)向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,说明过氧化氢氧化亚铁离子生成铁离子,反应的离子方程式为H2O2+2Fe2++2H+══2Fe3++2H2O。
方法点拨 铁、铜及其化合物在溶液中的共存规律
(1)Fe能与Fe3+、Cu2+发生反应,因而当溶液中有Fe粉剩余时,溶液中不可能大量存在Fe3+、Cu2+。由于氧化性Fe3+>Cu2+,所以向Fe3+、Cu2+的混合溶液中加入铁粉,铁先与Fe3+反应;由于还原性Fe>Cu,所以向Fe3+的溶液中加入Fe、Cu的混合物,Fe先反应。
(2)Cu能与Fe3+发生反应,因此当有Cu析出时,溶液中不可能大量存在Fe3+。
(3)Fe2+与Fe3+、Cu2+、Fe、Cu均能大量共存。
2.[2023湖南衡阳高一期中]电子工业常用FeCl3溶液腐蚀绝缘板上的铜箔,制造印刷电路板。从腐蚀废液(主要含FeCl3、FeCl2、CuCl2)中回收铜,并重新获得FeCl3溶液。废液处理流程如下:
(1)物质A的化学式是 。
(2)取少量滤液B置于试管中,滴加NaOH溶液,产生的现象是 。
请写出此过程中属于氧化还原反应的化学方程式: 。
(3)写出步骤(Ⅱ)中生成FeCl3的离子方程式: 。
(4)将FeCl3饱和溶液滴入 中,并继续煮沸至红褐色,可制得Fe(OH)3胶体。
(5)将一定量的铜粉加入FeCl3溶液中,完全反应后,所得溶液中的Cu2+和Fe3+的物质的量恰好相等,则已反应的Fe3+和未反应的Fe3+的物质的量之比为
。
答案 (1)Fe
(2)生成的白色沉淀迅速变成灰绿色,最终变为红褐色 4Fe(OH)2+O2+2H2O══4Fe(OH)3
(3)2Fe2++Cl2══2Fe3++2Cl-
(4)沸水
(5)2∶1
解析 由流程可知,向废液(主要含FeCl3、FeCl2、CuCl2)中加入过量铁,铁与氯化铁生成氯化亚铁、与氯化铜生成铜和氯化亚铁,故过量A是铁,滤液B中含有氯化亚铁,固体中含有过量的铁和生成的铜;固体中加入过量盐酸,盐酸与铜不反应、与铁反应生成氢气和氯化亚铁,故D为氢气、滤液C中含有过量盐酸和生成的氯化亚铁;滤液B与滤液C混合后通入氯气,氯气和氯化亚铁反应得到氯化铁溶液。
(5)铜粉放入三氯化铁溶液中,发生反应:Cu+2Fe3+══2Fe2++Cu2+,假设已反应的Fe3+的物质的量为n,则有Cu+2Fe3+══2Fe2++Cu2+
2 1
n 0.5n
溶液中的Fe3+和Cu2+的物质的量浓度相等,溶液中未反应的Fe3+的物质的量为0.5n,故已反应的Fe3+和未反应的Fe3+的物质的量之比=n∶0.5n=2∶1。
问题探究
探究2 Fe2+、Fe3+的检验
某同学为了检验家中一盒补铁剂是否变质,查阅资料后结合所学知识设计了如下实验:
将药片除去糖衣研细后,溶解过滤,取滤液分别加入两支试管中,在一支试管中滴入酸性高锰酸钾溶液,在另一支试管中滴入KSCN溶液。请分析并回答下列问题。
(1)若滴入酸性高锰酸钾溶液后褪色,滴入KSCN溶液后不变红,可以得出什么结论 在滴入KSCN溶液后的溶液中再滴加氯水,会观察到什么现象
(2)若滴入酸性高锰酸钾溶液后不褪色,滴入KSCN溶液后变红,可以得出什么结论
提示 根据实验现象分析,酸性高锰酸钾溶液褪色说明有Fe2+,KSCN溶液不变红说明没有Fe3+,从而确定药品没有被氧化;在滴入KSCN溶液后的溶液中再加入氯水,会将Fe2+氧化为Fe3+,溶液变红。
提示 根据实验现象分析,酸性高锰酸钾溶液不褪色说明没有Fe2+,滴入KSCN溶液变红说明有Fe3+,从而确定药品完全被氧化而变质。
(3)①若滴入酸性高锰酸钾溶液后褪色,滴入KSCN溶液后变红,可以得出什么结论
②在①中操作后的情况下,向其中一支试管中滴加适量的氢氧化钠溶液,根据现象能证明滤液中含有Fe2+吗
提示 ①根据实验现象分析,酸性高锰酸钾溶液褪色说明有Fe2+,滴入KSCN溶液变红说明有Fe3+,从而确定药品部分被氧化;②在①中操作后的两溶液中都含有Fe3+,滴加氢氧化钠溶液立即生成红褐色沉淀,干扰“生成的白色沉淀变为灰绿色,最后变成红褐色”现象的观察,即不能证明滤液中含有Fe2+。
归纳拓展
Fe2+、Fe3+的检验方法
方法 Fe3+ Fe2+
溶液颜色 (棕)黄色 浅绿色
加碱溶液 (如NaOH 溶液) 现象 红褐色沉淀 白色沉淀→灰绿色沉淀→红褐色沉淀
离子 方程式 Fe3++3OH-══Fe(OH)3↓ Fe2++2OH-══Fe(OH)2↓
4Fe(OH)2+O2+2H2O══4Fe(OH)3
加KSCN 溶液 现象 显红色(常用方法) 无明显现象,再加氯水显红色
离子方程式 Fe3++3SCN-══Fe(SCN)3 2Fe2++Cl2══2Fe3++2Cl-
Fe3++3SCN-══Fe(SCN)3
酸性KMnO4溶液 无明显现象 紫色褪去
应用体验
1.能验证某溶液中含有Fe2+,不含Fe3+的实验事实是( )
A.向溶液中滴加KSCN溶液,溶液变红
B.向溶液中滴加KSCN溶液,无明显变化;再滴加几滴氯水,溶液变红
C.向溶液中依次滴加氯水、KSCN溶液,溶液变红
D.向溶液中滴加少量NaOH溶液,产生红褐色沉淀
B
解析 向溶液中滴加KSCN溶液,溶液变红说明含Fe3+,A错误;向溶液中滴加KSCN溶液,无明显变化,说明不含Fe3+,再滴加几滴氯水,溶液变红,说明Fe2+被氯单质氧化为Fe3+,B正确;氯水能把Fe2+氧化为Fe3+,向溶液中依次滴加氯水、KSCN溶液,溶液变红,说明溶液中含有Fe2+或Fe3+或二者都有,C错误;Fe3+和OH-反应生成红褐色氢氧化铁沉淀,向溶液中滴加少量NaOH溶液,产生红褐色沉淀,证明含有Fe3+,D错误。
方法规律 (1)Fe3+的检验方法很多,但在没有特殊要求的条件下,最好选择KSCN溶液,因为此法最灵敏。
(2)检验Fe2+的最好方法:加KSCN溶液(无明显现象),然后加氯水(溶液变红色)。试剂顺序不能颠倒,若先滴入氯水,再加入KSCN溶液,溶液显红色,排除不了原溶液中可能含Fe3+的干扰。也不能选用加KSCN溶液(无明显现象),然后加酸性高锰酸钾溶液(溶液变红色)的方案,因为KMnO4本身显紫色,对实验现象有所干扰。
(3)若溶液中同时含有Fe3+、Fe2+,因为Fe3+对Fe2+的检验造成干扰,通常取少量溶液置于试管中,向溶液中滴加适量酸性高锰酸钾溶液(或溴水),溶液紫色(或橙黄色)褪去,说明含有Fe2+。另取少量溶液置于试管中加入KSCN溶液,显红色,说明溶液中含Fe3+。
2.选择合适试剂完成甲、乙两组实验。
甲组:检验含Fe3+的溶液中是否含有Fe2+;
乙组:检验含Fe2+的溶液中是否含有Fe3+。
下列试剂及加入试剂顺序能达到实验目的的是( )
选项 甲组 乙组
A 新制氯水、KSCN溶液 NaOH溶液
B 酸性KMnO4溶液 KSCN溶液
C KOH溶液 溴水
D 溴水 酸性KMnO4溶液
B
解析 甲组,在Fe3+存在的条件下检验Fe2+,要排除Fe3+的干扰。所选试剂具备下列条件:一是能与Fe2+发生有明显现象的反应;二是与Fe3+不反应。只有酸性KMnO4溶液符合条件:5Fe2++ +8H+══5Fe3++Mn2++4H2O,实验现象是紫色变浅(或褪去)。乙组,在Fe2+存在的条件下,用KSCN溶液检验Fe3+,Fe2+无干扰。
学以致用·随堂检测全达标
1
2
3
4
1.电子工业中利用FeCl3溶液作为“腐蚀液”制作印刷电路板,检验浸泡过覆铜板的“腐蚀液”中是否有Fe3+剩余,可选用的试剂是( )
A.氯水 B.酸性KMnO4溶液
C.KSCN溶液 D.H2O2溶液
C
解析 检验“腐蚀液”中是否有Fe3+剩余,可滴加KSCN溶液,若溶液变为红色,说明有Fe3+剩余,若不变色,则Fe3+没有剩余。
1
2
3
4
2.把一定量的铁粉、铜粉置于盛有FeCl3溶液的烧杯中,充分反应后加入KSCN溶液无明显现象,下列情况不能成立的是( )
A.烧杯中无铁粉剩余,有铜粉剩余
B.烧杯中铁粉、铜粉均剩余
C.烧杯中铁粉剩余,溶液中含Cu2+
D.烧杯中铜粉剩余,溶液中含Fe2+
C
1
2
3
4
解析 充分反应后加入硫氰酸钾溶液无明显现象,说明没有铁离子。铁首先与氯化铁反应生成氯化亚铁,FeCl3还有剩余时铜和氯化铁反应生成氯化亚铁和氯化铜。所以可能无铁粉剩余,但有铜粉剩余,故A正确;若氯化铁很少时,铁和铜都可以有剩余,故B正确;铁粉有剩余时,溶液中不存在铜离子,故C错误;根据上述分析可知,可能有铜粉剩余,溶液中进行的反应中都产生亚铁离子,所以一定有亚铁离子,故D正确。
1
2
3
4
3.将铁粉放入盐酸、MgCl2溶液、FeCl3溶液、CuCl2溶液组成的混合液中,充分反应后,铁粉有剩余,则此时溶液中含有的大量阳离子是( )
A.Cu2+和Fe2+ B.Fe2+和Mg2+
C.Fe3+和Fe2+ D.H+和Cu2+
B
解析 混合溶液中加入铁粉发生如下反应:2H++Fe══Fe2++H2↑, 2Fe3++Fe══3Fe2+,Cu2++Fe══Fe2++Cu,由于铁粉有剩余,故此时溶液中阳离子主要有Mg2+和Fe2+。
1
2
3
4
4.[2023湖北鄂州高一期中]为探究某食品包装袋内一小包脱氧剂中的还原铁粉是否变质,分别取少量样品溶于盐酸,再进行下列实验,其结论正确的是( )
A.滴加KSCN溶液,溶液变红,说明铁粉变质
B.滴加KSCN溶液,溶液未变红,说明铁粉未变质
C.依次滴加氯水、KSCN溶液,溶液变红,说明铁粉全部变质
D.滴加KSCN溶液,溶液未变红,再滴加氯水,溶液变红,说明铁粉全部变质
A
1
2
3
4
解析 取少量样品溶于盐酸,滴加KSCN溶液,溶液变红,则含有Fe3+,说明铁粉变质,A正确;滴加KSCN溶液,溶液未变红,则不含Fe3+,但还原铁粉有可能被氧化为Fe2+,B错误;依次滴加氯水、KSCN溶液,溶液变红,不能判断铁粉是否全部变质,C错误;滴加KSCN溶液,溶液未变红,再滴加氯水,溶液变红,说明溶液中含有Fe2+,Fe2+可能是Fe与盐酸反应产生的,D错误。
本 课 结 束
