第1节 第2课时 铁、铁的氧化物和铁的氢氧化物课件(共31张PPT)2023-2024学年高一化学鲁科版必修第一册
文档属性
| 名称 | 第1节 第2课时 铁、铁的氧化物和铁的氢氧化物课件(共31张PPT)2023-2024学年高一化学鲁科版必修第一册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 2.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-08 16:12:41 | ||
图片预览










文档简介
(共31张PPT)
第3章 物质的性质与转化
第1节 第2课时 铁、铁的氧化物和铁的氢氧化物
素 养 目 标
1.根据生产、生活中的应用实例或通过实验探究,培养宏观辨识与微观探析的化学核心素养。
2.能通过实验探究和交流研讨,掌握Fe、FeO、Fe2O3、Fe(OH)2、Fe(OH)3的性质及典型实验现象,能书写主要的化学方程式和离子方程式。能主动进行交流,逐步提升科学探究与创新意识。
3.通过从物质类别和元素价态两个角度研究物质性质的思路和方法去认识含铁物质在生产、生活中的应用,建立含铁物质的性质、实验现象、应用之间的联系,提升科学态度与社会责任。
基础落实·必备知识全过关
重难探究·能力素养全提升
目 录 索 引
学以致用·随堂检测全达标
基础落实·必备知识全过关
自主梳理
一、铁单质的性质
1.物理性质
铁单质为光亮的 色金属,密度较大,熔点为1 538 ℃,纯铁有很强的抗腐蚀能力。有良好的 性和 性,导电性比铜、铝差,能被磁铁吸引。
银白
延展
导热
2.化学性质 Fe具有较强的还原性
反应类型 化学方程式或离子方程式
Fe与非金属单质反应 3Fe+2O2 、2Fe+3Cl2
Fe与水蒸气反应
Fe与非氧化性酸反应 Fe+2H+══Fe2++H2↑
Fe与盐溶液反应 Fe+Cu2+══ 、
Fe+2Fe3+══
铝热反应
Fe3O4
2FeCl3
3Fe+4H2O(g) Fe3O4+4H2
Cu+Fe2+
3Fe2+
2Al+Fe2O3 2Fe+Al2O3
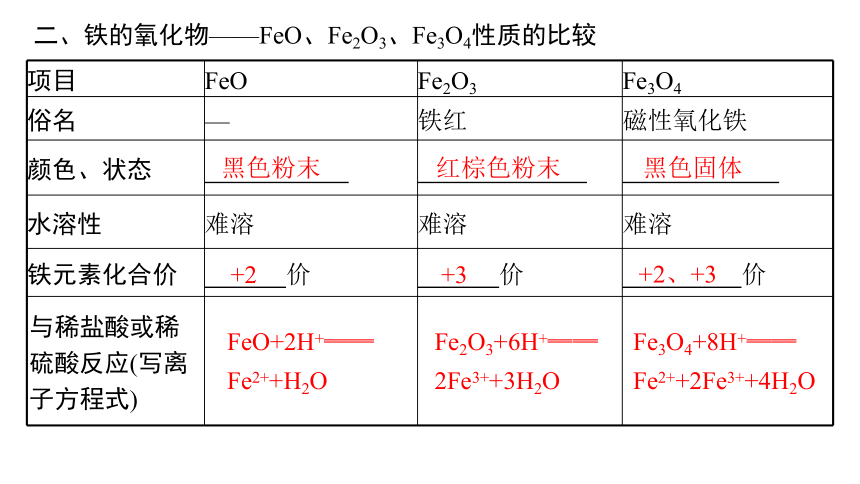
二、铁的氧化物——FeO、Fe2O3、Fe3O4性质的比较
项目 FeO Fe2O3 Fe3O4
俗名 — 铁红 磁性氧化铁
颜色、状态
水溶性 难溶 难溶 难溶
铁元素化合价 价 价 价
与稀盐酸或稀硫酸反应(写离子方程式)
黑色粉末
红棕色粉末
黑色固体
+2
+3
+2、+3
FeO+2H+══
Fe2++H2O
Fe2O3+6H+══
2Fe3++3H2O
Fe3O4+8H+══
Fe2++2Fe3++4H2O
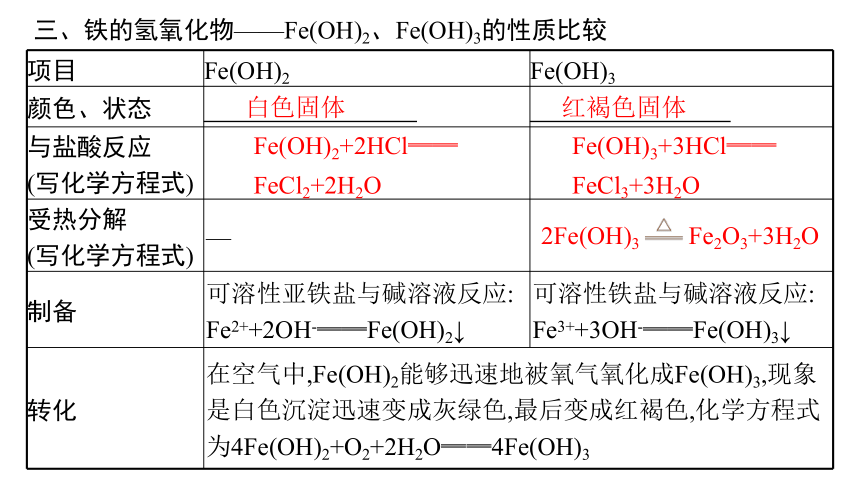
三、铁的氢氧化物——Fe(OH)2、Fe(OH)3的性质比较
项目 Fe(OH)2 Fe(OH)3
颜色、状态
与盐酸反应 (写化学方程式)
受热分解 (写化学方程式) —
制备 可溶性亚铁盐与碱溶液反应: Fe2++2OH-══Fe(OH)2↓ 可溶性铁盐与碱溶液反应:
Fe3++3OH-══Fe(OH)3↓
转化 在空气中,Fe(OH)2能够迅速地被氧气氧化成Fe(OH)3,现象是白色沉淀迅速变成灰绿色,最后变成红褐色,化学方程式为4Fe(OH)2+O2+2H2O══4Fe(OH)3
白色固体
红褐色固体
Fe(OH)2+2HCl══
FeCl2+2H2O
Fe(OH)3+3HCl══
FeCl3+3H2O
2Fe(OH)3 Fe2O3+3H2O
【微思考1】已知2Fe+3Cl2 2FeCl3和Fe+S FeS,请判断Cl2与硫单质氧化性的强弱
【微思考2】指出铁与水蒸气的反应、铝热反应中的氧化剂和还原剂。
提示 Cl2能将Fe氧化为+3价,硫单质只能将Fe氧化为+2价,说明Cl2的氧化性强于单质硫。
提示 铁与水蒸气的反应中铁做还原剂,水做氧化剂,说明铁具有还原性。铝热反应中铝做还原剂,氧化铁做氧化剂,说明氧化铁具有氧化性。
自我检测
判断下列说法是否正确,正确的画“√”,错误的画“×”。
1.Fe3O4是一种纯净物,而不是Fe2O3和FeO组成的混合物。( )
2.赤铁矿的主要成分是Fe3O4,磁铁矿的主要成分是Fe2O3,FeO俗称铁红。
( )
3.Fe3O4、FeO遇非氧化性酸(如盐酸、稀硫酸)发生非氧化还原反应。( )
4.Fe(OH)2在空气中加热得到FeO。( )
5.Fe3O4只有氧化性,没有还原性。( )
6.Fe2O3不可与水反应得到Fe(OH)3,所以不能通过化合反应制取Fe(OH)3。
( )
7.铁的氧化物都不溶于水,也不与水反应。( )
√
×
√
×
×
×
√
重难探究·能力素养全提升
问题探究
探究1 铁的性质
在课堂分组实验中,小明同学不小心将少量铁粉混入铜粉中。小明同学欲将混合物遗弃,被小兵同学阻止,小兵运用所学知识成功将少量铁粉除去。除去铜粉中混有的铁粉,可选用FeCl3溶液吗 若不可以,可以选用什么试剂 另外还可以用什么方法
提示 由于FeCl3溶液不仅与Fe反应,而且能与Cu反应,故不可以用FeCl3溶液除去铜粉中混有的铁粉;H2SO4和CuSO4溶液均与Fe反应而不与Cu反应,故可用H2SO4或CuSO4溶液除去铜粉中混有的铁粉。另外,铁能被磁铁吸引而铜不会,故也可用磁铁吸出铁粉。
归纳拓展
(1)常温下,Fe与H2O不反应。但在水、空气中的O2等的共同作用下,Fe很容易被腐蚀。铁不能与热水反应,但在高温下,Fe能与H2O(g)反应:
3Fe+4H2O(g) Fe3O4+4H2。
(2)铁单质中铁元素的化合价为0价,铁单质具有还原性,能与具有氧化性的物质发生反应。
(3)Fe只具有还原性,可以被氧化剂氧化为Fe2+、Fe3+。
①Fe能被I2、S、Fe3+、Cu2+、H+等氧化剂氧化为Fe2+,
如Fe+S FeS,Fe+2Fe3+══3Fe2+。
②Fe能被Cl2等强氧化剂氧化为Fe3+,如2Fe+3Cl2 2FeCl3。
应用体验
1.把铁粉放入下列溶液中,铁粉溶解,溶液质量减小,但没有气体放出的是
( )
A.稀硫酸 B.NaHSO4溶液
C.CuSO4溶液 D.NaCl溶液
C
解析 Fe与稀硫酸发生的反应为Fe+H2SO4══FeSO4+H2↑,铁粉溶解,溶液的质量增加,有气体放出,A不符合题意;NaHSO4溶液中有大量H+存在,加入铁粉可反应生成FeSO4和H2,有气体放出,B不符合题意;Fe与CuSO4溶液发生的反应为Fe+CuSO4══FeSO4+Cu,溶解56 g Fe的同时析出64 g Cu,则溶液的质量减小,且不产生气体,C符合题意;把Fe投入NaCl溶液中,Fe不会溶解,D不符合题意。
【变式设问】
若将铁粉投入AgNO3溶液中,铁粉和溶液的质量会发生怎样变化 写出反应的离子方程式。
提示 铁粉质量减小,溶液质量减小;Fe+2Ag+══Fe2++2Ag。
2.常温下,将铁片放入下列溶液中,不发生反应的是( )
A.稀硫酸 B.CH3COOH溶液
C.氢氧化钠溶液 D.硫酸铜溶液
C
解析 铁能与稀硫酸、CH3COOH溶液等酸溶液反应,也能与不活泼的金属的盐溶液反应,如Fe能与CuSO4溶液等发生反应,Fe不能与NaOH溶液反应。
问题探究
探究2 铁的氧化物、氢氧化物的性质
在学习铁及其化合物的性质时,同学们做了以下两个实验。已知苯是一种不溶于水的有机溶剂,密度比水的小。
(1)图甲实验中生成的产物是Fe3O4,可以写成FeO·Fe2O3的形式,那么Fe3O4是混合物吗
(2)图乙实验中制取的Fe(OH)2为什么能进行较长时间的观察
提示 不是。尽管Fe3O4中铁元素的化合价为+2价和+3价,可以写成FeO·Fe2O3的形式,但Fe3O4是一种化合物而非混合物。
提示 苯浮在盐溶液上层隔绝了空气,使生成的Fe(OH)2难以被氧化。
归纳拓展
(1)Fe3O4是一种纯净物,而不是Fe2O3和FeO组成的混合物。能通过化合反应制得Fe(OH)3:Fe(OH)2、O2和H2O反应生成Fe(OH)3。
(2)铁是典型的变价金属元素,常见价态有0价、+2价、+3价,其氧化物FeO、Fe2O3和Fe3O4都难溶于水,Fe(OH)2和Fe(OH)3都是难溶于水的弱碱。
(3)Fe3O4、FeO遇非氧化性酸(如盐酸、稀硫酸)发生非氧化还原反应;遇强氧化性酸(如HNO3)发生氧化还原反应,+2价的铁均被氧化成+3价。
(4)Fe(OH)2在空气中加热不能得到FeO,因Fe(OH)2在空气中易被氧化。在空气中,Fe(OH)2能够非常迅速地被氧气氧化成
Fe(OH)3,反应的化学方程式为4Fe(OH)2+O2+2H2O══4Fe(OH)3。
(5)由亚铁盐与铁盐制备Fe(OH)2和Fe(OH)3:
FeCl2+2NaOH══Fe(OH)2↓+2NaCl,FeCl3+3NaOH══Fe(OH)3↓+3NaCl。
应用体验
1.如图为Fe(OH)2制备实验的改进装置,使用该装置将能在较长时间内观察到白色沉淀。关于此实验,下列说法正确的是( )
A.装入药品后应关闭止水夹,等反应完成后再打开止水夹
B.此装置是通过H2的排出使A中压强减小,
从而将B中的烧碱溶液吸入A中产生
Fe(OH)2
C.H2的作用是排尽装置内的空气并将A中溶液压入B中
D.在药品用量上稀硫酸应过量,使铁粉能充分反应完
C
解析 装入药品后应该打开止水夹,让铁与稀硫酸反应生成的氢气将装置中的空气排净,避免后来生成的氢氧化亚铁被氧化,故A项错误;该装置是利用铁与稀硫酸反应生成的氢气将A中生成的硫酸亚铁溶液压入B中,从而使硫酸亚铁与氢氧化钠溶液反应生成氢氧化亚铁,故B项错误;根据实验装置可知,本实验中氢气的作用有:先将装置中空气排净,然后关闭止水夹后将A中液体压入B中,故C项正确;亚铁离子易被氧化,为了避免硫酸亚铁被氧化,该实验中铁粉应该过量,故D项错误。
方法规律 实验室在制备Fe(OH)2时,因氢氧化亚铁在空气中极易与氧气、水反应生成氢氧化铁,因此实验中要隔绝空气。常采取以下措施:(1)亚铁盐需新制(用足量铁与稀硫酸反应或还原氯化铁溶液);(2)将所用氢氧化钠溶液煮沸以赶尽溶于其中的空气(O2);(3)使用长滴管吸入氢氧化钠溶液后将滴管伸入氯化亚铁溶液的液面以下,慢慢挤压乳胶头使氢氧化钠溶液与氯化亚铁溶液混合。
2.下列有关氢氧化亚铁及其制备方法的叙述中,
不正确的是( )
A.氢氧化亚铁易被空气氧化
B.氢氧化亚铁为灰绿色沉淀
C.可利用如图所示装置制备氢氧化亚铁
D.实验中所用氢氧化钠溶液应预先煮沸
B
解析 氢氧化亚铁易被空气中的氧气氧化为氢氧化铁,故A项正确;氢氧化亚铁为白色沉淀,不是灰绿色,故B项错误;氢氧化亚铁的制备要隔绝空气,可利用胶头滴管将硫酸亚铁溶液滴入氢氧化钠溶液中,故C项正确;将硫酸亚铁滴入氢氧化钠溶液中可制取Fe(OH)2,氢氧化钠溶液预先煮沸可以将其中溶解的氧气排净,故D项正确。
学以致用·随堂检测全达标
1
2
3
4
1.[2023河北沧州高一期中]下列有关铁及其化合物的说法错误的是( )
A.陨铁中存在游离态的铁
B.铁能与水蒸气反应,生成氧化铁和氢气
C.铁的氧化物都不溶于水,也不与水反应
D.四氧化三铁与稀盐酸反应生成两种盐
B
解析 游离态的铁主要存在于陨铁中,A正确;铁能与水蒸气反应,生成四氧化三铁和氢气,B错误;铁的氧化物性质稳定,不溶于水,也不与水反应,C正确;四氧化三铁与稀盐酸反应生成FeCl2、FeCl3两种盐,D正确。
1
2
3
4
2.下列实验操作和现象、结论或目的均正确的是( )
选项 实验操作和现象 结论或目的
A 向红砖粉末中加入盐酸,充分反应后取上层清液置于试管中,滴加KSCN溶液2~3滴,溶液呈红色 红砖中含有Fe3+
B CO还原Fe2O3得到的黑色固体加入盐酸溶解后再加入KSCN溶液,溶液不显红色 黑色固体中没有Fe3O4
C 取少量Fe(NO3)2试样加水溶解,加稀硫酸酸化,滴加KSCN溶液,溶液变为红色 该Fe(NO3)2试样已经变质
D 向某溶液中通入Cl2,然后再加入KSCN溶液变红色 原溶液中含有Fe2+
A
1
2
3
4
解析 三价铁离子遇KSCN溶液会变红色,故A正确;CO还原Fe2O3得到单质Fe,即使有Fe3O4,其溶于盐酸后产生的少量Fe3+能与Fe发生反应Fe+2Fe3+══3Fe2+,加入KSCN溶液也不显红色,故B错误; 和H+共存时具有强氧化性,而Fe2+具有还原性,会发生氧化还原反应,有Fe3+生成,遇KSCN溶液呈红色,不能证明样品是否变质,故C错误;若原溶液中不存在Fe2+而存在Fe3+,先通入Cl2再加入KSCN后溶液也会变红色,故D错误。
1
2
3
4
3.下列叙述正确的是( )
①铁能被磁铁吸引 ②人体内的血红蛋白中含铁元素 ③Fe在纯氧中燃烧可得Fe2O3 ④Fe2O3能与水反应得Fe(OH)3,所以能通过化合反应制Fe(OH)3 ⑤Fe(OH)2在空气中加热,可得FeO
A.①② B.③④
C.④⑤ D.①⑤
A
解析 ①铁能被磁铁吸引;②人体血红蛋白中含铁元素;③铁在纯氧中燃烧可得Fe3O4;④Fe2O3不能与水反应,但Fe(OH)3可通过反应4Fe(OH)2+O2+2H2O══4Fe(OH)3制得;⑤Fe(OH)2在空气中加热得不到FeO。
1
2
3
4
4.[2023湖北黄冈中学高一调研]在中学化学中经常提到的铁的氧化物有FeO、Fe2O3和Fe3O4,在一定条件下它们之间可以相互转化,在超过1 400 ℃的温度下加热Fe2O3时,Fe2O3会部分失去氧,生成Fe3O4。下列有关说法错误的是( )
A.热稳定性:Fe3O4>Fe2O3
B.FeO和Fe2O3都是碱性氧化物,都能与稀盐酸反应
C.Fe3O4为黑色固体,其中+2价铁与+3价铁的物质的量之比为1∶2
D.由FeO、Fe2O3和Fe3O4组成的混合物中,铁元素与氧元素的质量之比可能为7∶3
D
1
2
3
4
解析 在超过1 400 ℃的温度下加热Fe2O3时,Fe2O3会部分失去氧,生成Fe3O4,则热稳定性:Fe3O4>Fe2O3,A正确;Fe3O4为黑色固体,可以写成FeO·Fe2O3,则+2价铁与+3价铁的物质的量之比为1∶2,C正确;在FeO中,铁元素与氧元素的质量之比为7∶2,在Fe2O3中,铁元素与氧元素的质量之比为7∶3,则FeO、Fe2O3和Fe3O4组成的混合物中,铁元素与氧元素的质量之比在7∶2和7∶3之间,D错误。
本 课 结 束
第3章 物质的性质与转化
第1节 第2课时 铁、铁的氧化物和铁的氢氧化物
素 养 目 标
1.根据生产、生活中的应用实例或通过实验探究,培养宏观辨识与微观探析的化学核心素养。
2.能通过实验探究和交流研讨,掌握Fe、FeO、Fe2O3、Fe(OH)2、Fe(OH)3的性质及典型实验现象,能书写主要的化学方程式和离子方程式。能主动进行交流,逐步提升科学探究与创新意识。
3.通过从物质类别和元素价态两个角度研究物质性质的思路和方法去认识含铁物质在生产、生活中的应用,建立含铁物质的性质、实验现象、应用之间的联系,提升科学态度与社会责任。
基础落实·必备知识全过关
重难探究·能力素养全提升
目 录 索 引
学以致用·随堂检测全达标
基础落实·必备知识全过关
自主梳理
一、铁单质的性质
1.物理性质
铁单质为光亮的 色金属,密度较大,熔点为1 538 ℃,纯铁有很强的抗腐蚀能力。有良好的 性和 性,导电性比铜、铝差,能被磁铁吸引。
银白
延展
导热
2.化学性质 Fe具有较强的还原性
反应类型 化学方程式或离子方程式
Fe与非金属单质反应 3Fe+2O2 、2Fe+3Cl2
Fe与水蒸气反应
Fe与非氧化性酸反应 Fe+2H+══Fe2++H2↑
Fe与盐溶液反应 Fe+Cu2+══ 、
Fe+2Fe3+══
铝热反应
Fe3O4
2FeCl3
3Fe+4H2O(g) Fe3O4+4H2
Cu+Fe2+
3Fe2+
2Al+Fe2O3 2Fe+Al2O3
二、铁的氧化物——FeO、Fe2O3、Fe3O4性质的比较
项目 FeO Fe2O3 Fe3O4
俗名 — 铁红 磁性氧化铁
颜色、状态
水溶性 难溶 难溶 难溶
铁元素化合价 价 价 价
与稀盐酸或稀硫酸反应(写离子方程式)
黑色粉末
红棕色粉末
黑色固体
+2
+3
+2、+3
FeO+2H+══
Fe2++H2O
Fe2O3+6H+══
2Fe3++3H2O
Fe3O4+8H+══
Fe2++2Fe3++4H2O
三、铁的氢氧化物——Fe(OH)2、Fe(OH)3的性质比较
项目 Fe(OH)2 Fe(OH)3
颜色、状态
与盐酸反应 (写化学方程式)
受热分解 (写化学方程式) —
制备 可溶性亚铁盐与碱溶液反应: Fe2++2OH-══Fe(OH)2↓ 可溶性铁盐与碱溶液反应:
Fe3++3OH-══Fe(OH)3↓
转化 在空气中,Fe(OH)2能够迅速地被氧气氧化成Fe(OH)3,现象是白色沉淀迅速变成灰绿色,最后变成红褐色,化学方程式为4Fe(OH)2+O2+2H2O══4Fe(OH)3
白色固体
红褐色固体
Fe(OH)2+2HCl══
FeCl2+2H2O
Fe(OH)3+3HCl══
FeCl3+3H2O
2Fe(OH)3 Fe2O3+3H2O
【微思考1】已知2Fe+3Cl2 2FeCl3和Fe+S FeS,请判断Cl2与硫单质氧化性的强弱
【微思考2】指出铁与水蒸气的反应、铝热反应中的氧化剂和还原剂。
提示 Cl2能将Fe氧化为+3价,硫单质只能将Fe氧化为+2价,说明Cl2的氧化性强于单质硫。
提示 铁与水蒸气的反应中铁做还原剂,水做氧化剂,说明铁具有还原性。铝热反应中铝做还原剂,氧化铁做氧化剂,说明氧化铁具有氧化性。
自我检测
判断下列说法是否正确,正确的画“√”,错误的画“×”。
1.Fe3O4是一种纯净物,而不是Fe2O3和FeO组成的混合物。( )
2.赤铁矿的主要成分是Fe3O4,磁铁矿的主要成分是Fe2O3,FeO俗称铁红。
( )
3.Fe3O4、FeO遇非氧化性酸(如盐酸、稀硫酸)发生非氧化还原反应。( )
4.Fe(OH)2在空气中加热得到FeO。( )
5.Fe3O4只有氧化性,没有还原性。( )
6.Fe2O3不可与水反应得到Fe(OH)3,所以不能通过化合反应制取Fe(OH)3。
( )
7.铁的氧化物都不溶于水,也不与水反应。( )
√
×
√
×
×
×
√
重难探究·能力素养全提升
问题探究
探究1 铁的性质
在课堂分组实验中,小明同学不小心将少量铁粉混入铜粉中。小明同学欲将混合物遗弃,被小兵同学阻止,小兵运用所学知识成功将少量铁粉除去。除去铜粉中混有的铁粉,可选用FeCl3溶液吗 若不可以,可以选用什么试剂 另外还可以用什么方法
提示 由于FeCl3溶液不仅与Fe反应,而且能与Cu反应,故不可以用FeCl3溶液除去铜粉中混有的铁粉;H2SO4和CuSO4溶液均与Fe反应而不与Cu反应,故可用H2SO4或CuSO4溶液除去铜粉中混有的铁粉。另外,铁能被磁铁吸引而铜不会,故也可用磁铁吸出铁粉。
归纳拓展
(1)常温下,Fe与H2O不反应。但在水、空气中的O2等的共同作用下,Fe很容易被腐蚀。铁不能与热水反应,但在高温下,Fe能与H2O(g)反应:
3Fe+4H2O(g) Fe3O4+4H2。
(2)铁单质中铁元素的化合价为0价,铁单质具有还原性,能与具有氧化性的物质发生反应。
(3)Fe只具有还原性,可以被氧化剂氧化为Fe2+、Fe3+。
①Fe能被I2、S、Fe3+、Cu2+、H+等氧化剂氧化为Fe2+,
如Fe+S FeS,Fe+2Fe3+══3Fe2+。
②Fe能被Cl2等强氧化剂氧化为Fe3+,如2Fe+3Cl2 2FeCl3。
应用体验
1.把铁粉放入下列溶液中,铁粉溶解,溶液质量减小,但没有气体放出的是
( )
A.稀硫酸 B.NaHSO4溶液
C.CuSO4溶液 D.NaCl溶液
C
解析 Fe与稀硫酸发生的反应为Fe+H2SO4══FeSO4+H2↑,铁粉溶解,溶液的质量增加,有气体放出,A不符合题意;NaHSO4溶液中有大量H+存在,加入铁粉可反应生成FeSO4和H2,有气体放出,B不符合题意;Fe与CuSO4溶液发生的反应为Fe+CuSO4══FeSO4+Cu,溶解56 g Fe的同时析出64 g Cu,则溶液的质量减小,且不产生气体,C符合题意;把Fe投入NaCl溶液中,Fe不会溶解,D不符合题意。
【变式设问】
若将铁粉投入AgNO3溶液中,铁粉和溶液的质量会发生怎样变化 写出反应的离子方程式。
提示 铁粉质量减小,溶液质量减小;Fe+2Ag+══Fe2++2Ag。
2.常温下,将铁片放入下列溶液中,不发生反应的是( )
A.稀硫酸 B.CH3COOH溶液
C.氢氧化钠溶液 D.硫酸铜溶液
C
解析 铁能与稀硫酸、CH3COOH溶液等酸溶液反应,也能与不活泼的金属的盐溶液反应,如Fe能与CuSO4溶液等发生反应,Fe不能与NaOH溶液反应。
问题探究
探究2 铁的氧化物、氢氧化物的性质
在学习铁及其化合物的性质时,同学们做了以下两个实验。已知苯是一种不溶于水的有机溶剂,密度比水的小。
(1)图甲实验中生成的产物是Fe3O4,可以写成FeO·Fe2O3的形式,那么Fe3O4是混合物吗
(2)图乙实验中制取的Fe(OH)2为什么能进行较长时间的观察
提示 不是。尽管Fe3O4中铁元素的化合价为+2价和+3价,可以写成FeO·Fe2O3的形式,但Fe3O4是一种化合物而非混合物。
提示 苯浮在盐溶液上层隔绝了空气,使生成的Fe(OH)2难以被氧化。
归纳拓展
(1)Fe3O4是一种纯净物,而不是Fe2O3和FeO组成的混合物。能通过化合反应制得Fe(OH)3:Fe(OH)2、O2和H2O反应生成Fe(OH)3。
(2)铁是典型的变价金属元素,常见价态有0价、+2价、+3价,其氧化物FeO、Fe2O3和Fe3O4都难溶于水,Fe(OH)2和Fe(OH)3都是难溶于水的弱碱。
(3)Fe3O4、FeO遇非氧化性酸(如盐酸、稀硫酸)发生非氧化还原反应;遇强氧化性酸(如HNO3)发生氧化还原反应,+2价的铁均被氧化成+3价。
(4)Fe(OH)2在空气中加热不能得到FeO,因Fe(OH)2在空气中易被氧化。在空气中,Fe(OH)2能够非常迅速地被氧气氧化成
Fe(OH)3,反应的化学方程式为4Fe(OH)2+O2+2H2O══4Fe(OH)3。
(5)由亚铁盐与铁盐制备Fe(OH)2和Fe(OH)3:
FeCl2+2NaOH══Fe(OH)2↓+2NaCl,FeCl3+3NaOH══Fe(OH)3↓+3NaCl。
应用体验
1.如图为Fe(OH)2制备实验的改进装置,使用该装置将能在较长时间内观察到白色沉淀。关于此实验,下列说法正确的是( )
A.装入药品后应关闭止水夹,等反应完成后再打开止水夹
B.此装置是通过H2的排出使A中压强减小,
从而将B中的烧碱溶液吸入A中产生
Fe(OH)2
C.H2的作用是排尽装置内的空气并将A中溶液压入B中
D.在药品用量上稀硫酸应过量,使铁粉能充分反应完
C
解析 装入药品后应该打开止水夹,让铁与稀硫酸反应生成的氢气将装置中的空气排净,避免后来生成的氢氧化亚铁被氧化,故A项错误;该装置是利用铁与稀硫酸反应生成的氢气将A中生成的硫酸亚铁溶液压入B中,从而使硫酸亚铁与氢氧化钠溶液反应生成氢氧化亚铁,故B项错误;根据实验装置可知,本实验中氢气的作用有:先将装置中空气排净,然后关闭止水夹后将A中液体压入B中,故C项正确;亚铁离子易被氧化,为了避免硫酸亚铁被氧化,该实验中铁粉应该过量,故D项错误。
方法规律 实验室在制备Fe(OH)2时,因氢氧化亚铁在空气中极易与氧气、水反应生成氢氧化铁,因此实验中要隔绝空气。常采取以下措施:(1)亚铁盐需新制(用足量铁与稀硫酸反应或还原氯化铁溶液);(2)将所用氢氧化钠溶液煮沸以赶尽溶于其中的空气(O2);(3)使用长滴管吸入氢氧化钠溶液后将滴管伸入氯化亚铁溶液的液面以下,慢慢挤压乳胶头使氢氧化钠溶液与氯化亚铁溶液混合。
2.下列有关氢氧化亚铁及其制备方法的叙述中,
不正确的是( )
A.氢氧化亚铁易被空气氧化
B.氢氧化亚铁为灰绿色沉淀
C.可利用如图所示装置制备氢氧化亚铁
D.实验中所用氢氧化钠溶液应预先煮沸
B
解析 氢氧化亚铁易被空气中的氧气氧化为氢氧化铁,故A项正确;氢氧化亚铁为白色沉淀,不是灰绿色,故B项错误;氢氧化亚铁的制备要隔绝空气,可利用胶头滴管将硫酸亚铁溶液滴入氢氧化钠溶液中,故C项正确;将硫酸亚铁滴入氢氧化钠溶液中可制取Fe(OH)2,氢氧化钠溶液预先煮沸可以将其中溶解的氧气排净,故D项正确。
学以致用·随堂检测全达标
1
2
3
4
1.[2023河北沧州高一期中]下列有关铁及其化合物的说法错误的是( )
A.陨铁中存在游离态的铁
B.铁能与水蒸气反应,生成氧化铁和氢气
C.铁的氧化物都不溶于水,也不与水反应
D.四氧化三铁与稀盐酸反应生成两种盐
B
解析 游离态的铁主要存在于陨铁中,A正确;铁能与水蒸气反应,生成四氧化三铁和氢气,B错误;铁的氧化物性质稳定,不溶于水,也不与水反应,C正确;四氧化三铁与稀盐酸反应生成FeCl2、FeCl3两种盐,D正确。
1
2
3
4
2.下列实验操作和现象、结论或目的均正确的是( )
选项 实验操作和现象 结论或目的
A 向红砖粉末中加入盐酸,充分反应后取上层清液置于试管中,滴加KSCN溶液2~3滴,溶液呈红色 红砖中含有Fe3+
B CO还原Fe2O3得到的黑色固体加入盐酸溶解后再加入KSCN溶液,溶液不显红色 黑色固体中没有Fe3O4
C 取少量Fe(NO3)2试样加水溶解,加稀硫酸酸化,滴加KSCN溶液,溶液变为红色 该Fe(NO3)2试样已经变质
D 向某溶液中通入Cl2,然后再加入KSCN溶液变红色 原溶液中含有Fe2+
A
1
2
3
4
解析 三价铁离子遇KSCN溶液会变红色,故A正确;CO还原Fe2O3得到单质Fe,即使有Fe3O4,其溶于盐酸后产生的少量Fe3+能与Fe发生反应Fe+2Fe3+══3Fe2+,加入KSCN溶液也不显红色,故B错误; 和H+共存时具有强氧化性,而Fe2+具有还原性,会发生氧化还原反应,有Fe3+生成,遇KSCN溶液呈红色,不能证明样品是否变质,故C错误;若原溶液中不存在Fe2+而存在Fe3+,先通入Cl2再加入KSCN后溶液也会变红色,故D错误。
1
2
3
4
3.下列叙述正确的是( )
①铁能被磁铁吸引 ②人体内的血红蛋白中含铁元素 ③Fe在纯氧中燃烧可得Fe2O3 ④Fe2O3能与水反应得Fe(OH)3,所以能通过化合反应制Fe(OH)3 ⑤Fe(OH)2在空气中加热,可得FeO
A.①② B.③④
C.④⑤ D.①⑤
A
解析 ①铁能被磁铁吸引;②人体血红蛋白中含铁元素;③铁在纯氧中燃烧可得Fe3O4;④Fe2O3不能与水反应,但Fe(OH)3可通过反应4Fe(OH)2+O2+2H2O══4Fe(OH)3制得;⑤Fe(OH)2在空气中加热得不到FeO。
1
2
3
4
4.[2023湖北黄冈中学高一调研]在中学化学中经常提到的铁的氧化物有FeO、Fe2O3和Fe3O4,在一定条件下它们之间可以相互转化,在超过1 400 ℃的温度下加热Fe2O3时,Fe2O3会部分失去氧,生成Fe3O4。下列有关说法错误的是( )
A.热稳定性:Fe3O4>Fe2O3
B.FeO和Fe2O3都是碱性氧化物,都能与稀盐酸反应
C.Fe3O4为黑色固体,其中+2价铁与+3价铁的物质的量之比为1∶2
D.由FeO、Fe2O3和Fe3O4组成的混合物中,铁元素与氧元素的质量之比可能为7∶3
D
1
2
3
4
解析 在超过1 400 ℃的温度下加热Fe2O3时,Fe2O3会部分失去氧,生成Fe3O4,则热稳定性:Fe3O4>Fe2O3,A正确;Fe3O4为黑色固体,可以写成FeO·Fe2O3,则+2价铁与+3价铁的物质的量之比为1∶2,C正确;在FeO中,铁元素与氧元素的质量之比为7∶2,在Fe2O3中,铁元素与氧元素的质量之比为7∶3,则FeO、Fe2O3和Fe3O4组成的混合物中,铁元素与氧元素的质量之比在7∶2和7∶3之间,D错误。
本 课 结 束
