第1节 第3课时 铁及其化合物之间的转化关系课件(42张)2023-2024学年高一化学鲁科版必修第一册
文档属性
| 名称 | 第1节 第3课时 铁及其化合物之间的转化关系课件(42张)2023-2024学年高一化学鲁科版必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 3.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-08 16:53:21 | ||
图片预览











文档简介
(共42张PPT)
第3章 物质的性质与转化
第1节 第3课时 铁及其化合物之间的转化关系
素 养 目 标
1.从物质类别、元素价态的角度,依据复分解反应规律和氧化还原反应原理,预测含有铁元素的物质的性质及物质之间的转化,设计实验进行初步验证,并能分析解释有关实验现象,培养科学探究与创新意识的化学核心素养。
2.利用含有铁元素的物质的性质和转化关系,设计制备、分离、检验等简单任务的方案;能从物质类别和元素价态变化的角度说明物质的转化路径,培养证据推理与模型认知的意识。
3.分别根据含有铁元素的物质性质,分析生产、生活中的实际问题,如补铁剂中铁元素价态的检验、腐蚀线路板废液的回收利用等,培养科学态度与社会责任的化学核心素养。
基础落实·必备知识全过关
重难探究·能力素养全提升
目 录 索 引
学以致用·随堂检测全达标
基础落实·必备知识全过关
自主梳理
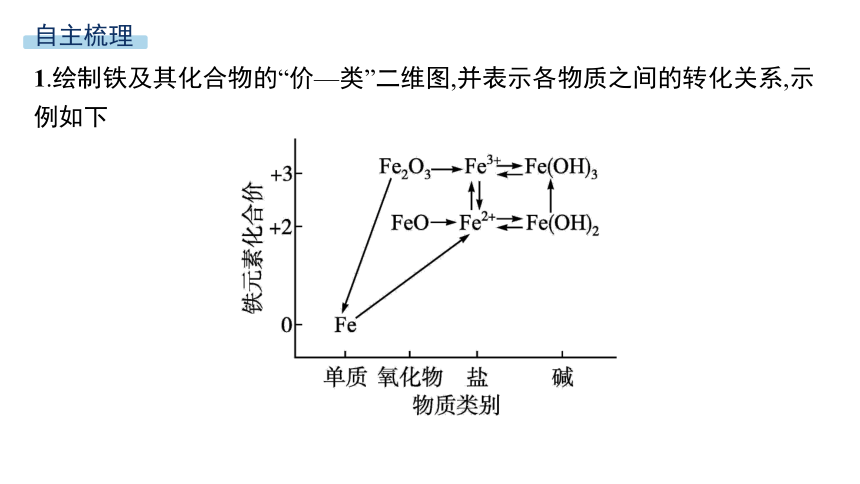
1.绘制铁及其化合物的“价—类”二维图,并表示各物质之间的转化关系,示例如下
2.补铁剂中铁元素价态的检验
实验步骤 实验现象 实验结论
①取少量补铁口服液置于试管中,滴入KSCN溶液 a.不变红
b.变红
②若出现现象a,向反应后的溶液中滴加氯水
③若出现现象b,另取补铁剂滴加酸性KMnO4溶液 紫色变浅或褪去
紫色无变化
无Fe3+
有Fe3+
溶液变红
有Fe2+
有Fe2+
无Fe2+
3.铁元素与人体健康
铁元素的生理功能 人体中含量 的生命必需微量元素,其中以血红蛋白的功能最为显著。血红蛋白分子中含有 ,具有载氧功能
缺铁的 危害 如果人体缺铁,就会出现
科学合理食用富铁食品及补铁 人体中铁元素主要来源于食物,动物血液、肝脏、骨髓以及菠菜、红枣等食物含铁丰富,可以多食用
维生素C具有 ,可以将Fe3+转化成人体可以吸收的Fe2+,所以适量服用维生素C有利于铁元素的吸收
最高
Fe2+
贫血
还原性
【微思考1】如何检验某铁的氧化物中含有Fe2+
【微思考2】碱性氧化物是否都能与水反应生成相应的碱
提示 取少量固体置于试管中,向其中加入稀盐酸配制成溶液,加入几滴酸性高锰酸钾溶液,高锰酸钾溶液褪色,证明氧化物中含有Fe2+。
提示 碱性氧化物不一定都能溶于水与水反应,如FeO、Fe2O3都难溶于水,与水不反应,因此不能与水反应生成相应的碱。
自我检测
判断下列说法是否正确,正确的画“√”,错误的画“×”。
1.NaOH溶液滴入FeSO4溶液中产生白色沉淀,随后变为红褐色,与氧化还原反应无关。( )
2.Cu与FeCl3溶液反应可生成CuCl2。( )
3.探究维生素C的还原性,可向盛有2 mL氯化铁溶液的试管中滴加浓的维生素C溶液,观察溶液颜色的变化。( )
4.向CuSO4溶液中加入铁粉,有红色固体析出,则Fe2+的氧化性强于Cu2+的氧化性。( )
5.铁与过量的硫粉共热的产物是Fe2S3。( )
×
√
√
×
×
6.某含铁盐化学式为Na2FeO4,具有较强的杀菌消毒功能,其中铁元素的化合价是+6价。( )
7.向2 mL 0.1 mol·L-1的FeCl3溶液中加足量铁粉,振荡,黄色逐渐消失,加KSCN溶液颜色不变,说明还原性:Fe>Fe2+。( )
√
√
重难探究·能力素养全提升
问题探究
探究1 补铁剂中铁元素价态的检验
(1)补铁剂所含铁盐中铁元素的价态有几种可能
(2)如何验证某补铁剂溶液中含Fe2+而不含Fe3+
提示 三种,Fe2+或Fe3+或Fe2+和Fe3+。
提示 验证某补铁剂中含Fe2+而不含Fe3+,可以根据检验亚铁离子的方法完成:取少量溶液置于试管中,先加几滴硫氰酸钾溶液,溶液不变为红色,证明补铁剂中不含Fe3+。再加过量氧化剂(补铁剂中存在较多的抗氧化物质如维生素C等),溶液变红色,证明补铁剂中含有Fe2+。
归纳拓展
检验Fe2+的注意事项
(1)只含Fe2+的溶液。
①加KSCN溶液前,禁止加氧化性物质使Fe2+被氧化。如H2O2、 (H+)等。
②氧化剂不能选用酸性KMnO4溶液,原因是酸性KMnO4溶液本身显紫色,对Fe(SCN)3的红色有干扰;酸性KMnO4溶液能氧化KSCN,溶液不变红色,不能证明不含Fe2+。
(2)同时含有Fe2+和Fe3+的溶液。
Fe2+对检验Fe3+无干扰,可以滴加KSCN溶液检验Fe3+;Fe3+对检验Fe2+有干扰,不能采用加KSCN溶液的方法检验Fe2+,通常向溶液中滴加适量酸性KMnO4溶液,溶液紫色褪去说明含有Fe2+。
(3)检验铁的氧化物中是否有+2价铁时,正确的思路为
①步骤a中不能选用盐酸,原因是酸性KMnO4溶液可以氧化HCl。
②步骤a中不能选用稀硝酸,原因是稀硝酸可以将Fe2+氧化为Fe3+。
应用体验
1.实验室以绿矾(FeSO4·7H2O)为原料制备补血剂甘氨酸亚铁[(H2NCH2COO)2Fe],有关物质的性质如下:
物质 甘氨酸(H2NCH2COOH) 柠檬酸 甘氨酸亚铁
性质 易溶于水,微溶于乙醇,两性化合物 易溶于水和乙醇,有酸性和还原性 易溶于水,难溶于乙醇
实验过程:
Ⅰ.配制含0.10 mol FeSO4的绿矾溶液。
Ⅱ.制备FeCO3:向配制好的绿矾溶液中缓慢加入200 mL 1.1 mol·L-1 NH4HCO3溶液,边加边搅拌,反应结束后过滤并洗涤沉淀。
Ⅲ.制备(H2NCH2COO)2Fe:实验装置如下图(夹持和加热仪器已省略),将实验Ⅱ得到的沉淀和含0.20 mol甘氨酸的水溶液混合后加入C中,然后利用A中反应产生的气体将C中空气排净,接着滴入柠檬酸溶液并加热。反应结束后过滤,滤液经蒸发结晶、过滤、洗涤、干燥得到产品。
回答下列问题:
(1)步骤Ⅰ中:实验室配制绿矾溶液时,为防止FeSO4被氧化变质,应加入的试剂为 (写化学式)。
(2)步骤Ⅱ中:生成沉淀的离子方程式为 。
(3)步骤Ⅲ中:
①检查装置A的气密性的方法是 。
②装置A中所盛放的药品是 (填字母)。
a.Na2CO3和稀硫酸 b.CaCO3和稀硫酸 c.CaCO3和稀盐酸
③确认C中空气排尽的实验现象是 。
④加入柠檬酸溶液一方面可促进FeCO3溶解,另一个作用是 。
⑤洗涤步骤Ⅲ中得到的沉淀,所选用的最佳洗涤试剂是 (填字母)。
a.热水 b.乙醇 c.柠檬酸溶液
⑥若产品的质量为17.34 g,则产率为 。
答案 (1)Fe
(2)Fe2++2 ══FeCO3↓+CO2↑+H2O
(3)①夹紧连接装置A的弹簧夹,从长颈漏斗注入一定量的水,使漏斗内的水面高于具支试管中的水面,停止加水一段时间后,若长颈漏斗与具支试管中的液面差保持不变,说明装置不漏气 ②c ③D中澄清石灰水变浑浊 ④防止二价铁被氧化 ⑤b ⑥85%
解析 (1)Fe2+具有较强的还原性,在制备碳酸亚铁的过程中,为了防止Fe2+被氧化,需加入少量铁粉。
(2)绿矾的水溶液与NH4HCO3溶液反应的离子方程式为Fe2++2 ══FeCO3↓+CO2↑+H2O。
(3)①检查装置A气密性的方法:夹紧连接装置A的弹簧夹,从长颈漏斗注入一定量的水,使漏斗内的水面高于具支试管中的水面,停止加水一段时间后,若长颈漏斗与具支试管中液面的高度差保持不变,说明装置不漏气。②装置A为固液不加热型制气装置,且具有随开随用、随关随停的特点,所以应选择块状不溶于水的CaCO3,酸只能选择盐酸,所以c项正确。③当C中充满CO2后,CO2开始进入D中,使D中的澄清石灰水变浑浊,这时说明C中空气已经排尽。④由题中信息可知,柠檬酸具有还原性,可防止Fe2+被氧化。⑤因甘氨酸亚铁易溶于水,难溶于乙醇,因此应选择乙醇作为洗涤剂,所以b正确。⑥含0.10 mol FeSO4的绿矾溶液中Fe2+的物质的量为0.10 mol,因NH4HCO3溶液过量,所以生成(H2NCH2COO)2Fe的物质的量为0.10 mol,质量为20.4 g,
则产率为 ×100%=85%。
2.[2023山东东明一中期末]铁是人体必需的微量元素,严重缺铁时需要服用补铁剂。实验小组为研究某补铁剂中铁元素的价态及其含量,设计并进行了如下实验:
【查阅资料】
①该补铁剂不溶于水,但能溶于人体中的胃液(含盐酸)。②KSCN中硫元素为-2价,易被氧化。
实验Ⅰ.检验该补铁剂中铁元素的价态。
(1)试剂1是 ,试剂2是 。
(2)加入试剂2后溶液变为浅红色,说明溶液①中含有 。
(3)能证明溶液①中含有Fe2+的实验现象是 。
(4)补全在上述条件下Fe2+与H2O2发生反应的离子方程式:
H++ Fe2++ H2O2══ +
(5)甲同学猜测深红色溶液③迅速变为无色溶液④的原因,可能是溶液中的SCN-与H2O2发生了化学反应。甲同学猜测的依据是 。
实验Ⅱ.测定该补铁剂中铁元素的含量。
(6)每片该补铁剂含铁元素的质量为 g。
答案 (1)稀盐酸 KSCN溶液
(2)铁离子(或Fe3+)
(3)加入过氧化氢溶液后,溶液变为深红色,说明亚铁离子被氧化生成了更多的铁离子
(4)2 2 1 2Fe3+ 2H2O
(5)KSCN中的硫元素为-2价,具有还原性,过氧化氢具有氧化性,两者会发生反应导致SCN-被消耗
解析 (1)补铁剂不溶于水,能溶于盐酸,所以试剂1是稀盐酸;加试剂2,溶液变为红色,说明试剂2为KSCN溶液,溶液①中含有Fe3+。
(3)加入过氧化氢溶液后,溶液变为深红色,说明Fe2+被氧化生成了更多的Fe3+,证明溶液①中含有Fe2+。
(4)Fe2+与H2O2发生反应的离子方程式为2H++2Fe2++H2O2══2Fe3++2H2O。
(5)KSCN中的硫元素为-2价,具有还原性,过氧化氢具有氧化性,两者会发生反应导致SCN-被消耗,所以溶液褪色。
问题探究
探究2 含铁元素物质之间的转化
(1)含有同种价态铁元素的物质之间通过什么类型的反应相互转化 含有不同价态铁元素的物质可以通过什么反应相互转化
提示 含有同种价态铁元素的物质之间可以通过复分解反应相互转化,含有不同价态铁元素的物质可以通过氧化还原反应转化。
(2)利用铁及其化合物之间的转化关系可以解决哪些问题
提示 ①离子共存问题。
Fe2+在酸性条件下不能与强氧化性离子大量共存;Fe3+不能与还原性离子大量共存,如I-、S2-、 等,也不能与OH-、SCN-等大量共存。
②分离与提纯。
a.FeCl2(杂质FeCl3),加入铁钉或铁粉后过滤。
b.FeCl3(杂质FeCl2),通入Cl2或滴加氯水或加入“绿色”氧化剂H2O2(2Fe2++H2O2+2H+══2H2O+2Fe3+)。
③溶液的配制与保存。
归纳拓展
1.不同价态铁元素之间的转化关系
2.铁及其化合物间的转化
(1)铁及其化合物的制备。
①冶炼铁:Fe2O3+2Al Al2O3+2Fe
Fe2O3+3CO 2Fe+3CO2
②亚铁盐、铁盐的制备:
Fe2O3+6HCl══2FeCl3+3H2O
2FeCl2+Cl2══2FeCl3
Fe+2HCl══FeCl2+H2↑
2Fe+3Cl2 2FeCl3
(2)亚铁盐溶液的保存:加入少量铁粉防止亚铁盐被氧化。如2FeCl3+Fe══3FeCl2。
(3)亚铁盐、铁盐的检验。
①FeCl3+3NaOH══Fe(OH)3↓+3NaCl(生成红褐色沉淀)
②FeCl2+2NaOH══Fe(OH)2↓+2NaCl、4Fe(OH)2+O2+2H2O══4Fe(OH)3(先生成白色沉淀,迅速变成灰绿色,最后变成红褐色)
应用体验
1.室温下,单质A、B、C分别为固体、黄绿色气体、无色气体。在合适的反应条件下,它们可以按下面框图进行反应;已知D溶液为黄色,E溶液为无色。请回答:
(1)B是 ,F是 (填化学式)。
(2)反应③的离子方程式为 。
(3)反应④的离子方程式为 。
答案 (1)Cl2 FeCl2
(2)Fe+2H+══Fe2++H2↑
(3)2Fe2++Cl2══2Fe3++2Cl-
解析 单质B为黄绿色气体,可知B为Cl2,C为无色气体,B与C反应生成E,E溶液是无色的,则C为H2,E为HCl,A与盐酸反应生成氢气,A应为金属单质,A与盐酸反应后生成的F为A的氯化物,F又能与氯气反应生成D,D溶液为黄色,且A与氯气可以直接生成D,可推知A为Fe,根据转化关系可知,F为FeCl2,D为FeCl3。
(1)由以上分析可知,B为Cl2,F为FeCl2。
(2)反应③为Fe和盐酸的反应,反应的离子方程式为Fe+2H+══Fe2++H2↑。
(3)反应④为FeCl2和Cl2的反应,反应的离子方程式为2Fe2++Cl2══2Fe3++2Cl-。
2.元素的“价—类”二维图是我们学习元素及其化合物相关知识的重要模型和工具,它指的是以元素的化合价为纵坐标,以物质的类别为横坐标所绘制的二维平面图像。下图为铁元素的“价—类”二维图,其中的箭头表示部分物质间的转化关系。
下列说法正确的是( )
A.铁与高温水蒸气的反应可实现上述转化①
B.FeO是一种黑色粉末,不稳定,在空气中受热,
迅速发生转化②生成红棕色粉末
C.转化⑦发生反应的类型是化合反应
D.加热Fe(OH)3发生转化⑥,加水溶解可实现转化③
C
解析 铁在高温条件下与水蒸气的反应不能实现题中转化①,A项错误;FeO是一种黑色粉末,不稳定,在空气中受热,部分被氧化,氧化生成Fe3O4,B项错误;转化⑦发生反应的化学方程式为4Fe(OH)2+O2+2H2O══4Fe(OH)3,属于化合反应,C项正确;加热Fe(OH)3发生转化⑥分解生成氧化铁,氢氧化铁不溶于水,加水溶解不可实现转化③,D项错误。
学以致用·随堂检测全达标
1
2
3
4
1.[2023辽宁辽阳高一期中]向含有一定物质的量的FeCl3和CuCl2的混合溶液中逐渐加入Fe粉至过量,该溶液的质量随加入铁粉的质量的变化关系图为( )
A
1
2
3
4
解析 向FeCl3和CuCl2的混合溶液中逐渐加入Fe粉至过量,可先后发生反应: 2FeCl3+Fe══3FeCl2、CuCl2+Fe══FeCl2+Cu。Fe先与FeCl3溶液反应,溶液的质量增加,FeCl3反应完全后再与CuCl2溶液反应,由于Fe的相对原子质量小于Cu的相对原子质量,导致溶液质量减小,当FeCl3和CuCl2全部反应完全,溶液质量保持不变,故A图像正确。
1
2
3
4
2.下列叙述不正确的是( )
选项 被提纯物质 杂质 除杂试剂或方法
A FeCl3溶液 FeCl2 通入适量Cl2
B FeCl2溶液 FeCl3 加入过量铁粉并过滤
C 银粉 铁粉 加入过量盐酸并过滤
D Fe(OH)3 Fe(OH)2 在空气中灼烧
D
解析 A项发生反应:2FeCl2+Cl2══2FeCl3,正确;B项发生反应:Fe+2FeCl3 ══3FeCl2,正确;C项银与盐酸不反应,而Fe与盐酸反应,正确;D项混合物在空气中灼烧时,Fe(OH)3会分解生成Fe2O3,错误。
1
2
3
4
3.下列说法正确的是( )
A.Fe在一定条件下与水反应生成H2和Fe(OH)3
B.Fe3O4溶于盐酸后加入几滴KSCN溶液,溶液显红色
C.工业上在常温下用CO还原含Fe2O3的铁矿石炼铁
D.Fe3+具有氧化性,据此可用KSCN溶液鉴别Fe3+
B
解析 高温下铁能与水蒸气反应生成Fe3O4和H2,故A项错误;Fe3O4溶于盐酸生成Fe3+和Fe2+,Fe3+与KSCN反应得到红色物质,故B项正确;一般炼铁的过程就是在高温下用CO还原Fe2O3生成Fe,故C项错误;用KSCN溶液鉴别Fe3+主要是利用了Fe3+与KSCN溶液反应显红色,而非Fe3+的氧化性,故D项错误。
1
2
3
4
4.[2023山东聊城高一期末]某兴趣小组进行某补血剂中铁元素含量的测定,实验流程如下:
下列说法不正确的是( )
A.步骤①研磨时需要在烧杯中进行
B.步骤②加入氨水的作用是将Fe3+完全沉淀
C.步骤③多步操作为过滤、洗涤、灼烧至恒重、冷却称重
D.每片补血剂中铁元素的质量为0.07w g
A
1
2
3
4
解析 研磨补血剂要在研钵中进行,A错误;向滤液中加入H2O2将Fe2+氧化成Fe3+,再加入过量氨水生成Fe(OH)3红褐色沉淀,B正确;将Fe(OH)3悬浊液过滤、洗涤、灼烧得到Fe2O3固体,冷却后称重得到氧化铁的质量,C正确;w g
本 课 结 束
第3章 物质的性质与转化
第1节 第3课时 铁及其化合物之间的转化关系
素 养 目 标
1.从物质类别、元素价态的角度,依据复分解反应规律和氧化还原反应原理,预测含有铁元素的物质的性质及物质之间的转化,设计实验进行初步验证,并能分析解释有关实验现象,培养科学探究与创新意识的化学核心素养。
2.利用含有铁元素的物质的性质和转化关系,设计制备、分离、检验等简单任务的方案;能从物质类别和元素价态变化的角度说明物质的转化路径,培养证据推理与模型认知的意识。
3.分别根据含有铁元素的物质性质,分析生产、生活中的实际问题,如补铁剂中铁元素价态的检验、腐蚀线路板废液的回收利用等,培养科学态度与社会责任的化学核心素养。
基础落实·必备知识全过关
重难探究·能力素养全提升
目 录 索 引
学以致用·随堂检测全达标
基础落实·必备知识全过关
自主梳理
1.绘制铁及其化合物的“价—类”二维图,并表示各物质之间的转化关系,示例如下
2.补铁剂中铁元素价态的检验
实验步骤 实验现象 实验结论
①取少量补铁口服液置于试管中,滴入KSCN溶液 a.不变红
b.变红
②若出现现象a,向反应后的溶液中滴加氯水
③若出现现象b,另取补铁剂滴加酸性KMnO4溶液 紫色变浅或褪去
紫色无变化
无Fe3+
有Fe3+
溶液变红
有Fe2+
有Fe2+
无Fe2+
3.铁元素与人体健康
铁元素的生理功能 人体中含量 的生命必需微量元素,其中以血红蛋白的功能最为显著。血红蛋白分子中含有 ,具有载氧功能
缺铁的 危害 如果人体缺铁,就会出现
科学合理食用富铁食品及补铁 人体中铁元素主要来源于食物,动物血液、肝脏、骨髓以及菠菜、红枣等食物含铁丰富,可以多食用
维生素C具有 ,可以将Fe3+转化成人体可以吸收的Fe2+,所以适量服用维生素C有利于铁元素的吸收
最高
Fe2+
贫血
还原性
【微思考1】如何检验某铁的氧化物中含有Fe2+
【微思考2】碱性氧化物是否都能与水反应生成相应的碱
提示 取少量固体置于试管中,向其中加入稀盐酸配制成溶液,加入几滴酸性高锰酸钾溶液,高锰酸钾溶液褪色,证明氧化物中含有Fe2+。
提示 碱性氧化物不一定都能溶于水与水反应,如FeO、Fe2O3都难溶于水,与水不反应,因此不能与水反应生成相应的碱。
自我检测
判断下列说法是否正确,正确的画“√”,错误的画“×”。
1.NaOH溶液滴入FeSO4溶液中产生白色沉淀,随后变为红褐色,与氧化还原反应无关。( )
2.Cu与FeCl3溶液反应可生成CuCl2。( )
3.探究维生素C的还原性,可向盛有2 mL氯化铁溶液的试管中滴加浓的维生素C溶液,观察溶液颜色的变化。( )
4.向CuSO4溶液中加入铁粉,有红色固体析出,则Fe2+的氧化性强于Cu2+的氧化性。( )
5.铁与过量的硫粉共热的产物是Fe2S3。( )
×
√
√
×
×
6.某含铁盐化学式为Na2FeO4,具有较强的杀菌消毒功能,其中铁元素的化合价是+6价。( )
7.向2 mL 0.1 mol·L-1的FeCl3溶液中加足量铁粉,振荡,黄色逐渐消失,加KSCN溶液颜色不变,说明还原性:Fe>Fe2+。( )
√
√
重难探究·能力素养全提升
问题探究
探究1 补铁剂中铁元素价态的检验
(1)补铁剂所含铁盐中铁元素的价态有几种可能
(2)如何验证某补铁剂溶液中含Fe2+而不含Fe3+
提示 三种,Fe2+或Fe3+或Fe2+和Fe3+。
提示 验证某补铁剂中含Fe2+而不含Fe3+,可以根据检验亚铁离子的方法完成:取少量溶液置于试管中,先加几滴硫氰酸钾溶液,溶液不变为红色,证明补铁剂中不含Fe3+。再加过量氧化剂(补铁剂中存在较多的抗氧化物质如维生素C等),溶液变红色,证明补铁剂中含有Fe2+。
归纳拓展
检验Fe2+的注意事项
(1)只含Fe2+的溶液。
①加KSCN溶液前,禁止加氧化性物质使Fe2+被氧化。如H2O2、 (H+)等。
②氧化剂不能选用酸性KMnO4溶液,原因是酸性KMnO4溶液本身显紫色,对Fe(SCN)3的红色有干扰;酸性KMnO4溶液能氧化KSCN,溶液不变红色,不能证明不含Fe2+。
(2)同时含有Fe2+和Fe3+的溶液。
Fe2+对检验Fe3+无干扰,可以滴加KSCN溶液检验Fe3+;Fe3+对检验Fe2+有干扰,不能采用加KSCN溶液的方法检验Fe2+,通常向溶液中滴加适量酸性KMnO4溶液,溶液紫色褪去说明含有Fe2+。
(3)检验铁的氧化物中是否有+2价铁时,正确的思路为
①步骤a中不能选用盐酸,原因是酸性KMnO4溶液可以氧化HCl。
②步骤a中不能选用稀硝酸,原因是稀硝酸可以将Fe2+氧化为Fe3+。
应用体验
1.实验室以绿矾(FeSO4·7H2O)为原料制备补血剂甘氨酸亚铁[(H2NCH2COO)2Fe],有关物质的性质如下:
物质 甘氨酸(H2NCH2COOH) 柠檬酸 甘氨酸亚铁
性质 易溶于水,微溶于乙醇,两性化合物 易溶于水和乙醇,有酸性和还原性 易溶于水,难溶于乙醇
实验过程:
Ⅰ.配制含0.10 mol FeSO4的绿矾溶液。
Ⅱ.制备FeCO3:向配制好的绿矾溶液中缓慢加入200 mL 1.1 mol·L-1 NH4HCO3溶液,边加边搅拌,反应结束后过滤并洗涤沉淀。
Ⅲ.制备(H2NCH2COO)2Fe:实验装置如下图(夹持和加热仪器已省略),将实验Ⅱ得到的沉淀和含0.20 mol甘氨酸的水溶液混合后加入C中,然后利用A中反应产生的气体将C中空气排净,接着滴入柠檬酸溶液并加热。反应结束后过滤,滤液经蒸发结晶、过滤、洗涤、干燥得到产品。
回答下列问题:
(1)步骤Ⅰ中:实验室配制绿矾溶液时,为防止FeSO4被氧化变质,应加入的试剂为 (写化学式)。
(2)步骤Ⅱ中:生成沉淀的离子方程式为 。
(3)步骤Ⅲ中:
①检查装置A的气密性的方法是 。
②装置A中所盛放的药品是 (填字母)。
a.Na2CO3和稀硫酸 b.CaCO3和稀硫酸 c.CaCO3和稀盐酸
③确认C中空气排尽的实验现象是 。
④加入柠檬酸溶液一方面可促进FeCO3溶解,另一个作用是 。
⑤洗涤步骤Ⅲ中得到的沉淀,所选用的最佳洗涤试剂是 (填字母)。
a.热水 b.乙醇 c.柠檬酸溶液
⑥若产品的质量为17.34 g,则产率为 。
答案 (1)Fe
(2)Fe2++2 ══FeCO3↓+CO2↑+H2O
(3)①夹紧连接装置A的弹簧夹,从长颈漏斗注入一定量的水,使漏斗内的水面高于具支试管中的水面,停止加水一段时间后,若长颈漏斗与具支试管中的液面差保持不变,说明装置不漏气 ②c ③D中澄清石灰水变浑浊 ④防止二价铁被氧化 ⑤b ⑥85%
解析 (1)Fe2+具有较强的还原性,在制备碳酸亚铁的过程中,为了防止Fe2+被氧化,需加入少量铁粉。
(2)绿矾的水溶液与NH4HCO3溶液反应的离子方程式为Fe2++2 ══FeCO3↓+CO2↑+H2O。
(3)①检查装置A气密性的方法:夹紧连接装置A的弹簧夹,从长颈漏斗注入一定量的水,使漏斗内的水面高于具支试管中的水面,停止加水一段时间后,若长颈漏斗与具支试管中液面的高度差保持不变,说明装置不漏气。②装置A为固液不加热型制气装置,且具有随开随用、随关随停的特点,所以应选择块状不溶于水的CaCO3,酸只能选择盐酸,所以c项正确。③当C中充满CO2后,CO2开始进入D中,使D中的澄清石灰水变浑浊,这时说明C中空气已经排尽。④由题中信息可知,柠檬酸具有还原性,可防止Fe2+被氧化。⑤因甘氨酸亚铁易溶于水,难溶于乙醇,因此应选择乙醇作为洗涤剂,所以b正确。⑥含0.10 mol FeSO4的绿矾溶液中Fe2+的物质的量为0.10 mol,因NH4HCO3溶液过量,所以生成(H2NCH2COO)2Fe的物质的量为0.10 mol,质量为20.4 g,
则产率为 ×100%=85%。
2.[2023山东东明一中期末]铁是人体必需的微量元素,严重缺铁时需要服用补铁剂。实验小组为研究某补铁剂中铁元素的价态及其含量,设计并进行了如下实验:
【查阅资料】
①该补铁剂不溶于水,但能溶于人体中的胃液(含盐酸)。②KSCN中硫元素为-2价,易被氧化。
实验Ⅰ.检验该补铁剂中铁元素的价态。
(1)试剂1是 ,试剂2是 。
(2)加入试剂2后溶液变为浅红色,说明溶液①中含有 。
(3)能证明溶液①中含有Fe2+的实验现象是 。
(4)补全在上述条件下Fe2+与H2O2发生反应的离子方程式:
H++ Fe2++ H2O2══ +
(5)甲同学猜测深红色溶液③迅速变为无色溶液④的原因,可能是溶液中的SCN-与H2O2发生了化学反应。甲同学猜测的依据是 。
实验Ⅱ.测定该补铁剂中铁元素的含量。
(6)每片该补铁剂含铁元素的质量为 g。
答案 (1)稀盐酸 KSCN溶液
(2)铁离子(或Fe3+)
(3)加入过氧化氢溶液后,溶液变为深红色,说明亚铁离子被氧化生成了更多的铁离子
(4)2 2 1 2Fe3+ 2H2O
(5)KSCN中的硫元素为-2价,具有还原性,过氧化氢具有氧化性,两者会发生反应导致SCN-被消耗
解析 (1)补铁剂不溶于水,能溶于盐酸,所以试剂1是稀盐酸;加试剂2,溶液变为红色,说明试剂2为KSCN溶液,溶液①中含有Fe3+。
(3)加入过氧化氢溶液后,溶液变为深红色,说明Fe2+被氧化生成了更多的Fe3+,证明溶液①中含有Fe2+。
(4)Fe2+与H2O2发生反应的离子方程式为2H++2Fe2++H2O2══2Fe3++2H2O。
(5)KSCN中的硫元素为-2价,具有还原性,过氧化氢具有氧化性,两者会发生反应导致SCN-被消耗,所以溶液褪色。
问题探究
探究2 含铁元素物质之间的转化
(1)含有同种价态铁元素的物质之间通过什么类型的反应相互转化 含有不同价态铁元素的物质可以通过什么反应相互转化
提示 含有同种价态铁元素的物质之间可以通过复分解反应相互转化,含有不同价态铁元素的物质可以通过氧化还原反应转化。
(2)利用铁及其化合物之间的转化关系可以解决哪些问题
提示 ①离子共存问题。
Fe2+在酸性条件下不能与强氧化性离子大量共存;Fe3+不能与还原性离子大量共存,如I-、S2-、 等,也不能与OH-、SCN-等大量共存。
②分离与提纯。
a.FeCl2(杂质FeCl3),加入铁钉或铁粉后过滤。
b.FeCl3(杂质FeCl2),通入Cl2或滴加氯水或加入“绿色”氧化剂H2O2(2Fe2++H2O2+2H+══2H2O+2Fe3+)。
③溶液的配制与保存。
归纳拓展
1.不同价态铁元素之间的转化关系
2.铁及其化合物间的转化
(1)铁及其化合物的制备。
①冶炼铁:Fe2O3+2Al Al2O3+2Fe
Fe2O3+3CO 2Fe+3CO2
②亚铁盐、铁盐的制备:
Fe2O3+6HCl══2FeCl3+3H2O
2FeCl2+Cl2══2FeCl3
Fe+2HCl══FeCl2+H2↑
2Fe+3Cl2 2FeCl3
(2)亚铁盐溶液的保存:加入少量铁粉防止亚铁盐被氧化。如2FeCl3+Fe══3FeCl2。
(3)亚铁盐、铁盐的检验。
①FeCl3+3NaOH══Fe(OH)3↓+3NaCl(生成红褐色沉淀)
②FeCl2+2NaOH══Fe(OH)2↓+2NaCl、4Fe(OH)2+O2+2H2O══4Fe(OH)3(先生成白色沉淀,迅速变成灰绿色,最后变成红褐色)
应用体验
1.室温下,单质A、B、C分别为固体、黄绿色气体、无色气体。在合适的反应条件下,它们可以按下面框图进行反应;已知D溶液为黄色,E溶液为无色。请回答:
(1)B是 ,F是 (填化学式)。
(2)反应③的离子方程式为 。
(3)反应④的离子方程式为 。
答案 (1)Cl2 FeCl2
(2)Fe+2H+══Fe2++H2↑
(3)2Fe2++Cl2══2Fe3++2Cl-
解析 单质B为黄绿色气体,可知B为Cl2,C为无色气体,B与C反应生成E,E溶液是无色的,则C为H2,E为HCl,A与盐酸反应生成氢气,A应为金属单质,A与盐酸反应后生成的F为A的氯化物,F又能与氯气反应生成D,D溶液为黄色,且A与氯气可以直接生成D,可推知A为Fe,根据转化关系可知,F为FeCl2,D为FeCl3。
(1)由以上分析可知,B为Cl2,F为FeCl2。
(2)反应③为Fe和盐酸的反应,反应的离子方程式为Fe+2H+══Fe2++H2↑。
(3)反应④为FeCl2和Cl2的反应,反应的离子方程式为2Fe2++Cl2══2Fe3++2Cl-。
2.元素的“价—类”二维图是我们学习元素及其化合物相关知识的重要模型和工具,它指的是以元素的化合价为纵坐标,以物质的类别为横坐标所绘制的二维平面图像。下图为铁元素的“价—类”二维图,其中的箭头表示部分物质间的转化关系。
下列说法正确的是( )
A.铁与高温水蒸气的反应可实现上述转化①
B.FeO是一种黑色粉末,不稳定,在空气中受热,
迅速发生转化②生成红棕色粉末
C.转化⑦发生反应的类型是化合反应
D.加热Fe(OH)3发生转化⑥,加水溶解可实现转化③
C
解析 铁在高温条件下与水蒸气的反应不能实现题中转化①,A项错误;FeO是一种黑色粉末,不稳定,在空气中受热,部分被氧化,氧化生成Fe3O4,B项错误;转化⑦发生反应的化学方程式为4Fe(OH)2+O2+2H2O══4Fe(OH)3,属于化合反应,C项正确;加热Fe(OH)3发生转化⑥分解生成氧化铁,氢氧化铁不溶于水,加水溶解不可实现转化③,D项错误。
学以致用·随堂检测全达标
1
2
3
4
1.[2023辽宁辽阳高一期中]向含有一定物质的量的FeCl3和CuCl2的混合溶液中逐渐加入Fe粉至过量,该溶液的质量随加入铁粉的质量的变化关系图为( )
A
1
2
3
4
解析 向FeCl3和CuCl2的混合溶液中逐渐加入Fe粉至过量,可先后发生反应: 2FeCl3+Fe══3FeCl2、CuCl2+Fe══FeCl2+Cu。Fe先与FeCl3溶液反应,溶液的质量增加,FeCl3反应完全后再与CuCl2溶液反应,由于Fe的相对原子质量小于Cu的相对原子质量,导致溶液质量减小,当FeCl3和CuCl2全部反应完全,溶液质量保持不变,故A图像正确。
1
2
3
4
2.下列叙述不正确的是( )
选项 被提纯物质 杂质 除杂试剂或方法
A FeCl3溶液 FeCl2 通入适量Cl2
B FeCl2溶液 FeCl3 加入过量铁粉并过滤
C 银粉 铁粉 加入过量盐酸并过滤
D Fe(OH)3 Fe(OH)2 在空气中灼烧
D
解析 A项发生反应:2FeCl2+Cl2══2FeCl3,正确;B项发生反应:Fe+2FeCl3 ══3FeCl2,正确;C项银与盐酸不反应,而Fe与盐酸反应,正确;D项混合物在空气中灼烧时,Fe(OH)3会分解生成Fe2O3,错误。
1
2
3
4
3.下列说法正确的是( )
A.Fe在一定条件下与水反应生成H2和Fe(OH)3
B.Fe3O4溶于盐酸后加入几滴KSCN溶液,溶液显红色
C.工业上在常温下用CO还原含Fe2O3的铁矿石炼铁
D.Fe3+具有氧化性,据此可用KSCN溶液鉴别Fe3+
B
解析 高温下铁能与水蒸气反应生成Fe3O4和H2,故A项错误;Fe3O4溶于盐酸生成Fe3+和Fe2+,Fe3+与KSCN反应得到红色物质,故B项正确;一般炼铁的过程就是在高温下用CO还原Fe2O3生成Fe,故C项错误;用KSCN溶液鉴别Fe3+主要是利用了Fe3+与KSCN溶液反应显红色,而非Fe3+的氧化性,故D项错误。
1
2
3
4
4.[2023山东聊城高一期末]某兴趣小组进行某补血剂中铁元素含量的测定,实验流程如下:
下列说法不正确的是( )
A.步骤①研磨时需要在烧杯中进行
B.步骤②加入氨水的作用是将Fe3+完全沉淀
C.步骤③多步操作为过滤、洗涤、灼烧至恒重、冷却称重
D.每片补血剂中铁元素的质量为0.07w g
A
1
2
3
4
解析 研磨补血剂要在研钵中进行,A错误;向滤液中加入H2O2将Fe2+氧化成Fe3+,再加入过量氨水生成Fe(OH)3红褐色沉淀,B正确;将Fe(OH)3悬浊液过滤、洗涤、灼烧得到Fe2O3固体,冷却后称重得到氧化铁的质量,C正确;w g
本 课 结 束
