第3节 第3课时 硝酸 人类活动对氮循环和环境的影响课件(共34张PPT)2023-2024学年高一化学鲁科版必修第一册
文档属性
| 名称 | 第3节 第3课时 硝酸 人类活动对氮循环和环境的影响课件(共34张PPT)2023-2024学年高一化学鲁科版必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 2.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-08 17:54:18 | ||
图片预览











文档简介
(共34张PPT)
第3章 物质的性质与转化
第3节 第3课时 硝酸 人类活动对氮循环和环境的影响
素 养 目 标
1.通过对浓硝酸性质的学习,认识硝酸的物理性质和化学性质以及典型的实验现象,能书写主要反应的化学方程式,知道它们的主要应用,建立变化观念与平衡思想。
2.通过了解人类活动对氮循环的影响,了解酸雨、光化学烟雾和水体富营养化等环境问题的危害以及如何减少氮氧化物的排放,树立环境保护的意识,同时知道常见氮的化合物在实验室中的安全使用注意事项,培养科学态度与社会责任。
3.从氮元素价态、物质类别角度构建氮及其化合物的转化关系,并能够应用其分析解释实验现象及物质的保存、检验、分离等问题;能够预测陌生的含有氮元素物质的性质、反应或实验现象,设计方案制备含有氮元素的物质和研究它们的性质,培养科学探究与创新意识。
基础落实·必备知识全过关
重难探究·能力素养全提升
目 录 索 引
学以致用·随堂检测全达标
基础落实·必备知识全过关
自主梳理
一、硝酸
1.物理性质
纯净的硝酸是 、 、 气味的液体,熔点为 ,沸点为 ,密度为 。通常市售硝酸中HNO3的质量分数为 ,密度约为 。HNO3的质量分数为 以上的浓硝酸在空气中由于挥发出 会产生
现象,通常叫作发烟硝酸。
无色
易挥发
有刺激性
-42 ℃
83 ℃
1.5 g·cm-3
68%~70%
1.42 g·cm-3
95%
硝酸蒸气
发烟
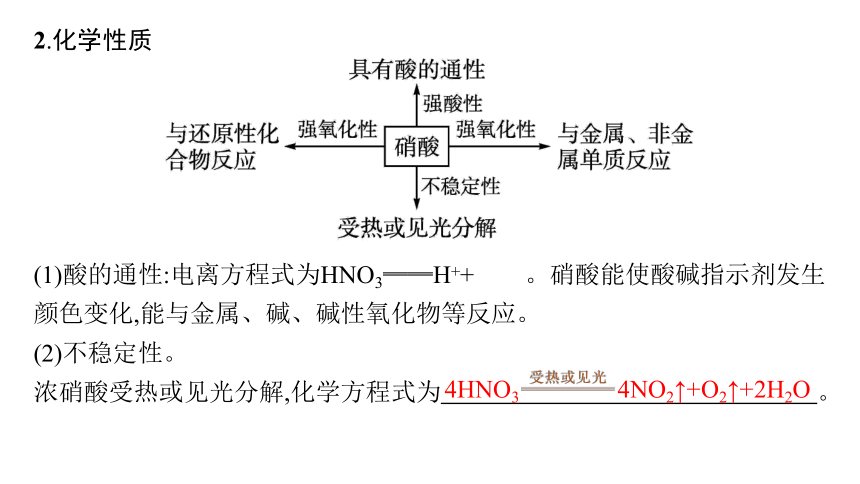
2.化学性质
(1)酸的通性:电离方程式为HNO3══H++ 。硝酸能使酸碱指示剂发生颜色变化,能与金属、碱、碱性氧化物等反应。
(2)不稳定性。
浓硝酸受热或见光分解,化学方程式为 。
4HNO3 4NO2↑+O2↑+2H2O
(3)强氧化性。 与金属反应不能产生H2
3Cu+8HNO3(稀)══3Cu(NO3)2+2NO↑+4H2O
Cu+4HNO3(浓)══Cu(NO3)2+2NO2↑+2H2O
致密的氧化膜而钝化
C+4HNO3(浓) 4NO2↑+CO2↑+2H2O
3.用途
硝酸是一种重要的化工原料,可用于制造 、 、
和硝酸盐等。在实验室里,硝酸是一种重要的化学试剂。
【微思考1】为什么浓硝酸一般呈黄色 如何消除其黄色
炸药
染料
塑料
提示 纯硝酸为无色液体,由于HNO3分解产生的NO2又溶于其中,故浓硝酸一般呈黄色;向浓硝酸中通入O2,可以消除其黄色。
二、人类活动对氮循环和环境的影响
1.含氮物质的来源及其危害
产生光化
形成酸雨
学烟雾
水体富营养化
2.减少人类活动对氮循环和环境影响的措施
(1)控制进入大气、土壤和水体中含有氮元素的物质的量。
(2)增强生态系统对含有氮元素的物质的吸收能力。
【微思考2】氮氧化物对环境的污染有哪些
提示 常见的污染类型
(1)光化学烟雾:NOx在紫外线作用下,与碳氢化合物发生一系列光化学反应,产生一种有毒的烟雾。
(2)酸雨:NOx排入大气中后,与水反应生成HNO3和HNO2,随雨雪降到地面。
(3)破坏臭氧层:NO2可使平流层中的臭氧减少,导致地面紫外线辐射量增加。
(4)NO与血红蛋白结合使人中毒。
自我检测
判断下列说法是否正确,正确的画“√”,错误的画“×”。
1.硝酸可与活泼金属反应生成盐和氢气。( )
2.浓硝酸显黄色是因为含有NO2。( )
3.硝酸与木炭的反应既表现出氧化性又表现出酸性。( )
4.硝酸与金属反应时,主要是+5价的氮得电子。( )
5.浓硝酸与浓盐酸按3∶1的体积比混合所得的物质叫王水。( )
6.常温下,向浓硝酸中投入铁片,会产生大量的红棕色气体。( )
×
√
×
√
×
×
重难探究·能力素养全提升
问题探究
探究1 硝酸的氧化性
硝酸与铜反应时,体现了硝酸的哪些性质
提示 体现了硝酸的氧化性和酸性。硝酸被还原成氮的氧化物体现了氧化性,与金属结合成硝酸盐体现了硝酸的酸性。
归纳拓展
浓硝酸和稀硝酸均具有强氧化性,主要是由于硝酸中的+5价的氮元素具有很强的得电子能力。其主要表现为能将大多数金属(除Au、Pt之外)溶解、能与很多非金属反应以及与某些还原性化合物发生反应。
1.浓硝酸
(1)与金属单质反应。浓硝酸与金属反应生成的气体主要是NO2。
①与不活泼金属单质反应:
2HNO3(浓)+Ag══AgNO3+NO2↑+H2O
4HNO3(浓)+Cu══Cu(NO3)2+2NO2↑+2H2O
②铁和铝常温下遇浓硝酸钝化,钝化是化学变化。
(2)与非金属单质反应。浓硝酸在加热条件下能与非金属单质反应,本身被还原为NO2,非金属单质一般被氧化成氧化物或酸。
C+4HNO3(浓) CO2↑+4NO2↑+2H2O
S+6HNO3(浓) H2SO4+6NO2↑+2H2O
2.稀硝酸
稀硝酸常温下与绝大多数金属单质反应生成的气体主要是NO,不产生氢气。
(1)稀硝酸与铜反应。
8HNO3(稀)+3Cu══3Cu(NO3)2+2NO↑+4H2O
(2)稀硝酸与铁反应。
反应物量的关系 HNO3过量 Fe过量 恰好反应
产 物 Fe(NO3)3 Fe(NO3)2 Fe(NO3)3或Fe(NO3)2或二者的混合物
应用体验
1.足量铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、N2O4、NO的混合气体,这些气体与1.68 L O2(标准状况)混合后通入水中,所有气体恰好完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入5 mol·L-1 NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是( )
A.60 mL B.45 mL C.30 mL D.15 mL
A
2.[2023湖南长沙雅礼中学高一月考]将6.4 g铜片加入100 mL一定浓度的硝酸溶液中,铜片完全溶解,产生2.24 L气体(标准状况),向反应后的溶液中加入200 mL 4 mol·L-1 NaOH溶液,溶液中的Cu2+恰好完全沉淀。下列说法正确的是( )
A.原硝酸溶液的浓度为3 mol·L-1
B.铜与硝酸反应产生的气体为NO2
C.铜片溶解后,溶液中溶质为Cu(NO3)2
D.若将产生的气体与足量O2混合通入水中充分反应,消耗O2 0.05 mol
D
NO2,则得到电子的物质的量为0.1 mol,若全部为NO,得到电子为0.3 mol,均存在得失电子总数不相等,则气体应为NO2和NO的混合气体,加入NaOH后可能的反应有HNO3+NaOH══NaNO3+H2O、Cu(NO3)2+2NaOH══Cu(OH)2↓+2NaNO3,根据Cu2+和NaOH的物质的量可知,Cu与硝酸的反应中HNO3过量,根据原子守恒可知,100 mL溶液中n(HNO3)=n(气体)+n(NaNO3)=0.1 mol+0.2 L×4 mol·L-1=0.9 mol,据此分析解题。由分析可知,原硝酸溶液的浓度为 =9 mol·L-1,A错误;
由分析可知,铜与硝酸反应产生的气体为NO2和NO的混合气体,B错误;由分析可知,铜片溶解后,HNO3过量,故溶液中溶质为Cu(NO3)2和HNO3,C错误;若将产生的气体与足量O2混合通入水中充分反应,即发生反应4NO2+O2+2H2O══4HNO3、4NO+3O2+2H2O══4HNO3,根据电子得失总数相等可知,2n(Cu)=n(NO2)+3n(NO)=4n(O2),故消耗O2的物质的量为
=0.05 mol,D正确。
问题探究
探究2 人类活动对氮循环和环境的影响
水体中氮元素的来源主要有哪些 有什么危害
提示 水体中的氮元素主要来源于工业废水、生活污水、农田灌溉以及水产养殖所投入的饵料和肥料等。水体中富含氮元素会导致水体富营养化,从而造成“赤潮”和“水华”。
归纳拓展
1.主要环境污染
污染类型 具体表现 主要物质或原因
空气污染 酸雨 SO2、氮氧化物
光化学烟雾 氮氧化物、碳氢化合物
臭氧空洞 氟氯烃、碳氢化合物
温室效应 CO2、CH4等
雾霾 SO2、氮氧化物、颗粒物(PM), 颗粒物是加重雾霾天气的主要原因
室内空气 污染 家用燃料的燃烧,烹调,吸烟产生的CO、CO2、NO、NO2、SO2等,各种建筑材料和装饰材料释放出的甲醛、苯等有机物造成的污染
污染类型 具体表现 主要物质或原因
水体 污染 重金属 污染 重金属Hg、Cd、Pb、Cr等的离子进入水中形成的污染,主要来自化工、冶金、电子、电镀等排放的工业废水
植物营养物 质污染 (如赤潮) 进入水中腐烂的含蛋白质的物质、含磷洗涤剂及大量使用磷肥造成的水体富营养化,主要来源于工、农业生产及城市生活污水的任意排放
2.绿色化学
应用体验
1.下列说法错误的是( )
A.氮的氧化物是汽车尾气中的主要污染物之一
B.氮的氧化物既可形成酸雨,又是形成光化学烟雾的主要成分
C.化石燃料的燃烧是造成空气中二氧化硫含量增多的主要因素
D.酸雨在空气中静置一段时间后,雨水的酸性会慢慢减弱
D
解析 氮的氧化物是汽车尾气中的主要污染物之一,A正确;氮的氧化物既可形成酸雨,又能形成光化学烟雾,B正确;化石燃料中含有硫元素,因此化石燃料的燃烧是造成空气中二氧化硫含量增多的主要因素,C正确;酸雨中的亚硫酸极易被氧化生成强酸硫酸,因此酸雨在空气中静置一段时间后,雨水的酸性会慢慢增强,D不正确。
2.下列因果关系不正确的是( )
选项 原因 结果
A 大量植树造林 温室效应
B SO2和NO2气体的大量排放 酸雨
C 含氮、磷等生活废水的大量排放 水华、赤潮
D 汽车尾气的大量排放 光化学烟雾
A
解析 植物的光合作用会吸收二氧化碳,大量植树造林不会导致温室效应,A错误;SO2和NO2气体大量排放,最终会转变成硫酸和硝酸,形成酸雨,B正确;氮、磷是植物的营养元素,含氮、磷等生活废水的大量排放,会导致水体富营养化,藻类疯长,引发水华、赤潮,C正确;汽车尾气的大量排放,会产生氮氧化物,从而造成光化学烟雾,D正确。
学以致用·随堂检测全达标
1
2
3
4
1.关于硝酸的说法正确的是( )
A.硝酸电离出的H+,能被Zn还原成H2
B.常温下,向浓硝酸中投入Fe片,会产生大量的红棕色气体
C.向装有Fe(NO3)2溶液的试管中加入稀硫酸,可在管口观察到红棕色气体
D.过量的Fe粉与稀硝酸充分反应后,滴入KSCN溶液,溶液呈红色
C
解析 稀硝酸与Zn反应生成氮氧化物等,不生成H2,A错误;常温下Fe、Al等金属在浓硝酸中钝化,不会生成大量NO2气体,B错误;向Fe(NO3)2溶液中加入稀硫酸,Fe2+、 及H+反应可生成NO,NO与O2反应可生成NO2,C正确;过量Fe与稀硝酸反应生成Fe(NO3)2,再加入KSCN溶液不变色,D错误。
1
2
3
4
2.下列块状金属在常温时,能全部溶于足量的浓硝酸的是( )
A.Au B.Cu
C.Al D.Fe
B
解析 Au与浓硝酸不反应,Al、Fe在常温下遇浓硝酸钝化,不能全部溶解,Cu能与浓硝酸反应,能全部溶于足量的浓硝酸中。
1
2
3
4
3.以下非金属氧化物与其引起的环境问题及主要来源对应不正确的是
( )
选项 氧化物 环境问题 主要来源
A CO2 温室效应 化石燃料的燃烧
B NO2 酸雨 工厂废气的排放
C CO CO中毒 燃料的不完全燃烧
D SO2 光化学烟雾 汽车尾气的排放
D
解析 CO2主要是导致温室效应,A正确;NO2可以引起酸雨和光化学烟雾,B正确;燃料的不完全燃烧生成CO,CO有毒,C正确;光化学烟雾主要是氮的氧化物引起的,SO2主要引起酸雨,且SO2的主要来源不是汽车尾气的排放,D错误。
1
2
3
4
4.[2023山东菏泽单县二中月考]
某学习小组为研究铜与浓、稀硝
酸反应的差异,设计了如图所示的
实验装置。
下列说法不正确的是( )
A.反应开始前通入过量的CO2气体,
目的是排除装置内的空气
B.A中反应的离子方程式为Cu+2 +4H+══Cu2++2NO2↑+2H2O
C.当B中0.03 mol铜粉被氧化时,B中产生的NO气体大于0.02 mol
D.C装置中装入一定量的水进行尾气处理
D
1
2
3
4
解析 铜与浓硝酸反应生成NO2,NO2为红棕色气体,铜与稀硝酸反应生成NO,NO为无色气体,NO能与氧气反应生成NO2,为了避免空气中氧气对实验干扰,先通入二氧化碳排除装置中的空气,然后打开分液漏斗活塞,滴加浓硝酸,三颈烧瓶中出现红棕色气体,说明铜与浓硝酸反应生成NO2,NO2与B中水反应生成NO和HNO3,B中铜粉溶解,溶液变蓝;试管B中气体不显红棕色,说明铜和稀硝酸反应生成NO;氮的氧化物有毒,需要尾气处理,据此分析。为便于观察B中生成无色气体,防止NO被氧化,开始前通入二氧化碳气体,排除装置内的空气,故A正确;A中Cu与浓硝酸反应生成硝酸铜、二氧化氮和水,离子方程式为Cu+2N+4H+══Cu2++2NO2↑+2H2O,故B正确;
1
2
3
4
B中Cu与硝酸反应生成硝酸铜、NO和水,根据得失电子数目守恒,0.03 mol ×2=n(NO)×3,解得n(NO)=0.02 mol,NO2与水反应也能产生NO,因此试管B中产生NO气体大于0.02 mol,故C正确;NO不与水反应,不能用水进行尾气处理,故D错误。
本 课 结 束
第3章 物质的性质与转化
第3节 第3课时 硝酸 人类活动对氮循环和环境的影响
素 养 目 标
1.通过对浓硝酸性质的学习,认识硝酸的物理性质和化学性质以及典型的实验现象,能书写主要反应的化学方程式,知道它们的主要应用,建立变化观念与平衡思想。
2.通过了解人类活动对氮循环的影响,了解酸雨、光化学烟雾和水体富营养化等环境问题的危害以及如何减少氮氧化物的排放,树立环境保护的意识,同时知道常见氮的化合物在实验室中的安全使用注意事项,培养科学态度与社会责任。
3.从氮元素价态、物质类别角度构建氮及其化合物的转化关系,并能够应用其分析解释实验现象及物质的保存、检验、分离等问题;能够预测陌生的含有氮元素物质的性质、反应或实验现象,设计方案制备含有氮元素的物质和研究它们的性质,培养科学探究与创新意识。
基础落实·必备知识全过关
重难探究·能力素养全提升
目 录 索 引
学以致用·随堂检测全达标
基础落实·必备知识全过关
自主梳理
一、硝酸
1.物理性质
纯净的硝酸是 、 、 气味的液体,熔点为 ,沸点为 ,密度为 。通常市售硝酸中HNO3的质量分数为 ,密度约为 。HNO3的质量分数为 以上的浓硝酸在空气中由于挥发出 会产生
现象,通常叫作发烟硝酸。
无色
易挥发
有刺激性
-42 ℃
83 ℃
1.5 g·cm-3
68%~70%
1.42 g·cm-3
95%
硝酸蒸气
发烟
2.化学性质
(1)酸的通性:电离方程式为HNO3══H++ 。硝酸能使酸碱指示剂发生颜色变化,能与金属、碱、碱性氧化物等反应。
(2)不稳定性。
浓硝酸受热或见光分解,化学方程式为 。
4HNO3 4NO2↑+O2↑+2H2O
(3)强氧化性。 与金属反应不能产生H2
3Cu+8HNO3(稀)══3Cu(NO3)2+2NO↑+4H2O
Cu+4HNO3(浓)══Cu(NO3)2+2NO2↑+2H2O
致密的氧化膜而钝化
C+4HNO3(浓) 4NO2↑+CO2↑+2H2O
3.用途
硝酸是一种重要的化工原料,可用于制造 、 、
和硝酸盐等。在实验室里,硝酸是一种重要的化学试剂。
【微思考1】为什么浓硝酸一般呈黄色 如何消除其黄色
炸药
染料
塑料
提示 纯硝酸为无色液体,由于HNO3分解产生的NO2又溶于其中,故浓硝酸一般呈黄色;向浓硝酸中通入O2,可以消除其黄色。
二、人类活动对氮循环和环境的影响
1.含氮物质的来源及其危害
产生光化
形成酸雨
学烟雾
水体富营养化
2.减少人类活动对氮循环和环境影响的措施
(1)控制进入大气、土壤和水体中含有氮元素的物质的量。
(2)增强生态系统对含有氮元素的物质的吸收能力。
【微思考2】氮氧化物对环境的污染有哪些
提示 常见的污染类型
(1)光化学烟雾:NOx在紫外线作用下,与碳氢化合物发生一系列光化学反应,产生一种有毒的烟雾。
(2)酸雨:NOx排入大气中后,与水反应生成HNO3和HNO2,随雨雪降到地面。
(3)破坏臭氧层:NO2可使平流层中的臭氧减少,导致地面紫外线辐射量增加。
(4)NO与血红蛋白结合使人中毒。
自我检测
判断下列说法是否正确,正确的画“√”,错误的画“×”。
1.硝酸可与活泼金属反应生成盐和氢气。( )
2.浓硝酸显黄色是因为含有NO2。( )
3.硝酸与木炭的反应既表现出氧化性又表现出酸性。( )
4.硝酸与金属反应时,主要是+5价的氮得电子。( )
5.浓硝酸与浓盐酸按3∶1的体积比混合所得的物质叫王水。( )
6.常温下,向浓硝酸中投入铁片,会产生大量的红棕色气体。( )
×
√
×
√
×
×
重难探究·能力素养全提升
问题探究
探究1 硝酸的氧化性
硝酸与铜反应时,体现了硝酸的哪些性质
提示 体现了硝酸的氧化性和酸性。硝酸被还原成氮的氧化物体现了氧化性,与金属结合成硝酸盐体现了硝酸的酸性。
归纳拓展
浓硝酸和稀硝酸均具有强氧化性,主要是由于硝酸中的+5价的氮元素具有很强的得电子能力。其主要表现为能将大多数金属(除Au、Pt之外)溶解、能与很多非金属反应以及与某些还原性化合物发生反应。
1.浓硝酸
(1)与金属单质反应。浓硝酸与金属反应生成的气体主要是NO2。
①与不活泼金属单质反应:
2HNO3(浓)+Ag══AgNO3+NO2↑+H2O
4HNO3(浓)+Cu══Cu(NO3)2+2NO2↑+2H2O
②铁和铝常温下遇浓硝酸钝化,钝化是化学变化。
(2)与非金属单质反应。浓硝酸在加热条件下能与非金属单质反应,本身被还原为NO2,非金属单质一般被氧化成氧化物或酸。
C+4HNO3(浓) CO2↑+4NO2↑+2H2O
S+6HNO3(浓) H2SO4+6NO2↑+2H2O
2.稀硝酸
稀硝酸常温下与绝大多数金属单质反应生成的气体主要是NO,不产生氢气。
(1)稀硝酸与铜反应。
8HNO3(稀)+3Cu══3Cu(NO3)2+2NO↑+4H2O
(2)稀硝酸与铁反应。
反应物量的关系 HNO3过量 Fe过量 恰好反应
产 物 Fe(NO3)3 Fe(NO3)2 Fe(NO3)3或Fe(NO3)2或二者的混合物
应用体验
1.足量铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、N2O4、NO的混合气体,这些气体与1.68 L O2(标准状况)混合后通入水中,所有气体恰好完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入5 mol·L-1 NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是( )
A.60 mL B.45 mL C.30 mL D.15 mL
A
2.[2023湖南长沙雅礼中学高一月考]将6.4 g铜片加入100 mL一定浓度的硝酸溶液中,铜片完全溶解,产生2.24 L气体(标准状况),向反应后的溶液中加入200 mL 4 mol·L-1 NaOH溶液,溶液中的Cu2+恰好完全沉淀。下列说法正确的是( )
A.原硝酸溶液的浓度为3 mol·L-1
B.铜与硝酸反应产生的气体为NO2
C.铜片溶解后,溶液中溶质为Cu(NO3)2
D.若将产生的气体与足量O2混合通入水中充分反应,消耗O2 0.05 mol
D
NO2,则得到电子的物质的量为0.1 mol,若全部为NO,得到电子为0.3 mol,均存在得失电子总数不相等,则气体应为NO2和NO的混合气体,加入NaOH后可能的反应有HNO3+NaOH══NaNO3+H2O、Cu(NO3)2+2NaOH══Cu(OH)2↓+2NaNO3,根据Cu2+和NaOH的物质的量可知,Cu与硝酸的反应中HNO3过量,根据原子守恒可知,100 mL溶液中n(HNO3)=n(气体)+n(NaNO3)=0.1 mol+0.2 L×4 mol·L-1=0.9 mol,据此分析解题。由分析可知,原硝酸溶液的浓度为 =9 mol·L-1,A错误;
由分析可知,铜与硝酸反应产生的气体为NO2和NO的混合气体,B错误;由分析可知,铜片溶解后,HNO3过量,故溶液中溶质为Cu(NO3)2和HNO3,C错误;若将产生的气体与足量O2混合通入水中充分反应,即发生反应4NO2+O2+2H2O══4HNO3、4NO+3O2+2H2O══4HNO3,根据电子得失总数相等可知,2n(Cu)=n(NO2)+3n(NO)=4n(O2),故消耗O2的物质的量为
=0.05 mol,D正确。
问题探究
探究2 人类活动对氮循环和环境的影响
水体中氮元素的来源主要有哪些 有什么危害
提示 水体中的氮元素主要来源于工业废水、生活污水、农田灌溉以及水产养殖所投入的饵料和肥料等。水体中富含氮元素会导致水体富营养化,从而造成“赤潮”和“水华”。
归纳拓展
1.主要环境污染
污染类型 具体表现 主要物质或原因
空气污染 酸雨 SO2、氮氧化物
光化学烟雾 氮氧化物、碳氢化合物
臭氧空洞 氟氯烃、碳氢化合物
温室效应 CO2、CH4等
雾霾 SO2、氮氧化物、颗粒物(PM), 颗粒物是加重雾霾天气的主要原因
室内空气 污染 家用燃料的燃烧,烹调,吸烟产生的CO、CO2、NO、NO2、SO2等,各种建筑材料和装饰材料释放出的甲醛、苯等有机物造成的污染
污染类型 具体表现 主要物质或原因
水体 污染 重金属 污染 重金属Hg、Cd、Pb、Cr等的离子进入水中形成的污染,主要来自化工、冶金、电子、电镀等排放的工业废水
植物营养物 质污染 (如赤潮) 进入水中腐烂的含蛋白质的物质、含磷洗涤剂及大量使用磷肥造成的水体富营养化,主要来源于工、农业生产及城市生活污水的任意排放
2.绿色化学
应用体验
1.下列说法错误的是( )
A.氮的氧化物是汽车尾气中的主要污染物之一
B.氮的氧化物既可形成酸雨,又是形成光化学烟雾的主要成分
C.化石燃料的燃烧是造成空气中二氧化硫含量增多的主要因素
D.酸雨在空气中静置一段时间后,雨水的酸性会慢慢减弱
D
解析 氮的氧化物是汽车尾气中的主要污染物之一,A正确;氮的氧化物既可形成酸雨,又能形成光化学烟雾,B正确;化石燃料中含有硫元素,因此化石燃料的燃烧是造成空气中二氧化硫含量增多的主要因素,C正确;酸雨中的亚硫酸极易被氧化生成强酸硫酸,因此酸雨在空气中静置一段时间后,雨水的酸性会慢慢增强,D不正确。
2.下列因果关系不正确的是( )
选项 原因 结果
A 大量植树造林 温室效应
B SO2和NO2气体的大量排放 酸雨
C 含氮、磷等生活废水的大量排放 水华、赤潮
D 汽车尾气的大量排放 光化学烟雾
A
解析 植物的光合作用会吸收二氧化碳,大量植树造林不会导致温室效应,A错误;SO2和NO2气体大量排放,最终会转变成硫酸和硝酸,形成酸雨,B正确;氮、磷是植物的营养元素,含氮、磷等生活废水的大量排放,会导致水体富营养化,藻类疯长,引发水华、赤潮,C正确;汽车尾气的大量排放,会产生氮氧化物,从而造成光化学烟雾,D正确。
学以致用·随堂检测全达标
1
2
3
4
1.关于硝酸的说法正确的是( )
A.硝酸电离出的H+,能被Zn还原成H2
B.常温下,向浓硝酸中投入Fe片,会产生大量的红棕色气体
C.向装有Fe(NO3)2溶液的试管中加入稀硫酸,可在管口观察到红棕色气体
D.过量的Fe粉与稀硝酸充分反应后,滴入KSCN溶液,溶液呈红色
C
解析 稀硝酸与Zn反应生成氮氧化物等,不生成H2,A错误;常温下Fe、Al等金属在浓硝酸中钝化,不会生成大量NO2气体,B错误;向Fe(NO3)2溶液中加入稀硫酸,Fe2+、 及H+反应可生成NO,NO与O2反应可生成NO2,C正确;过量Fe与稀硝酸反应生成Fe(NO3)2,再加入KSCN溶液不变色,D错误。
1
2
3
4
2.下列块状金属在常温时,能全部溶于足量的浓硝酸的是( )
A.Au B.Cu
C.Al D.Fe
B
解析 Au与浓硝酸不反应,Al、Fe在常温下遇浓硝酸钝化,不能全部溶解,Cu能与浓硝酸反应,能全部溶于足量的浓硝酸中。
1
2
3
4
3.以下非金属氧化物与其引起的环境问题及主要来源对应不正确的是
( )
选项 氧化物 环境问题 主要来源
A CO2 温室效应 化石燃料的燃烧
B NO2 酸雨 工厂废气的排放
C CO CO中毒 燃料的不完全燃烧
D SO2 光化学烟雾 汽车尾气的排放
D
解析 CO2主要是导致温室效应,A正确;NO2可以引起酸雨和光化学烟雾,B正确;燃料的不完全燃烧生成CO,CO有毒,C正确;光化学烟雾主要是氮的氧化物引起的,SO2主要引起酸雨,且SO2的主要来源不是汽车尾气的排放,D错误。
1
2
3
4
4.[2023山东菏泽单县二中月考]
某学习小组为研究铜与浓、稀硝
酸反应的差异,设计了如图所示的
实验装置。
下列说法不正确的是( )
A.反应开始前通入过量的CO2气体,
目的是排除装置内的空气
B.A中反应的离子方程式为Cu+2 +4H+══Cu2++2NO2↑+2H2O
C.当B中0.03 mol铜粉被氧化时,B中产生的NO气体大于0.02 mol
D.C装置中装入一定量的水进行尾气处理
D
1
2
3
4
解析 铜与浓硝酸反应生成NO2,NO2为红棕色气体,铜与稀硝酸反应生成NO,NO为无色气体,NO能与氧气反应生成NO2,为了避免空气中氧气对实验干扰,先通入二氧化碳排除装置中的空气,然后打开分液漏斗活塞,滴加浓硝酸,三颈烧瓶中出现红棕色气体,说明铜与浓硝酸反应生成NO2,NO2与B中水反应生成NO和HNO3,B中铜粉溶解,溶液变蓝;试管B中气体不显红棕色,说明铜和稀硝酸反应生成NO;氮的氧化物有毒,需要尾气处理,据此分析。为便于观察B中生成无色气体,防止NO被氧化,开始前通入二氧化碳气体,排除装置内的空气,故A正确;A中Cu与浓硝酸反应生成硝酸铜、二氧化氮和水,离子方程式为Cu+2N+4H+══Cu2++2NO2↑+2H2O,故B正确;
1
2
3
4
B中Cu与硝酸反应生成硝酸铜、NO和水,根据得失电子数目守恒,0.03 mol ×2=n(NO)×3,解得n(NO)=0.02 mol,NO2与水反应也能产生NO,因此试管B中产生NO气体大于0.02 mol,故C正确;NO不与水反应,不能用水进行尾气处理,故D错误。
本 课 结 束
