1.1.1.物质的分类课件(共23张PPT)2023-2024学年高一上学期人教版(2019)必修第一册
文档属性
| 名称 | 1.1.1.物质的分类课件(共23张PPT)2023-2024学年高一上学期人教版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 1.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-08 18:14:47 | ||
图片预览





文档简介
(共23张PPT)
第一章 物质及其变化
第一节 物质的分类与转化
第1课时 物质的分类
1.了解物质的分类依据
2.认识分类方法的应用
3.感受分类方法对化学学科研究和学习的重要作用
学习目标
生活中的分类
思考:大型超市里有成千上万种商品,为什么你能够迅速挑出你所需要的商品?
超市按照商品的不同用途将商品进行了分类。
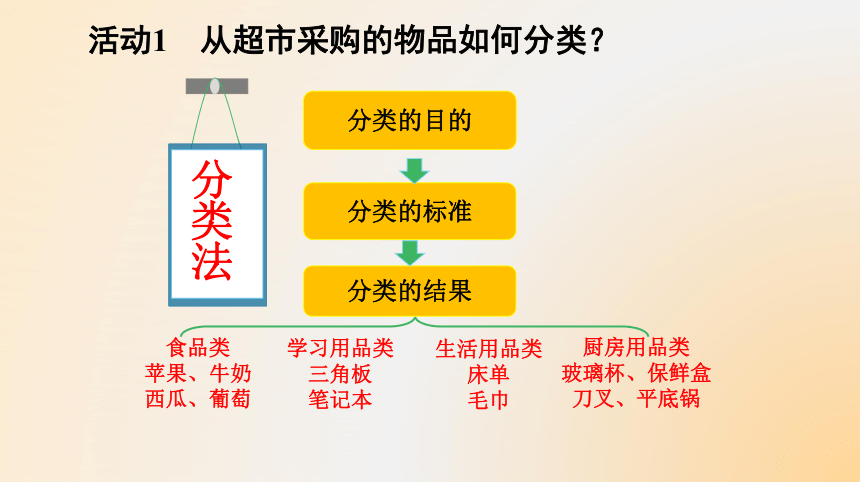
活动1 从超市采购的物品如何分类?
生活用品类
床单
毛巾
学习用品类
三角板
笔记本
厨房用品类
玻璃杯、保鲜盒
刀叉、平底锅
食品类
苹果、牛奶
西瓜、葡萄
分类的目的
分类的标准
分类的结果
分类法
一、物质分类
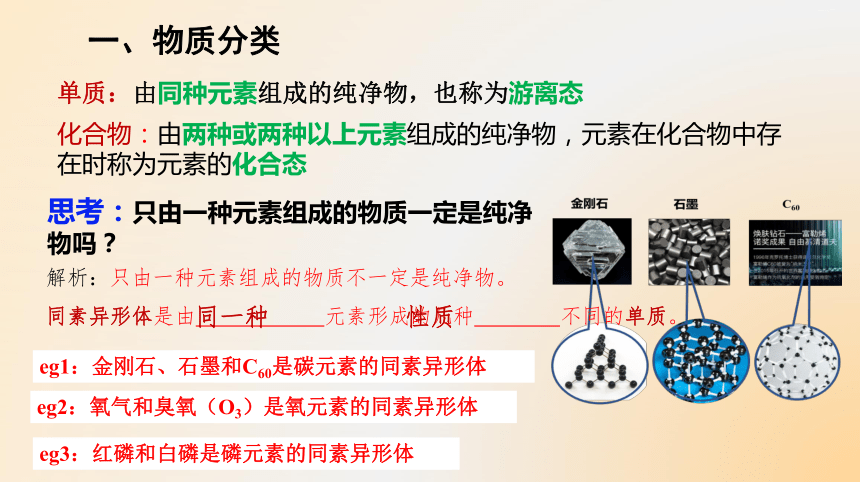
单质:由同种元素组成的纯净物,也称为游离态
化合物:由两种或两种以上元素组成的纯净物,元素在化合物中存在时称为元素的化合态
思考:只由一种元素组成的物质一定是纯净物吗?
解析:只由一种元素组成的物质不一定是纯净物。
同素异形体是由 元素形成的几种 不同的单质。
同一种
性质
eg1:金刚石、石墨和C60是碳元素的同素异形体
eg2:氧气和臭氧(O3)是氧元素的同素异形体
eg3:红磷和白磷是磷元素的同素异形体
1.下列属于同素异形体的是( )
A.水和双氧水 B.冰和干冰
C.二氧化碳和一氧化碳 D. S2、S4和S8
课堂检测
微提醒
同素异形体必须是单质
D
一、物质分类
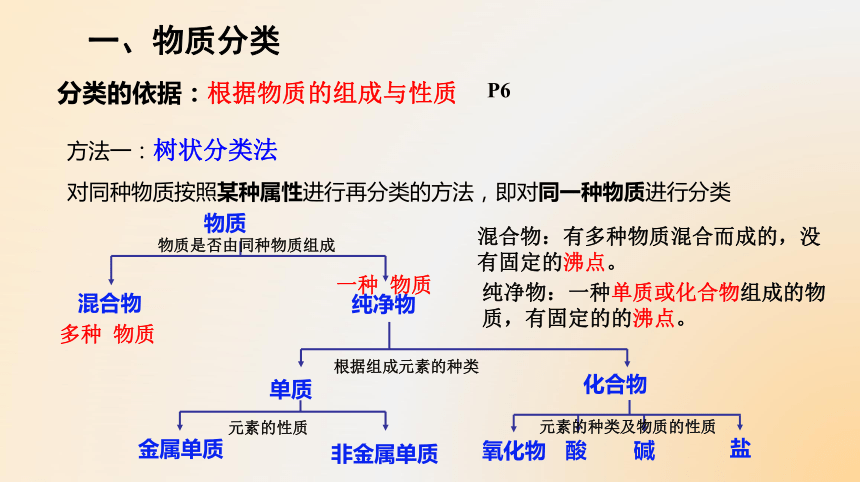
分类的依据:根据物质的组成与性质
方法一:树状分类法
对同种物质按照某种属性进行再分类的方法,即对同一种物质进行分类
物质
纯净物
混合物
单质
化合物
金属单质
非金属单质
酸
碱
盐
氧化物
混合物:有多种物质混合而成的,没有固定的沸点。
纯净物:一种单质或化合物组成的物质,有固定的的沸点。
物质是否由同种物质组成
根据组成元素的种类
元素的性质
元素的种类及物质的性质
P6
多种 物质
一种 物质
有以下几种物质,其中分类正确的是( )
①食盐水②液态氧③硝酸钾溶液④胆矾⑤二氧化碳
⑥氧化铜⑦金刚石⑧纯碱⑨生石灰⑩碘酒
A.属于混合物的是③⑩
B.属于氧化物的是⑤⑥
C.属于盐的是①④⑧
D.属于单质的是②⑦
D
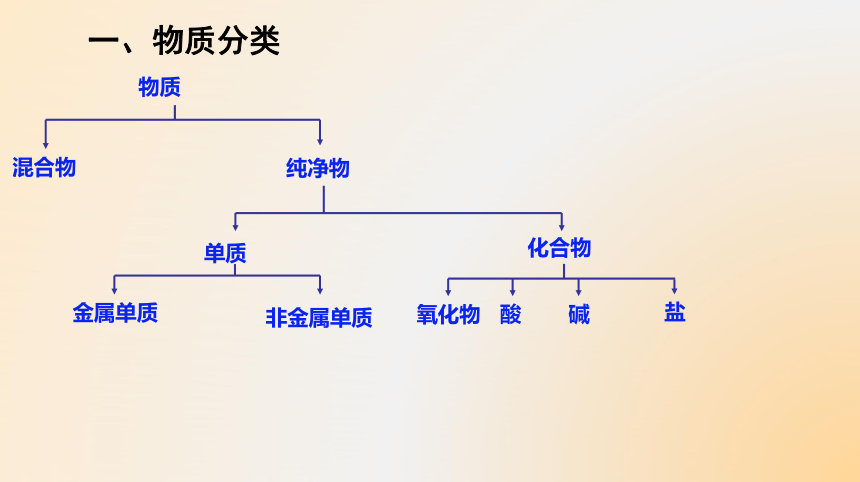
一、物质分类
物质
纯净物
混合物
单质
化合物
金属单质
非金属单质
酸
碱
盐
氧化物
一、物质分类
CuO、Fe2O3、Na2O
CO、P2O5、H2O
CO2、P2O5、SO3、Mn2O7
CaO、CuO、K2O
氧
化
物
从组成元素
非金属氧化物
金属氧化物
Al2O3
不成盐氧化物
酸性氧化物
碱性氧化物
两性氧化物
从性质
成盐氧化物
H2O、NO、CO
既能与酸又能与碱发生反应生
成盐和水的化合物
不能与酸和碱发生反应,生成盐和
水的化合物
氧化物 = X + O(负价)
氧化物:由两种元素组成且其中一种是氧元素的化合物,如CO2、SO3等
一、物质分类
Q1:非金属氧化物一定是酸性氧化物吗?
Q2:酸性氧化物一定是非金属氧化物吗?
不一定,例如:CO、H2O
不一定,例如:Mn2O7
Q3:金属氧化物一定是碱性氧化物吗?
Q4:碱氧化物一定是金属氧化物吗?
不一定,例如:Mn2O7、Al2O3、Na2O2
一定
氧化物 = X + O(负价)
酸性氧化物不一定是非金属氧化物,
非金属氧化物不一定是酸性氧化物。
金属氧化物不一定是碱性氧化物,
碱性氧化物一定是金属氧化物,
测一测
物质的分类如下图所示:
由图判断下列说法中不正确的是( )
A.甲图所示的分类方法属于树状分类法
B.乙图所示的分类方法属于交叉分类法
C.非金属氧化物一定是酸性氧化物
D.碱性氧化物一定是金属氧化物
C
解析:非金属氧化物不一定是酸性氧化物,如CO、NO等,既不能与酸反应又不能与碱反应生成相应的盐和水,属于不成盐氧化物。
酸
H2SO4、HNO3、H3PO4、H2CO3、CH3COOH
HCl、H2S
H2SO4、HNO3、HCl、HBr、HI、HClO4 、HMnO4 、HClO3
H2CO3 、 CH3COOH、HF、H2SO3、HClO
从是否含氧
从酸性强弱分
从电离产生的H+数目
无氧酸
含氧酸
弱酸
强酸
一元酸
二元酸
多元酸
HNO3、HCl、CH3COOH、
H2SO4、H2CO3、H2S
H3PO4
从挥发性
易挥发性酸
高沸点酸
HCl、HNO3
H2SO4、 H3PO4
(按能电离出H+的个数)
酸 = H+ + 酸根离子
酸:在水溶液中电离出阳离子全部为H+的化合物,如HCl、H2SO4
一个酸分子只能电离出一个氢离子
二元酸是指一个该酸分子电离后能产生
两个氢离子的酸
多元酸是指三元及其以上的酸,分为三元酸、四元酸等等
一、物质分类
碱
NaOH KOH Ba(OH)2 Ca(OH)2
Fe(OH)3
从碱性强弱
从电离产生的OH-数目
弱碱
强碱
一元碱
二元碱
三元碱
NaOH KOH NH3·H2O
Ba(OH)2 Fe(OH) 2
从溶解性
易溶碱
难溶碱
NaOH KOH Ba(OH)2 NH3·H2O
Cu(OH)2 Fe(OH)3
碱 = 金属离子(铵根离子) + OH-
一、物质分类
碱:在水溶液中电离出的阴离子全部为OH—的化合物,如NaOH,Ca(OH)2
NH3·H2O
盐
按溶解性
可溶盐
难溶盐
NaCl、AgNO3、CuSO4、NH4Cl
CaCO3、 BaCO3 、BaSO4
NaCl、CaCl2
酸式盐
碱式盐
正盐
NaHSO4、 Ca(HCO3)2
Cu2(OH)2CO3 (铜绿)
按组成
能电离出H+的化合物不一定是酸。能电离出OH-的化合物不一定是碱
盐 = 金属离子 (铵根离子) + 酸根离子
只有金属阳离子(或铵根)和酸根离子的盐
电离时生成的阳离子除金属离子(或铵根)外还有氢离子,阴离子为酸根离子的盐
除了含有金属离子和酸根离子外、还含有氢氧根或氧离子的盐类
一、物质分类
复盐
KAl(SO4)2
盐:由金属阳离子或NH4+与酸根离子结合形成的化合物,如BaSO4、(NH4)2CO3
1.物质的元素组成
单质:由同种元素组成的纯净物,也称为游离态
化合物:由两种或两种以上元素组成的纯净物,元素在化合物中存在时称为元素的化合态
酸:在水溶液中电离出阳离子全部为H+的化合物,如HCl、H2SO4
碱:在水溶液中电离出的阴离子全部为OH—的化合物,如NaOH,Ca(OH)2
盐:由金属阳离子或NH4+与酸根离子或非金属离子结合形成的化合物,如BaSO4、(NH4)2CO3
氧化物:由两种元素组成且其中一种是氧元素的化合物,如CO2、SO3等
氢化物:由两种元素组成且其中一种是氢元素的化合物,如H2S、NaH等
请尝试对你所学过的化学物质进行分类,并与同学交流。
物质
混合物
单质
纯净物
化合物
碱
盐
酸
氧化物
金属单质
非金属单质
Cu、Fe
O2、He
CaO、CO2
HCl、H2SO4
Ca(OH)2
NaCl、K2CO3
空气、碘酒、石油
空气 O2 CO2 Cu He Fe CaO NaCl Ca(OH)2 K2CO3 HCl H2SO4 碘酒 石油
是否由同种物质组成
是否由同种元素组成
按元素的种类
按物质的性质
说一说
常见混合物:煤油、煤、漂白粉、碱石灰、铝热剂、氯水、王水、水玻璃、福尔马林、水煤气、煤气、天然气
树状分类法
测一测
①酸 ②氢化物 ③氧化物 ④含氧酸 ⑤难挥发性酸
⑥强氧化性酸 ⑦一元酸 ⑧化合物 ⑨混合物
A.①②③④⑤⑥⑦⑧
B.①④⑤⑥⑦
C.①⑨
D.①④⑥⑦⑧
按照物质不同的分类方法,HNO3应属于( )
D
氢化物:由两种元素组成且其中一种是氢元素的化合物,如H2S、NaH等
Na2SO4
K2SO4
K2CO3
碳酸盐
硫酸盐
钾盐
Na2CO3
钠盐
根据组成的阳离子分类
根据组成的阴离子分类
交叉分类法
一、物质分类
方法二:交叉分类法:对一种事物用两种及以上标准分类。
二、方法引导
活动 预测陌生物质的性质
——如何吸收烟气中的SO2?
SO2
依据酸性氧化物共性
酸性氧化物
类比CO2性质
预测SO2的性质
SO2+H2O == H2SO3
SO2+CaO == CaSO3
SO2+2NaOH == Na2SO3 +H2O
学习评价1
易混淆概念辨析
下列每组中的两种物质之间的关系为同素异形体的一组是( )
A.CaO和CaS B. 和
C.C60和C70 D.HCNO和HOCN
同素异形体:同种元素形成的性质不同的单质
C
学习评价2
分类方法运用
现有下列物质:①H2O ②空气 ③Mg ④CaO ⑤H2SO4 ⑥Ca(OH)2 ⑦CuSO4·5H2O ⑧碘酒 ⑨C2H5OH ⑩NaHCO3。
其中属于混合物的是_____(填序号,下同);
属于酸的是________;属于盐的是________;属于有机物的是______;
②⑧ ⑤ ⑩⑦ ⑨
学习总结
物质的分类
1. 分类是一种科学的学习方法,科学分类的前提是有准确的分类标准
2. 用树状分类法,按物质组成、物质性质对氧化物、酸、碱、盐进行分类
3. 了解、掌握常见概念并区分
第一章 物质及其变化
第一节 物质的分类与转化
第1课时 物质的分类
1.了解物质的分类依据
2.认识分类方法的应用
3.感受分类方法对化学学科研究和学习的重要作用
学习目标
生活中的分类
思考:大型超市里有成千上万种商品,为什么你能够迅速挑出你所需要的商品?
超市按照商品的不同用途将商品进行了分类。
活动1 从超市采购的物品如何分类?
生活用品类
床单
毛巾
学习用品类
三角板
笔记本
厨房用品类
玻璃杯、保鲜盒
刀叉、平底锅
食品类
苹果、牛奶
西瓜、葡萄
分类的目的
分类的标准
分类的结果
分类法
一、物质分类
单质:由同种元素组成的纯净物,也称为游离态
化合物:由两种或两种以上元素组成的纯净物,元素在化合物中存在时称为元素的化合态
思考:只由一种元素组成的物质一定是纯净物吗?
解析:只由一种元素组成的物质不一定是纯净物。
同素异形体是由 元素形成的几种 不同的单质。
同一种
性质
eg1:金刚石、石墨和C60是碳元素的同素异形体
eg2:氧气和臭氧(O3)是氧元素的同素异形体
eg3:红磷和白磷是磷元素的同素异形体
1.下列属于同素异形体的是( )
A.水和双氧水 B.冰和干冰
C.二氧化碳和一氧化碳 D. S2、S4和S8
课堂检测
微提醒
同素异形体必须是单质
D
一、物质分类
分类的依据:根据物质的组成与性质
方法一:树状分类法
对同种物质按照某种属性进行再分类的方法,即对同一种物质进行分类
物质
纯净物
混合物
单质
化合物
金属单质
非金属单质
酸
碱
盐
氧化物
混合物:有多种物质混合而成的,没有固定的沸点。
纯净物:一种单质或化合物组成的物质,有固定的的沸点。
物质是否由同种物质组成
根据组成元素的种类
元素的性质
元素的种类及物质的性质
P6
多种 物质
一种 物质
有以下几种物质,其中分类正确的是( )
①食盐水②液态氧③硝酸钾溶液④胆矾⑤二氧化碳
⑥氧化铜⑦金刚石⑧纯碱⑨生石灰⑩碘酒
A.属于混合物的是③⑩
B.属于氧化物的是⑤⑥
C.属于盐的是①④⑧
D.属于单质的是②⑦
D
一、物质分类
物质
纯净物
混合物
单质
化合物
金属单质
非金属单质
酸
碱
盐
氧化物
一、物质分类
CuO、Fe2O3、Na2O
CO、P2O5、H2O
CO2、P2O5、SO3、Mn2O7
CaO、CuO、K2O
氧
化
物
从组成元素
非金属氧化物
金属氧化物
Al2O3
不成盐氧化物
酸性氧化物
碱性氧化物
两性氧化物
从性质
成盐氧化物
H2O、NO、CO
既能与酸又能与碱发生反应生
成盐和水的化合物
不能与酸和碱发生反应,生成盐和
水的化合物
氧化物 = X + O(负价)
氧化物:由两种元素组成且其中一种是氧元素的化合物,如CO2、SO3等
一、物质分类
Q1:非金属氧化物一定是酸性氧化物吗?
Q2:酸性氧化物一定是非金属氧化物吗?
不一定,例如:CO、H2O
不一定,例如:Mn2O7
Q3:金属氧化物一定是碱性氧化物吗?
Q4:碱氧化物一定是金属氧化物吗?
不一定,例如:Mn2O7、Al2O3、Na2O2
一定
氧化物 = X + O(负价)
酸性氧化物不一定是非金属氧化物,
非金属氧化物不一定是酸性氧化物。
金属氧化物不一定是碱性氧化物,
碱性氧化物一定是金属氧化物,
测一测
物质的分类如下图所示:
由图判断下列说法中不正确的是( )
A.甲图所示的分类方法属于树状分类法
B.乙图所示的分类方法属于交叉分类法
C.非金属氧化物一定是酸性氧化物
D.碱性氧化物一定是金属氧化物
C
解析:非金属氧化物不一定是酸性氧化物,如CO、NO等,既不能与酸反应又不能与碱反应生成相应的盐和水,属于不成盐氧化物。
酸
H2SO4、HNO3、H3PO4、H2CO3、CH3COOH
HCl、H2S
H2SO4、HNO3、HCl、HBr、HI、HClO4 、HMnO4 、HClO3
H2CO3 、 CH3COOH、HF、H2SO3、HClO
从是否含氧
从酸性强弱分
从电离产生的H+数目
无氧酸
含氧酸
弱酸
强酸
一元酸
二元酸
多元酸
HNO3、HCl、CH3COOH、
H2SO4、H2CO3、H2S
H3PO4
从挥发性
易挥发性酸
高沸点酸
HCl、HNO3
H2SO4、 H3PO4
(按能电离出H+的个数)
酸 = H+ + 酸根离子
酸:在水溶液中电离出阳离子全部为H+的化合物,如HCl、H2SO4
一个酸分子只能电离出一个氢离子
二元酸是指一个该酸分子电离后能产生
两个氢离子的酸
多元酸是指三元及其以上的酸,分为三元酸、四元酸等等
一、物质分类
碱
NaOH KOH Ba(OH)2 Ca(OH)2
Fe(OH)3
从碱性强弱
从电离产生的OH-数目
弱碱
强碱
一元碱
二元碱
三元碱
NaOH KOH NH3·H2O
Ba(OH)2 Fe(OH) 2
从溶解性
易溶碱
难溶碱
NaOH KOH Ba(OH)2 NH3·H2O
Cu(OH)2 Fe(OH)3
碱 = 金属离子(铵根离子) + OH-
一、物质分类
碱:在水溶液中电离出的阴离子全部为OH—的化合物,如NaOH,Ca(OH)2
NH3·H2O
盐
按溶解性
可溶盐
难溶盐
NaCl、AgNO3、CuSO4、NH4Cl
CaCO3、 BaCO3 、BaSO4
NaCl、CaCl2
酸式盐
碱式盐
正盐
NaHSO4、 Ca(HCO3)2
Cu2(OH)2CO3 (铜绿)
按组成
能电离出H+的化合物不一定是酸。能电离出OH-的化合物不一定是碱
盐 = 金属离子 (铵根离子) + 酸根离子
只有金属阳离子(或铵根)和酸根离子的盐
电离时生成的阳离子除金属离子(或铵根)外还有氢离子,阴离子为酸根离子的盐
除了含有金属离子和酸根离子外、还含有氢氧根或氧离子的盐类
一、物质分类
复盐
KAl(SO4)2
盐:由金属阳离子或NH4+与酸根离子结合形成的化合物,如BaSO4、(NH4)2CO3
1.物质的元素组成
单质:由同种元素组成的纯净物,也称为游离态
化合物:由两种或两种以上元素组成的纯净物,元素在化合物中存在时称为元素的化合态
酸:在水溶液中电离出阳离子全部为H+的化合物,如HCl、H2SO4
碱:在水溶液中电离出的阴离子全部为OH—的化合物,如NaOH,Ca(OH)2
盐:由金属阳离子或NH4+与酸根离子或非金属离子结合形成的化合物,如BaSO4、(NH4)2CO3
氧化物:由两种元素组成且其中一种是氧元素的化合物,如CO2、SO3等
氢化物:由两种元素组成且其中一种是氢元素的化合物,如H2S、NaH等
请尝试对你所学过的化学物质进行分类,并与同学交流。
物质
混合物
单质
纯净物
化合物
碱
盐
酸
氧化物
金属单质
非金属单质
Cu、Fe
O2、He
CaO、CO2
HCl、H2SO4
Ca(OH)2
NaCl、K2CO3
空气、碘酒、石油
空气 O2 CO2 Cu He Fe CaO NaCl Ca(OH)2 K2CO3 HCl H2SO4 碘酒 石油
是否由同种物质组成
是否由同种元素组成
按元素的种类
按物质的性质
说一说
常见混合物:煤油、煤、漂白粉、碱石灰、铝热剂、氯水、王水、水玻璃、福尔马林、水煤气、煤气、天然气
树状分类法
测一测
①酸 ②氢化物 ③氧化物 ④含氧酸 ⑤难挥发性酸
⑥强氧化性酸 ⑦一元酸 ⑧化合物 ⑨混合物
A.①②③④⑤⑥⑦⑧
B.①④⑤⑥⑦
C.①⑨
D.①④⑥⑦⑧
按照物质不同的分类方法,HNO3应属于( )
D
氢化物:由两种元素组成且其中一种是氢元素的化合物,如H2S、NaH等
Na2SO4
K2SO4
K2CO3
碳酸盐
硫酸盐
钾盐
Na2CO3
钠盐
根据组成的阳离子分类
根据组成的阴离子分类
交叉分类法
一、物质分类
方法二:交叉分类法:对一种事物用两种及以上标准分类。
二、方法引导
活动 预测陌生物质的性质
——如何吸收烟气中的SO2?
SO2
依据酸性氧化物共性
酸性氧化物
类比CO2性质
预测SO2的性质
SO2+H2O == H2SO3
SO2+CaO == CaSO3
SO2+2NaOH == Na2SO3 +H2O
学习评价1
易混淆概念辨析
下列每组中的两种物质之间的关系为同素异形体的一组是( )
A.CaO和CaS B. 和
C.C60和C70 D.HCNO和HOCN
同素异形体:同种元素形成的性质不同的单质
C
学习评价2
分类方法运用
现有下列物质:①H2O ②空气 ③Mg ④CaO ⑤H2SO4 ⑥Ca(OH)2 ⑦CuSO4·5H2O ⑧碘酒 ⑨C2H5OH ⑩NaHCO3。
其中属于混合物的是_____(填序号,下同);
属于酸的是________;属于盐的是________;属于有机物的是______;
②⑧ ⑤ ⑩⑦ ⑨
学习总结
物质的分类
1. 分类是一种科学的学习方法,科学分类的前提是有准确的分类标准
2. 用树状分类法,按物质组成、物质性质对氧化物、酸、碱、盐进行分类
3. 了解、掌握常见概念并区分
