3.1 铁及其化合物 课堂同步练(含解析)2023-2024学年高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 3.1 铁及其化合物 课堂同步练(含解析)2023-2024学年高一上学期化学人教版(2019)必修第一册 |  | |
| 格式 | docx | ||
| 文件大小 | 215.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-08 21:42:36 | ||
图片预览




文档简介
3.1 铁及其化合物 课堂同步练
一、单选题
1.次磷酸根离子()具有较强的还原性。利用Fe2+、H2O2联合除去废水中,转化过程如图所示。下列说法错误的是( )
A.转化(I)中1mol氧化剂参加反应转移1mole-
B.转化(II)的离子方程式:2·OH+=+H2
C.转化(III)表明Fe3+结合的能力强于H+结合的能力
D.、中心原子的杂化方式相同
2.化学与生产、生活密切相关。下列说法错误的是( )
A.过氧化钠可用于呼吸面具或潜水艇中作为氧气的来源
B.“84”消毒液的有效成分是次氯酸钠
C.积极推广共享单车以减少雾霾和光化学烟雾
D.Fe3O4是一种复杂的混合物,可以写成FeO·Fe2O3
3.下列有关物质性质的叙述错误的是( )
A.少量铁在足量氧气中燃烧可以得到Fe2O3固体
B.将工业废气通入FeCl2溶液中,可除去工业废气中的氯气
C.高温下将水蒸气通入铁粉中,固体质量增加
D.制备Fe(OH)2过程中应该注意隔绝空气
4.向100和的混合液中加入一定量铁粉,溶液中不溶物的质量变化如图。下列说法正确的是( )
A.氧化性:
B.b点溶液中的金属阳离子有:、
C.原溶液中和物质的量之比为
D.溶液体积变化忽略,c点溶液中
5.下列物质性质与应用对应关系正确的是( )
A.氯气具有漂白性,可作漂白剂
B.Fe2O3是一种红棕色粉末,常用作红色油漆
C.Na2O2具有强氧化性,常用作供氧剂
D.FeCl3能水解,可用于腐蚀印刷铜制电路板
6.印刷铜质电路板的“腐蚀液”为FeCl3.已知铜、铁均能与FeCl3溶液反应,反应方程式分别为:Cu+2FeCl3═CuCl2+2FeCl2,FeCl3+2Fe═3FeCl2.现将一包铜铁的混合粉末放入到盛有FeCl3溶液的烧杯中,充分反应后烧杯仍有少量固体.关于烧杯中物质组成的说法正确的是( )
A.溶液中一定含有FeCl2,固体中一定含有铜
B.溶液中一定含有FeCl2、FeCl3,固体中一定含有铜和铁
C.溶液中一定含有FeCl2、CuCl2,固体中一定含有铜
D.溶液中一定含有FeCl2,固体只有铜
7.下列说法错误的是( )
①FeCl3溶液可用于铜质印刷线路板制作是因为FeCl3能从含Cu2+的溶液中置换出铜
②室温下,不能将浓硫酸盛放在铁桶中 ③K+、Fe3+、NO3-、SCN﹣在水溶液中能大量共存
④因氧化铁能与酸反应,可用于制作红色涂料 ⑤将Fe(NO3)2样品溶于稀H2SO4后,滴加KSCN溶液观察溶液是否变红,可检验Fe(NO3)2晶体是否已氧化变质.
A.仅①②③ B.仅①③④
C.仅②④⑤ D.全部
8.部分含铁物质的物质类别与相应化合价的关系如图所示,下列相关说法错误的是( )
A.Fe高温下可与水蒸气反应生成②
B.③用于生产红色涂料,可长久不变色
C.在空气中加热⑥,不易得到纯净的FeO,易生成红棕色的Fe2O3
D.向盛有少量酸性KMnO4溶液的试管中加入足量④溶液,紫色褪去,说明④溶液未变质
9.已知X,Y,Z,W均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示(部分产物已略去).则W,X不可能是( )
选项 W X
A 稀硫酸 NaAlO2溶液
B 稀硝酸 Fe
C CO2 Ca(OH)2溶液
D Cl2 Fe
A.A B.B C.C D.D
10.下列解释事实的方程式正确的是( )
A.用氯化钠溶液做导电实验,灯泡发光:NaCl Na++Cl﹣
B.氢氧化铁沉淀溶于氢碘酸中:Fe(OH)3+3H+═Fe3++3H2O
C.石灰水表面漂着的“白膜”可用醋酸溶解:CaCO3+2H+═Ca2++H2O+CO2↑
D.向硫酸氢钠溶液中滴加氢氧化钡溶液至刚好为中性:2H++SO42﹣+Ba2++2OH﹣═BaSO4↓+2H2O
11.为了检验某Fe2+溶液是否变质,可向溶液中加入( )
A.NaOH溶液 B.铁片 C.石蕊溶液 D.KSCN溶液
12.为了防止变质,月饼包装袋内放入一小包铁粉,铁粉主要表现的性质是( )
A.氧化性 B.还原性 C.漂白性 D.酸性
13.下列有关铁及其化合物说法错误的是( )
A.将饱和氯化铁溶液滴入沸水中继续煮沸,可制得氢氧化铁胶体
B.FeCl2既有氧化性又有还原性
C.铁与硫酸铜溶液反应后滴加KSCN溶液,溶液变红
D.生铁和钢都是铁的合金,其中生铁的含碳量高于钢
14.下列关于铁的叙述正确的是( )
①铁能被磁铁吸引,但纯铁易被腐蚀 ②在人体内的血红蛋白中含有铁元素 ③铁位于元素周期表中第四周期第ⅧB族 ④铁能在氧气中剧烈燃烧,但不能在水蒸气中燃烧 ⑤铁与强氧化剂硝酸反应的产物仅是Fe(NO3)3⑥不能通过化合反应制得FeCl2和Fe(OH)3
A.①③ B.②④ C.②⑤ D.④⑥
15.下列说法中正确的是( )
A.铝粉与氧化镁混合共热能冶炼出镁
B.FeCl2只能通过置换反应生成,FeCl3只能通过化合反应生成
C.Fe3O4中铁元素的化合价为+2,+3价,故Fe3O4为混合物
D.等质量的NaHCO3和Na2CO3与足量盐酸反应,在相同条件下Na2CO3产生的CO2体积小
16.将0.3 mol钠、0.1 mol铁分别加入到各盛有500 mL 0.2 mol·L-1稀硫酸的两个烧杯中,下列说法正确的是( )
A.两个烧杯中金属沉在液面下
B.两个烧杯中都没有金属剩余
C.两个烧杯中都有金属剩余
D.两个烧杯中产生氢气的质量相同
二、综合题
17.填空。
(1)①小苏打的化学式是 ;
②漂白粉有效成分的化学式 。
(2)实验室制氯气的化学方程式是 。
(3)向FeCl3溶液中滴加几滴KSCN溶液,观察到的现象是 。
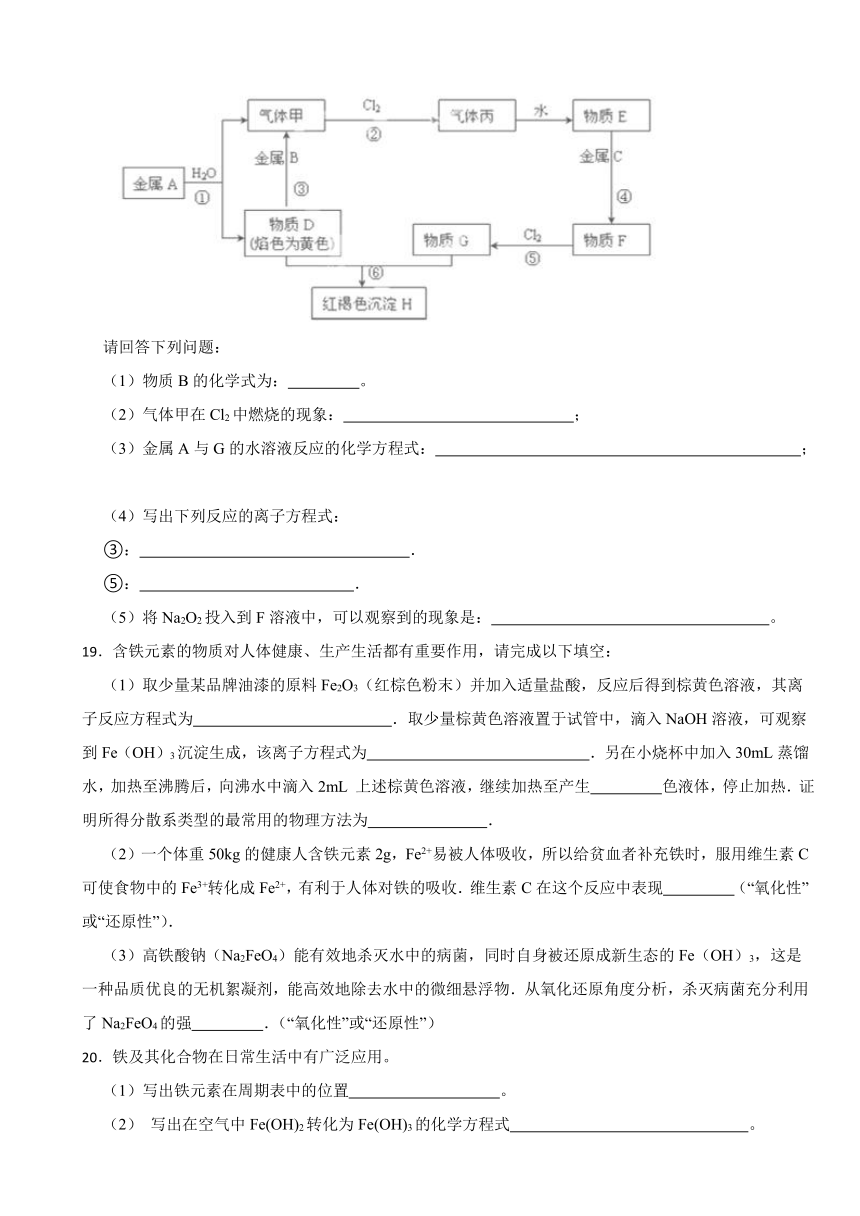
18.现有金属单质A,B,C和气体甲、丙以及物质D、E、F、G、H,它们之间的相互转化关系如下图所示(图中有些反应的生成物和反应的条件没有标出)。
请回答下列问题:
(1)物质B的化学式为: 。
(2)气体甲在Cl2中燃烧的现象: ;
(3)金属A与G的水溶液反应的化学方程式: ;
(4)写出下列反应的离子方程式:
③: .
⑤: .
(5)将Na2O2投入到F溶液中,可以观察到的现象是: 。
19.含铁元素的物质对人体健康、生产生活都有重要作用,请完成以下填空:
(1)取少量某品牌油漆的原料Fe2O3(红棕色粉末)并加入适量盐酸,反应后得到棕黄色溶液,其离子反应方程式为 .取少量棕黄色溶液置于试管中,滴入NaOH溶液,可观察到Fe(OH)3沉淀生成,该离子方程式为 .另在小烧杯中加入30mL蒸馏水,加热至沸腾后,向沸水中滴入2mL 上述棕黄色溶液,继续加热至产生 色液体,停止加热.证明所得分散系类型的最常用的物理方法为 .
(2)一个体重50kg的健康人含铁元素2g,Fe2+易被人体吸收,所以给贫血者补充铁时,服用维生素C可使食物中的Fe3+转化成Fe2+,有利于人体对铁的吸收.维生素C在这个反应中表现 (“氧化性”或“还原性”).
(3)高铁酸钠(Na2FeO4)能有效地杀灭水中的病菌,同时自身被还原成新生态的Fe(OH)3,这是一种品质优良的无机絮凝剂,能高效地除去水中的微细悬浮物.从氧化还原角度分析,杀灭病菌充分利用了Na2FeO4的强 .(“氧化性”或“还原性”)
20.铁及其化合物在日常生活中有广泛应用。
(1)写出铁元素在周期表中的位置 。
(2) 写出在空气中Fe(OH)2转化为Fe(OH)3的化学方程式 。
(3)绿矾(FeSO4·7H2O)是补血剂的原料,易变质。
①由FeSO4溶液制得FeSO4·7H2O过程中的操作有 、过滤、洗涤、干燥。
②检验绿矾是否变质的试剂是 。
(4)利用绿矾制备还原铁粉的工业流程如下:
①干燥过程主要是为了脱去游离水和结晶水,过程中会有少量FeCO3·nH2O在空气中被氧化为FeOOH,该反应的化学方程式为 。
②取干燥后的FeCO3样品12.49g,焙烧,最终得到还原铁粉6.16g,计算样品中杂质FeOOH的质量 。
(5)以羰基化合物为载体运用化学平衡移动原理分离、提纯某纳米级活性铁粉(含有一些不反应的杂质),反应装置如下图。
Fe(s)+5CO(g) Fe(CO)5(g) △H<0,T1 T2(填“>”、“<”或“=”)。
21.回答以下问题:
(1)将已去除表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是 .
(2)另称取已去除表面氧化物的铁钉(碳素钢)6.0g放入15.0mL浓硫酸中,加热,充分反应后得到溶液X并收集到气体Y.
①甲同学认为X中除Fe3+外还可能含有Fe2+.写出生成Fe2+所有可能的离子方程式: .(写出一个即可)
②乙同学取336mL(标准状况)气体Y通入足量氯水中,发生反应的化学方程式为: .
然后加入足量BaCl2溶液,经适当操作后得干燥固体2.33g.由于此推知气体Y中SO2的体积分数为 .
(3)向100mL水中投入Na和Al共16克,充分反应后剩余金属1g.计算放出H2的体积为 升(标准状况下)
(4)向一定量的Fe、Fe2O3和CuO混合物投入100mL 2.2mol/L的硫酸溶液中,充分反应后生成896mL标准状况下的气体,得不溶物1.28g,过滤后,向滤液中加入2mol/L的NaOH溶液,加至40mL时开始出现沉淀,则滤液中FeSO4的物质的量浓度为(设滤液体积为100mL) mol/L.
答案解析部分
1.【答案】B
【解析】【解答】A.从图中分析,反应(I)中氧化剂是H2O2,其还原产物是A,同时还有,故只有一半的氧原子从-1价降到-2价,即1mol氧化剂参加反应转移1mole-,A不符合题意;
B.转化(II)的离子方程式:4·OH+=+2H2O,B符合题意;
C.转化(III)表明上的H被Fe3+替换,即Fe3+结合的能力强于H+结合的能力,C不符合题意;
D.、中心原子价电子数对数都是4,均是sp3杂化,D不符合题意;
故答案为:B。
【分析】A、结合图示可以知道过氧化氢中的氧原子没有全部降价;
B、结合图示可以知道反应为4·OH+=+2H2O;
C、上的H被Fe3+替换,即Fe3+结合的能力强于H+结合的能力;
D、杂化轨道=中心原子成键电子对数+孤电子对数,若杂化轨道数=2,为sp杂化,杂化轨道数=3,为sp2杂化,杂化轨道数=4,为sp3杂化。
2.【答案】D
【解析】【解答】A.过氧化钠能与二氧化碳反应生成氧气,可用于呼吸面具或潜水艇中作为氧气的来源,A不符合题意;
B.84消毒液中含有的NaClO具有强氧性,可以杀菌消毒,即NaClO是“84消毒液”的有效成分,B不符合题意;
C.积极推广共享单车,可以减少汽车的使用,能减少雾霾和光化学烟雾,C不符合题意;
D.Fe3O4是一种化合物,不是混合物,D符合题意;
故答案为:D。
【分析】A.过氧化钠常用作供氧剂;
B.84消毒液由氯气和氢氧化钠溶液反应制得;
C.单车的使用有利于减少化学燃料的使用;
D.混合物是指由两种或两种以上物质组成。
3.【答案】B
【解析】【解答】A.少量铁,氧气足量时,可以反应得到Fe2O3固体,故A不符合题意;
B.氯气具有强氧化性,能氧化亚铁离子生成铁离子,铁离子能氧化Fe生成亚铁离子;所以去工业废气中的氯气,还需加入铁粉,故B符合题意;
C.高温下将水蒸气通入铁粉中,生成四氧化三铁,固体质量增加,故C不符合题意;
D.二价Fe容易被氧化,所以制备Fe(OH)2过程中应该注意隔绝空气,故D不符合题意;
故答案为:B。
【分析】A.铁与氧气燃烧,可以生成主要四氧化三铁,当铁少量时候也可以生成三氧化二铁。
B.亚铁溶液极易被空气氧化,一般不用氯化亚铁吸收氯气,常用氢氧化钠溶液。
4.【答案】C
【解析】【解答】A.Fe先被Fe3+氧化,然后再被Cu2+氧化,氧化性,故A不符合题意;
B.b点①②反应完全,仅有Fe2+,B不符合题意;
C.①消耗0.1molFe粉,原溶液中有0.2molFe3+;②消耗0.05molFe粉,原溶液中有0.05molCu2+,Cu2+与Fe3+物质的量比为1:4,C符合题意;
D.c点有0.3molFeCl2和0.05molCuCl2,n(Cl-)=0.7mol,c(Cl-)==7mol/L,D不符合题意;
故答案为:C。
【分析】A.依据强制弱及反应的先后顺序,Fe先被Fe3+氧化,然后再被Cu2+氧化;
B.由A项分析结合图中曲线判断;
C.图中曲线判断计算;
D.依据电荷守恒。
5.【答案】B
【解析】【解答】解:A、氯气与水反应生成具有强氧化性的HClO,而氯气本身不做漂白剂,故A错误;
B、Fe2O3为红色物质,则常用作红色油漆和涂料,故B正确;
C、过氧化钠与水和二氧化碳反应生成氧气,而不是本身的强氧化性,故C错误;
D、氯化铁与铜反应生成氯化亚铁和氯化铜,是铜发生氧化还原反应,而不是水解反应,故D错误;
故选B.
【分析】A、氯气与水反应生成具有强氧化性的HClO;
B、Fe2O3为红色物质,可作油漆涂料;
C、过氧化钠与水和二氧化碳反应生成氧气;
D、氯化铁与铜反应生成氯化亚铁和氯化铜.
6.【答案】A
【解析】【解答】解:A.铁的化学性质比铜活泼,因此铁首先和氯化铁溶液反应,只有铁反应完,铜才可以与氯化铁溶液反应生成CuCl2,因此充分反应后烧杯中仍有少量固体,则烧杯溶液中一定含有的溶质是 FeCl2,烧杯中一定含有的固体是 Cu,故A正确;
B.烧杯仍有少量固体,而铁和铜都能够与三价铁离子反应,所以不可能有三价铁离子,故B错误;
C.如果铁过量,则溶液中只有氯化亚铁,不会有氯化铜,故C错误;
D.铁过量,反应生成氯化铁,剩余铜和铁,故D错误;
故选:A.
【分析】在金属活动性顺序中,铁>铜,即铁的还原性强于铜,将一包铜铁的混合粉末放入到盛有FeCl3溶液的烧杯中,铁先与三价铁离子反应,铁过量则铜不发生反应,铁不足铜再与氯化铁发生反应.
7.【答案】D
【解析】【解答】①氯化铁和铜反应生成氯化亚铁和氯化铜,所以FeCl3溶液可用于铜质印刷线路板制作,①不符合题意;
②室温下,浓硫酸使Fe钝化,所以能将浓硫酸盛放在铁桶中,②不符合题意;
③Fe3+与SCN-发生络合反应,所以Fe3+与SCN-不能大量共存,③不符合题意;
④氧化铁为红棕色,而且氧化铁难溶于水,可以作红色涂料,因果关系不符合题意,④不符合题意;
⑤将Fe(NO)2样品溶于稀H2SO4后,酸性条件下,NO3-能把Fe2+氧化为Fe3+,滴加KSCN溶液变红,不能说明Fe(NO3)2晶体已经变质,⑤不符合题意;
综上,说法错误的为:①②③④⑤,D符合题意;
故答案为:D
【分析】①Fe3+具有氧化性,能将Cu氧化成Cu2+;
②常温下,浓硫酸能使铁钝化;
③Fe3+能与SCN-形成络合物;
④能与酸反应,与做红色涂料没关系;
⑤NO3-在酸性条件下具有氧化性,能将Fe2+氧化成Fe3+;
8.【答案】D
【解析】【解答】A. 高温下铁与水蒸气反应生成和,A项不符合题意;
B. 作红色涂料很稳定,B项不符合题意;
C. 在空气中容易发生反应,分解为,C项不符合题意;
D. 实验只能证明有,无法判断是否有,D项符合题意。
故答案为:D。
【分析】易错分析:D.要检验含有二价铁溶液是否变质,应该检验是否含有三价铁,应该用硫氰化钾进行检验。
9.【答案】D
【解析】【解答】解:A、W为稀硫酸、X为NaAlO2溶液,则Y为硫酸铝,Z为氢氧化铝,硫酸铝通入二氧化碳转化为氢氧化铝,氢氧化铝与硫酸反应生成硫酸铝,所以可以实现以上转化,故A不选;
B、W为稀硝酸、X为Fe,则Y为硝酸铁,Z为硝酸亚铁,硝酸铁与铁反应生成硝酸亚铁,硝酸亚铁与硝酸反应生成硝酸﹣﹣所以可以实现以上转化,故B不选;
C、W为CO2、X为Ca(OH)2溶液,则Y为碳酸氢钙,Z为碳酸钙,二者可以相互转化,碳酸钙和二氧化碳、水反应生成碳酸氢钙,碳酸氢钙分解生成碳酸钙,故C不选;
D、W为Cl2、X为Fe,铁和氯气反应只能生成氯化铁,不能生成不同价态的化合物,故D错误;
故选D.
【分析】A、W为稀硫酸、X为NaAlO2溶液,则Y为硫酸铝,Z为氢氧化铝;
B、W为稀硝酸、X为Fe,则Y为硝酸铁,Z为硝酸亚铁;
C、W为CO2、X为Ca(OH)2溶液,则Y为碳酸氢钙,Z为碳酸钙,二者可以相互转化;
D、W为Cl2、X为Fe,铁和氯气反应只能生成氯化铁;
10.【答案】D
【解析】【解答】解:A.用氯化钠溶液做导电实验,灯泡发光,发生电离为NaCl=Na++Cl﹣,故A错误;
B.氢氧化铁沉淀溶于氢碘酸中的离子反应为2Fe(OH)3+2I﹣+6H+═2Fe2++I2+6H2O,故B错误;
C.石灰水表面漂着的“白膜”可用醋酸溶解的离子反应为CaCO3+2CH3COOH═2CH3COO﹣+Ca2++H2O+CO2↑,故C错误;
D.向硫酸氢钠溶液中滴加氢氧化钡溶液至刚好为中性的离子反应为2H++SO42﹣+Ba2++2OH﹣═BaSO4↓+2H2O,故D正确;
故选D.
【分析】A.电离的条件为溶于水,不是通电;
B.发生氧化还原反应生成碘化亚铁、碘、水;
C.醋酸在离子反应中保留化学式;
D.反应生成硫酸钡、硫酸钠和水.
11.【答案】D
【解析】【解答】Fe2+溶液若变质,溶液中含有Fe3+,要检验Fe2+溶液是否变质即检验溶液中是否含Fe3+,检验Fe3+用KSCN溶液,加入KSCN溶液后,若溶液变红色证明Fe2+溶液已经变质,若溶液不变红说明Fe2+溶液没有变质,
故答案为:D。
【分析】A.若不变质,加入NaOH溶液后,因为氢氧化亚铁及易被氧化为氧化铁,而不溶于进行判断;
B.铁片与变质后的铁离子反应的现象不明显;
C.石蕊试液不能检验铁离子;
D.硫氰化钾溶液是检验铁离子的特效试剂。
12.【答案】B
【解析】【解答】月饼包装袋内放入一小包铁粉,主要是为了吸收氧气,防止月饼中的油脂被空气中的氧气氧化,所以铁粉表现还原性,
故答案为:B。
【分析】铁粉容易被氧气氧化,可以吸收包装内的氧气。
13.【答案】C
【解析】【解答】A.制备Fe(OH)3胶体的操作为:加热烧杯中的水至沸腾,向沸水滴加几滴饱和氯化铁溶液,继续煮沸至溶液呈红褐色,即停止加热,得到氢氧化铁胶体,A项不符合题意;
B.FeCl2中Fe呈+2价,为中间价态,因此FeCl2既有氧化性又有还原性,B项不符合题意;
C.铁与硫酸铜溶液反应的方程式为: ,反应后的溶液中无Fe3+,滴加KSCN溶液,溶液不会变红,C项符合题意;
D.生铁和钢都是碳铁合金,生铁中碳的含量高于钢中碳的含量,D项不符合题意;
故答案为:C。
【分析】硫氰酸钾主要是检验铁离子,但是铁和硫酸铜溶液反应不会查产生铁离子,主要形成的是亚铁离子,其他均正确
14.【答案】B
【解析】【解答】当铁中含有杂质时,在潮湿的空气中会发生电化学腐蚀,而纯铁的抗腐蚀能力较强;铁位于元素周期表的第Ⅷ族,而不是第ⅧB族;铁与强氧化剂反应,能被氧化为Fe3+,但若铁过量,则Fe3+被Fe还原为Fe2+,所以,Fe与HNO3反应的产物可能因铁过量而生成Fe(NO3)2;FeCl2、Fe(OH)3可分别通过化合反应Fe+2FeCl3=3FeCl2、4Fe(OH)2+O2+2H2O=4Fe(OH)3制得。
故答案为:B
【分析】①纯铁稳定,不易发生腐蚀;②血红蛋白中含有铁元素;③根据帖元素在周期表中的位置判断;
④铁能与水蒸气反应;⑤铁与硝酸反应的产物与硝酸的量的多少有关;⑥氯化铁与铁反应生成氯化亚铁,氢氧化亚铁与氧气化合生成氢氧化铁。
15.【答案】D
【解析】【解答】A.由于金属活动性Mg>Al,因此铝粉无法将MgO中的Mg置换,A不符合题意;
B.FeCl2、FeCl3都可通过复分解反应制得,如Fe(OH)2+2HCl=FeCl2+2H2O、Fe(OH)3+3HCl=FeCl3+3H2O,B不符合题意;
C.Fe3O4只表示一种物质,为纯净物,C不符合题意;
D.由于NaHCO3中所含碳元素的质量分数大于Na2CO3,因此等质量的NaHCO3和Na2CO3中,NaHCO3中所含碳元素的质量大,因此与足量的稀盐酸反应生成CO2的体积较大,D符合题意;
故答案为:D
【分析】A.根据Mg、Al金属性的强弱分析;
B.FeCl2、FeCl3都可通过复分解反应制得;
C.Fe3O4为纯净物;
D.根据碳元素质量守恒进行分析;
16.【答案】B
【解析】【解答】A. 钠的密度小于水,因此两个烧杯中铁沉在液面下,钠浮在水面上,A不符合题意;
B. 由于钠极易和水反应,则钠投入到硫酸中钠一定全部反应。硫酸的物质的量是0.5L×0.2mol/L=0.1mol,铁也是0.1mol,则铁和稀硫酸恰好反应,所以两个烧杯中都没有金属剩余,B符合题意;
C. 根据选项B中的分析可知两个烧杯中都没有金属剩余,C不符合题意;
D. 0.3mol钠产生0.15mol氢气,0.1mol铁产生0.1mol氢气,则两个烧杯中产生氢气的质量不相同,D不符合题意。
故答案为:B。
【分析】硫酸的物质的量是0.5L×0.2mol/L=0.1mol,铁和硫酸反应的化学方程式为:;钠和稀硫酸和水都反应。
17.【答案】(1)NaHCO ;Ca(ClO)2
(2)
(3)溶液出现红色
【解析】【解答】(1)①小苏打是碳酸氢钠,其化学式为:NaHCO ;
②漂白粉是氯化钙和次氯酸钙的混合物,其中有效成分是Ca(ClO)2;
(2)实验室制氯气是用二氧化锰和浓盐酸加热制备,方程式为:;
(3)Fe3+与SCN-反应生成血红色的Fe(SCN)3络合物,所以向FeCl3溶液中滴加几滴KSCN溶液,观察到的现象是溶液出现红色,故答案为:溶液出现红色。
【分析】(1)①小苏打为碳酸氢钠;
②漂白粉有效成分为次氯酸钙;
(2)实验室常加热浓盐酸和二氧化锰制备氯气;
(3)三价铁遇KSCN溶液变红。
18.【答案】(1)Al
(2)有苍白色火焰,瓶口有白雾
(3)6Na+2FeCl3+6H2O=2Fe(OH)3↓+6NaCl+3H2↑
(4)2OH﹣+2H2O+2Al=2AlO2﹣+3H2↑;Cl2+2Fe2+=2Fe3++2Cl﹣
(5)生成红褐色沉淀,有无色气体产生
【解析】【解答】根据分析可知A是Na,B是Al,C是Fe,D是NaOH,E是盐酸,F是FeCl2,G是FeCl3,H是Fe(OH)3,甲是H2,丙是HCl。则(1)物质B是铝,化学式为Al。
(2)氢气在Cl2中燃烧生成氯化氢,则现象为有苍白色火焰,瓶口有白雾;(3)金属钠极易与水反应生成氢氧化钠和氢气,生成的氢氧化钠再与氯化铁反应,则与氯化铁溶液反应的化学方程式6Na+2FeCl3+6H2O=2Fe(OH)3↓+6NaCl+3H2↑;
(4)写出下列反应的离子方程式:③是Al与NaOH溶液发生反应生成偏铝酸钠和氢气,反应的离子方程式是2OH-+2H2O+2Al=2AlO2-+3H2↑。⑤是氯气氧化氯化亚铁生成氯化铁,离子方程式为Cl2+2Fe2+=2Fe3++2Cl﹣;
(5)过氧化钠具有强氧化性,溶于水与水反应生成氢氧化钠和氧气,则将Na2O2投入到氯化亚铁溶液中,可以观察到的现象是生成红褐色沉淀,有无色气体产生。
【分析】根据红褐色沉淀H为突破口,确定H是氢氧化铁,金属单质A与水反应的产物D的焰色反应为黄色,确定含有钠元素,进而推断A是金属钠,物质G含有铁离子,结合转化关系推出其他物质即可。
19.【答案】(1)Fe2O3+6H+=2Fe3++3H2O;Fe3++3OH﹣═Fe(OH)3↓;红褐色;丁达尔效应
(2)还原性
(3)氧化性
【解析】【解答】解:(1)取少量某品牌油漆的原料Fe2O3(红棕色粉末)并加入适量盐酸,氧化铁与盐酸反应生成铁离子和水,反应的离子方程式为:Fe2O3+6H+=2Fe3++3H2O;棕黄色FeCl3溶液中滴入NaOH溶液会产生Fe(OH)3沉淀,反应的离子方程式为:Fe3++3OH﹣═Fe(OH)3↓;在小烧杯中加入30mL蒸馏水,加热至沸腾后,向沸水中滴入2mL氯化铁棕黄色溶液,继续加热可以获得红褐色的氢氧化铁胶体,氢氧化铁胶体具有丁达尔效应,可以利用此性质检验胶体的存在,
故答案为:Fe2O3+6H+=2Fe3++3H2O;Fe3++3OH﹣═Fe(OH)3↓;红褐色;丁达尔效应;(2)服用维生素C可使食物中的Fe3+转化成Fe2+,Fe3+转化成Fe2+发生了还原反应,需加入还原剂才能实现,所以维生素C在这个反应中做还原剂,表现还原性,
故答案为:还原性;(3)高铁酸钠中铁元素的化合价是+6价,居于铁元素的最高价,净水过程中自身被还原成新生态的Fe(OH)3,所以Na2FeO4具有氧化性,
故答案为:氧化性.
【分析】(1)氧化铁与盐酸反应生成氯化铁和水;氯化铁与氢氧化钠溶液反应生成氢氧化铁沉淀,据此写出反应的离子方程式;根据氢氧化铁胶体的制备方法和胶体的性质进行解答;(2)Fe3+转化成Fe2+发生了还原反应,需加入还原剂才能实现;(3)根据高铁酸钠中铁元素的化合价及题中信息来分析具有的性质.
20.【答案】(1)第四周期第Ⅷ族
(2)4Fe(OH)2+O2+2H2O=4Fe(OH)3
(3)蒸发浓缩、冷却结晶;KSCN溶液
(4)4FeCO3·nH2O+O2=4FeOOH +4CO2+(4n-2)H2O;0.89g
(5)<
【解析】【解答】(1)铁的核电荷数为26,核外电子排布为1s22s22p63s23p63d64s2,位于周期表中第四周期第Ⅷ族;正确答案:第四周期第Ⅷ族。(2) Fe(OH)2与空气中的氧气、水共同反应生成Fe(OH)3,化学方程式为:4Fe(OH)2+O2+2H2O==4Fe(OH)3 ;正确答案:4Fe(OH)2+O2+2H2O==4Fe(OH)3 。(3)①由FeSO4溶液先进行加热浓缩,变为浓溶液,然后冷却结晶、过滤、洗涤、干燥等操作,制得FeSO4·7H2O;正确答案:蒸发浓缩、冷却结晶。 ②亚铁离子还原性较强,易被氧化为铁离子;因此检验绿矾是否变质,就是要检验铁离子的存在,可以用硫氰化钾溶液,若出现红色溶液,则有铁离子存在,绿矾(FeSO4·7H2O)已变质;正确答案:KSCN溶液。(4)①干燥过程主要是为了脱去游离水和结晶水,过程中会有少量FeCO3·nH2O被空气氧化为FeOOH,根据氧化还原反应的电子守恒和原子守恒规律,化学方程式为: 4FeCO3·nH2O+O2=4FeOOH +4CO2+(4n-2)H2O ;正确答案:4FeCO3·nH2O+O2=4FeOOH +4CO2+(4n-2)H2O 。 ②设样品中FeCO3的物质的量为xmol, FeOOH的物质的量为ymol,则根据质量守恒和铁原子的量守恒列方程如下:116x+89y=12.49,x+y=6.16/56=0.11,解之得y=0.01mol,样品中杂质FeOOH的质量为0.01×89=0.89g,正确答案:0.89g。(5)反应Fe(s)+5CO(g) Fe(CO)5,△H<0,铁粉和一氧化碳化合成羰基合铁时放出热量,低温有利于合成易挥发的羰基合铁,羰基合铁易挥发,杂质残留在玻璃管左端;当羰基合铁挥发到较高温度区域T2时,羰基合铁分解,纯铁粉残留在右端,一氧化碳循环利用,所以T1【分析】(1)根据价电子排布式来确定元素在周期表中的位置;(2) Fe(OH)2和Fe(OH)3的转化;(3)铁离子的检验:用KSCN溶液;(4)根据氧化还原反应的电子守恒和原子守恒规律分析;
21.【答案】(1)铁表面被钝化
(2)Fe+2H+=Fe2++H2↑、Fe+2Fe3+=3Fe2+;SO2+Br2+2H2O=2HBr+H2SO4;66.7%
(3)13.44
(4)1.87
【解析】【解答】解:(1)铁钉(碳素钢)放入冷浓硫酸中,浓硫酸有较强的氧化性能使铁钉钝化阻止反应进一步进行,故答案为:铁表面被钝化;(2)①金属铁和硫酸之间发生反应,可能会发生的反应有:Fe+2H+=Fe2++H2↑、Fe+2Fe3+=3Fe2+;故答案为:Fe+2H+=Fe2++H2↑、Fe+2Fe3+=3Fe2+;②SO2具有还原性,通入足量溴水中,发生SO2+Br2+2H2O=2HBr+H2SO4,
n(混合气体)= =0.015mol,
SO2→BaSO4
1mol 233g
n 2.33g
n=0.01mol
则 SO2的体积分数: ×100%=66.7%,
故答案为:66.7%.(3)Al和水不反应,所以剩余金属应该是Al,反应方程式为2Na+2H2O=2NaOH+H2↑,2Al+2NaOH+2H2O=2NaAlO2+3H2↑,可以得出关系式Na~NaOH~Al,则参与反应的Na和Al的质量之比为23:27,Na和Al的质量和为15g,所以n(Na)= mol=0.3mol,n(Al)= mol=0.3mol,根据Na、Al和氢气之间的关系式得氢气体积=(0.3mol×0.5+0.3mol×1.5)×22.4L/mol=13.44L,
故答案为:13.44;(4)固体混合物和稀硫酸反应后有固体剩余,说明溶液中不存在铁离子,向滤液中加入加入2mol/L的NaOH溶液,加至40mL时开始出现沉淀,说明硫酸有剩余,铁先和铜离子后和氢离子发生置换反应,所以滤液中的溶质是硫酸、硫酸亚铁,n(H2SO4)=2.2mol/L×0.12L=0.264mol,
与氢氧化钠反应的硫酸的物质的量为: n(NaOH)= ×2mol/L×0.04L=0.04mol,剩余的硫酸的物质的量=0.264mol﹣0.04mol=0.224mol,
剩余硫酸与固体反应生成了硫酸亚铁,根据硫酸和硫酸亚铁的关系式计算硫酸亚铁的物质的量浓度= =1.87mol/L,
故答案为:1.87.
【分析】(1)铁钉(碳素钢)放入冷浓硫酸中,浓硫酸有较强的氧化性能使铁钉钝化;(2)①利用+2价亚铁离子能使酸化的高锰酸钾褪色来检验;
②生成的SO2具有还原性,通入足量溴水中,发生SO2+Br2+2H2O=2HBr+H2SO4,利用硫元素的守恒,结合关系式:SO2→BaSO4求出SO2的体积分数;(3)Al和水不反应,所以剩余金属应该是Al,根据Na和Al之间的关系式及转移电子守恒计算;(4)固体混合物和稀硫酸反应后有固体剩余,说明溶液中不存在铁离子,向滤液中加入加入2mol/L的NaOH溶液,加至40mL时开始出现沉淀,说明硫酸有剩余,铁先和铜离子后和氢离子发生置换反应,所以滤液中的溶质是硫酸、硫酸亚铁,根据硫酸根离子守恒计算硫酸亚铁的物质的量浓度.
一、单选题
1.次磷酸根离子()具有较强的还原性。利用Fe2+、H2O2联合除去废水中,转化过程如图所示。下列说法错误的是( )
A.转化(I)中1mol氧化剂参加反应转移1mole-
B.转化(II)的离子方程式:2·OH+=+H2
C.转化(III)表明Fe3+结合的能力强于H+结合的能力
D.、中心原子的杂化方式相同
2.化学与生产、生活密切相关。下列说法错误的是( )
A.过氧化钠可用于呼吸面具或潜水艇中作为氧气的来源
B.“84”消毒液的有效成分是次氯酸钠
C.积极推广共享单车以减少雾霾和光化学烟雾
D.Fe3O4是一种复杂的混合物,可以写成FeO·Fe2O3
3.下列有关物质性质的叙述错误的是( )
A.少量铁在足量氧气中燃烧可以得到Fe2O3固体
B.将工业废气通入FeCl2溶液中,可除去工业废气中的氯气
C.高温下将水蒸气通入铁粉中,固体质量增加
D.制备Fe(OH)2过程中应该注意隔绝空气
4.向100和的混合液中加入一定量铁粉,溶液中不溶物的质量变化如图。下列说法正确的是( )
A.氧化性:
B.b点溶液中的金属阳离子有:、
C.原溶液中和物质的量之比为
D.溶液体积变化忽略,c点溶液中
5.下列物质性质与应用对应关系正确的是( )
A.氯气具有漂白性,可作漂白剂
B.Fe2O3是一种红棕色粉末,常用作红色油漆
C.Na2O2具有强氧化性,常用作供氧剂
D.FeCl3能水解,可用于腐蚀印刷铜制电路板
6.印刷铜质电路板的“腐蚀液”为FeCl3.已知铜、铁均能与FeCl3溶液反应,反应方程式分别为:Cu+2FeCl3═CuCl2+2FeCl2,FeCl3+2Fe═3FeCl2.现将一包铜铁的混合粉末放入到盛有FeCl3溶液的烧杯中,充分反应后烧杯仍有少量固体.关于烧杯中物质组成的说法正确的是( )
A.溶液中一定含有FeCl2,固体中一定含有铜
B.溶液中一定含有FeCl2、FeCl3,固体中一定含有铜和铁
C.溶液中一定含有FeCl2、CuCl2,固体中一定含有铜
D.溶液中一定含有FeCl2,固体只有铜
7.下列说法错误的是( )
①FeCl3溶液可用于铜质印刷线路板制作是因为FeCl3能从含Cu2+的溶液中置换出铜
②室温下,不能将浓硫酸盛放在铁桶中 ③K+、Fe3+、NO3-、SCN﹣在水溶液中能大量共存
④因氧化铁能与酸反应,可用于制作红色涂料 ⑤将Fe(NO3)2样品溶于稀H2SO4后,滴加KSCN溶液观察溶液是否变红,可检验Fe(NO3)2晶体是否已氧化变质.
A.仅①②③ B.仅①③④
C.仅②④⑤ D.全部
8.部分含铁物质的物质类别与相应化合价的关系如图所示,下列相关说法错误的是( )
A.Fe高温下可与水蒸气反应生成②
B.③用于生产红色涂料,可长久不变色
C.在空气中加热⑥,不易得到纯净的FeO,易生成红棕色的Fe2O3
D.向盛有少量酸性KMnO4溶液的试管中加入足量④溶液,紫色褪去,说明④溶液未变质
9.已知X,Y,Z,W均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示(部分产物已略去).则W,X不可能是( )
选项 W X
A 稀硫酸 NaAlO2溶液
B 稀硝酸 Fe
C CO2 Ca(OH)2溶液
D Cl2 Fe
A.A B.B C.C D.D
10.下列解释事实的方程式正确的是( )
A.用氯化钠溶液做导电实验,灯泡发光:NaCl Na++Cl﹣
B.氢氧化铁沉淀溶于氢碘酸中:Fe(OH)3+3H+═Fe3++3H2O
C.石灰水表面漂着的“白膜”可用醋酸溶解:CaCO3+2H+═Ca2++H2O+CO2↑
D.向硫酸氢钠溶液中滴加氢氧化钡溶液至刚好为中性:2H++SO42﹣+Ba2++2OH﹣═BaSO4↓+2H2O
11.为了检验某Fe2+溶液是否变质,可向溶液中加入( )
A.NaOH溶液 B.铁片 C.石蕊溶液 D.KSCN溶液
12.为了防止变质,月饼包装袋内放入一小包铁粉,铁粉主要表现的性质是( )
A.氧化性 B.还原性 C.漂白性 D.酸性
13.下列有关铁及其化合物说法错误的是( )
A.将饱和氯化铁溶液滴入沸水中继续煮沸,可制得氢氧化铁胶体
B.FeCl2既有氧化性又有还原性
C.铁与硫酸铜溶液反应后滴加KSCN溶液,溶液变红
D.生铁和钢都是铁的合金,其中生铁的含碳量高于钢
14.下列关于铁的叙述正确的是( )
①铁能被磁铁吸引,但纯铁易被腐蚀 ②在人体内的血红蛋白中含有铁元素 ③铁位于元素周期表中第四周期第ⅧB族 ④铁能在氧气中剧烈燃烧,但不能在水蒸气中燃烧 ⑤铁与强氧化剂硝酸反应的产物仅是Fe(NO3)3⑥不能通过化合反应制得FeCl2和Fe(OH)3
A.①③ B.②④ C.②⑤ D.④⑥
15.下列说法中正确的是( )
A.铝粉与氧化镁混合共热能冶炼出镁
B.FeCl2只能通过置换反应生成,FeCl3只能通过化合反应生成
C.Fe3O4中铁元素的化合价为+2,+3价,故Fe3O4为混合物
D.等质量的NaHCO3和Na2CO3与足量盐酸反应,在相同条件下Na2CO3产生的CO2体积小
16.将0.3 mol钠、0.1 mol铁分别加入到各盛有500 mL 0.2 mol·L-1稀硫酸的两个烧杯中,下列说法正确的是( )
A.两个烧杯中金属沉在液面下
B.两个烧杯中都没有金属剩余
C.两个烧杯中都有金属剩余
D.两个烧杯中产生氢气的质量相同
二、综合题
17.填空。
(1)①小苏打的化学式是 ;
②漂白粉有效成分的化学式 。
(2)实验室制氯气的化学方程式是 。
(3)向FeCl3溶液中滴加几滴KSCN溶液,观察到的现象是 。
18.现有金属单质A,B,C和气体甲、丙以及物质D、E、F、G、H,它们之间的相互转化关系如下图所示(图中有些反应的生成物和反应的条件没有标出)。
请回答下列问题:
(1)物质B的化学式为: 。
(2)气体甲在Cl2中燃烧的现象: ;
(3)金属A与G的水溶液反应的化学方程式: ;
(4)写出下列反应的离子方程式:
③: .
⑤: .
(5)将Na2O2投入到F溶液中,可以观察到的现象是: 。
19.含铁元素的物质对人体健康、生产生活都有重要作用,请完成以下填空:
(1)取少量某品牌油漆的原料Fe2O3(红棕色粉末)并加入适量盐酸,反应后得到棕黄色溶液,其离子反应方程式为 .取少量棕黄色溶液置于试管中,滴入NaOH溶液,可观察到Fe(OH)3沉淀生成,该离子方程式为 .另在小烧杯中加入30mL蒸馏水,加热至沸腾后,向沸水中滴入2mL 上述棕黄色溶液,继续加热至产生 色液体,停止加热.证明所得分散系类型的最常用的物理方法为 .
(2)一个体重50kg的健康人含铁元素2g,Fe2+易被人体吸收,所以给贫血者补充铁时,服用维生素C可使食物中的Fe3+转化成Fe2+,有利于人体对铁的吸收.维生素C在这个反应中表现 (“氧化性”或“还原性”).
(3)高铁酸钠(Na2FeO4)能有效地杀灭水中的病菌,同时自身被还原成新生态的Fe(OH)3,这是一种品质优良的无机絮凝剂,能高效地除去水中的微细悬浮物.从氧化还原角度分析,杀灭病菌充分利用了Na2FeO4的强 .(“氧化性”或“还原性”)
20.铁及其化合物在日常生活中有广泛应用。
(1)写出铁元素在周期表中的位置 。
(2) 写出在空气中Fe(OH)2转化为Fe(OH)3的化学方程式 。
(3)绿矾(FeSO4·7H2O)是补血剂的原料,易变质。
①由FeSO4溶液制得FeSO4·7H2O过程中的操作有 、过滤、洗涤、干燥。
②检验绿矾是否变质的试剂是 。
(4)利用绿矾制备还原铁粉的工业流程如下:
①干燥过程主要是为了脱去游离水和结晶水,过程中会有少量FeCO3·nH2O在空气中被氧化为FeOOH,该反应的化学方程式为 。
②取干燥后的FeCO3样品12.49g,焙烧,最终得到还原铁粉6.16g,计算样品中杂质FeOOH的质量 。
(5)以羰基化合物为载体运用化学平衡移动原理分离、提纯某纳米级活性铁粉(含有一些不反应的杂质),反应装置如下图。
Fe(s)+5CO(g) Fe(CO)5(g) △H<0,T1 T2(填“>”、“<”或“=”)。
21.回答以下问题:
(1)将已去除表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是 .
(2)另称取已去除表面氧化物的铁钉(碳素钢)6.0g放入15.0mL浓硫酸中,加热,充分反应后得到溶液X并收集到气体Y.
①甲同学认为X中除Fe3+外还可能含有Fe2+.写出生成Fe2+所有可能的离子方程式: .(写出一个即可)
②乙同学取336mL(标准状况)气体Y通入足量氯水中,发生反应的化学方程式为: .
然后加入足量BaCl2溶液,经适当操作后得干燥固体2.33g.由于此推知气体Y中SO2的体积分数为 .
(3)向100mL水中投入Na和Al共16克,充分反应后剩余金属1g.计算放出H2的体积为 升(标准状况下)
(4)向一定量的Fe、Fe2O3和CuO混合物投入100mL 2.2mol/L的硫酸溶液中,充分反应后生成896mL标准状况下的气体,得不溶物1.28g,过滤后,向滤液中加入2mol/L的NaOH溶液,加至40mL时开始出现沉淀,则滤液中FeSO4的物质的量浓度为(设滤液体积为100mL) mol/L.
答案解析部分
1.【答案】B
【解析】【解答】A.从图中分析,反应(I)中氧化剂是H2O2,其还原产物是A,同时还有,故只有一半的氧原子从-1价降到-2价,即1mol氧化剂参加反应转移1mole-,A不符合题意;
B.转化(II)的离子方程式:4·OH+=+2H2O,B符合题意;
C.转化(III)表明上的H被Fe3+替换,即Fe3+结合的能力强于H+结合的能力,C不符合题意;
D.、中心原子价电子数对数都是4,均是sp3杂化,D不符合题意;
故答案为:B。
【分析】A、结合图示可以知道过氧化氢中的氧原子没有全部降价;
B、结合图示可以知道反应为4·OH+=+2H2O;
C、上的H被Fe3+替换,即Fe3+结合的能力强于H+结合的能力;
D、杂化轨道=中心原子成键电子对数+孤电子对数,若杂化轨道数=2,为sp杂化,杂化轨道数=3,为sp2杂化,杂化轨道数=4,为sp3杂化。
2.【答案】D
【解析】【解答】A.过氧化钠能与二氧化碳反应生成氧气,可用于呼吸面具或潜水艇中作为氧气的来源,A不符合题意;
B.84消毒液中含有的NaClO具有强氧性,可以杀菌消毒,即NaClO是“84消毒液”的有效成分,B不符合题意;
C.积极推广共享单车,可以减少汽车的使用,能减少雾霾和光化学烟雾,C不符合题意;
D.Fe3O4是一种化合物,不是混合物,D符合题意;
故答案为:D。
【分析】A.过氧化钠常用作供氧剂;
B.84消毒液由氯气和氢氧化钠溶液反应制得;
C.单车的使用有利于减少化学燃料的使用;
D.混合物是指由两种或两种以上物质组成。
3.【答案】B
【解析】【解答】A.少量铁,氧气足量时,可以反应得到Fe2O3固体,故A不符合题意;
B.氯气具有强氧化性,能氧化亚铁离子生成铁离子,铁离子能氧化Fe生成亚铁离子;所以去工业废气中的氯气,还需加入铁粉,故B符合题意;
C.高温下将水蒸气通入铁粉中,生成四氧化三铁,固体质量增加,故C不符合题意;
D.二价Fe容易被氧化,所以制备Fe(OH)2过程中应该注意隔绝空气,故D不符合题意;
故答案为:B。
【分析】A.铁与氧气燃烧,可以生成主要四氧化三铁,当铁少量时候也可以生成三氧化二铁。
B.亚铁溶液极易被空气氧化,一般不用氯化亚铁吸收氯气,常用氢氧化钠溶液。
4.【答案】C
【解析】【解答】A.Fe先被Fe3+氧化,然后再被Cu2+氧化,氧化性,故A不符合题意;
B.b点①②反应完全,仅有Fe2+,B不符合题意;
C.①消耗0.1molFe粉,原溶液中有0.2molFe3+;②消耗0.05molFe粉,原溶液中有0.05molCu2+,Cu2+与Fe3+物质的量比为1:4,C符合题意;
D.c点有0.3molFeCl2和0.05molCuCl2,n(Cl-)=0.7mol,c(Cl-)==7mol/L,D不符合题意;
故答案为:C。
【分析】A.依据强制弱及反应的先后顺序,Fe先被Fe3+氧化,然后再被Cu2+氧化;
B.由A项分析结合图中曲线判断;
C.图中曲线判断计算;
D.依据电荷守恒。
5.【答案】B
【解析】【解答】解:A、氯气与水反应生成具有强氧化性的HClO,而氯气本身不做漂白剂,故A错误;
B、Fe2O3为红色物质,则常用作红色油漆和涂料,故B正确;
C、过氧化钠与水和二氧化碳反应生成氧气,而不是本身的强氧化性,故C错误;
D、氯化铁与铜反应生成氯化亚铁和氯化铜,是铜发生氧化还原反应,而不是水解反应,故D错误;
故选B.
【分析】A、氯气与水反应生成具有强氧化性的HClO;
B、Fe2O3为红色物质,可作油漆涂料;
C、过氧化钠与水和二氧化碳反应生成氧气;
D、氯化铁与铜反应生成氯化亚铁和氯化铜.
6.【答案】A
【解析】【解答】解:A.铁的化学性质比铜活泼,因此铁首先和氯化铁溶液反应,只有铁反应完,铜才可以与氯化铁溶液反应生成CuCl2,因此充分反应后烧杯中仍有少量固体,则烧杯溶液中一定含有的溶质是 FeCl2,烧杯中一定含有的固体是 Cu,故A正确;
B.烧杯仍有少量固体,而铁和铜都能够与三价铁离子反应,所以不可能有三价铁离子,故B错误;
C.如果铁过量,则溶液中只有氯化亚铁,不会有氯化铜,故C错误;
D.铁过量,反应生成氯化铁,剩余铜和铁,故D错误;
故选:A.
【分析】在金属活动性顺序中,铁>铜,即铁的还原性强于铜,将一包铜铁的混合粉末放入到盛有FeCl3溶液的烧杯中,铁先与三价铁离子反应,铁过量则铜不发生反应,铁不足铜再与氯化铁发生反应.
7.【答案】D
【解析】【解答】①氯化铁和铜反应生成氯化亚铁和氯化铜,所以FeCl3溶液可用于铜质印刷线路板制作,①不符合题意;
②室温下,浓硫酸使Fe钝化,所以能将浓硫酸盛放在铁桶中,②不符合题意;
③Fe3+与SCN-发生络合反应,所以Fe3+与SCN-不能大量共存,③不符合题意;
④氧化铁为红棕色,而且氧化铁难溶于水,可以作红色涂料,因果关系不符合题意,④不符合题意;
⑤将Fe(NO)2样品溶于稀H2SO4后,酸性条件下,NO3-能把Fe2+氧化为Fe3+,滴加KSCN溶液变红,不能说明Fe(NO3)2晶体已经变质,⑤不符合题意;
综上,说法错误的为:①②③④⑤,D符合题意;
故答案为:D
【分析】①Fe3+具有氧化性,能将Cu氧化成Cu2+;
②常温下,浓硫酸能使铁钝化;
③Fe3+能与SCN-形成络合物;
④能与酸反应,与做红色涂料没关系;
⑤NO3-在酸性条件下具有氧化性,能将Fe2+氧化成Fe3+;
8.【答案】D
【解析】【解答】A. 高温下铁与水蒸气反应生成和,A项不符合题意;
B. 作红色涂料很稳定,B项不符合题意;
C. 在空气中容易发生反应,分解为,C项不符合题意;
D. 实验只能证明有,无法判断是否有,D项符合题意。
故答案为:D。
【分析】易错分析:D.要检验含有二价铁溶液是否变质,应该检验是否含有三价铁,应该用硫氰化钾进行检验。
9.【答案】D
【解析】【解答】解:A、W为稀硫酸、X为NaAlO2溶液,则Y为硫酸铝,Z为氢氧化铝,硫酸铝通入二氧化碳转化为氢氧化铝,氢氧化铝与硫酸反应生成硫酸铝,所以可以实现以上转化,故A不选;
B、W为稀硝酸、X为Fe,则Y为硝酸铁,Z为硝酸亚铁,硝酸铁与铁反应生成硝酸亚铁,硝酸亚铁与硝酸反应生成硝酸﹣﹣所以可以实现以上转化,故B不选;
C、W为CO2、X为Ca(OH)2溶液,则Y为碳酸氢钙,Z为碳酸钙,二者可以相互转化,碳酸钙和二氧化碳、水反应生成碳酸氢钙,碳酸氢钙分解生成碳酸钙,故C不选;
D、W为Cl2、X为Fe,铁和氯气反应只能生成氯化铁,不能生成不同价态的化合物,故D错误;
故选D.
【分析】A、W为稀硫酸、X为NaAlO2溶液,则Y为硫酸铝,Z为氢氧化铝;
B、W为稀硝酸、X为Fe,则Y为硝酸铁,Z为硝酸亚铁;
C、W为CO2、X为Ca(OH)2溶液,则Y为碳酸氢钙,Z为碳酸钙,二者可以相互转化;
D、W为Cl2、X为Fe,铁和氯气反应只能生成氯化铁;
10.【答案】D
【解析】【解答】解:A.用氯化钠溶液做导电实验,灯泡发光,发生电离为NaCl=Na++Cl﹣,故A错误;
B.氢氧化铁沉淀溶于氢碘酸中的离子反应为2Fe(OH)3+2I﹣+6H+═2Fe2++I2+6H2O,故B错误;
C.石灰水表面漂着的“白膜”可用醋酸溶解的离子反应为CaCO3+2CH3COOH═2CH3COO﹣+Ca2++H2O+CO2↑,故C错误;
D.向硫酸氢钠溶液中滴加氢氧化钡溶液至刚好为中性的离子反应为2H++SO42﹣+Ba2++2OH﹣═BaSO4↓+2H2O,故D正确;
故选D.
【分析】A.电离的条件为溶于水,不是通电;
B.发生氧化还原反应生成碘化亚铁、碘、水;
C.醋酸在离子反应中保留化学式;
D.反应生成硫酸钡、硫酸钠和水.
11.【答案】D
【解析】【解答】Fe2+溶液若变质,溶液中含有Fe3+,要检验Fe2+溶液是否变质即检验溶液中是否含Fe3+,检验Fe3+用KSCN溶液,加入KSCN溶液后,若溶液变红色证明Fe2+溶液已经变质,若溶液不变红说明Fe2+溶液没有变质,
故答案为:D。
【分析】A.若不变质,加入NaOH溶液后,因为氢氧化亚铁及易被氧化为氧化铁,而不溶于进行判断;
B.铁片与变质后的铁离子反应的现象不明显;
C.石蕊试液不能检验铁离子;
D.硫氰化钾溶液是检验铁离子的特效试剂。
12.【答案】B
【解析】【解答】月饼包装袋内放入一小包铁粉,主要是为了吸收氧气,防止月饼中的油脂被空气中的氧气氧化,所以铁粉表现还原性,
故答案为:B。
【分析】铁粉容易被氧气氧化,可以吸收包装内的氧气。
13.【答案】C
【解析】【解答】A.制备Fe(OH)3胶体的操作为:加热烧杯中的水至沸腾,向沸水滴加几滴饱和氯化铁溶液,继续煮沸至溶液呈红褐色,即停止加热,得到氢氧化铁胶体,A项不符合题意;
B.FeCl2中Fe呈+2价,为中间价态,因此FeCl2既有氧化性又有还原性,B项不符合题意;
C.铁与硫酸铜溶液反应的方程式为: ,反应后的溶液中无Fe3+,滴加KSCN溶液,溶液不会变红,C项符合题意;
D.生铁和钢都是碳铁合金,生铁中碳的含量高于钢中碳的含量,D项不符合题意;
故答案为:C。
【分析】硫氰酸钾主要是检验铁离子,但是铁和硫酸铜溶液反应不会查产生铁离子,主要形成的是亚铁离子,其他均正确
14.【答案】B
【解析】【解答】当铁中含有杂质时,在潮湿的空气中会发生电化学腐蚀,而纯铁的抗腐蚀能力较强;铁位于元素周期表的第Ⅷ族,而不是第ⅧB族;铁与强氧化剂反应,能被氧化为Fe3+,但若铁过量,则Fe3+被Fe还原为Fe2+,所以,Fe与HNO3反应的产物可能因铁过量而生成Fe(NO3)2;FeCl2、Fe(OH)3可分别通过化合反应Fe+2FeCl3=3FeCl2、4Fe(OH)2+O2+2H2O=4Fe(OH)3制得。
故答案为:B
【分析】①纯铁稳定,不易发生腐蚀;②血红蛋白中含有铁元素;③根据帖元素在周期表中的位置判断;
④铁能与水蒸气反应;⑤铁与硝酸反应的产物与硝酸的量的多少有关;⑥氯化铁与铁反应生成氯化亚铁,氢氧化亚铁与氧气化合生成氢氧化铁。
15.【答案】D
【解析】【解答】A.由于金属活动性Mg>Al,因此铝粉无法将MgO中的Mg置换,A不符合题意;
B.FeCl2、FeCl3都可通过复分解反应制得,如Fe(OH)2+2HCl=FeCl2+2H2O、Fe(OH)3+3HCl=FeCl3+3H2O,B不符合题意;
C.Fe3O4只表示一种物质,为纯净物,C不符合题意;
D.由于NaHCO3中所含碳元素的质量分数大于Na2CO3,因此等质量的NaHCO3和Na2CO3中,NaHCO3中所含碳元素的质量大,因此与足量的稀盐酸反应生成CO2的体积较大,D符合题意;
故答案为:D
【分析】A.根据Mg、Al金属性的强弱分析;
B.FeCl2、FeCl3都可通过复分解反应制得;
C.Fe3O4为纯净物;
D.根据碳元素质量守恒进行分析;
16.【答案】B
【解析】【解答】A. 钠的密度小于水,因此两个烧杯中铁沉在液面下,钠浮在水面上,A不符合题意;
B. 由于钠极易和水反应,则钠投入到硫酸中钠一定全部反应。硫酸的物质的量是0.5L×0.2mol/L=0.1mol,铁也是0.1mol,则铁和稀硫酸恰好反应,所以两个烧杯中都没有金属剩余,B符合题意;
C. 根据选项B中的分析可知两个烧杯中都没有金属剩余,C不符合题意;
D. 0.3mol钠产生0.15mol氢气,0.1mol铁产生0.1mol氢气,则两个烧杯中产生氢气的质量不相同,D不符合题意。
故答案为:B。
【分析】硫酸的物质的量是0.5L×0.2mol/L=0.1mol,铁和硫酸反应的化学方程式为:;钠和稀硫酸和水都反应。
17.【答案】(1)NaHCO ;Ca(ClO)2
(2)
(3)溶液出现红色
【解析】【解答】(1)①小苏打是碳酸氢钠,其化学式为:NaHCO ;
②漂白粉是氯化钙和次氯酸钙的混合物,其中有效成分是Ca(ClO)2;
(2)实验室制氯气是用二氧化锰和浓盐酸加热制备,方程式为:;
(3)Fe3+与SCN-反应生成血红色的Fe(SCN)3络合物,所以向FeCl3溶液中滴加几滴KSCN溶液,观察到的现象是溶液出现红色,故答案为:溶液出现红色。
【分析】(1)①小苏打为碳酸氢钠;
②漂白粉有效成分为次氯酸钙;
(2)实验室常加热浓盐酸和二氧化锰制备氯气;
(3)三价铁遇KSCN溶液变红。
18.【答案】(1)Al
(2)有苍白色火焰,瓶口有白雾
(3)6Na+2FeCl3+6H2O=2Fe(OH)3↓+6NaCl+3H2↑
(4)2OH﹣+2H2O+2Al=2AlO2﹣+3H2↑;Cl2+2Fe2+=2Fe3++2Cl﹣
(5)生成红褐色沉淀,有无色气体产生
【解析】【解答】根据分析可知A是Na,B是Al,C是Fe,D是NaOH,E是盐酸,F是FeCl2,G是FeCl3,H是Fe(OH)3,甲是H2,丙是HCl。则(1)物质B是铝,化学式为Al。
(2)氢气在Cl2中燃烧生成氯化氢,则现象为有苍白色火焰,瓶口有白雾;(3)金属钠极易与水反应生成氢氧化钠和氢气,生成的氢氧化钠再与氯化铁反应,则与氯化铁溶液反应的化学方程式6Na+2FeCl3+6H2O=2Fe(OH)3↓+6NaCl+3H2↑;
(4)写出下列反应的离子方程式:③是Al与NaOH溶液发生反应生成偏铝酸钠和氢气,反应的离子方程式是2OH-+2H2O+2Al=2AlO2-+3H2↑。⑤是氯气氧化氯化亚铁生成氯化铁,离子方程式为Cl2+2Fe2+=2Fe3++2Cl﹣;
(5)过氧化钠具有强氧化性,溶于水与水反应生成氢氧化钠和氧气,则将Na2O2投入到氯化亚铁溶液中,可以观察到的现象是生成红褐色沉淀,有无色气体产生。
【分析】根据红褐色沉淀H为突破口,确定H是氢氧化铁,金属单质A与水反应的产物D的焰色反应为黄色,确定含有钠元素,进而推断A是金属钠,物质G含有铁离子,结合转化关系推出其他物质即可。
19.【答案】(1)Fe2O3+6H+=2Fe3++3H2O;Fe3++3OH﹣═Fe(OH)3↓;红褐色;丁达尔效应
(2)还原性
(3)氧化性
【解析】【解答】解:(1)取少量某品牌油漆的原料Fe2O3(红棕色粉末)并加入适量盐酸,氧化铁与盐酸反应生成铁离子和水,反应的离子方程式为:Fe2O3+6H+=2Fe3++3H2O;棕黄色FeCl3溶液中滴入NaOH溶液会产生Fe(OH)3沉淀,反应的离子方程式为:Fe3++3OH﹣═Fe(OH)3↓;在小烧杯中加入30mL蒸馏水,加热至沸腾后,向沸水中滴入2mL氯化铁棕黄色溶液,继续加热可以获得红褐色的氢氧化铁胶体,氢氧化铁胶体具有丁达尔效应,可以利用此性质检验胶体的存在,
故答案为:Fe2O3+6H+=2Fe3++3H2O;Fe3++3OH﹣═Fe(OH)3↓;红褐色;丁达尔效应;(2)服用维生素C可使食物中的Fe3+转化成Fe2+,Fe3+转化成Fe2+发生了还原反应,需加入还原剂才能实现,所以维生素C在这个反应中做还原剂,表现还原性,
故答案为:还原性;(3)高铁酸钠中铁元素的化合价是+6价,居于铁元素的最高价,净水过程中自身被还原成新生态的Fe(OH)3,所以Na2FeO4具有氧化性,
故答案为:氧化性.
【分析】(1)氧化铁与盐酸反应生成氯化铁和水;氯化铁与氢氧化钠溶液反应生成氢氧化铁沉淀,据此写出反应的离子方程式;根据氢氧化铁胶体的制备方法和胶体的性质进行解答;(2)Fe3+转化成Fe2+发生了还原反应,需加入还原剂才能实现;(3)根据高铁酸钠中铁元素的化合价及题中信息来分析具有的性质.
20.【答案】(1)第四周期第Ⅷ族
(2)4Fe(OH)2+O2+2H2O=4Fe(OH)3
(3)蒸发浓缩、冷却结晶;KSCN溶液
(4)4FeCO3·nH2O+O2=4FeOOH +4CO2+(4n-2)H2O;0.89g
(5)<
【解析】【解答】(1)铁的核电荷数为26,核外电子排布为1s22s22p63s23p63d64s2,位于周期表中第四周期第Ⅷ族;正确答案:第四周期第Ⅷ族。(2) Fe(OH)2与空气中的氧气、水共同反应生成Fe(OH)3,化学方程式为:4Fe(OH)2+O2+2H2O==4Fe(OH)3 ;正确答案:4Fe(OH)2+O2+2H2O==4Fe(OH)3 。(3)①由FeSO4溶液先进行加热浓缩,变为浓溶液,然后冷却结晶、过滤、洗涤、干燥等操作,制得FeSO4·7H2O;正确答案:蒸发浓缩、冷却结晶。 ②亚铁离子还原性较强,易被氧化为铁离子;因此检验绿矾是否变质,就是要检验铁离子的存在,可以用硫氰化钾溶液,若出现红色溶液,则有铁离子存在,绿矾(FeSO4·7H2O)已变质;正确答案:KSCN溶液。(4)①干燥过程主要是为了脱去游离水和结晶水,过程中会有少量FeCO3·nH2O被空气氧化为FeOOH,根据氧化还原反应的电子守恒和原子守恒规律,化学方程式为: 4FeCO3·nH2O+O2=4FeOOH +4CO2+(4n-2)H2O ;正确答案:4FeCO3·nH2O+O2=4FeOOH +4CO2+(4n-2)H2O 。 ②设样品中FeCO3的物质的量为xmol, FeOOH的物质的量为ymol,则根据质量守恒和铁原子的量守恒列方程如下:116x+89y=12.49,x+y=6.16/56=0.11,解之得y=0.01mol,样品中杂质FeOOH的质量为0.01×89=0.89g,正确答案:0.89g。(5)反应Fe(s)+5CO(g) Fe(CO)5,△H<0,铁粉和一氧化碳化合成羰基合铁时放出热量,低温有利于合成易挥发的羰基合铁,羰基合铁易挥发,杂质残留在玻璃管左端;当羰基合铁挥发到较高温度区域T2时,羰基合铁分解,纯铁粉残留在右端,一氧化碳循环利用,所以T1
21.【答案】(1)铁表面被钝化
(2)Fe+2H+=Fe2++H2↑、Fe+2Fe3+=3Fe2+;SO2+Br2+2H2O=2HBr+H2SO4;66.7%
(3)13.44
(4)1.87
【解析】【解答】解:(1)铁钉(碳素钢)放入冷浓硫酸中,浓硫酸有较强的氧化性能使铁钉钝化阻止反应进一步进行,故答案为:铁表面被钝化;(2)①金属铁和硫酸之间发生反应,可能会发生的反应有:Fe+2H+=Fe2++H2↑、Fe+2Fe3+=3Fe2+;故答案为:Fe+2H+=Fe2++H2↑、Fe+2Fe3+=3Fe2+;②SO2具有还原性,通入足量溴水中,发生SO2+Br2+2H2O=2HBr+H2SO4,
n(混合气体)= =0.015mol,
SO2→BaSO4
1mol 233g
n 2.33g
n=0.01mol
则 SO2的体积分数: ×100%=66.7%,
故答案为:66.7%.(3)Al和水不反应,所以剩余金属应该是Al,反应方程式为2Na+2H2O=2NaOH+H2↑,2Al+2NaOH+2H2O=2NaAlO2+3H2↑,可以得出关系式Na~NaOH~Al,则参与反应的Na和Al的质量之比为23:27,Na和Al的质量和为15g,所以n(Na)= mol=0.3mol,n(Al)= mol=0.3mol,根据Na、Al和氢气之间的关系式得氢气体积=(0.3mol×0.5+0.3mol×1.5)×22.4L/mol=13.44L,
故答案为:13.44;(4)固体混合物和稀硫酸反应后有固体剩余,说明溶液中不存在铁离子,向滤液中加入加入2mol/L的NaOH溶液,加至40mL时开始出现沉淀,说明硫酸有剩余,铁先和铜离子后和氢离子发生置换反应,所以滤液中的溶质是硫酸、硫酸亚铁,n(H2SO4)=2.2mol/L×0.12L=0.264mol,
与氢氧化钠反应的硫酸的物质的量为: n(NaOH)= ×2mol/L×0.04L=0.04mol,剩余的硫酸的物质的量=0.264mol﹣0.04mol=0.224mol,
剩余硫酸与固体反应生成了硫酸亚铁,根据硫酸和硫酸亚铁的关系式计算硫酸亚铁的物质的量浓度= =1.87mol/L,
故答案为:1.87.
【分析】(1)铁钉(碳素钢)放入冷浓硫酸中,浓硫酸有较强的氧化性能使铁钉钝化;(2)①利用+2价亚铁离子能使酸化的高锰酸钾褪色来检验;
②生成的SO2具有还原性,通入足量溴水中,发生SO2+Br2+2H2O=2HBr+H2SO4,利用硫元素的守恒,结合关系式:SO2→BaSO4求出SO2的体积分数;(3)Al和水不反应,所以剩余金属应该是Al,根据Na和Al之间的关系式及转移电子守恒计算;(4)固体混合物和稀硫酸反应后有固体剩余,说明溶液中不存在铁离子,向滤液中加入加入2mol/L的NaOH溶液,加至40mL时开始出现沉淀,说明硫酸有剩余,铁先和铜离子后和氢离子发生置换反应,所以滤液中的溶质是硫酸、硫酸亚铁,根据硫酸根离子守恒计算硫酸亚铁的物质的量浓度.
