苏教版(2019)必修第一册 专题1 第三单元 人类对原子结构的认识(3)(共34张PPT)
文档属性
| 名称 | 苏教版(2019)必修第一册 专题1 第三单元 人类对原子结构的认识(3)(共34张PPT) |  | |
| 格式 | ppt | ||
| 文件大小 | 2.1MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-09 19:44:47 | ||
图片预览









文档简介
(共34张PPT)
汇报人:XXX
XX月XX日
人类对原子结构的认识
苏教版高中化学必修一课件
01
1.德谟克利特的古代原子学说
他认为万物都是由间断的、不可分割的微粒即_____构成的,原子的结合和分离是万物变化的根本原因。
2.道尔顿的近代原子学说
英国科学家道尔顿是________________的创始人。他认为物质由_____组成,原子不能被创造,也不能被毁灭,在化学变化中不可再分割,它们在化学反应中保持本性不变。
笃学一 原子结构模型的演变
原子
近代原子学说
原子
3.汤姆生的“葡萄干面包式”原子结构模型
他认为原子是由更小的微粒构成的,______的发现使人们认识到原子是可以______的。
4.卢瑟福的带核原子结构模型
物理学家卢瑟福根据____现象,指出原子是由_________和________构成的,__________带正电荷,它几乎集中了原子的全部________,但只占有很小的______,________带负电荷,在原子核周围空间做____________________。
电子
再分
α?
粒子散射
原子核
核外电子
原子核
质量
体积
核外电子高速运动
5.玻尔的轨道原子结构模型
丹麦物理学家波尔指出:原子核外电子在原子核外空间内一系列____________上绕核做高速运动,每个轨道都具有一个确定的________;核外电子在这些____________上运动时,既不放出能量,也不吸收能量。
6.电子云模型(现代原子结构学说)
现代科学家根据微观世界____________的规律,提出用______________描述核外电子运动。
稳定的轨道
能量值
稳定的轨道
波粒二象性
量子力学模型
02
1.原子核外电子排布
对于多电子原子来说,原子核外电子是______排布的,原子的核外电子数越多,占据的电子层越多。
分层
笃学二 原子核外电子排布与元素的化学性质
2.原子的8电子稳定结构
稀有气体最外层电子达到稳定结构,其原子核外最外层电子排布是____个或____个。钠、镁、铝等活泼金属原子的最外层电子数______,与活泼非金属反应时容易______电子,形成______的电子层结构;氧、氟、氯等活泼非金属原子的最外层电子数______,与活泼金属反应时容易______电子,形成______的电子层结构。
2
8
较少
失去
稳定
较多
得到
稳定
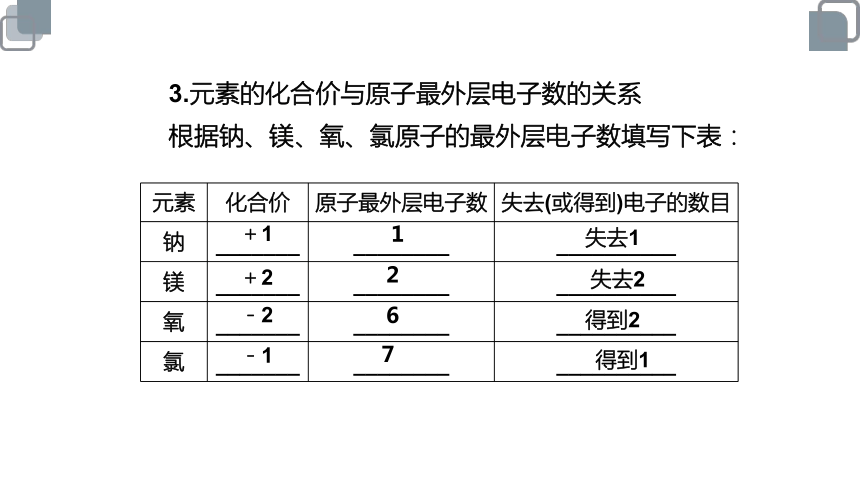
3.元素的化合价与原子最外层电子数的关系
根据钠、镁、氧、氯原子的最外层电子数填写下表:
元素 化合价 原子最外层电子数 失去(或得到)电子的数目
钠 _______ ________ __________
镁 _______ ________ __________
氧 _______ ________ __________
氯 _______ ________ __________
+1
1
失去1
+2
2
失去2
-2
6
得到2
-1
7
得到1
1.原子的组成:原子是由带正电的__________和带负电的__________构成的,原子核又是由______和______构成的,______带正电,______不带电。
笃学三 原子的组成和三种粒子间的关系
原子核
核外电子
质子
中子
质子
中子
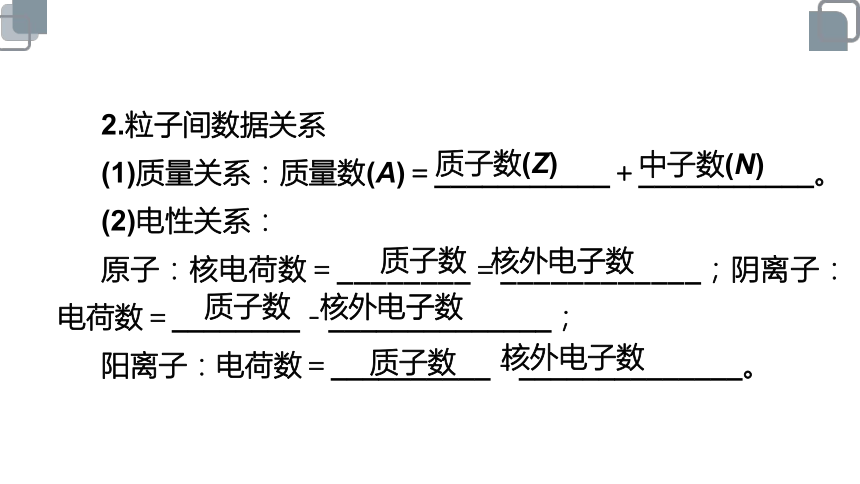
2.粒子间数据关系
(1)质量关系:质量数(A)=___________+___________。
(2)电性关系:
原子:核电荷数=________=____________;阴离子:电荷数=________-______________;
阳离子:电荷数=__________-______________。
质子数(Z)
中子数(N)
质子数
核外电子数
质子数
核外电子数
质子数
核外电子数
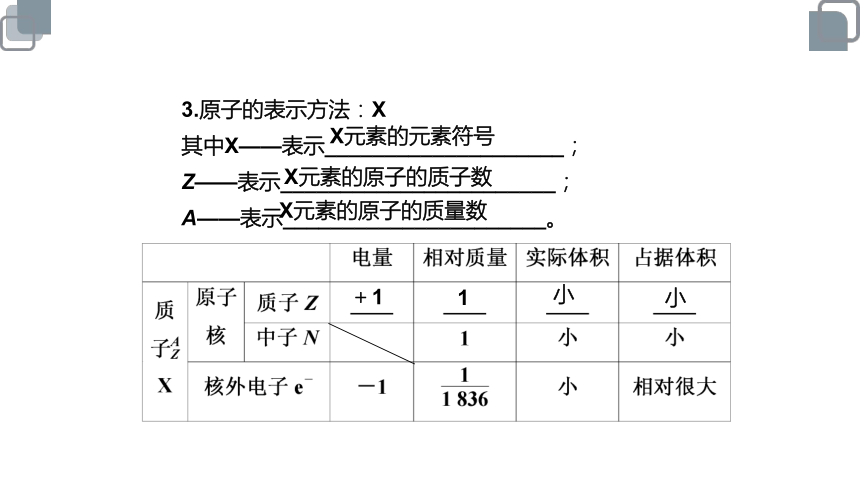
3.原子的表示方法:X
其中X——表示____________________;
Z——表示_______________________;
A——表示______________________。
X元素的元素符号
X元素的原子的质子数
X元素的原子的质量数
+1
1
小
小
1.元素:具有相同的_____________________的同一类原子的总称。
2.核素:具有一定质子数和一定中子数的某种______。
3.同位素:_________________________________的原子的互称。
笃学四 核素与同位素
核电荷数(即质子数)
原子
质子数相同而质量数(或中子数)不同
【慎思1】 元素的化合价与得到或失去的电子数的关系是什么?
【答案】元素的化合价与得到或失去的电子数的关系:
失去的电子数=正价的数值。
得到的电子数=负价的数值。
【慎思2】 原子的质量主要由哪些微粒决定?
【答案】因电子的质量比质子和中子的质量小得多,可以忽略不计。因此原子的质量主要集中在原子核上,而原子核又是由质子和中子构成的。故原子的质量主要由质子和中子决定。
【慎思3】 怎样用图示形象地表示出元素、核素、同位素的关系?
【答案】可以表示为:
【答案】质量数 质子数 离子所带电荷 原子的个数 19 20 19 同位素 相同 不同
【慎思5】 用A质子数、B中子数、C核外电子数、D最外层电子数、E电子层数,用字母填写下列各空格。
(1)原子种类由____决定。
(2)元素种类由____决定。
(3)元素有无同位素由________决定。
(4)同位素相对原子质量由________决定。
(5)元素的原子半径由________决定。
【答案】(1)AB (2)A (3)B (4)AB (5)AE
元素性质与原子结构的关系
原子核外电子排布
元素 最外层电子数 得失电子能力 化学性质 主要化合价
稀有气体元素 8(He为2) 一般不易得失电子 较稳定,一般不参与化学反应
金属
元素 <4 易失
电子 金属性 无负价,一般为+1~+3
非金属元素 ≥4 易得
电子 非金属性 既有正价又有负价
注意:(1)元素的化合价一般是由最外层电子数决定的,而且最高正化合价=最外层电子数。
(2)金属元素只有正价,没有负价,非金属元素一般既有正价又有负价(氟、氧除外)。
解析 质子数小于电子数的是B,属于阴离子;金属元素的最外层电子数一般小于4个,则D属于金属元素;化学性质由最外层电子数决定,A与C具有相同的最外层电子数,则化学性质相似。
答案 (1)B (2)D (3)AC
(1)元素的化学性质主要是由最外层电子数决定的;当最外层电子数小于4时,一般是金属元素,当最外层电子数大于4时,一般属于非金属元素。(2)当质子数大于电子数时,该微粒属于阳离子,反之属于阴离子。
【答案】D
【解释】元素的最高化合价等于最外层电子数,氯原子最外层有7个电子,则最高化合价为+7。
原子的组成
答案 B
对于原子而言,质子数=电子数=核电荷数;质量数=质子数+中子数。
【答案】A
【解释】原子的核外电子数等于质子数。
核素和同位素
元素 核素 同位素
概念 具有相同质子数的同一类原子的总称 具有一定数目的质子和一定数目中子的一种原子 质子数相同,中子数不同的同一元素的不同核素互为同位素
对象 宏观概念 元素的某种原子 同一元素不同原子间的互称
特征 以单质或化合物形式存在,性质通过形成的物质来体现 不同核素质量不同 天然存在的各种同位素所占的原子百分数一般是不变的
举例 16O、17O、18O是氧元素的三种核素,它们互称为同位素
答案 B
【答案】B
【解释】中子数=质量数-质子数,A选项显然错误;元素的定义是具有相同核电荷数的一类原子的总称,B正确,D错误;对于原子来说,质子数=核电荷数=核外电子数,C错误。
汇报人:XXX
XX月XX日
人类对原子结构的认识
苏教版高中化学必修一课件
01
1.德谟克利特的古代原子学说
他认为万物都是由间断的、不可分割的微粒即_____构成的,原子的结合和分离是万物变化的根本原因。
2.道尔顿的近代原子学说
英国科学家道尔顿是________________的创始人。他认为物质由_____组成,原子不能被创造,也不能被毁灭,在化学变化中不可再分割,它们在化学反应中保持本性不变。
笃学一 原子结构模型的演变
原子
近代原子学说
原子
3.汤姆生的“葡萄干面包式”原子结构模型
他认为原子是由更小的微粒构成的,______的发现使人们认识到原子是可以______的。
4.卢瑟福的带核原子结构模型
物理学家卢瑟福根据____现象,指出原子是由_________和________构成的,__________带正电荷,它几乎集中了原子的全部________,但只占有很小的______,________带负电荷,在原子核周围空间做____________________。
电子
再分
α?
粒子散射
原子核
核外电子
原子核
质量
体积
核外电子高速运动
5.玻尔的轨道原子结构模型
丹麦物理学家波尔指出:原子核外电子在原子核外空间内一系列____________上绕核做高速运动,每个轨道都具有一个确定的________;核外电子在这些____________上运动时,既不放出能量,也不吸收能量。
6.电子云模型(现代原子结构学说)
现代科学家根据微观世界____________的规律,提出用______________描述核外电子运动。
稳定的轨道
能量值
稳定的轨道
波粒二象性
量子力学模型
02
1.原子核外电子排布
对于多电子原子来说,原子核外电子是______排布的,原子的核外电子数越多,占据的电子层越多。
分层
笃学二 原子核外电子排布与元素的化学性质
2.原子的8电子稳定结构
稀有气体最外层电子达到稳定结构,其原子核外最外层电子排布是____个或____个。钠、镁、铝等活泼金属原子的最外层电子数______,与活泼非金属反应时容易______电子,形成______的电子层结构;氧、氟、氯等活泼非金属原子的最外层电子数______,与活泼金属反应时容易______电子,形成______的电子层结构。
2
8
较少
失去
稳定
较多
得到
稳定
3.元素的化合价与原子最外层电子数的关系
根据钠、镁、氧、氯原子的最外层电子数填写下表:
元素 化合价 原子最外层电子数 失去(或得到)电子的数目
钠 _______ ________ __________
镁 _______ ________ __________
氧 _______ ________ __________
氯 _______ ________ __________
+1
1
失去1
+2
2
失去2
-2
6
得到2
-1
7
得到1
1.原子的组成:原子是由带正电的__________和带负电的__________构成的,原子核又是由______和______构成的,______带正电,______不带电。
笃学三 原子的组成和三种粒子间的关系
原子核
核外电子
质子
中子
质子
中子
2.粒子间数据关系
(1)质量关系:质量数(A)=___________+___________。
(2)电性关系:
原子:核电荷数=________=____________;阴离子:电荷数=________-______________;
阳离子:电荷数=__________-______________。
质子数(Z)
中子数(N)
质子数
核外电子数
质子数
核外电子数
质子数
核外电子数
3.原子的表示方法:X
其中X——表示____________________;
Z——表示_______________________;
A——表示______________________。
X元素的元素符号
X元素的原子的质子数
X元素的原子的质量数
+1
1
小
小
1.元素:具有相同的_____________________的同一类原子的总称。
2.核素:具有一定质子数和一定中子数的某种______。
3.同位素:_________________________________的原子的互称。
笃学四 核素与同位素
核电荷数(即质子数)
原子
质子数相同而质量数(或中子数)不同
【慎思1】 元素的化合价与得到或失去的电子数的关系是什么?
【答案】元素的化合价与得到或失去的电子数的关系:
失去的电子数=正价的数值。
得到的电子数=负价的数值。
【慎思2】 原子的质量主要由哪些微粒决定?
【答案】因电子的质量比质子和中子的质量小得多,可以忽略不计。因此原子的质量主要集中在原子核上,而原子核又是由质子和中子构成的。故原子的质量主要由质子和中子决定。
【慎思3】 怎样用图示形象地表示出元素、核素、同位素的关系?
【答案】可以表示为:
【答案】质量数 质子数 离子所带电荷 原子的个数 19 20 19 同位素 相同 不同
【慎思5】 用A质子数、B中子数、C核外电子数、D最外层电子数、E电子层数,用字母填写下列各空格。
(1)原子种类由____决定。
(2)元素种类由____决定。
(3)元素有无同位素由________决定。
(4)同位素相对原子质量由________决定。
(5)元素的原子半径由________决定。
【答案】(1)AB (2)A (3)B (4)AB (5)AE
元素性质与原子结构的关系
原子核外电子排布
元素 最外层电子数 得失电子能力 化学性质 主要化合价
稀有气体元素 8(He为2) 一般不易得失电子 较稳定,一般不参与化学反应
金属
元素 <4 易失
电子 金属性 无负价,一般为+1~+3
非金属元素 ≥4 易得
电子 非金属性 既有正价又有负价
注意:(1)元素的化合价一般是由最外层电子数决定的,而且最高正化合价=最外层电子数。
(2)金属元素只有正价,没有负价,非金属元素一般既有正价又有负价(氟、氧除外)。
解析 质子数小于电子数的是B,属于阴离子;金属元素的最外层电子数一般小于4个,则D属于金属元素;化学性质由最外层电子数决定,A与C具有相同的最外层电子数,则化学性质相似。
答案 (1)B (2)D (3)AC
(1)元素的化学性质主要是由最外层电子数决定的;当最外层电子数小于4时,一般是金属元素,当最外层电子数大于4时,一般属于非金属元素。(2)当质子数大于电子数时,该微粒属于阳离子,反之属于阴离子。
【答案】D
【解释】元素的最高化合价等于最外层电子数,氯原子最外层有7个电子,则最高化合价为+7。
原子的组成
答案 B
对于原子而言,质子数=电子数=核电荷数;质量数=质子数+中子数。
【答案】A
【解释】原子的核外电子数等于质子数。
核素和同位素
元素 核素 同位素
概念 具有相同质子数的同一类原子的总称 具有一定数目的质子和一定数目中子的一种原子 质子数相同,中子数不同的同一元素的不同核素互为同位素
对象 宏观概念 元素的某种原子 同一元素不同原子间的互称
特征 以单质或化合物形式存在,性质通过形成的物质来体现 不同核素质量不同 天然存在的各种同位素所占的原子百分数一般是不变的
举例 16O、17O、18O是氧元素的三种核素,它们互称为同位素
答案 B
【答案】B
【解释】中子数=质量数-质子数,A选项显然错误;元素的定义是具有相同核电荷数的一类原子的总称,B正确,D错误;对于原子来说,质子数=核电荷数=核外电子数,C错误。
