2.1.1 人类对原子结构的认识 原子核外电子的运动特征 课件(共31张PPT) 2023-2024学年高二化学苏教版选择性必修2
文档属性
| 名称 | 2.1.1 人类对原子结构的认识 原子核外电子的运动特征 课件(共31张PPT) 2023-2024学年高二化学苏教版选择性必修2 |

|
|
| 格式 | pptx | ||
| 文件大小 | 3.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-09 12:50:02 | ||
图片预览










文档简介
(共31张PPT)
专题2 原子结构与元素性质
第一单元 第1课时 人类对原子结构的认识
原子核外电子的运动特征
素 养 目 标
1.了解有关核外电子运动模型的历史发展过程,认识基于实验证据建构和优化模型的思路,培养证据推理与模型认知的化学核心素养。
2.能用轨道和能级概念描述核外电子的运动状态,培养宏观辨识与微观探析的化学核心素养。
基础落实·必备知识全过关
重难探究·能力素养全提升
目 录 索 引
基础落实·必备知识全过关
一、人类对原子结构的认识
1.人类对原子结构的认识过程
时间 科学家 原子结构观点
19世纪 英国科学家道尔顿 提出了 ,认为原子有质量,
19世纪末 英国物理学家汤姆生 发现电子 提出电子普遍存在于原子中,提出了“葡萄干面包式”原子结构模型
1911年 英国物理学家卢瑟福 做了α粒子散射实验 提出了原子结构的 模型:
(1)原子的质量主要集中在 上;
(2)电子在原子核外 做高速运动
1913年 丹麦物理学家玻尔 研究了 光谱,根据 的观点,提出新的原子结构模型
近代原子论
不可分割
有核
原子核
空间
氢原子
量子力学
2.玻尔理论
(1)内容
①原子核外电子在一系列稳定的轨道上运动,这些轨道称为 轨道;核外电子在原子轨道上运动时,既不放出能量,也不吸收能量。
②不同的原子轨道具有 同的能量,原子轨道的能量变化是 。
③原子核外电子可以在 的轨道上发生跃迁。
原子
不
不连续的
能量不同
(2)贡献——较好地解释了氢原子线状光谱
①当电子 后,会从能量较低的轨道跃迁到能量较高的轨道上。
②处于能量较高轨道的电子不稳定,会回到能量较低的轨道上,并发射出 ,发出光的波长取决于两个轨道的 。
(3)局限性
玻尔原子结构模型无法解释氢原子线状光谱的 结构,更无法解释
原子的光谱。
吸收能量
光子
能量之差
精细
多电子
3.电子云
(1)含义:用小点的疏密来描述电子在原子核外空间出现的机会大小所得到的图形叫做电子云。
(2)意义:小点代表电子 ,小点的疏密与电子 成正比。
(3)基态: 时简称为基态。
在核外空间区域出现的机会
在该区域内出现的机会大小
原子的核外电子处于能量最低状态
教材阅读 想一想阅读教材“然而,玻尔原子结构模型也存在着很大的局限性”一段。
思考:玻尔原子结构模型也存在着很大的局限性,如该模型无法解释氢原子线状光谱的精细结构。氢原子线状光谱的精细结构是指同一条光谱中出现了分裂,即光谱可能是两条,玻尔的结论为什么不能解释光谱分裂现象
提示 按玻尔的理论,每个轨道只有一种能量,电子从一个轨道到另一个轨道跃迁时能量变化就只有一种,不可能出现两种光谱。
易错辨析 判一判
(1)被称为“原子之父”的科学家为卢瑟福。( )
(2)在电子云中的每个小点表示一个电子。( )
提示 电子云就是用小点疏密来表示电子在原子核外空间出现的机会大小的一种图形,小点表示电子在核外空间区域出现的机会。
(3)卢瑟福通过α粒子散射实验发现了电子。( )
提示 电子是汤姆生发现的,卢瑟福通过α粒子散射实验提出了原子结构的有核模型。
√
×
×
二、原子核外电子的运动特征
1.电子层(n)
分层 标准 电子离核的远近
取值 1 2 3 4 5 6 7
符号
能量
离核
K
L
M
N
O
P
Q
低→高
近→远
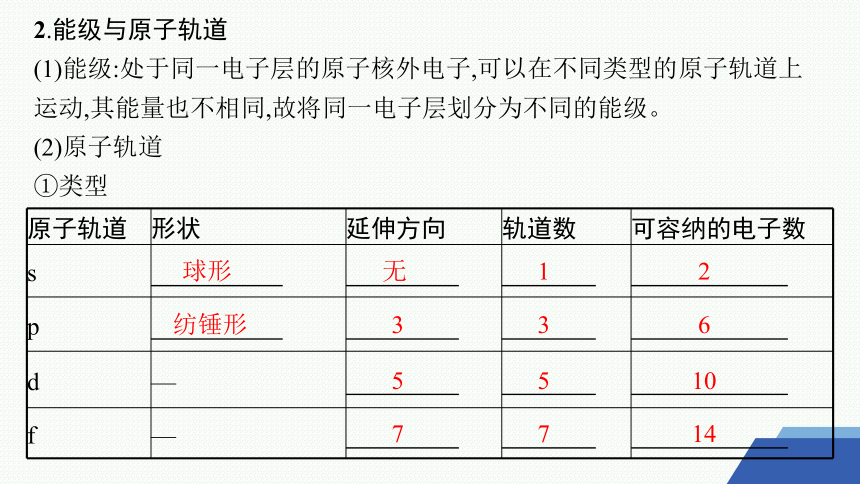
2.能级与原子轨道
(1)能级:处于同一电子层的原子核外电子,可以在不同类型的原子轨道上运动,其能量也不相同,故将同一电子层划分为不同的能级。
(2)原子轨道
①类型
原子轨道 形状 延伸方向 轨道数 可容纳的电子数
s
p
d —
f —
球形
无
1
2
纺锤形
3
3
6
5
5
10
7
7
14
②表示方法:原子轨道用 和
结合起来共同表示,如1s、2s、2p(2px、2py、2pz)、3d等。
③各电子层包含的原子轨道数目和可容纳的电子数
电子层 原子轨道类型 原子轨道数目 可容纳的电子数
1 1s 1 2
2 2s、2p 4 8
3 3s、3p、3d 9 18
4 4s、4p、4d、4f 16 32
n — n2 2n2
表示电子层的n
表示原子轨道形状的s、p、d、f
④原子轨道能量高低
相同电子层的原子轨道 ns np nd nf
形状相同的原子轨道 2p 3p 4p
电子层数和原子轨道形状均相同 2px 2py 2pz
<
<
<
<
<
=
=
3.自旋
原子核外电子还存在一种称为“自旋”的运动。自旋可以有两种不同的状态,分别用“↑”和“↓”表示。
教材阅读 想一想自学教材“表2-1”。
思考:第n电子层中含有的原子轨道类型有几种 原子轨道数目是多少 可容纳的电子数是多少 结合第4电子层进行分析。
提示 第n电子层中含有的原子轨道类型有n种,原子轨道数目n2个,可容纳的电子数是2n2个。
例如:第4电子层中,含有4s、4p、4d、4f四种类型的轨道,原子轨道数目为1+3+5+7=16=42个,一共可容纳的电子数为32=2×42个。
易错辨析 判一判
(1)第n电子层共有n个能级,n2个原子轨道。( )
(2)每个轨道容纳的2个电子自旋状态不固定。( )
提示 每个轨道容纳的2个电子有两种不同的自旋状态。
(3)当电子层n=2时,有2s、2px、2py、2pz四个原子轨道。( )
(4)Ca原子的结构示意图为 ,说明第2电子层和第3电子层最多均容纳8个电子。( )
提示 第2电子层最多容纳8个电子,第3电子层最多容纳18个电子。
√
×
√
×
重难探究·能力素养全提升
探究 核外电子的运动特征
情境探究
氮化镓充电器在最近几年十分流行,优点是小巧轻便充电快,一般一个氮化镓充电器会有三个充电口,它可以同时为两台手机、一台笔记本电脑同时使用,散热效率也比普通充电器优秀,因此也更加安全。
镓元素为ⅢA族的金属元素,其原子结构示意图为 。
1.该元素的原子核外共有多少个电子层 核外电子占据多少个原子轨道
2.该元素原子的次外层上有几种原子轨道类型 如何表示 该层每种类型的原子轨道中分别容纳了几个电子
提示 该元素的原子核外共有4个电子层,16个原子轨道。
提示 该元素的次外层为第3层,共有3种原子轨道类型,分别为3s、3p、3d。3s容纳2个电子,3p容纳6个电子,3d容纳10个电子。
方法突破
1.描述电子运动状态的参数
2.常见原子轨道的图形描述
3.各电子层包含的原子轨道类型及最多容纳的电子数
电子层(n) 1 2 3 4 5 6 7
符号 K L M N O P Q
原子轨 道类型 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f … … …
原子轨 道数 1 1 3 1 3 5 1 3 5 7 … … …
1 4 9 16 n2
最多容纳 的电子数 2 2 6 2 6 10 2 6 10 14 … … …
2 8 18 32 2n2
离核远近 近→远
能量高低 低→高
4.不同原子轨道能量高低的关系
应用体验
视角1 电子层与原子轨道的能量高低及形状
1.[2023河北衡水第十三中学质检]下列各能级上的电子能量最高的是
( )
A.2p B.3s
C.3d D.4s
C
解析 原子的核外电子排布遵循能量最低原理,基态原子核外电子的排布遵循下列顺序:1s、2s、2p、3s、3p、4s、3d、4p,所以选项中电子能量最高的是3d。
2.[2023河北衡水第二中学检测]下列说法正确的是( )
A.2p能级有3个轨道
B.1s、2s、3s的电子云轮廓图形状不同
C.p轨道呈纺锤形,因此p轨道上电子的运动轨迹呈纺锤形
D.同一电子层的p轨道电子能量不一定高于s轨道电子能量
A
解析 任何电子层的p能级都有3个p轨道,故A正确;不同电子层的s轨道的形状都是球形,只是球的半径不同,故B错误;p轨道呈纺锤形,因此p轨道上电子云密度分布呈纺锤形,不是电子的实际运动轨迹,故C错误;同一电子层的p轨道电子能量一定高于s轨道电子能量,故D错误。
3.3px所代表的含义是( )
A.px轨道上有3个电子
B.第3电子层px轨道有3个伸展方向
C.px电子云有3个伸展方向
D.第3电子层沿x轴方向伸展的p轨道
D
解析 3px中,3表示第3电子层,px表示沿x轴方向伸展的p轨道。
视角2 电子层与原子轨道所能容纳的电子数
4.下列关于电子层与原子轨道的说法正确的是( )
A.不同的电子层中的s原子轨道的能量相同
B.原子核外每一个电子层最多可容纳的电子数为n2
C.每种类型的原子轨道里最多容纳的电子数与原子轨道数相等
D.任一电子层中所含有的原子轨道类型数等于该电子层数
D
解析 A项中不同电子层中的s原子轨道的能量不同,电子层数越大,能量越高;B项中每一个电子层最多可容纳的电子数为2n2;C项中每种类型的原子轨道里最多容纳的电子数是原子轨道数目的2倍。
5.若原子的电子层数为n,则下列推论不正确的是( )
A.第n电子层中具有的原子轨道类型为n种
B.第n电子层中具有的原子轨道数为n2个
C.第n电子层中最多具有的电子数为2n2个
D.同一原子轨道上的电子能量一定相同,不同原子轨道上的电子能量一定不同
D
解析 不同的原子轨道,只要对应的电子层数和原子轨道类型相同,则能量相同,如2px和2py能量相同,D项错误。
6.下列说法正确的是( )
A.第3电子层有s、p两个能级
B.在基态多电子原子中,p轨道电子能量一定高于s轨道电子能量
C.第3电子层最多容纳8个电子
D.无论哪一电子层的s轨道最多容纳的电子数均为2
D
解析 第3电子层有s、p、d三个能级,A错误;同一电子层中的p轨道电子的能量一定比s轨道电子能量高,但电子层较高的s轨道电子能量则比电子层低的p轨道电子能量高,B错误;每个电子层最多可容纳的电子数是2n2,第3电子层最多容纳18个电子,C错误;s轨道最多容纳的电子数为2,D正确。
7.填空。
(1)用符号填写电子层所含能级种类:K层:1s;L层: ;
M层: ;N层: 。
(2)用数字填写能级所含原子轨道数目:
s: ;p: ;d: ;f: 。
(3)用数字填写电子层最多容纳的电子数目:L层: ;M层: ;
N层: 。
答案 (1)2s、2p 3s、3p、3d 4s、4p、4d、4f
(2)1 3 5 7
(3)8 18 32
本 课 结 束
专题2 原子结构与元素性质
第一单元 第1课时 人类对原子结构的认识
原子核外电子的运动特征
素 养 目 标
1.了解有关核外电子运动模型的历史发展过程,认识基于实验证据建构和优化模型的思路,培养证据推理与模型认知的化学核心素养。
2.能用轨道和能级概念描述核外电子的运动状态,培养宏观辨识与微观探析的化学核心素养。
基础落实·必备知识全过关
重难探究·能力素养全提升
目 录 索 引
基础落实·必备知识全过关
一、人类对原子结构的认识
1.人类对原子结构的认识过程
时间 科学家 原子结构观点
19世纪 英国科学家道尔顿 提出了 ,认为原子有质量,
19世纪末 英国物理学家汤姆生 发现电子 提出电子普遍存在于原子中,提出了“葡萄干面包式”原子结构模型
1911年 英国物理学家卢瑟福 做了α粒子散射实验 提出了原子结构的 模型:
(1)原子的质量主要集中在 上;
(2)电子在原子核外 做高速运动
1913年 丹麦物理学家玻尔 研究了 光谱,根据 的观点,提出新的原子结构模型
近代原子论
不可分割
有核
原子核
空间
氢原子
量子力学
2.玻尔理论
(1)内容
①原子核外电子在一系列稳定的轨道上运动,这些轨道称为 轨道;核外电子在原子轨道上运动时,既不放出能量,也不吸收能量。
②不同的原子轨道具有 同的能量,原子轨道的能量变化是 。
③原子核外电子可以在 的轨道上发生跃迁。
原子
不
不连续的
能量不同
(2)贡献——较好地解释了氢原子线状光谱
①当电子 后,会从能量较低的轨道跃迁到能量较高的轨道上。
②处于能量较高轨道的电子不稳定,会回到能量较低的轨道上,并发射出 ,发出光的波长取决于两个轨道的 。
(3)局限性
玻尔原子结构模型无法解释氢原子线状光谱的 结构,更无法解释
原子的光谱。
吸收能量
光子
能量之差
精细
多电子
3.电子云
(1)含义:用小点的疏密来描述电子在原子核外空间出现的机会大小所得到的图形叫做电子云。
(2)意义:小点代表电子 ,小点的疏密与电子 成正比。
(3)基态: 时简称为基态。
在核外空间区域出现的机会
在该区域内出现的机会大小
原子的核外电子处于能量最低状态
教材阅读 想一想阅读教材“然而,玻尔原子结构模型也存在着很大的局限性”一段。
思考:玻尔原子结构模型也存在着很大的局限性,如该模型无法解释氢原子线状光谱的精细结构。氢原子线状光谱的精细结构是指同一条光谱中出现了分裂,即光谱可能是两条,玻尔的结论为什么不能解释光谱分裂现象
提示 按玻尔的理论,每个轨道只有一种能量,电子从一个轨道到另一个轨道跃迁时能量变化就只有一种,不可能出现两种光谱。
易错辨析 判一判
(1)被称为“原子之父”的科学家为卢瑟福。( )
(2)在电子云中的每个小点表示一个电子。( )
提示 电子云就是用小点疏密来表示电子在原子核外空间出现的机会大小的一种图形,小点表示电子在核外空间区域出现的机会。
(3)卢瑟福通过α粒子散射实验发现了电子。( )
提示 电子是汤姆生发现的,卢瑟福通过α粒子散射实验提出了原子结构的有核模型。
√
×
×
二、原子核外电子的运动特征
1.电子层(n)
分层 标准 电子离核的远近
取值 1 2 3 4 5 6 7
符号
能量
离核
K
L
M
N
O
P
Q
低→高
近→远
2.能级与原子轨道
(1)能级:处于同一电子层的原子核外电子,可以在不同类型的原子轨道上运动,其能量也不相同,故将同一电子层划分为不同的能级。
(2)原子轨道
①类型
原子轨道 形状 延伸方向 轨道数 可容纳的电子数
s
p
d —
f —
球形
无
1
2
纺锤形
3
3
6
5
5
10
7
7
14
②表示方法:原子轨道用 和
结合起来共同表示,如1s、2s、2p(2px、2py、2pz)、3d等。
③各电子层包含的原子轨道数目和可容纳的电子数
电子层 原子轨道类型 原子轨道数目 可容纳的电子数
1 1s 1 2
2 2s、2p 4 8
3 3s、3p、3d 9 18
4 4s、4p、4d、4f 16 32
n — n2 2n2
表示电子层的n
表示原子轨道形状的s、p、d、f
④原子轨道能量高低
相同电子层的原子轨道 ns np nd nf
形状相同的原子轨道 2p 3p 4p
电子层数和原子轨道形状均相同 2px 2py 2pz
<
<
<
<
<
=
=
3.自旋
原子核外电子还存在一种称为“自旋”的运动。自旋可以有两种不同的状态,分别用“↑”和“↓”表示。
教材阅读 想一想自学教材“表2-1”。
思考:第n电子层中含有的原子轨道类型有几种 原子轨道数目是多少 可容纳的电子数是多少 结合第4电子层进行分析。
提示 第n电子层中含有的原子轨道类型有n种,原子轨道数目n2个,可容纳的电子数是2n2个。
例如:第4电子层中,含有4s、4p、4d、4f四种类型的轨道,原子轨道数目为1+3+5+7=16=42个,一共可容纳的电子数为32=2×42个。
易错辨析 判一判
(1)第n电子层共有n个能级,n2个原子轨道。( )
(2)每个轨道容纳的2个电子自旋状态不固定。( )
提示 每个轨道容纳的2个电子有两种不同的自旋状态。
(3)当电子层n=2时,有2s、2px、2py、2pz四个原子轨道。( )
(4)Ca原子的结构示意图为 ,说明第2电子层和第3电子层最多均容纳8个电子。( )
提示 第2电子层最多容纳8个电子,第3电子层最多容纳18个电子。
√
×
√
×
重难探究·能力素养全提升
探究 核外电子的运动特征
情境探究
氮化镓充电器在最近几年十分流行,优点是小巧轻便充电快,一般一个氮化镓充电器会有三个充电口,它可以同时为两台手机、一台笔记本电脑同时使用,散热效率也比普通充电器优秀,因此也更加安全。
镓元素为ⅢA族的金属元素,其原子结构示意图为 。
1.该元素的原子核外共有多少个电子层 核外电子占据多少个原子轨道
2.该元素原子的次外层上有几种原子轨道类型 如何表示 该层每种类型的原子轨道中分别容纳了几个电子
提示 该元素的原子核外共有4个电子层,16个原子轨道。
提示 该元素的次外层为第3层,共有3种原子轨道类型,分别为3s、3p、3d。3s容纳2个电子,3p容纳6个电子,3d容纳10个电子。
方法突破
1.描述电子运动状态的参数
2.常见原子轨道的图形描述
3.各电子层包含的原子轨道类型及最多容纳的电子数
电子层(n) 1 2 3 4 5 6 7
符号 K L M N O P Q
原子轨 道类型 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f … … …
原子轨 道数 1 1 3 1 3 5 1 3 5 7 … … …
1 4 9 16 n2
最多容纳 的电子数 2 2 6 2 6 10 2 6 10 14 … … …
2 8 18 32 2n2
离核远近 近→远
能量高低 低→高
4.不同原子轨道能量高低的关系
应用体验
视角1 电子层与原子轨道的能量高低及形状
1.[2023河北衡水第十三中学质检]下列各能级上的电子能量最高的是
( )
A.2p B.3s
C.3d D.4s
C
解析 原子的核外电子排布遵循能量最低原理,基态原子核外电子的排布遵循下列顺序:1s、2s、2p、3s、3p、4s、3d、4p,所以选项中电子能量最高的是3d。
2.[2023河北衡水第二中学检测]下列说法正确的是( )
A.2p能级有3个轨道
B.1s、2s、3s的电子云轮廓图形状不同
C.p轨道呈纺锤形,因此p轨道上电子的运动轨迹呈纺锤形
D.同一电子层的p轨道电子能量不一定高于s轨道电子能量
A
解析 任何电子层的p能级都有3个p轨道,故A正确;不同电子层的s轨道的形状都是球形,只是球的半径不同,故B错误;p轨道呈纺锤形,因此p轨道上电子云密度分布呈纺锤形,不是电子的实际运动轨迹,故C错误;同一电子层的p轨道电子能量一定高于s轨道电子能量,故D错误。
3.3px所代表的含义是( )
A.px轨道上有3个电子
B.第3电子层px轨道有3个伸展方向
C.px电子云有3个伸展方向
D.第3电子层沿x轴方向伸展的p轨道
D
解析 3px中,3表示第3电子层,px表示沿x轴方向伸展的p轨道。
视角2 电子层与原子轨道所能容纳的电子数
4.下列关于电子层与原子轨道的说法正确的是( )
A.不同的电子层中的s原子轨道的能量相同
B.原子核外每一个电子层最多可容纳的电子数为n2
C.每种类型的原子轨道里最多容纳的电子数与原子轨道数相等
D.任一电子层中所含有的原子轨道类型数等于该电子层数
D
解析 A项中不同电子层中的s原子轨道的能量不同,电子层数越大,能量越高;B项中每一个电子层最多可容纳的电子数为2n2;C项中每种类型的原子轨道里最多容纳的电子数是原子轨道数目的2倍。
5.若原子的电子层数为n,则下列推论不正确的是( )
A.第n电子层中具有的原子轨道类型为n种
B.第n电子层中具有的原子轨道数为n2个
C.第n电子层中最多具有的电子数为2n2个
D.同一原子轨道上的电子能量一定相同,不同原子轨道上的电子能量一定不同
D
解析 不同的原子轨道,只要对应的电子层数和原子轨道类型相同,则能量相同,如2px和2py能量相同,D项错误。
6.下列说法正确的是( )
A.第3电子层有s、p两个能级
B.在基态多电子原子中,p轨道电子能量一定高于s轨道电子能量
C.第3电子层最多容纳8个电子
D.无论哪一电子层的s轨道最多容纳的电子数均为2
D
解析 第3电子层有s、p、d三个能级,A错误;同一电子层中的p轨道电子的能量一定比s轨道电子能量高,但电子层较高的s轨道电子能量则比电子层低的p轨道电子能量高,B错误;每个电子层最多可容纳的电子数是2n2,第3电子层最多容纳18个电子,C错误;s轨道最多容纳的电子数为2,D正确。
7.填空。
(1)用符号填写电子层所含能级种类:K层:1s;L层: ;
M层: ;N层: 。
(2)用数字填写能级所含原子轨道数目:
s: ;p: ;d: ;f: 。
(3)用数字填写电子层最多容纳的电子数目:L层: ;M层: ;
N层: 。
答案 (1)2s、2p 3s、3p、3d 4s、4p、4d、4f
(2)1 3 5 7
(3)8 18 32
本 课 结 束
