2.1.2 原子核外电子的排布 课件 (共48张PPT)2023-2024学年高二化学苏教版选择性必修2
文档属性
| 名称 | 2.1.2 原子核外电子的排布 课件 (共48张PPT)2023-2024学年高二化学苏教版选择性必修2 |  | |
| 格式 | pptx | ||
| 文件大小 | 6.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-09 12:50:43 | ||
图片预览







文档简介
(共48张PPT)
专题2 原子结构与元素性质
第一单元 第2课时 原子核外电子的排布
素 养 目 标
1.能举例说明原子核外电子排布的构造原理,结合原子核外电子排布规律,建立观点、结论和证据之间的逻辑关系,培养证据推理与模型认知的化学核心素养。
2.能用电子排布式、轨道表示式表征1~36号元素基态原子的核外电子排布,理解原子核外电子的运动不同于宏观物体的运动,培养宏观辨识与微观探析的化学核心素养。
基础落实·必备知识全过关
重难探究·能力素养全提升
目 录 索 引
基础落实·必备知识全过关
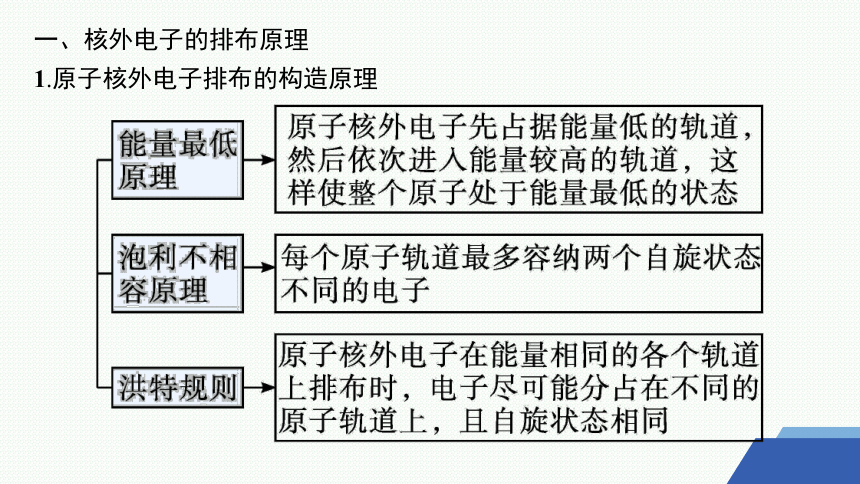
一、核外电子的排布原理
1.原子核外电子排布的构造原理
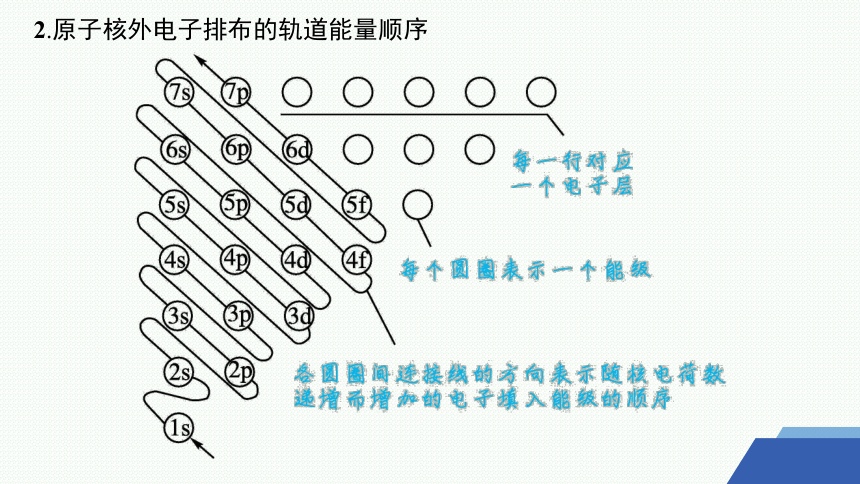
2.原子核外电子排布的轨道能量顺序
教材阅读 想一想自学教材“原子核外电子排布的构造原理”。
思考:碳-14呼气试验可用于判断患者是否存在幽门螺旋杆菌感染。幽门螺旋杆菌可引起多种胃病,根除幽门螺旋杆菌已经成为现代消化道疾病治疗的重要措施。当病人服用14C标记的尿素后,如患者的胃内存在幽门螺旋杆菌感染,胃中的尿素酶可将尿素分解为氨和14CO2,14CO2通过血液经呼气排出,定时收集呼出的气体,通过分析呼气中14CO2的含量即可判断患者是否存在幽门螺旋杆菌感染。碳元素原子核外电子排布遵循什么原则 先后占据了哪些原子轨道 有多少个未成对电子
提示 遵循能量最低原理、泡利不相容原理和洪特规则。电子先后占据了1s、2s、2p三个轨道,由于2p有三个轨道两个电子,根据洪特规则,这两个电子分占不同原子轨道,因此有2个未成对电子。
易错辨析 判一判
(1)电子总是先填满低电子层再填高电子层。( )
提示 不一定,如电子先填4s轨道后填3d轨道。
(2)同一原子中2p、3p、4p轨道数相等。( )
(3)原子核外电子填充3p、3d、4s能级的顺序为3p→4s→3d。( )
(4)每个原子轨道最多容纳两个自旋状态相同的电子,称为泡利不相容原理。
( )
提示 每个原子轨道上最多容纳两个自旋状态不同的电子。
×
√
√
×
二、原子核外电子排布的表示方法
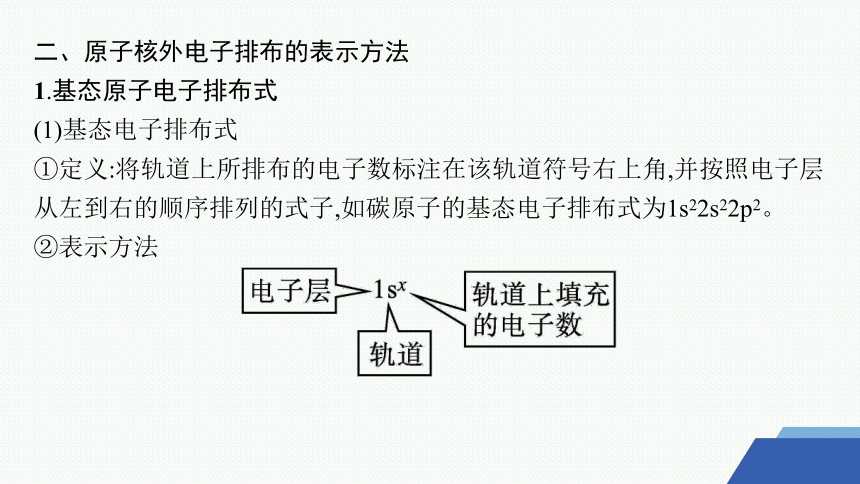
1.基态原子电子排布式
(1)基态电子排布式
①定义:将轨道上所排布的电子数标注在该轨道符号右上角,并按照电子层从左到右的顺序排列的式子,如碳原子的基态电子排布式为1s22s22p2。
②表示方法
(2)简化的电子排布式
为了避免电子排布式书写过于繁琐,把内层电子已达到 结构的部分写成“原子实”,以相应 表示,得到简化的电子排布式,如碳原子简化的电子排布式为[He]2s22p2。
(3)外围电子排布式
对于过渡元素的原子在简化的电子排布式中,省去相应的稀有气体的“原子实”后剩下的部分称为外围电子排布式;对于主族元素的原子,外围电子排布式就是最外层电子的排布式。
稀有气体
稀有气体的元素符号外加方括号
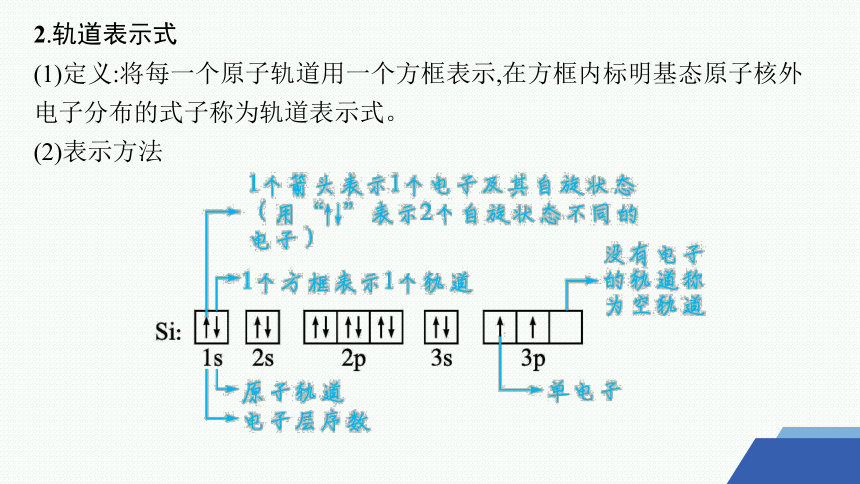
2.轨道表示式
(1)定义:将每一个原子轨道用一个方框表示,在方框内标明基态原子核外电子分布的式子称为轨道表示式。
(2)表示方法
3.光谱和光谱分析
(1)光谱形成原因:不同元素的原子中电子发生 时会吸收或释放不同的光。
(2)光谱分类
(3)应用:在日常生活中,我们看到的许多可见光,如霓虹灯光、激光、焰火等,都与原子核外电子发生跃迁释放能量有关。
(4)光谱分析:在现代化学中,人们可通过原子发射光谱或吸收光谱来检测元素,称为光谱分析。
跃迁
教材阅读 想一想自学教材“在通常情况下,原子核外电子的排布”一段和“原子光谱分析原理”。
思考:霓虹灯光、激光、焰火都与原子核外电子跃迁形成的光谱有关,这些光谱属于发射光谱还是吸收光谱
提示 发射光谱。
易错辨析 判一判
(1)3d6的轨道表示式为 。( )
提示 题中轨道表示式违背了洪特规则。
(2)基态Zn原子的电子排布式为[Ar]4s23d10。( )
提示 基态Zn原子的电子排布式为[Ar]3d104s2。
(3)第2周期元素中基态原子未成对电子数最多的为氮原子。( )
(4)电子仅在激发态跃迁到基态时才会产生原子光谱。( )
提示 电子从能量较低的激发态或基态跃迁到能量较高的激发态时,也会产生原子光谱。
×
×
√
×
重难探究·能力素养全提升
探究一 核外电子的排布原理
情境探究
构造原理是由玻尔、西蒙、泡利和鲁拉一起提出的。构造原理可用于确定原子、分子或离子的电子组态。此原理须确定取得它们相对于原子核和其他已存在的电子间的最稳定情况(电子轨道)。简而言之,电子会先填入能量较低的轨道,其次再填入能量较高的轨道,即整个体系的能量越低越好。一般来说,新填入的电子都是填在能量最低的空轨道上的。
1.根据构造原理,电子填入轨道是从最低的能量状态开始,随后进入能量状态较高的轨道(即1s会在2s之前)。这句话正确吗
2.根据构造原理,对多电子原子而言,轨道能量由低至高的次序为1s<2s<2p<3s<3p<4s<3d<4p……这种说法正确吗
提示 正确。电子会先填入能量较低的轨道,再填入能量较高的轨道,即整个体系的能量越低越好。
提示 正确。根据构造原理,电子所排的轨道能量顺序:1s、2s、2p、3s、3p、4s、3d、4p、5s、4d、5p、6s、4f、5d、6p、7s……
方法突破
1.泡利不相容原理与洪特规则
(1)泡利不相容原理
①内容:每个原子轨道最多容纳两个自旋状态不同的电子。
②自旋状态只有两种:↑、↓。
③原子轨道与原子轨道数和最多容纳的电子数的关系:
原子轨道类型 s p d f
原子轨道数 1 3 5 7
最多容纳的电子数 2 6 10 14
(2)洪特规则
①内容:电子在能量相同的轨道(例如3个p轨道,5个d轨道,7个f轨道)上排布时,将尽可能分占不同的轨道,而且自旋状态相同。如:2p3轨道上的电子排布为 ,不能为 或 。
将在原子轨道上运动的单个电子称为未成对电子
②特例:能量相等轨道上的电子排布在全充满、半充满和全空状态时,具有较低的能量和较高的稳定性。
例如:
铬(24Cr)的基态电子排布式
3d为半充满
铜(29Cu)的基态电子排布式
3d为全充满
2.基态电子排布式的书写方法
3.核外电子排布的表示方法
应用体验
视角1 原子核外电子排布的构造原理
1.[2023河北衡水第二中学检测]下列对电子排布式或轨道表示式书写的评价正确的是( )
选项 电子排布式或轨道表示式 评价
A N原子的轨道表示式: 错误;违反洪特规则
B O原子的轨道表示式: 错误;违反泡利不相容原理
C K原子的轨道表示式:1s22s22p63s23p63d1 错误;违反能量最低原理
D Br-的电子排布式:[Ar]3d104s24p6 错误;违反能量最低原理
C
解析 相同轨道中的两个电子自旋状态不同,A项违反了泡利不相容原理,不符合题意,A错误;原子核外电子在能量相同的各个轨道上排布时,电子尽可能分占在不同的原子轨道上,且自旋状态相同,B项违反了洪特规则,不符合题意,B错误;K原子的电子排布式为1s22s22p63s23p64s1,C项违反能量最低原理,符合题意,C正确;Br-的电子排布式:[Ar]3d104s24p6,正确,评价错误,D错误。
2.下列原子或离子的电子排布表示方法中,正确的是 ,违反能量最低原理的是 ,违反洪特规则的是 ,违反泡利不相容原理的是 。
①Ca2+:1s22s22p63s23p6
②F-:1s22s23p6
④Fe:1s22s22p63s23p63d64s2
⑤Mg2+:1s22s22p6
答案 ①④⑤ ② ③ ⑥
解析 根据核外电子排布规律知②中错误在于电子排完2s轨道后应排2p轨道,而不是3p轨道,应为1s22s22p6;③中没有遵循洪特规则——电子在同一能级的不同轨道上排布时,应尽可能分占不同的轨道并且自旋状态相同;⑥违反泡利不相容原理,应为 。
视角2 基态原子、离子的核外电子排布
3.已知某原子结构示意图如图所示,下列有关说法正确的是( )
A.原子结构示意图中x=2
B.该原子的电子排布式为1s22s22p63s23p63d44s2
C.该原子3d轨道的轨道表示式为
D.该原子结构中共有7个能级上有电子
D
解析 由原子结构示意图可知,K层排满时为2个电子,故x=1,该元素为铬,故A项错误;根据洪特规则特例该原子的电子排布式为1s22s22p63s23p63d54s1,故B项错误;铬原子3d轨道上填充了5个电子,根据洪特规则,5个电子应分占5个轨道且自旋状态相同,故C项错误;该原子结构中共有1s、2s、2p、3s、3p、3d、4s 7个能级上有电子,故D项正确。
考题点睛
【变式设问】
(1)试写出铬原子的简化电子排布式和铬原子的外围电子排布式。
(2)写出Cr3+的电子排布式。
(3)基态铬原子核外有几个未成对电子
提示 铬原子的简化电子排布式为[Ar]3d54s1,外围电子排布式为3d54s1。
提示 1s22s22p63s23p63d3。
提示 6个。
4.下列叙述正确的是( )
A.3d64s2是基态原子的电子排布式
B.铬原子的电子排布式:1s22s22p63s23p64s13d5
C.铜原子的电子排布式:1s22s22p63s23p63d104s1
D.氮原子的轨道表示式是
C
解析 A项是原子的外围电子排布式;B项,在书写电子排布式时,不能完全按填充顺序书写;D项违反了洪特规则,应为 。
5.下列化学用语中正确的是( )
A.铬原子的简化电子排布式为[Ar]3d44s2
B.Cl-的结构示意图为
C.N原子的轨道表示式为
D.Cu原子的电子排布式为1s22s22p63s23p63d104s1
D
解析 A项违背洪特规则特例;B项Cl-最外层有8个电子;C项中N原子2p轨道上应是3个电子且自旋状态相同。
探究二 原子核外电子排布构造原理的应用
情境探究
钛合金主要用于制作飞机发动机压气机部件,其次为火箭、导弹和高速飞机的结构件。钛及其合金已在一般工业中应用,用于制作电解工业的电极,发电站的冷凝器,石油精炼和海水淡化的加热器以及环境污染控制装置等。钛及其合金已成为一种耐蚀结构材料。此外还用于生产贮氢材料和形状记忆合金等。
1.基态钛原子的核外电子排布式如何表示
2.钛原子的电子有多少种空间运动状态 多少种电子的运动状态
3.基态钛原子的外围电子轨道表示式如何表示 存在几个未成对电子
提示 1s22s22p63s23p63d24s2。
提示 电子的空间运动状态是指原子轨道,钛原子核外电子第一层1s,1个轨道;第二层2s和2p,共有4个轨道;第三层3s、3p共4个轨道,3d填充电子的轨道为2,则第三层共6个轨道;第四层4s,1个轨道,因此共有12个原子轨道,即12种空间运动状态。
在原子中每个电子的运动状态都是不同的,故该元素原子有22种电子的运动状态。
方法突破
1.电子空间运动状态和电子运动状态
(1)电子空间运动状态:是指原子轨道,原子核外有几个填充电子的轨道,就有几种电子空间运动状态。
(2)电子运动状态:在同一原子中,没有运动状态完全相同的两个电子存在,原子核外有几个电子,就有几种运动状态。
①电子层不同,则电子运动状态不同;
②电子层相同,能级相同,若在不同轨道,则电子运动状态不同,如2px和2py轨道上的电子运动状态不同;
③电子层相同,能级相同,轨道也相同,两电子的自旋状态不同,则电子运动状态不同。
2.原子的最外层、次外层电子数
(1)最外层电子数不超过8:由于能级交错,当ns和np轨道全充满时(共4个轨道,最多容纳8个电子),多余电子不是填入nd轨道,而是首先形成新电子层,填入(n+1)s轨道中,因此最外层电子数不可能超过8个。
(2)次外层电子数不超过18:若最外层是第n层,次外层就是第(n-1)层,在第(n+1)层出现前,次外层只有(n-1)s、(n-1)p、(n-1)d上有电子,其共有9个轨道,最多可容纳18个电子,因此次外层电子数不超过18个。例如,某原子最外层是第五层,次外层就是第四层,在第六层出现之前,次外层(第四层)只有4s、4p和4d轨道上有电子,4s、4p、4d共有9个轨道,最多可容纳18个电子,也就是次外层电子数不超过18个。
3.基态原子中未成对电子的判断
(1)主族元素未成对电子数规律
(2)第4周期过渡元素未成对电子数规律
应用体验
视角1 核外电子排布基态、激发态的判断
1.[2023湖南长沙浏阳期末调研]下列电子排布式或外围电子轨道表示式不能表示基态粒子的是( )
A.Ca 1s22s22p63s23p63d2
B.P 1s22s22p63s23p3
A
解析 Ca的基态电子排布式为1s22s22p63s23p64s2,故A符合题意。
2.[2023河北衡水中学四调节选]氮、磷、铁、铜、钇在现代工农业、科技及国防建设等领域中都有着广泛的应用。回答下列问题:
基态磷原子核外电子共有 种空间运动状态。磷原子在成键时,能将一个3s电子激发进入3d能级而参与成键,写出该激发态磷原子的核外电子排布式: 。
答案 9 1s22s22p63s13p33d1
解析 基态磷原子核外电子排布式为1s22s22p63s23p3,原子核外每一个原子轨道都是一种电子空间运动状态,s能级有1个轨道,p能级有3个轨道,所以一共有9个轨道,即9种空间运动状态。磷原子在成键时,由于将一个3s电子激发进入3d能级,则激发态磷原子的核外电子排布式为1s22s22p63s13p33d1。
视角2 核外电子排布构造原理的应用
3.某元素原子的3p轨道上有两个未成对电子,因此其( )
A.第3电子层上有4个电子
B.最高正价为+2
C.最高正价为+4
D.第2电子层没有未成对电子
D
解析 3p轨道上有两个未成对电子,则该基态原子电子排布式为1s22s22p63s23p2或1s22s22p63s23p4,即为Si元素或S元素。第3层有4或6个电子,最高正价为+4或+6,A、B、C均错误;第2层均为2s22p6,没有未成对电子,D正确。
4.下列说法中正确的是( )
A.3p2表示3p能级上有两个轨道
B.M层中的原子轨道数目为3
C.1s22s12p1是激发态原子的电子排布式
D.处于同一轨道上的电子可以有多个,它的运动状态完全相同
C
解析 3p2表示3p能级上填充了2个电子,A错误;M层中有3s、3p、3d三个能级,原子轨道数目为9,B错误;在此电子排布式中1个2s电子跃迁到2p能级上,表示的是激发态原子,C正确;在同一轨道上运动的电子最多有2个,因其自旋状态不同,故它们的状态不完全相同,D错误。
5.A、B、C、D、E代表前四周期的五种元素,原子序数依次增大。请填空:
(1)A元素基态原子的最外层有3个未成对电子,次外层有2个电子,其轨道表示式为 。
(2)B元素的负一价离子的电子层结构与氩相同,B离子的结构示意图为
。
(3)C元素的正三价离子的3d能级为半充满,C的元素符号为 ,其基态原子的电子排布式为 。
(4)D元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,
D的元素符号为 ,其基态原子的电子排布式为 。
(5)E元素基态原子中没有未成对电子,E的电子排布式是 。
(3)Fe 1s22s22p63s23p63d64s2
(4)Cu 1s22s22p63s23p63d104s1
(5)1s22s22p63s23p63d104s2或1s22s22p63s23p63d104s24p6
解析 (1)基态原子的最外层有3个未成对电子,次外层有2个电子的元素为氮元素,其轨道表示式为 。
(2)因为B-的电子层结构与氩相同,即核外电子数相同,所以B元素的质子数为18-1=17,则B-为Cl-,其结构示意图为 。
(3)C元素的正三价离子的3d能级为半充满,C的元素符号为Fe,其基态原子的电子排布式:1s22s22p63s23p63d64s2。
(4)D元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,则D为Cu,其基态原子电子排布式为1s22s22p63s23p63d104s1。
(5)E元素基态原子中没有未成对电子,且E的原子序数在五种元素中最大,因此E元素为30号元素Zn或36号元素Kr,其电子排布式为1s22s22p63s23p63d104s2或1s22s22p63s23p63d104s24p6。
易错提醒 核外电子在原子轨道上排布要遵循三个原则,即能量最低原理、泡利不相容原理和洪特规则。这三个原则并不是孤立的,而是相互联系、相互制约的,也就是说核外电子在原子轨道上排布要同时遵循这三个原则。其中能量最低原理可叙述为在不违反泡利不相容原理的前提下,核外电子在各个原子轨道上的排布方式应使整个原子体系的能量最低。
本 课 结 束
专题2 原子结构与元素性质
第一单元 第2课时 原子核外电子的排布
素 养 目 标
1.能举例说明原子核外电子排布的构造原理,结合原子核外电子排布规律,建立观点、结论和证据之间的逻辑关系,培养证据推理与模型认知的化学核心素养。
2.能用电子排布式、轨道表示式表征1~36号元素基态原子的核外电子排布,理解原子核外电子的运动不同于宏观物体的运动,培养宏观辨识与微观探析的化学核心素养。
基础落实·必备知识全过关
重难探究·能力素养全提升
目 录 索 引
基础落实·必备知识全过关
一、核外电子的排布原理
1.原子核外电子排布的构造原理
2.原子核外电子排布的轨道能量顺序
教材阅读 想一想自学教材“原子核外电子排布的构造原理”。
思考:碳-14呼气试验可用于判断患者是否存在幽门螺旋杆菌感染。幽门螺旋杆菌可引起多种胃病,根除幽门螺旋杆菌已经成为现代消化道疾病治疗的重要措施。当病人服用14C标记的尿素后,如患者的胃内存在幽门螺旋杆菌感染,胃中的尿素酶可将尿素分解为氨和14CO2,14CO2通过血液经呼气排出,定时收集呼出的气体,通过分析呼气中14CO2的含量即可判断患者是否存在幽门螺旋杆菌感染。碳元素原子核外电子排布遵循什么原则 先后占据了哪些原子轨道 有多少个未成对电子
提示 遵循能量最低原理、泡利不相容原理和洪特规则。电子先后占据了1s、2s、2p三个轨道,由于2p有三个轨道两个电子,根据洪特规则,这两个电子分占不同原子轨道,因此有2个未成对电子。
易错辨析 判一判
(1)电子总是先填满低电子层再填高电子层。( )
提示 不一定,如电子先填4s轨道后填3d轨道。
(2)同一原子中2p、3p、4p轨道数相等。( )
(3)原子核外电子填充3p、3d、4s能级的顺序为3p→4s→3d。( )
(4)每个原子轨道最多容纳两个自旋状态相同的电子,称为泡利不相容原理。
( )
提示 每个原子轨道上最多容纳两个自旋状态不同的电子。
×
√
√
×
二、原子核外电子排布的表示方法
1.基态原子电子排布式
(1)基态电子排布式
①定义:将轨道上所排布的电子数标注在该轨道符号右上角,并按照电子层从左到右的顺序排列的式子,如碳原子的基态电子排布式为1s22s22p2。
②表示方法
(2)简化的电子排布式
为了避免电子排布式书写过于繁琐,把内层电子已达到 结构的部分写成“原子实”,以相应 表示,得到简化的电子排布式,如碳原子简化的电子排布式为[He]2s22p2。
(3)外围电子排布式
对于过渡元素的原子在简化的电子排布式中,省去相应的稀有气体的“原子实”后剩下的部分称为外围电子排布式;对于主族元素的原子,外围电子排布式就是最外层电子的排布式。
稀有气体
稀有气体的元素符号外加方括号
2.轨道表示式
(1)定义:将每一个原子轨道用一个方框表示,在方框内标明基态原子核外电子分布的式子称为轨道表示式。
(2)表示方法
3.光谱和光谱分析
(1)光谱形成原因:不同元素的原子中电子发生 时会吸收或释放不同的光。
(2)光谱分类
(3)应用:在日常生活中,我们看到的许多可见光,如霓虹灯光、激光、焰火等,都与原子核外电子发生跃迁释放能量有关。
(4)光谱分析:在现代化学中,人们可通过原子发射光谱或吸收光谱来检测元素,称为光谱分析。
跃迁
教材阅读 想一想自学教材“在通常情况下,原子核外电子的排布”一段和“原子光谱分析原理”。
思考:霓虹灯光、激光、焰火都与原子核外电子跃迁形成的光谱有关,这些光谱属于发射光谱还是吸收光谱
提示 发射光谱。
易错辨析 判一判
(1)3d6的轨道表示式为 。( )
提示 题中轨道表示式违背了洪特规则。
(2)基态Zn原子的电子排布式为[Ar]4s23d10。( )
提示 基态Zn原子的电子排布式为[Ar]3d104s2。
(3)第2周期元素中基态原子未成对电子数最多的为氮原子。( )
(4)电子仅在激发态跃迁到基态时才会产生原子光谱。( )
提示 电子从能量较低的激发态或基态跃迁到能量较高的激发态时,也会产生原子光谱。
×
×
√
×
重难探究·能力素养全提升
探究一 核外电子的排布原理
情境探究
构造原理是由玻尔、西蒙、泡利和鲁拉一起提出的。构造原理可用于确定原子、分子或离子的电子组态。此原理须确定取得它们相对于原子核和其他已存在的电子间的最稳定情况(电子轨道)。简而言之,电子会先填入能量较低的轨道,其次再填入能量较高的轨道,即整个体系的能量越低越好。一般来说,新填入的电子都是填在能量最低的空轨道上的。
1.根据构造原理,电子填入轨道是从最低的能量状态开始,随后进入能量状态较高的轨道(即1s会在2s之前)。这句话正确吗
2.根据构造原理,对多电子原子而言,轨道能量由低至高的次序为1s<2s<2p<3s<3p<4s<3d<4p……这种说法正确吗
提示 正确。电子会先填入能量较低的轨道,再填入能量较高的轨道,即整个体系的能量越低越好。
提示 正确。根据构造原理,电子所排的轨道能量顺序:1s、2s、2p、3s、3p、4s、3d、4p、5s、4d、5p、6s、4f、5d、6p、7s……
方法突破
1.泡利不相容原理与洪特规则
(1)泡利不相容原理
①内容:每个原子轨道最多容纳两个自旋状态不同的电子。
②自旋状态只有两种:↑、↓。
③原子轨道与原子轨道数和最多容纳的电子数的关系:
原子轨道类型 s p d f
原子轨道数 1 3 5 7
最多容纳的电子数 2 6 10 14
(2)洪特规则
①内容:电子在能量相同的轨道(例如3个p轨道,5个d轨道,7个f轨道)上排布时,将尽可能分占不同的轨道,而且自旋状态相同。如:2p3轨道上的电子排布为 ,不能为 或 。
将在原子轨道上运动的单个电子称为未成对电子
②特例:能量相等轨道上的电子排布在全充满、半充满和全空状态时,具有较低的能量和较高的稳定性。
例如:
铬(24Cr)的基态电子排布式
3d为半充满
铜(29Cu)的基态电子排布式
3d为全充满
2.基态电子排布式的书写方法
3.核外电子排布的表示方法
应用体验
视角1 原子核外电子排布的构造原理
1.[2023河北衡水第二中学检测]下列对电子排布式或轨道表示式书写的评价正确的是( )
选项 电子排布式或轨道表示式 评价
A N原子的轨道表示式: 错误;违反洪特规则
B O原子的轨道表示式: 错误;违反泡利不相容原理
C K原子的轨道表示式:1s22s22p63s23p63d1 错误;违反能量最低原理
D Br-的电子排布式:[Ar]3d104s24p6 错误;违反能量最低原理
C
解析 相同轨道中的两个电子自旋状态不同,A项违反了泡利不相容原理,不符合题意,A错误;原子核外电子在能量相同的各个轨道上排布时,电子尽可能分占在不同的原子轨道上,且自旋状态相同,B项违反了洪特规则,不符合题意,B错误;K原子的电子排布式为1s22s22p63s23p64s1,C项违反能量最低原理,符合题意,C正确;Br-的电子排布式:[Ar]3d104s24p6,正确,评价错误,D错误。
2.下列原子或离子的电子排布表示方法中,正确的是 ,违反能量最低原理的是 ,违反洪特规则的是 ,违反泡利不相容原理的是 。
①Ca2+:1s22s22p63s23p6
②F-:1s22s23p6
④Fe:1s22s22p63s23p63d64s2
⑤Mg2+:1s22s22p6
答案 ①④⑤ ② ③ ⑥
解析 根据核外电子排布规律知②中错误在于电子排完2s轨道后应排2p轨道,而不是3p轨道,应为1s22s22p6;③中没有遵循洪特规则——电子在同一能级的不同轨道上排布时,应尽可能分占不同的轨道并且自旋状态相同;⑥违反泡利不相容原理,应为 。
视角2 基态原子、离子的核外电子排布
3.已知某原子结构示意图如图所示,下列有关说法正确的是( )
A.原子结构示意图中x=2
B.该原子的电子排布式为1s22s22p63s23p63d44s2
C.该原子3d轨道的轨道表示式为
D.该原子结构中共有7个能级上有电子
D
解析 由原子结构示意图可知,K层排满时为2个电子,故x=1,该元素为铬,故A项错误;根据洪特规则特例该原子的电子排布式为1s22s22p63s23p63d54s1,故B项错误;铬原子3d轨道上填充了5个电子,根据洪特规则,5个电子应分占5个轨道且自旋状态相同,故C项错误;该原子结构中共有1s、2s、2p、3s、3p、3d、4s 7个能级上有电子,故D项正确。
考题点睛
【变式设问】
(1)试写出铬原子的简化电子排布式和铬原子的外围电子排布式。
(2)写出Cr3+的电子排布式。
(3)基态铬原子核外有几个未成对电子
提示 铬原子的简化电子排布式为[Ar]3d54s1,外围电子排布式为3d54s1。
提示 1s22s22p63s23p63d3。
提示 6个。
4.下列叙述正确的是( )
A.3d64s2是基态原子的电子排布式
B.铬原子的电子排布式:1s22s22p63s23p64s13d5
C.铜原子的电子排布式:1s22s22p63s23p63d104s1
D.氮原子的轨道表示式是
C
解析 A项是原子的外围电子排布式;B项,在书写电子排布式时,不能完全按填充顺序书写;D项违反了洪特规则,应为 。
5.下列化学用语中正确的是( )
A.铬原子的简化电子排布式为[Ar]3d44s2
B.Cl-的结构示意图为
C.N原子的轨道表示式为
D.Cu原子的电子排布式为1s22s22p63s23p63d104s1
D
解析 A项违背洪特规则特例;B项Cl-最外层有8个电子;C项中N原子2p轨道上应是3个电子且自旋状态相同。
探究二 原子核外电子排布构造原理的应用
情境探究
钛合金主要用于制作飞机发动机压气机部件,其次为火箭、导弹和高速飞机的结构件。钛及其合金已在一般工业中应用,用于制作电解工业的电极,发电站的冷凝器,石油精炼和海水淡化的加热器以及环境污染控制装置等。钛及其合金已成为一种耐蚀结构材料。此外还用于生产贮氢材料和形状记忆合金等。
1.基态钛原子的核外电子排布式如何表示
2.钛原子的电子有多少种空间运动状态 多少种电子的运动状态
3.基态钛原子的外围电子轨道表示式如何表示 存在几个未成对电子
提示 1s22s22p63s23p63d24s2。
提示 电子的空间运动状态是指原子轨道,钛原子核外电子第一层1s,1个轨道;第二层2s和2p,共有4个轨道;第三层3s、3p共4个轨道,3d填充电子的轨道为2,则第三层共6个轨道;第四层4s,1个轨道,因此共有12个原子轨道,即12种空间运动状态。
在原子中每个电子的运动状态都是不同的,故该元素原子有22种电子的运动状态。
方法突破
1.电子空间运动状态和电子运动状态
(1)电子空间运动状态:是指原子轨道,原子核外有几个填充电子的轨道,就有几种电子空间运动状态。
(2)电子运动状态:在同一原子中,没有运动状态完全相同的两个电子存在,原子核外有几个电子,就有几种运动状态。
①电子层不同,则电子运动状态不同;
②电子层相同,能级相同,若在不同轨道,则电子运动状态不同,如2px和2py轨道上的电子运动状态不同;
③电子层相同,能级相同,轨道也相同,两电子的自旋状态不同,则电子运动状态不同。
2.原子的最外层、次外层电子数
(1)最外层电子数不超过8:由于能级交错,当ns和np轨道全充满时(共4个轨道,最多容纳8个电子),多余电子不是填入nd轨道,而是首先形成新电子层,填入(n+1)s轨道中,因此最外层电子数不可能超过8个。
(2)次外层电子数不超过18:若最外层是第n层,次外层就是第(n-1)层,在第(n+1)层出现前,次外层只有(n-1)s、(n-1)p、(n-1)d上有电子,其共有9个轨道,最多可容纳18个电子,因此次外层电子数不超过18个。例如,某原子最外层是第五层,次外层就是第四层,在第六层出现之前,次外层(第四层)只有4s、4p和4d轨道上有电子,4s、4p、4d共有9个轨道,最多可容纳18个电子,也就是次外层电子数不超过18个。
3.基态原子中未成对电子的判断
(1)主族元素未成对电子数规律
(2)第4周期过渡元素未成对电子数规律
应用体验
视角1 核外电子排布基态、激发态的判断
1.[2023湖南长沙浏阳期末调研]下列电子排布式或外围电子轨道表示式不能表示基态粒子的是( )
A.Ca 1s22s22p63s23p63d2
B.P 1s22s22p63s23p3
A
解析 Ca的基态电子排布式为1s22s22p63s23p64s2,故A符合题意。
2.[2023河北衡水中学四调节选]氮、磷、铁、铜、钇在现代工农业、科技及国防建设等领域中都有着广泛的应用。回答下列问题:
基态磷原子核外电子共有 种空间运动状态。磷原子在成键时,能将一个3s电子激发进入3d能级而参与成键,写出该激发态磷原子的核外电子排布式: 。
答案 9 1s22s22p63s13p33d1
解析 基态磷原子核外电子排布式为1s22s22p63s23p3,原子核外每一个原子轨道都是一种电子空间运动状态,s能级有1个轨道,p能级有3个轨道,所以一共有9个轨道,即9种空间运动状态。磷原子在成键时,由于将一个3s电子激发进入3d能级,则激发态磷原子的核外电子排布式为1s22s22p63s13p33d1。
视角2 核外电子排布构造原理的应用
3.某元素原子的3p轨道上有两个未成对电子,因此其( )
A.第3电子层上有4个电子
B.最高正价为+2
C.最高正价为+4
D.第2电子层没有未成对电子
D
解析 3p轨道上有两个未成对电子,则该基态原子电子排布式为1s22s22p63s23p2或1s22s22p63s23p4,即为Si元素或S元素。第3层有4或6个电子,最高正价为+4或+6,A、B、C均错误;第2层均为2s22p6,没有未成对电子,D正确。
4.下列说法中正确的是( )
A.3p2表示3p能级上有两个轨道
B.M层中的原子轨道数目为3
C.1s22s12p1是激发态原子的电子排布式
D.处于同一轨道上的电子可以有多个,它的运动状态完全相同
C
解析 3p2表示3p能级上填充了2个电子,A错误;M层中有3s、3p、3d三个能级,原子轨道数目为9,B错误;在此电子排布式中1个2s电子跃迁到2p能级上,表示的是激发态原子,C正确;在同一轨道上运动的电子最多有2个,因其自旋状态不同,故它们的状态不完全相同,D错误。
5.A、B、C、D、E代表前四周期的五种元素,原子序数依次增大。请填空:
(1)A元素基态原子的最外层有3个未成对电子,次外层有2个电子,其轨道表示式为 。
(2)B元素的负一价离子的电子层结构与氩相同,B离子的结构示意图为
。
(3)C元素的正三价离子的3d能级为半充满,C的元素符号为 ,其基态原子的电子排布式为 。
(4)D元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,
D的元素符号为 ,其基态原子的电子排布式为 。
(5)E元素基态原子中没有未成对电子,E的电子排布式是 。
(3)Fe 1s22s22p63s23p63d64s2
(4)Cu 1s22s22p63s23p63d104s1
(5)1s22s22p63s23p63d104s2或1s22s22p63s23p63d104s24p6
解析 (1)基态原子的最外层有3个未成对电子,次外层有2个电子的元素为氮元素,其轨道表示式为 。
(2)因为B-的电子层结构与氩相同,即核外电子数相同,所以B元素的质子数为18-1=17,则B-为Cl-,其结构示意图为 。
(3)C元素的正三价离子的3d能级为半充满,C的元素符号为Fe,其基态原子的电子排布式:1s22s22p63s23p63d64s2。
(4)D元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,则D为Cu,其基态原子电子排布式为1s22s22p63s23p63d104s1。
(5)E元素基态原子中没有未成对电子,且E的原子序数在五种元素中最大,因此E元素为30号元素Zn或36号元素Kr,其电子排布式为1s22s22p63s23p63d104s2或1s22s22p63s23p63d104s24p6。
易错提醒 核外电子在原子轨道上排布要遵循三个原则,即能量最低原理、泡利不相容原理和洪特规则。这三个原则并不是孤立的,而是相互联系、相互制约的,也就是说核外电子在原子轨道上排布要同时遵循这三个原则。其中能量最低原理可叙述为在不违反泡利不相容原理的前提下,核外电子在各个原子轨道上的排布方式应使整个原子体系的能量最低。
本 课 结 束
